cellecyklussen er den række begivenheder, der regulerer cellens levetid. Denne regulering er resultatet af en kombination af flere signaler fra forskellige reguleringsveje, der aktiveres som reaktion på specifikke stimuli. Cellecyklussen har en central rolle i at kontrollere cellevækst og proliferation. Det bliver ofte målet for genetisk ændring, hvis ophobning kan føre til deregulering af disse ordnede begivenheder og kan være relateret til kræftens begyndelse. Med den voksende forståelse af den vigtige rolle cellecyklusregulering i tumordannelse og apoptose er cellecyklusinhibitorer blevet undersøgt yderligere inden for kræftbehandling.
Cyclinafhængige Kinase (CDK)-hæmmere
Progression gennem cellecyklussen sikres af særlige proteinkomplekser, de cyclinafhængige kinaser (CDK ‘ er). CDK ‘ erne er en familie af stærkt konserverede serin/threoninkinaser, som deler en høj homologi i en bestemt region. CDK ‘ er kan kontrollere cellecyklussen ved phosphorylering af forskellige mål, som igen kan aktiveres eller inaktiveres. Regulering af CDK / cyclin-aktivitet kan forekomme gennem regulatoriske proteiner, såsom CDK-hæmmere (CKI ‘ er). CKI ‘ erne kan hæmme aktiviteten af CDK ved at forbinde in vivo med CDK-underenheden, cyclin eller cyclin/CDK-komplekset. Denne inhibering kan forekomme på forskellige måder, såsom inhibering af CDK-kinaseaktiviteten, interferens med Cak-medieret CDK-aktivering eller konkurrence med cycliner i binding til den katalytiske underenhed. Den inhiberende proces kan udføres af en eller en kombination af disse mekanismer. Ekspressionen af disse CKI ‘ er kan induceres af stimuli såsom senescens, kontaktinhibering, ekstracellulære anti-mitogene faktorer og cellecykluskontrolpunkter.
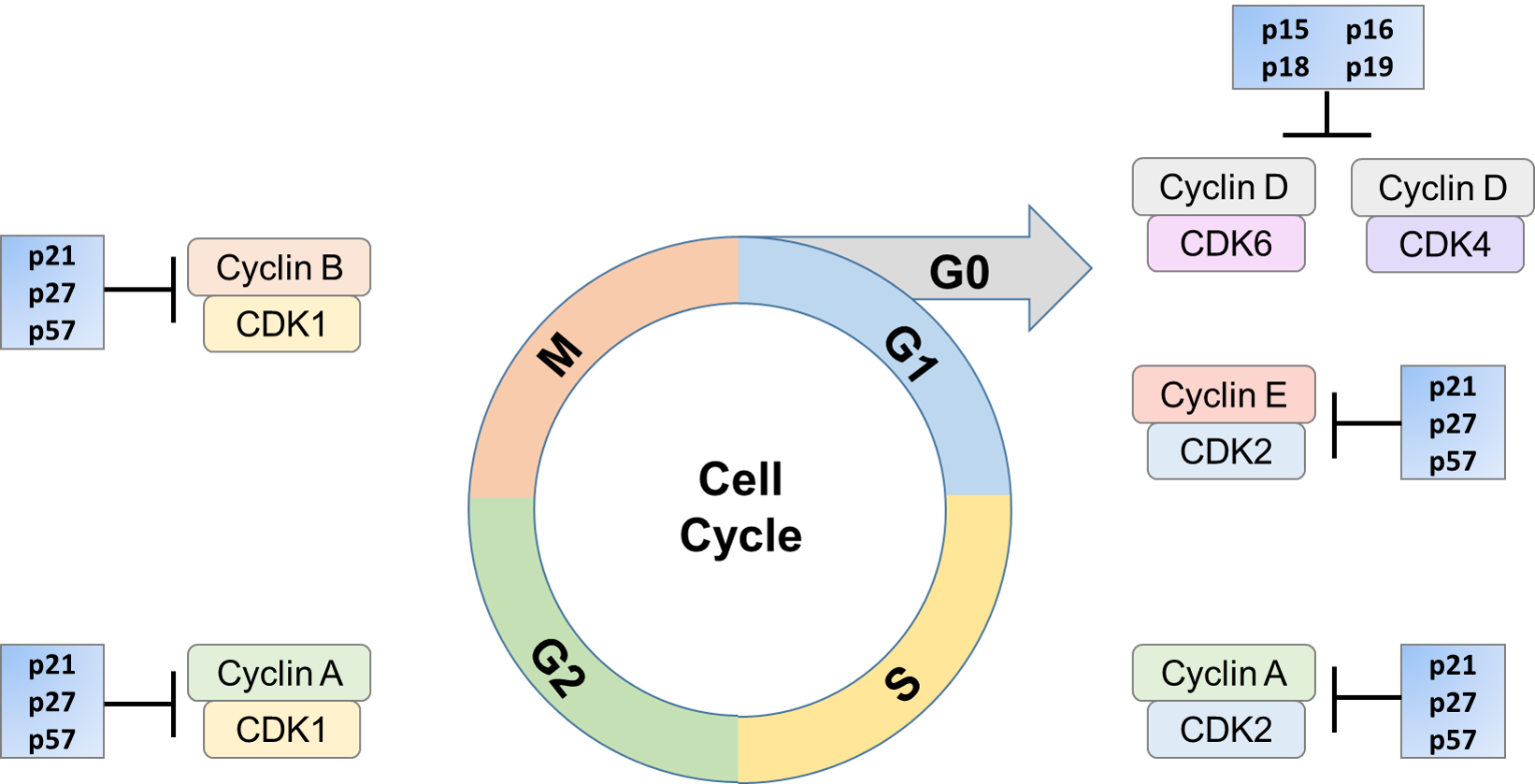
deres rolle i at kontrollere cellecyklus er afgørende. I flere former for kræft muteres CKI ‘ er som p16 og p27. De har også vist sig at være nedbrudt i flere typer kræft. Lave niveauer af p27 niveauer er korreleret med dårlig klinisk prognose. Disse hæmmere kan opreguleres, når det er nødvendigt, og blokerer således aktiveringen af CDK med en cyclin. Dette arresterer cellen i en bestemt del af cellecyklussen, indtil forholdene er sådan, at den kan fortsætte mod spredning eller om nødvendigt styres mod celledød.
- INK4 familie
der er to familier af CKI ‘ er. Den første familie inkluderer INK4-proteinerne (inhibitorer af CDK4), så opkaldt efter deres evne til specifikt at hæmme de katalytiske underenheder af CDK4 og CDK6. Denne familie omfatter fire proteiner, p16INK4a, p15INK4b, p18INK4c og p19INK4d. disse proteiner er sammensat af flere ankirin-gentagelser og binder kun til CDK4 og CDK6.
| INK4 | beskrivelse |
| p15 | Cyclinafhængig kinase 4-hæmmer B, også kendt som multiple tumor suppressor 2 (MTS-2) eller p15INK4b, induceres ved TGF-behandling og udtrykkes allestedsnærværende. Proteinet kodes af CDKN2B-genet hos mennesker, som ofte slettes i humane kræftformer, hvilket antyder, at tabet af genet kan være signifikant i udviklingen af visse typer tumorer. |
| p16 | p16, også kendt som p16INK4a, cyclinafhængig kinasehæmmer 2a og multiple tumor suppressor 1, kodes af CDKN2A-genet hos mennesker. Det blev identificeret i en to-hybrid screening ved hjælp af CDK4 som agn. p16 kan blokere CDK4-og CDK6-funktion ved at sekvestrere den katalytiske underenhed eller ved at blokere kinaseaktiviteten af præmonterede komplekser. På grund af det faktum, at flere humane kræftformer er forbundet med tab af P16-funktion, blev dette gen foreslået som en tumorundertrykker in vivo. |
| p18 | p18, også kendt som cyclinafhængig kinase 4-hæmmer C, er et ferment, der hos mennesker er kodet af CDKN2C-genet. p18 har vist sig at interagere med CDK4 eller CDK6 og forhindre aktivering af CDK-kinaserne og fungerer således som en cellevækstregulator, der styrer cellecyklus G1-progression. Både p18 og p19 er vidt udbredt i forskellige celletyper og væv. |
| p19 | p19, også kendt som cyclinafhængig kinase 4-hæmmer D, er et ferment, der hos mennesker er kodet af CDKN2D-genet. I nogle celletyper svinger P19-niveauer under cellecyklussen og gennemgår induktion, når celler går ind i S-fase. p19 kan fungere ved at regulere aktiviteten af cyclin d-afhængige kinaser, når celler forlader G1-fase. Alle fire hæmmere har lignende egenskaber og kan reagere forskelligt på antiproliferative signaler. |
- CIP / KIP-familien
sidstnævnte familie består af medlemmerne af Cip/Kip-familien og inkluderer p21Cip1, p27Kip1 og p57Kip2, som alle indeholder karakteristiske motiver inden for deres amino-terminale dele, der gør det muligt for dem at binde til både cyclin-og CDK-underenheder. Medlemmer af Cip-familien binder til og hæmmer det aktive cyclin/CDK-kompleks.
| CIP / KIP | beskrivelse |
| p21 | p21Cip1, også kendt som cyclinafhængig kinasehæmmer 1 eller CDK-interagerende protein 1, kodes af CDKN1A-genet hos mennesker og kan fungere som en potent og universel hæmmer af CDK-aktivitet. Det hæmmer cdk2 -, CDK4-og CDK6-kinaser og er i stand til at inducere cellecyklusstop i G1, når det er overudtrykt. I normalt cykelceller er p21 i kompleks med cyclin / CDK. |
| p27 | Cyclinafhængig kinasehæmmer 1B (p27Kip1) er en hæmmer, der hos mennesker er kodet af CDKN1B-genet. p27 blev identificeret i en række undersøgelser af væksthæmmende aktivitet induceret af TGF, og i en anden undersøgelse blev isoleret ved en to-hybrid screening ved anvendelse af CDK4 som agn. p27 er strukturelt relateret til p21 og hæmmer cdk2, CDK3, CDK4 og CDK6 komplekser in vitro. |
| p57 | Cyclinafhængig kinasehæmmer 1C (p57, Kip2) er protein, som hos mennesker er kodet af CDKN1C-genet. p57 binder til og hæmmer flere cyclin / CDK-komplekser, og dets ekspression synes at være vævsbegrænset. p57 synes ligesom p27 ikke at kræve p53 og pRb for sin funktion. p57 kortlægger det 11p15 kromosomale locus, som gennemgår hyppige sletninger eller omlejringer i mange former for menneskelig kræft. |
Tumor Suppressor og cellecyklus kontrol
Tumortransformation er en flertrinsproces, der involverer klonal ophobning af genetiske læsioner, der påvirker proto-onkogener eller tumorundertrykkende gener. Produkterne fra disse gener spiller senere en vigtig rolle i signaltransduktionsveje ved at kontrollere cellecyklus, celledifferentiering og endda celledød. Der er nu stigende bevis for, at normal cellecyklusprogression er resultatet af en afbalanceret interaktion mellem flere regulatoriske faktorer, såsom tumorundertrykkende genprodukter og cellecyklusassocierede proteiner. Det er ikke overraskende, at grundlæggende ændringer i tumorundertrykkende gener kan resultere i ureguleret cellecyklus og eventuel tumortransformation. Derfor kan folk definere kræft som en genetisk sygdom i cellecyklussen.
prototypen tumor-suppressor gener er p53 og RB. Inddragelsen af disse tumorundertrykkende gener i kræft er udbredt, og ofte viser generne stor specificitet for bestemte tumortyper. Den mest almindelige ændring, der findes i disse gener, er repræsenteret ved deletion eller punktmutation. Desuden kan inaktivering af tumorundertrykkende gener skyldes interaktion med virale oncoproteiner. Faktisk er virale midler i stand til integration i værtens genetiske materiale og kan forstyrre reguleringen af normal cellevækst og proliferation ved at interagere med funktionen af tumorundertrykkende gener, såsom p53-og pRb-familierne.
Celleregulering og Cellecykluskontrol
cellecyklussen er ikke en uafhængig cellulær mekanisme, men en proces, der er tæt knyttet til andre cellulære reguleringsmekanismer. For eksempel påvirker proteiner, der regulerer kromatinomdannelse, også cellecyklussen, såsom ADNP-genet; proteiner, der hæmmer cellulær energimetabolisme, hæmmer også cellecyklussen, såsom ALDH1L1; proteiner, der hæmmer kræftcellevækst og kromatinkondensation, kan også fungere som cellecyklusinhibitorproteiner, såsom asb2. Anden celleproces, herunder apoptose, cellevækst, allestedsnærværende, calciumresponsiv transkription, et al., kan påvirke den normale cellecyklus. Cellebiologi er et komplekst og interagerende netværk, så for fuldt ud at forstå mekanismerne for cellecyklusinhibitorer skal du forstå multiplekscellereguleringsprocessen.
konklusion
Cellecyklusinhibitorer har brede udsigter inden for human kræftbehandling. En række CDK-hæmmere er i de kliniske og prækliniske forsøg. Tidligere undersøgelser har vist, at disse lægemidler kan hæmme cellecyklussen og inducere apoptose i tumorceller. I kliniske forsøg er den bedste effekt, disse lægemidler kan opnå, at stabilisere tilstanden. Generelt er cellecyklusinhibitorer en af de effektive strategier til kræftbehandling og er værdige til dybdegående eksperimenter og forskning.