nyckelord
Cytomegalovirus lunginflammation; Bronchiolitisobliterans som organiserar lunginflammation; Immunkompetent
introduktion
de kliniska manifestationerna av cytomegalovirus (CMV)infektion kan delas in i akut primär infektion ochaktivering. Primär CMV-infektion förekommer oftastunder amning och barndom och är asymptomatisk eller närvarande som ett mildt mononukleosliknande syndrom iimmunokompetenta vuxna . Då fortsätter viruset för livet ivärd, vanligtvis i latent stadium. Reaktivering av cmvfrån latens är välkänt hos immunkomprometterade patienter, och det kan påverka nästan vilket organ som helst. Allvarlig CMV-lunginflammation är dock sällsynt hos immunkompetenta värdar . För närvarande är de exakta molekylära och immunologiska mekanismernainvolverade är fortfarande okända.
Bronchiolitis obliterans organizing pneumonia (BOOP) är akliniskt tillstånd som kännetecknas av hosta, sjukdom, feber ochdyspnoea och inget svar på antibiotika . Dess bröstradiografi beskrivs som lokal, multipel och diffunderar förändringar. Det kan hittas med allergisk alveolit, bestrålningspneumonit, läkemedelsreaktioner och andra organiserande infektioner. Fall involverade i viral etiologi komplicerat med Boophar sporadiskt rapporterats. Här presenterar vi ett fall avcmv lunginflammation associerad med BOOP hos en immunkompetent patient genom behandling av ganciklovir, vilket ärDet första sådana fallet som någonsin rapporterats så långt vi känt.
fallrapport
en 63-årig man hänvisades till vårt sjukhus på grund av en 10-dagars historia av hosta och feber. Han hade en paroxysmal hostamed gult sputum. Feber, med wheezing uppträdde huvudsakligen ieftermiddagen och natten och den högsta temperaturen var39, 3(102.74). Hans tidigare medicinska historia inkluderade högt blodtryck, diabetes och gikt. Hans tidigare familjehistoriavar unremarkable. Hans vitala tecken var följande: kropptemperatur: 36,5 (97,7 ), hjärtfrekvens: 98 slag per minut(BPM), blodtryck: 98/61 mmHg.
vid fysisk undersökning noterades sena inspiratoriska sprickor i de bilaterala nedre lungfälten. Antalet vita blodkroppar(WBC) var 14,2 109/l, med 81,9% neutrofiler(NEUTR), 12,8% lymfocyter (LYR) och 0,53 109/lmonocyter (MONOR) (Figur 1). Serum C-reaktivt protein (CRP) nivå var 110,67 mg/L.
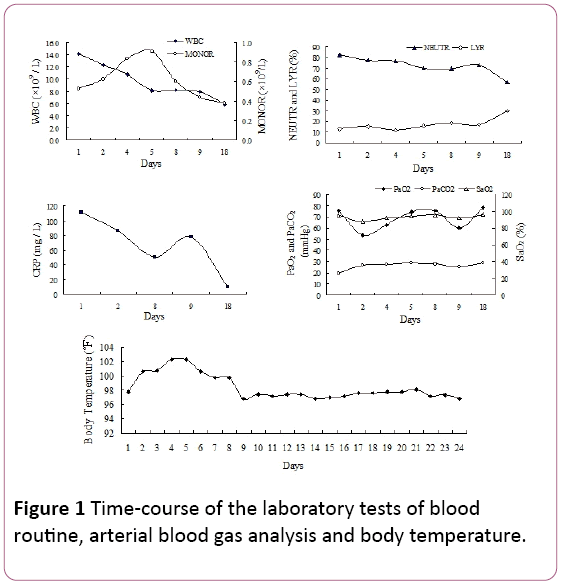
Figur 1: Tid-kurs av laboratorietester av bloodroutine, arteriell blodgasanalys och kroppstemperatur.
arteriellt partiellt tryck av syre (PaO2) var 75,5 mmHg,med 25,8 mmHg arteriellt partiellt tryck av CO2 (PaCO2) och94, 7% syremättnad (SaO2, 2 L/min syretillförsel vianasal kanyl). På grund av feber och tecken påandningsinfektioner började vi erfarenhetsmässigt antibiotikabehandling med piperacillin tazobactam. Men patientenstemperaturen minskade inte och andfåddutvecklas i ihållande 4 dagars sjukhusinläggning.
arteriella blodgasmätningar avslöjade misslyckande avandning (PaO2: 53,5 mmHg, PaCO2: 35,6 mmHg, SaO2: 87,7%) med motvikt metabolisk acidos (HCO3 -: 21 mmol/l, pH 7,39) vid användning av 2 L/min syre genom nasal kanyl.Laboratorie undersökningsresultaten var följande: mycoplasmapneumonia antikropp: 1: 40 (positiv), bakteriell endotoxin (thetotalt innehåll av lipopolysackarid av gramnegativa bakterier): 49,14 pg/ mL, plasma fibrinogen (Fg): 7,51 g/L, aktiveradpartiell tromboplastintid (APTT): 45,9 sekund.
elektrokardiogrammet visade sinus takykardi med Twave-förändring. Bröströntgen hittade två lunginfektioner, inteförutom pulmonella interstitiella lesioner (figur 2A). En thoraciccomputed tomography (CT) – skanning avslöjade pulmonary interstitial lesioner (skugga av rutnät i båda lungorna) ochmediastinal lymfkörtelförstoring (figur 2D). Sedan levererades 3,5 L/min syre med ansiktsmask och antibiotikabehandling byttes till Cefoperazonnatrium ochsulbaktam natrium plus Levofloxacin.
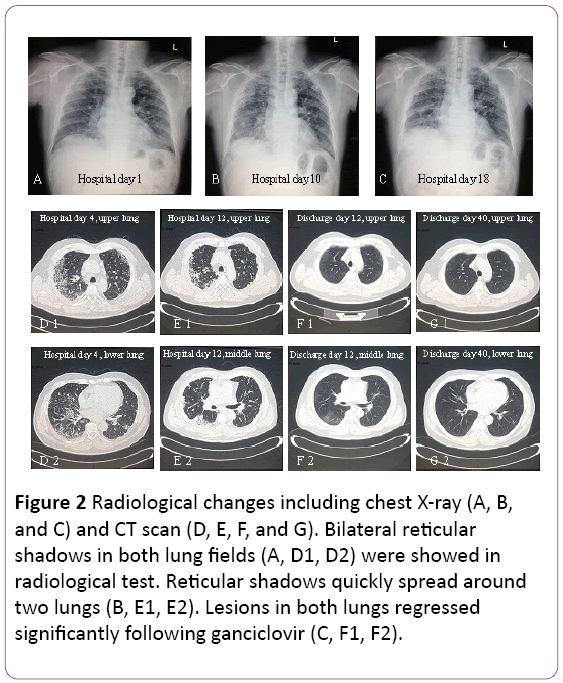
Figur 2: Radiologiska förändringar inklusive bröströntgen (A,B och C) och CT-skanning (D, E, F och G). Bilaterala retikulärskuggor i båda lungfälten (A, D1, D2) visades iradiologiskt test. Retikulära skuggor sprids snabbt runttvå lungor (B, E1, E2). Lesioner i båda lungorna regresseradesignifikant efter ganciklovir (C, F1, F2).
med tanke på diagnos av interstitiell lunginflammation, relevantlaboratorietester och fiberoptisk bronkoskopi utfördespå dag 5. Laboratorietestresultaten var följande: CMV PCR: negativ, CMV IgM: negativ, immunoglobulin IgG: positiv, HIV: negativ, WBC: 7,96 109 /L, NEUTR: 72,4%, LYR: 17%,CRP:77,51 mg/L, immunologisk funktion (t, B, NK-celler): normal, T-lymfocyter delmängder: normal. Markörer förautoimmuna sjukdomar inklusive perinuclear-ANCA (p-ANCA),cytoplasmatisk-ANCA (c-ANCA), ANA och anti-dsDNA var allanegativa.
lungfunktion föreslog måttlig restriktivventilatorisk dysfunktion. Röntgen-och CT-skanning avslöjade lesioner påövre lung absorberades, men det förvärrades i höger nedre lunga (Figur 2B och 2e).
en bronkoskopi visade bilateral bronkit (figur 3A).Bronchoalveolar lavage (BAL) vätska var negativ formykobakterier och PAS fläck. Differentialcellantal visade11% neutrofiler, 19% lymfocyter och 70% makrofager.Intranukleära och intracytoplasmiska inklusionskroppar hittadesi lateralt basalt segment av lungvävnaden transbronchialbiopsy (TBLB) i höger nedre (figur 3B). Baserat pådiagnos av cytomegalovirus lunginflammation med organisation påbörjades behandling med ganciklovir (5 mg/kg) via intravenös infusionvar 12: e timme dag 8. Enligt ovanstående kombination med kliniska symtom (feber försvinner) ändrades antibiotikabehandlingen till Moxifloxacin på dag8. Efter 1 vecka av antivirusterapi, hosta ihållande. Heunderwent lungbiopsi via CT-styrd. En lungbiopsi avslöjadeboop (figur 3C). Därefter behandlas patienten med oral steroidhormon. Ändå förbättrades hans symptom gradvis iföljande 1 vecka. Lungröntgen visade att två lunglesioner var bättre än tidigare (figur 2C).
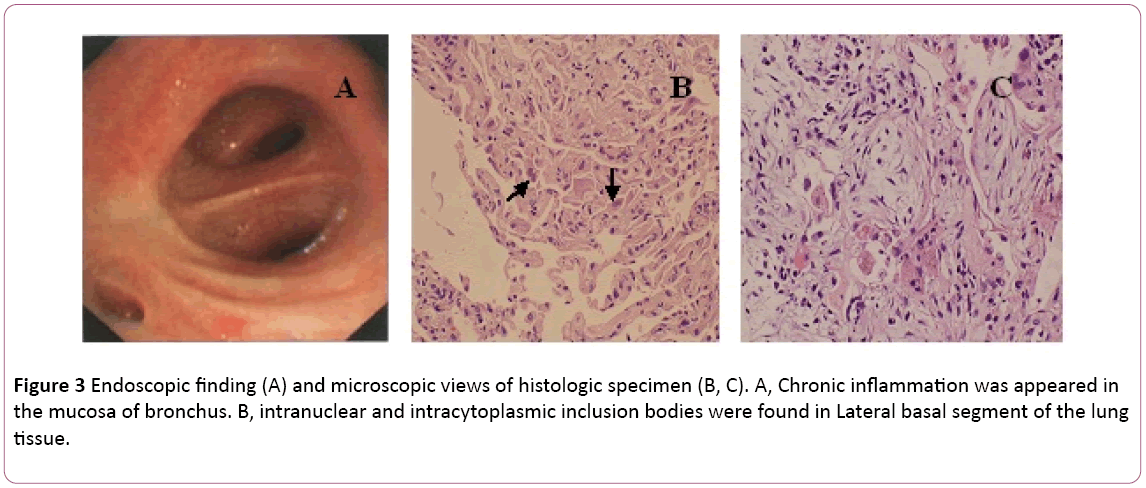
Figur 3: Endoskopisk upptäckt (A) och mikroskopiska vyer av histologiskt prov (B, C). A, kronisk inflammation uppträdde islemhinnan i bronchus. B, intranukleära och intracytoplasmiska inklusionskroppar hittades i lateralt basalsegment av lungvävnaden.
behandlingen ändrades till oral ganciklovir, 0,6 g / d (q12h)i 7 dagar, urladdning. I sin uppföljning regresserade shadow of grid i bothlungs signifikant (figur 2F och 2G). Han är fortfarandeunder uppföljning på polikliniken.
diskussion
CMV är ett DNA-virus i familjen Herpesviridae, och dessinfektion är vanlig. Faktum är att 40% till 100% av vuxna ärinfekterad med CMV över hela världen . CMV-infektioneri den allmänna befolkningen är vanligtvis subklinisk. Densymptomatisk CMV-infektion inträffade huvudsakligen iimmunkomprometterade patienter med immundysfunktion,inklusive patienter med AIDS, malignitet, transplantationsmottagare och nyfödda . I fall med immunbrist, Cmvinfektion kan orsaka lunginflammation, retinit,hepatit, encefalit, demyeliniserande polyneuropati,myokardit, pankreatit,gastrointestinala sjukdomar och binjurssjukdomar, och så vidare . Tvärtom, allvarlig livshotande infektion inducerad av CMV, inklusive CMV lunginflammation, ärhandfull hos immunkompetenta individer . I detta pappervi beskriver ett fall av CMV lunginflammation, associerad med Boopi en immunkompetent värd och behandlas effektivt medganciklovir.
CMV lunginflammation presenterar ofta som svår viral lunginflammation, med diffusa interstitiella infiltrat på röntgen och andningsfel . Laboratoriediagnosen kan varasvårt och görs serologiskt eller patologiskt.I allmänhet är de serologiska analyserna för att detektera human CMV-infektionär inklusive CMV-antikroppar (IgM,IgG) titer, CMV-proteinpp65 och CMV PCR . Det är viktigt att histopatologiskaupptäckt av CMV-inklusionskroppar på transbronchial eller openlungbiopsi är patognomonisk, eftersom CMV-lunginflammation iimmunokompetenta patienter representerar en sällsynt händelse .
vår patient presenterade icke-specifika symtom (hostaoch feber), som hade utvecklats under 10 dagar.Symtomen försämrades efter 2 dagar på sjukhus(svår hypoxemi), trots empirisk antibiotikabehandling. Diagnosen av CMV-lunginflammation baserades på TBLB, som varhittade intranukleära och intracytoplasmiska inklusionskroppar ijätteceller som guldstandard. Dessutom var serum CMV IGG-antikroppspositiv ett annat diagnostiskt index. Denradiologisk bild inklusive röntgen och CT-skanning som visarbilaterala retikulära skuggor i båda lungfälten stödde diagnosen viral lunginflammation. I vårt fall observerades också mononukleos avblodrutin (Figur 1). SerumIgM CMV var dock negativ i det här fallet, vilket var i överensstämmelse med Eddleston-rapporten . CMV PCR var också negativt. Det kan förklara med falska negativa resultat inducerade av övergående natur av viremi .
under sjukhusvistelsen minskade hans lymfocyterbetydligt. Lymfopeni orsakades av CMV-infektion förbåde direkt hämning av stamcellstillväxt och misslyckandet av stamcellsförnyelse . Det kan noteras att teimmunfunktionsanalys såsom T-cell delmängd, B-cell och nkcell, analys var normala. Övergående eller subklinisk t-cellabnormalitet och en inversion av CD4/CD8 T-cellförhållandet observerades inte i detta fall. Vid HIV-sjukdom, en minskning av CD4+ – celler <100 10 6/l i 100 CMV-sjukdom, vilket motsvarar en hög risk för CMV-sjukdom. Dessutom uppvisade vår patient Inga bevis på andraimmunbrister (HIV: negativa) och autoimmuna sjukdomar (autoimmun antikropp: negativ).
BOOP beskrevs först av Epler et al. och sedan dess har omfattande undersökts och rapporterats i hela världen . Det finns många smittämnen kan varaassocierad med BOOP, såsom cytomegalovirus (CMV), herpessimplex virus (HSV) . Parasitiska och pneumocystis cariniiinfektioner har också rapporterats . Eftersom BOOPrepresent sätt på vilket lungan kan reagera på eninflammatorisk stimulans är de viktigaste patofysiologiska fynden relaterade till den inflammatoriska vägen. Histologiska egenskaperinkluderar granulationsvävnad i väggarna i alveolerna ochbronkioler är signifikanta, associerade med infiltration iinterstitiell och trakealhålighet i olika grader avmononukleära celler och skumceller. Typ II alveolär epitelialcellhyperplasi kan också ses . I currentpatient diagnostiserades BOOP i lungbiopsi en vecka senareän TBLB, vilket tyder på att CMV kan vara den mest sannolika pathogen.
även om det inte finns någon rekommenderad standardvaraktighet förganciklovirbehandling för patienter med CMV-lunginflammation, läkemedlet kunde endast startas efter definitiv diagnos och administreras vanligtvis i två till tre veckor. Så snart sombehandling med ganciklovir förbättrades vår patients kliniska tillstånd, med fullständig upplösning av den kliniska ochradiologiska bilden under en månads uppföljning.
slutsats
vi rapporterar ett akut CMV-infektionsfall som presenterasmed feber, hosta, sputum och tachypnea. Den senareförsämras snabbt och är förknippat med andningsfel.CT-skanning avslöjade en liten förändring av markglas vid början, menförändringen spred sig snabbt runt två lungor. Efter ofpatologisk undersökning (TBLB) bekräftades diagnosen Cmvpneumoni. För patienter med noimmunbriststörningar är det mycket lätt att feldiagnostisera.Den aktuella rapporten tyder på att när bröstet CT visarinterstitiella lesioner, förutom att överväga tuberkulos,bakteriell lunginflammation och andra virussjukdomar, Cmvlunginflammation bör ingå i äldre patienter med en mängd grundläggande sjukdom. Viktigt är att detta fall demonstreradeatt cytomegalovirus lunginflammation kan associera med BOOP inen immunkompetent patient. Ganciklovirbehandling äreffektiv. Ytterligare studier är nödvändiga för att analyserarelationer och dess underliggande mekanism mellan Cmvlunginflammation och BOOP.
författarens bidrag
CXC utarbetade och skrev manuskriptet. WC, LL och LYH togvård av patienten och bidrog till att koordineramanuscript. XL utförde de mikrobiologiska analyserna. Lyhbidrog till utkastet till manuskriptet och reviderademanuskript. Alla författare har läst manuskriptet ochgodkände sin slutliga version.
bekräftelser
vi är tacksamma för Prof.Zhiqiang Qin för hans teoretiska stöd.
- Hamprecht K, Maschmann J, Vochem M, Dietz K, Speer CP, et al. (2001) epidemiologi för överföring av cytomegalovirus från mor till prematura barn genom amning. Lancet 357:513-518.
- Carter D, Olchovsky D, Pokroy R, Ezra D (2006) cytomegalovirusassocierad kolit som orsakar diarre hos en immunkompetent patient. Världen J Gastroenterol12: 6898-6899.
- Kralickova P, Mala E, Vokurkova D, Krcmova I, Pliskova L, et al. (2014) Cytomegalovirussjukdom hos patienter med vanlig variabel immunbrist: tre fallrapporter. Internationella Arkiv för allergi och immunologi 163: 69-74.
- Eddleston M, Peacock S, Juniper M, Warrell DA (1997) Allvarlig cytomegalovirusinfektion hos immunkompetenta patienter. Clin Infekterar Dis 24:52-56.
- Cunha BA (2010) cytomegalovirus lunginflammation: samhällsförvärvad lunginflammation hos immunkompetenta värdar. Infektera Detta Clin Norr Am 24: 147-158.
- Cohen JI, Corey GR(1991) Cytomegalovirus infection in the normal host. Medicine 1985; 64:100-114.
- Geddes DM. BOOP and COP. Thorax46:545-547.
- Hansell DM (1992) What are bronchiolitis obliterans organizing pneumonia (BOOP) and cryptogenic organizing pneumonia (COP)? ClinRadiol45:369-70.
- Cunha BA, Syed U, Mickail N(2012) Renal transplant with bronchiolitis obliterans organizing pneumonia (BOOP) attributable to tacrolimus and herpes simplex virus (HSV) pneumonia. Heart & Lung 41:310-315
- Bitzan M, Ouahed JD, Carpineta L, Bernard C, Bell LE(2010) kryptogen organiserande lunginflammation efter rituximab-behandling för antagen lymfoproliferativ sjukdom efter njurtransplantation. Pediatrisk Nefrologi 25:1163-1167.
- de la Hoz RE, Stephens G, Sherlock C (2002) diagnos och behandlingsmetoder för CMV-infektioner hos vuxna patienter. J ClinVirol 25: 1-12.
- Sanadgol N, Ramroodi N, Ahmadi GA, Komijani M, Moghtaderi A, et al.(2011) prevalens av cytomegalovirusinfektion och dess roll i totalt immunoglobulinmönster hos iranska patienter med olika subtyper av multipel skleros. Nya Microbiologica 34:263-274.
- Chiotan C, Radu L, Serban R, Cornacel C, Cioboata M, et al. (2014) Cytomegalovirus retinit hos HIV/AIDS-patienter. Journal of medicine och liv 7:237-240.
- Liu WL, lai CC, Ko WC, Chen YH, Tang HJ, et al. (2011) kliniska och mikrobiologiska egenskaper hos infektioner orsakade av olika Nocardia-arter i Taiwan: en multicenterstudie från 1998 till 2010. Eur J ClinMicrobiol Infektera Dis30: 1341-1347.
- Beam e, Razonable RR(2012)Cytomegalovirus i fast organtransplantation: epidemiologi, förebyggande och behandling. Curr Infektera Dis Rep14: 633-641.
- Westman G, Berglund D, Widen J, Ingelsson M, Korsgren O, et al. (2014) ökat inflammatoriskt svar hos Cytomegalovirus seropositiva patienter med Alzheimers sjukdom. PloS one9: 96779.
- Carney WP, Rubin RH, Hoffman RA, Hansen WP, Healey K, et al. (1981) analys av T-lymfocytundergrupper vid cytomegalovirusmononukleos. J Immunol126: 2114-2116.
- Boeckh M, Leisenring W, Riddell SR, Bowden RA, Huang ML, et al. (2003) sen cytomegalovirussjukdom och dödlighet hos mottagare av allogena hematopoietiska stamcellstransplantationer: betydelsen av viral belastning och t-cellimmunitet. Blod 101: 407-414.
- Gunthard HF, Aberg JA, Eron JJ, Hoy JF, Telenti A,et al. (2014) Antiretroviral behandling av vuxen HIV-infektion: 2014 rekommendationer från International Antiviral Society-USA Panel. JAMA 312: 410-425.
- Epler GR, Colby TV, McLoud TC, Carrington CB, Gaensler EA(1985) bronkiolit obliterans organisera lunginflammation. N Engl J Med 312:152-158.
- Kute VB, Patel MP, Patil SB, Shah PR, Vanikar AV,et al. (2013) Bronchiolitis obliterans organizing pneumonia (BOOP) after renal transplantation. IntUrolNephrol 45:1517-1521.
- White KA, Ruth-Sahd LA (2007) Bronchiolitis obliterans organizing pneumonia. Crit Care Nurse27:53-66.
- Yale SH, Adlakha A, Sebo TJ, Ryu JH(1993)Bronchiolitis obliterans organizing pneumonia caused by Plasmodium vivax malaria. Chest 104:1294-1296.
- Kleindienst R, Fend F, Prior C, Margreiter R, Vogel W(1999)Bronchiolitis obliterans organizing pneumonia associated with Pneumocystis carinii infection in a liver transplant patient receiving tacrolimus. Clin Transplant13:65-67.
- Moore SL (2003)Bronchiolitis obliterans organizing pneumonia: a late complication of stem cell transplantation. Clin J OncolNurs 7:659-662.