Inleiding
Helicobacter pylori (H. pylori) is een gramnegatieve microaerofiele bacterie, waarvan de natuurlijke habitat de maag is. Hoewel het typisch een bacillaire vorm met verscheidene flagella aan één uiteinde heeft, neemt het een coccoid verschijning in ongunstige milieuomstandigheden aan.1,2
H. pylori is een belangrijke etiologische factor in actieve chronische gastritis, maagzweer, met maagslijmvlies geassocieerd lymfoïde weefsel (MALT) lymfoom en maagkanker. Hoewel de bacterie naar schatting aanwezig is in het maagslijmvlies van de helft van de wereldbevolking, ontwikkelen deze ziekten zich slechts bij ongeveer 15-20% van de gekoloniseerde individuen.2,3
de meest voorkomende behandelingsschema ‘ s resulteerden in een eradicatiepercentage van ongeveer 85% in veel geografische gebieden,4-6, maar de werkzaamheid is, vooral in de afgelopen jaren, in het gedrang gekomen door het snelle ontstaan van antibioticaresistente stammen en slechte therapietrouw.5,7
het is belangrijk om in overweging te nemen dat de genezing (evenals de preventie van complicaties) van actieve chronische gastritis en ulcus pepticum en voor enkele laaggradige vormen van maagmoutlymfoom afhankelijk is van het succes van de eradicatie van H. pylori. Bovendien zou het verzekeren en in stand houden van succesvolle uitroeiing van dit micro-organisme in al zijn biologische vormen herhaling van de infectie en dus terugval van de ziekte voorkomen.
het doel van dit overzicht is een algemeen overzicht te geven van de coccoïde vorm van H. pylori, waarbij het microbiologische profiel, de gevoeligheid voor antibiotica en de virulentie ervan worden belicht. De betrokkenheid bij maagziekte zal ook worden geanalyseerd, en de mate waarin het is geassocieerd met infectie recrudescence en ziekte recidief zal worden onderzocht.
overleving en cellulaire aanpassing van H. pylorenalgemene overwegingen
alle levende organismen zijn uitgerust met mechanismen die hen in staat stellen in ongunstige omgevingen te overleven. Voor sommigen, impliceert hun reactie (naast metabolische aanpassingen) veranderingen in celmorfologie.8,9 verschillende micro-organismen hebben het vermogen om zich te differentiëren in een levensvatbare maar niet-cultureerbare (VBNC) toestand als reactie op omgevingsomstandigheden die ongunstig zijn voor overleving en groei. Deze strategie wordt veel gebruikt door micro-organismen zoals Salmonella, Campylobacter en Escherichia.10,11
in de vbnc-toestand nemen bacteriën over het algemeen hun grootte af en veranderen van vorm om kleine bolvormige lichamen te worden. Ze verminderen hun ademhalingssnelheid en nutriëntentransport en veranderen genexpressie en moleculaire synthese. In deze toestand kunnen ze niet worden gedetecteerd met behulp van conventionele kweektechnieken. Veranderingen in de omgevingsomstandigheden kunnen er echter toe leiden dat deze micro-organismen ofwel “herleven” (en terugkeren naar hun actieve toestand) of degenereren.10-13
Hetzelfde Geldt Voor H. pylori, wanneer het schadelijke omgevingsomstandigheden ervaart (in of buiten zijn natuurlijke habitat), verandert zijn klassieke bacillaire vorm en komt in een VBNC-toestand die leidt tot morfologische en metabole veranderingen evenals veranderingen in groeigedrag.14,15
levensvatbare maar niet-cultureerbare toestand van H. pylori
hoewel sommige auteurs aanvankelijk probeerden aan te tonen dat de omzetting van bacillaire naar coccoidevorm een passief proces was dat resulteerde in celdood en dat de coccoidevormen daarom de gedegenereerde resten van dode bacteriën waren, 16, 17 drie vormen van H. pylori worden momenteel beschouwd als bestaande, namelijk (in volgorde van meest tot minst virulente), de levensvatbare, cultureerbare bacillaire vorm, de vbnc coccoide vorm en de niet-levensvatbare degeneratieve vorm.Morfologisch vindt conversie van de bacillaire naar de coccoide vorm plaats door middel van tussenliggende V – en U-vormen13,14 (Fig. 1 en 2), waarbij celstructuren zoals het cytoplasma en het celmembraan intact blijven,15, 21 terwijl de flagella de neiging hebben om zich rond de coccoïde cellulaire structuur te wikkelen, waardoor ze bijna onzichtbaar worden. Andere ultrastructurele wijzigingen aan de coccoide vorm resulteren in twee subtypes. Type A heeft onregelmatige randen met een ruw oppervlak en wordt beschouwd als een dode cel, terwijl type B een gladder oppervlak heeft, kleiner is en wordt beschouwd als een levende cel.21,22
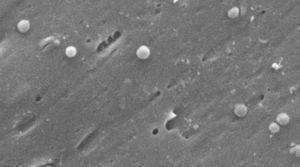
beelden van de coccoïde vorm van Helicobacter pylori. Scanning elektronenmicroscoop figuur met dank aan Dr. Nuno F. Azevedo. LEPABE-Vakgroep chemische Ingenieurswetenschappen van de Faculteit Ingenieurswetenschappen van de Universiteit van Porto (Portugal).
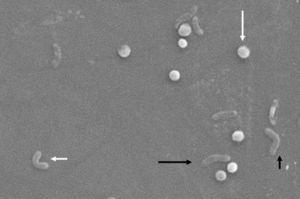
morfologische veranderingen in Helicobacter pylori. Spiraalvorm (lange zwarte pijl), V-vorm (korte zwarte pijl), U-vorm (korte witte pijl) en coccoïde vorm (lange witte pijl). Scanning elektronenmicroscoop figuur met dank aan Dr. Nuno F. Azevedo. LEPABE-Vakgroep chemische Ingenieurswetenschappen van de Faculteit Ingenieurswetenschappen van de Universiteit van Porto (Portugal).
in scanning electron microscope (SEM) analyses van de oppervlakteslijmgellaag van maagkankerpatiënten geïnfecteerd met H. pylori, Ogata et al.23 waargenomen de co-existentie van zowel bacillaire en coccoid vormen. Andere auteurs hebben de aanwezigheid van de coccoide vorm bevestigd in zowel de menselijke maag als de twaalfvingerige darm, 24-26 hoewel het lijkt dat het percentage coccoide vormen hoger is in de twaalfvingerige darm dan in de maag, tot het punt waar alleen de coccoide vorm wordt waargenomen in sommige duodenale biopten.26,27 dit feit suggereert ofwel dat H. pylori wordt gedwongen zich aan te passen aan biologische omstandigheden in de twaalfvingerige darm of dat deze omstandigheden ideaal zijn voor H. pylori om daar zijn toevlucht te nemen in de VBNC-toestand.
In vitro en in vivo experimenten hebben aangetoond dat, bij ongunstige omstandigheden zoals aerobiosis,28,29 alkalische pH,29,30 hoge temperatuur,31 lange incubatieperiode,29,32 langdurige incubatie in water33 of behandeling met proton pomp inhibitors32 of antibiotica,34 de coccoid fenotype kan het handhaven van een bepaalde mate van metabole activiteit, want het is de uitdrukking van een grote verscheidenheid van genen die aanwezig zijn in de bacteriële vorm,35 onderhoudt detecteerbare niveaus van de urease-activiteit,36 blijft de synthese van eiwitten, zij het in kleinere hoeveelheden (minder dan 1% van de hoeveelheid eiwitten gesynthetiseerd door de al deze gegevens onderstrepen het feit dat de biologische veranderingen in H. pylori in reactie op schadelijke stimuli zijn krachtige vermogen, tijdens zijn nuttige leven, weerspiegelen om de species te behouden.
biofilmvorming
net als bij andere bacteriën is het vermogen van H. pylori om als een infectieuze entiteit aan te houden en weerstand te bieden aan het arsenaal van antimicrobiële middelen die gericht zijn op het uitroeien van de ziekte, te wijten aan de genetische variabiliteit die het mogelijk maakt bacteriële resistentie te ontwikkelen. Zijn overlevingsstrategie wordt verder verbeterd wanneer bacteriële cellen vormen wat biofilms worden genoemd.20 Biofilms zijn een soort microbiële “gemeenschap” waarin de bacteriën stevig hechten aan biotische of abiotische oppervlakken door middel van een zelf geproduceerde matrix. Deze matrijs, samengesteld uit extracellulaire polymere substanties,39,40 leidt tot een milieu dat van antimicrobial agenten zeer tolerant en sterk bestand tegen fagocytose is. Verschillende verdedigingsmechanismen van de gastheren worden daarom omzeild, waardoor uitroeiing moeilijk wordt. Biofilms worden beschouwd om werkelijk complexe, dynamische systemen te zijn die horizontale genoverdracht tussen bacteriën vergemakkelijken. Zo verlenen zij bacteriële populaties met nieuwe gewijzigde genomen die beduidend tot bacteriële weerstand, rekvariabiliteit en aanpassingsvermogen bijdragen.41-43
in een studie met 21 biopten van patiënten bij wie de bacterie eerder was uitgeroeid, werd H. pylori in 7 van de biopten geïsoleerd door kweek, terwijl genexpressietechnieken levensvatbare H. pylori-cellen in de meeste biopten detecteerden. SEM, ondertussen, toonde geclusterde coccoidenbacteriën geschikt in een microbiële biofilm, die voorstellen dat de coccoidvormen bacteriële persistentie en antibiotische weerstand konden vergemakkelijken.Gevoeligheid voor antibiotica van de coccoïde vorm
vele studies hebben aangetoond dat H. pylori van de bacillaire naar coccoïde vorm kan veranderen bij blootstelling (in vitro) aan verschillende antimicrobiële middelen. Verschillende concentraties van amoxicilline, claritromycine, metronidazol en erythromycine (om maar een paar van de beschikbare antibiotica te noemen) kunnen deze morfologische transformatie induceren.34,35,45 het grootste inductie-effect is waargenomen met amoxicilline, 27, 34, 46 waarvan bekend is dat het in vitro zeer effectief is tegen H. pylori; morfologische waarnemingen van de culturen tonen echter aan dat bacillaire vormen in aantal afnemen ten gunste van coccoïde vormen.34,46 Faghri et al.Bij meer dan 60% met metronidazol bij tweemaal de minimum inhibitory concentration (mic) en bij 80-90% met claritromycine bij MIC; behandeling met amoxicilline met MIC en MIC× 2 remde echter geen levensvatbare coccoidvormen. Ook Berry et al.34 waargenomen dat terwijl amoxicilline bij MIC× 10 elimineerde bacillaire vormen van H. pylori, het ook de vorming van coccoïde vormen induceerde. Perkins et al.In een onderzoek bij katten die op natuurlijke wijze waren geïnfecteerd met H. pylori, werd waargenomen dat 6 weken na eradicatiebehandeling, maagsappen positief waren voor H. pylori bij slechts één kat, maar toch identificeerde de polymerasekettingreactie (PCR) analyse H. pylori genetisch materiaal bij alle katten in de studie. Hoewel H. pylori werd waargenomen bij een enkele kat, de histologische laesies waren consistent met chronische gastritis en werden gekenmerkt door de aanwezigheid van lymfoïde follikels.Rekening houdend met deze microbiologische en fundamentele onderzoeksgegevens werd in een eerder onderzoek bij patiënten met H. pylori—waarbij de gevoeligheid van de geïsoleerde stammen voor amoxicilline eerder was vastgesteld—bij duale therapie (protonpompremmers en amoxicilline) slechts 66% van de amoxicillinegevoelige stammen genezen. Dit resultaat toont de aanwezigheid van belangrijke bijkomende onafhankelijke bacteriële resistentiefactoren met betrekking tot het succesvolle gebruik van dit antibioticum.49 dit is vooral het geval als we bedenken dat het onmogelijk lijkt dat coccoïde vormen gevoelig kunnen zijn voor β-lactam antibiotica, omdat coccoïde vormen verschillende penicilline-bindende eiwitprofielen hebben van bacillaire vormen.Het is daarom waarschijnlijk dat niet alle H. pylori-organismen volledig worden geëlimineerd na een eradicatiebehandeling, maar dat sommige organismen waarschijnlijk worden omgezet in coccoïde vormen en zo resistent worden tegen antibacteriële geneesmiddelen. Dit zou het falen van de behandeling en recrudescence verklaren.13,34,45
Er zij op gewezen dat enkele zeer recente studies hebben aangetoond dat vrije vetzuren, zoals linoleenzuur en liposomaal linoleenzuur, een bactericide werking hebben op beide H. pylori-vormen, ongeacht hun resistentie tegen antibiotica.51,52 deze moleculen zouden daarom een potentieel effectief antimicrobieel effect kunnen hebben bij de behandeling van infecties met H. pylori, vooral in zijn coccoïde vorm.
virulentie en pathogeniteit van de coccoïde vorm
de virulentiefactoren voor de bacillaire vorm van H. pylori en de mechanismen waardoor deze bacterie betrokken is bij de ontwikkeling van gastro-intestinale aandoeningen zijn uitgebreid bestudeerd.Over de virulentie en pathogeniteit van de coccoïde vorm is echter weinig bekend. Hieronder bekijken we de meest relevante bevindingen over dit onderwerp.
net als de bacillaire vorm brengt de coccoïde vorm belangrijke virulentiegenen tot expressie, zoals ureum, ureB, hpaA, vacA en cagA, cagE en BabA.35,53,54 deze uitdrukking, die zich over een lange periode voordoet, speelt waarschijnlijk een belangrijke rol bij chronische ernstige maagaandoeningen.
therapietrouw van H. pylori aan het gastroduodenale epitheel is bekend als een belangrijke stap in de inductie van actieve chronische ontsteking van de mucosale laag. SEM studies hebben aangetoond dat de coccoid vorm van H. pylori kan aanwezig zijn op het plasmamembraan oppervlak van de maag epitheliale cellen en, net als de bacillaire vorm, heeft de capaciteit om deze cellen binnen te vallen.15,55 als een celinvasie optreedt, worden de coccoïde vormen ingesloten in dubbellaagse membraanblaasjes en verschijnen de epitheelcellen van de maag gezwollen en lytisch, met erosie van de mucosale laag.Aangezien de coccoïde vorm minder gevoelig is voor antibiotica, wordt aangenomen dat deze latente plasmamembraan-vormen zich kunnen verspreiden en andere naburige epitheliale cellen kunnen infecteren bij afwezigheid van een effectieve concentratie antibiotica.Van H. pylori-infectie is ook bekend dat het een lokale immuunrespons veroorzaakt die de bacteriën niet uitroeit, waardoor de maagziekte chronisch wordt. De immune reactie kan door antilichaamopsporing worden bepaald gebruikend serologische methodes die gebruikend de bacillaire vorm van H. pylori worden ontwikkeld.In feite kan de aanwezigheid van deze specifieke antilichamen worden gebruikt als epidemiologische indicator van infectie en om het succes van de behandeling te bevestigen. Er zijn echter geen serologische methoden die coccoïde vormen detecteren. Om te bepalen of coccoïde vormen enig effect hadden op de immuunrespons bij gekoloniseerde individuen, Figueroa et al.59 ontwikkelde een specifieke enzyme-linked immunosorbent assay (ELISA) techniek om de immuunrespons op coccoïde en bacillaire vormen te evalueren en te vergelijken met een panel van sera van symptomatische en asymptomatische geïnfecteerde individuen. De coccoïde vormen van H. pylori werd getoond om een humorale immune reactie te veroorzaken gelijkend op die door de bacillaire vormen in besmette individuen wordt veroorzaakt. In een andere studie die werd uitgevoerd bij kinderen met epigastrische pijn, werd de mogelijke rol van de coccoïde vorm bij H. pylori-infectie onderzocht met behulp van een ELISA-techniek en antigenen bereid uit bacillaire en coccoïde celvormen. Er werd vastgesteld dat 13,3% en 55,8% van de cellen seropositief waren voor respectievelijk antigenen van de bacillaire vorm en de coccoïde vorm, terwijl de seropositiviteitswaarden voor astmatische kinderen respectievelijk slechts 7,0% en 26,5% waren. Dit ruwweg viervoudige verschil in seropositiviteit tussen de coccoïde – en bacillaire-vormantigenen bij symptomatische en asymptomatische patiënten kan wijzen op een mogelijke infectieuze rol van de coccoïde vorm van H. pylori.60
Cellini et al.61 intragastrisch geënte geconcentreerde suspensies van H. pylori in coccoïde vorm in een balb / C muismodel. H. pylori werd 2 weken later geïsoleerd, histopathologische veranderingen traden 1 maand later op en alle gekoloniseerde muizen vertoonden een systemische antilichaamrespons op H. pylori. In andere experimenten met BALB/c-muizen ontwikkelden dieren die waren ingeënt met coccoïde vormen significante pathologische veranderingen in de maag, waaronder erosieve laesies en inflammatoire celinfiltratie van het maagslijmvlies.36 She et al., 53 om virulentie en infectiviteit te vergelijken, intragastrisch geïnoculeerde balb/c muizen met H. pylori, één groep met de bacillaire vorm en een tweede groep met de coccoïde vorm. Bij het SEM-onderzoek van monsters uit de 2 groepen, hebben zij de hechting van zowel bacillaire als coccoide vormen aan de epitheliale cellen van de maagwand en de aanwezigheid van flagella in de coccoide vormen waargenomen. Histologisch onderzoek toonde verschillende gradaties van laesies in het maagslijmvlies aan, van milde inflammatoire celinfiltratie tot erosies en zweren. De mucosale laesie was milder bij de muizen die besmet waren met de coccoïde vorm, terwijl een positief resultaat niet werd verkregen in de controlegroep die steriel water kreeg.53 Rabelo-Gonçalves et al.62 toonde aan dat coccoïde vormen van H. pylori veroorzaakte een acute ontstekingsreactie in de maag van muizen vanaf de vroegste stadia van de infectie. De bovenstaande resultaten benadrukken het vermogen van coccoïde vormen om het maagslijmvlies in vivo te koloniseren en te infecteren.
verschillende studies hebben de aanwezigheid van coccoïde vorm in water aangetoond.33,63 een van deze studies—door onze groep-vergeleek 2 groepen gespeende Wistar muizen, één toegediend bronwater en leidingwater voor een langere periode en de andere toegediend steriel gedestilleerd water, het vinden van dat de studiegroep muizen ontwikkelde een chronisch ontstekingsproces met de vorming van lymfocytaire plaques en de aanwezigheid van bacillen in overeenstemming met H. pylori.64
zoals eerder vermeld, zou het logisch zijn om aan te nemen dat, in ongunstige omstandigheden, H. pylori komt in een “rustgevende” toestand en wijzigt zijn klassieke bacillaire vorm in de coccoïde vorm zonder degeneratieve veranderingen in zijn genoom te veroorzaken en behoudt het vermogen om terug te keren naar de bacillaire vorm zodra de milieu-of natuurlijke habitatomstandigheden verbeteren.
deelname van de coccoïde vorm aan recidief
recidief van H. pylori na succesvolle eradicatie is zeldzaam in ontwikkelde landen in vergelijking met ontwikkelingslanden, met jaarlijkse recidiefpercentages van respectievelijk 2,67% en 13%.65,66
er zijn twee soorten recidieven van H. pylori-infectie: recrudescence, wanneer de bacteriestam die verantwoordelijk is voor de recidief genetisch identiek is aan die geïsoleerd voorafgaand aan de uitroeiing; en herinfectie, wanneer de recidief wordt veroorzaakt door een andere stam.Het onderscheiden van recrudescence van re-infectie vereist PCR of genetische polymorfisme analyse om bacteriestammen te identificeren.Omdat deze methoden niet routinematig worden toegepast, is het vaak onmogelijk om onderscheid te maken tussen recrudescentie en herinfectie in de routine klinische praktijk.
H. recidief van pylori is klinisch relevant, aangezien een terugval van ulcus pepticum kan worden waargenomen bij een aanzienlijk deel van de geïnfecteerde patiënten, terwijl het opnieuw verschijnen van micro-organismen sommige recidieven van MALTLYMFOOM na de behandeling zou kunnen verklaren.Er wordt aangenomen dat factoren zoals het drinken van leidingwater, tand-en tandvleesaandoeningen, terugkerende tonsillitis, ziekenhuisopname, tandheelkundige en medische apparatuur en contact met familieleden de recidief van H. pylori beïnvloeden.Andere factoren die in verband worden gebracht met recidief van infecties zijn jongere leeftijd, diabetes bij jonge patiënten, laag jaarlijks inkomen en langdurige remming van maagzuur na eradicatie.Recidief wordt beschouwd als de meest waarschijnlijke reden voor recidief in het eerste jaar na eradicatie, terwijl herinfectie na een langere periode kan optreden.68,77 veel gevallen van herhaling in ontwikkelde landen zijn in werkelijkheid het gevolg van een recuperatie. Herinfectie komt vaker voor in ontwikkelingslanden, omdat mensen blijkbaar constant worden blootgesteld aan H. pylori.65,78
gebruik makend van polyacrylamidegeleiwitelektroforese technieken, Costas et al.79 vastgesteld dat patiënten met recidief 4 weken na eradicatie behandeling waren in feite niet geïnfecteerd met een andere stam van H. pylori; in plaats daarvan, de stam die de oorspronkelijke infectie had veroorzaakt was niet volledig uitgeroeid door de behandeling, wat leidde tot recrudescence van de infectie. Daarom is het belangrijk om rekening te houden met de werkzaamheid van het therapeutische regime: H. recidief van pylori komt vaak voor bij patiënten die worden behandeld met therapieën met een lage werkzaamheid, maar is zeldzaam wanneer therapieën met een hoge werkzaamheid worden gebruikt. Dit werd aangetoond door een studie naar de incidentie van recidief van H. pylori in Spanje door Gisbert et al.Het recidief van H. pylori 6 maanden na eradicatie was 8,2% bij patiënten behandeld met therapieën met een lage werkzaamheid, maar slechts 1,7% bij patiënten behandeld met therapieën met een hoge werkzaamheid.
in een studie uitgevoerd in Korea van 2007 tot 2010, H. recidiefpercentages van pylori werden geanalyseerd na 6 maanden succesvolle eerste-en tweedelijns-eradicatietherapieën, met jaarlijkse follow—up—tot het einde van de studieperiode-op basis van ademtesten, maagbiopsie en snelle ureasetests.Er werd vastgesteld dat de jaarlijkse recidiefpercentages binnen en na de 2-jarige follow-up respectievelijk 9,3% en 2,0% waren na de eerstelijnstherapie en respectievelijk 4,5% en 2,9% na de tweedelijnstherapie. De auteurs concludeerden dat jaarlijkse H. recidiefpercentages van pylori bij patiënten die een eradicatiebehandeling kregen, vertoonden een sterke daling na de follow-upperiode van 2 jaar. Dit werd beschouwd als voldoende tijd na de behandeling om de eradicatie te bevestigen, en ook voldoende tijd om een onderscheid te maken tussen recidief en recudescentie van H. pylori stammen.81
Slotoverwegingen en conclusies
gezien het vermogen van H. om in een VBNC-toestand te komen wanneer deze wordt blootgesteld aan ongunstige omstandigheden binnen of buiten zijn habitat, is het redelijk om aan te nemen dat antibioticabehandelingsschema ‘ s die worden gebruikt om de bacillaire vorm van H. pylori uit te roeien, VBNC-coccoidevormen kunnen induceren die in de gastroduodenale omgeving langdurig kunnen overleven. Vanaf hier kunnen ze direct en indirect pathogeen potentieel dat leidt tot recrudescence van de infectie en, als gevolg daarvan, behandeling mislukkingen, infectie recidieven en herhaling van gastroduodenale ziekte. Een succesvolle uitroeiing kan daarom niet alleen de uitroeiing van de bacillaire vormen, maar ook van de coccoide vormen vereisen, of ervoor zorgen dat coccoide vormen niet worden geïnduceerd.
rekening houdend met het feit dat, aangezien de routinemethoden die momenteel in de klinische praktijk worden toegepast om de uitroeiing van H. pylori te bevestigen, coccoidevormen niet kunnen detecteren, gastheren ten onrechte als infectievrij kunnen worden gediagnosticeerd; bovendien kunnen deze methoden mogelijk geen volledig bewijs leveren van het klinische potentieel van de geneesmiddelen die worden gebruikt om H. pylori uit te roeien. Om eradicatie als succesvol te beschouwen, wordt een jaarlijkse follow-up aanbevolen—met behulp van niet-invasieve technieken of, indien beschikbaar, moleculaire methoden—om te bepalen of bacteriën volledig zijn geëlimineerd, vooral in gebieden met hoge prevalentie en bij patiënten met een risico op recidief.
ten slotte is verder onderzoek nodig naar de coccoide VBNC-vorm van H. pylori, het pathogene potentieel ervan, de betrokkenheid bij infectie en recudescentie en de rol ervan bij de vorming van biofilms in de maag en andere plaatsen in de gastheer. Dergelijke studies zouden de ontwikkeling mogelijk maken van zowel effectievere diagnostische protocollen die de kolonisatie door H. pylori niet onderschatten als van nieuwe therapeutische strategieën gericht op het elimineren van coccoïde vormen en het “ontwapenen” van biofilms.
belangenverstrengeling
de auteurs verklaren dat zij geen belangenverstrengeling hebben.