słowa kluczowe
zapalenie płuc wywołane przez cytomegalowirusa; Bronchiolitisobliterans organizujące zapalenie płuc; Immunocompetent
wprowadzenie
objawy kliniczne zakażenia wirusem cytomegalii (CMV)można podzielić na Ostre zakażenie pierwotne iaktywacja. Pierwotna infekcja CMV występuje najczęściej w okresie karmienia piersią i dzieciństwa i jest bezobjawowa lub występuje jako łagodny zespół podobny do mononukleozy uimmunokompetentnych dorosłych . Następnie wirus utrzymuje się przez całe życiew gospodarz, na ogół w stadium utajonym. Reaktywacja CMV z latencji jest dobrze znana u pacjentów z obniżoną odpornością i może wpływać na prawie każdy narząd. Jednakże ciężkie zapalenie płuc wywołane przez CMV występuje rzadko u immunokompetentnych gospodarzy . Obecnie dokładne mechanizmy molekularne i immunologiczne są nadal nieznane.
zapalenie oskrzelików (ang. Bronchiolitis obliterans organizing pneumonia, BOOP) – stan kliniczny charakteryzujący się kaszlem, złym samopoczuciem, gorączką oraz brakiem odpowiedzi na antybiotyki . Jego klatkę piersiową opisano jako zmiany miejscowe, wielokrotne i dyfuzyjne. Można go znaleźć z alergicznym zapaleniem pęcherzyków płucnych, napromieniowaniem zapalenia płuc, reakcjami lekowymi i innymi infekcjami organizującymi. Sporadycznie zgłaszano przypadki związane z etiologią wirusową powikłaną Boofawą. Poniżej przedstawiamy przypadek zapalenia płuc CMV związanego z BOOPEM u immunokompetentnego pacjenta za pomocą terapii gancyklowiru, który jest pierwszym takim przypadkiem w historii, o ile nam wiadomo.
opis przypadku
63-letni mężczyzna został skierowany do naszego szpitala z powodu 10-dniowego kaszlu i gorączki. Miał napadowy kaszel z żółtą plwociną. Gorączka, ze świszczącym oddechem pojawiała się głównie po południu iw nocy, a najwyższa temperatura wynosiła 39,3(102,74). Jego wcześniejsza historia medyczna obejmowała nadciśnienie, cukrzycę i podagrę. Jego poprzednia historia rodzinna była niczym niezwykła. Jego parametry życiowe były następujące: temperatura ciała: 36,5 (97,7), tętno: 98 uderzeń na minutę(BPM), ciśnienie krwi: 98/61 mmHg.
na badaniu fizykalnym wykryto późne pęknięcia wdechowe w obustronnych dolnych polach płucnych. Liczba białych krwinek(WBC) wynosiła 14,2 × 109/L, z 81,9% neutrofilami (NEUTR), 12,8% limfocytami (LYR) i 0,53 × 109/Lmonocytami (MONOR) (rycina 1). Stężenie białka C-reaktywnego w surowicy(CRP) wynosiło 110,67 mg/l.
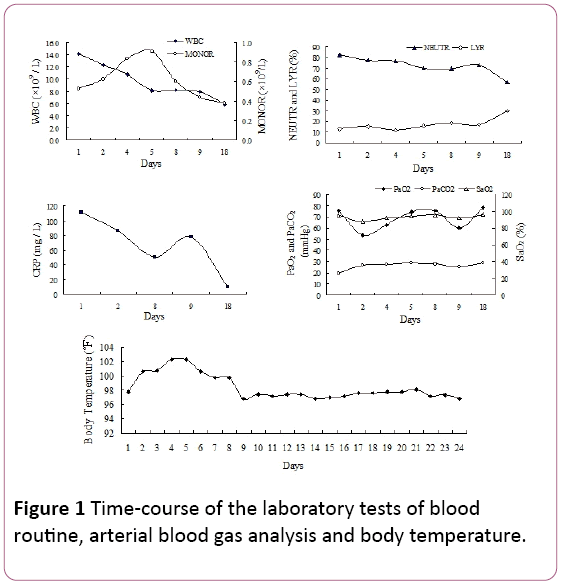
Rysunek 1: Czas-przebieg badań laboratoryjnych krwiodruku, analiza gazowa krwi tętniczej i temperatura ciała.
parcjalne ciśnienie tętnicze tlenu (PaO2) wynosiło 75,5 mmHg,parcjalne ciśnienie tętnicze CO2 (PaCO2) 25,8 mmHg I nasycenie tlenem 94,7% (sao2, 2 L/min dopływ tlenu przez kaniulę nosową). Z powodu gorączki i objawów infekcji oddechowych, empirycznie rozpoczęliśmy leczenie antybiotykami tazobaktamem piperacyliny. Jednak temperatura pacjenta nie zmniejszyła się, a duszność rozwijała się w uporczywych 4 dniach przyjmowania do szpitala.
pomiary gazometrii krwi tętniczej wykazały niepowodzenieodpływu (PaO2: 53,5 mmHg, PaCO2: 35,6 mmHg, SaO2: 87,7%) z równoważoną kwasicą metaboliczną (HCO3 -: 21mmol/l, pH 7,39) przy użyciu tlenu 2 L/min przez kaniulę nosową.Wyniki badań laboratoryjnych były następujące: przeciwciało mykoplazmapneumoniczne: 1: 40 (dodatnie), endotoksyna bakteryjna (całkowita zawartość lipopolisacharydu bakterii gram-ujemnych): 49,14 pg/ mL, fibrynogen w osoczu (Fg): 7,51 g/L, aktywowany czas częściowej tromboplastyny (APTT): 45,9 sekundy.
elektrokardiogram wykazał tachykardię zatokową ze zmianą Twave. Zdjęcie rentgenowskie klatki piersiowej wykazało dwie infekcje płuc, nie licząc zmian śródmiąższowych w płucach (rycina 2A). Tomografia komputerowa klatki piersiowej (CT) wykazała zmiany śródmiąższowe (cień siatki w obu płucach) oraz powiększenie węzłów chłonnych śródmiąższowych (ryc. 2D). Następnie 3,5 L/min dostarczano z maseczką do twarzy tlen, a leczenie antybiotykami zamieniono na cefoperazon sodowy i sól sodową sulbaktamu i lewofloksacynę.
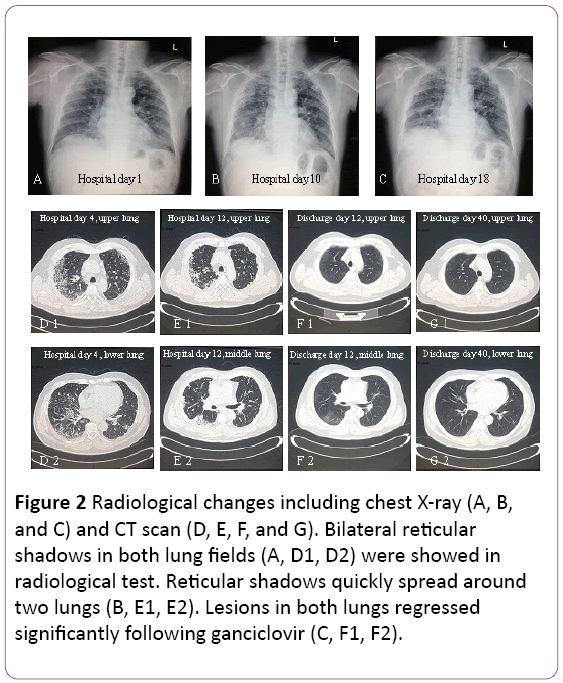
Rysunek 2: Zmiany radiologiczne, w tym RTG klatki piersiowej (A, B I C) i tomografia komputerowa (D, E, F I G). W teścieradiologicznym wykazano obustronne cienie siateczkowe w obu polach płucnych (a, D1, D2). Cienie siateczkowe szybko rozprzestrzeniają się wokół dwóch płuc (B, E1, E2). Zmiany w obu płucach ulegały regresji znacząco po gancyklowirze (C, F1, F2).
biorąc pod uwagę rozpoznanie śródmiąższowego zapalenia płuc, przeprowadzono odpowiednie testy laboratoryjne i bronchoskopię światłowodową w dniu 5. Wyniki badań laboratoryjnych były następujące: CMV PCR: negatywny, CMV IgM: negatywny, immunoglobulina IgG: pozytywny, HIV: ujemny, WBC: 7,96 × 109 /L, NEUTR: 72,4%, LYR: 17%, CRP: 77,51 mg/l, funkcja immunologiczna (komórki T, B, NK):normalna, podgrupy limfocytów T: normalna. Markery chorób autoimmunologicznych, w tym okołojądrzastych-ANCA (p-ANCA),cytoplazmatycznych-ANCA (C-ANCA), ANA i anty-dsDNA były allnegatywne.
czynność płuc sugerowała umiarkowaną dysfunkcję wentylacyjną. RTG i tomografia komputerowa wykazały, że zmiany w płucach górnych zostały wchłonięte, ale zaostrzyły się w prawym dolnym płucu (ryc. 2b i 2e).
bronchoskopia wykazała obustronne zapalenie oskrzeli (rycina 3A).Płyn do płukania oskrzelowo-pęcherzykowego (Bal) był ujemny w postaciobakterii i plamy PAS. Różnicowa liczba komórek wykazała 11% neutrofili, 19% limfocytów i 70% makrofagów.Wewnątrzjądrzaste i wewnątrzcytoplazmatyczne ciała inkluzywne znaleziono w bocznym segmencie podstawy tkanki płucnej transbronchialbiopsy (Tblb) prawej dolnej części (fig.3b). W oparciu o diagnozę zapalenia płuc wywołanego wirusem cytomegalii z organizacją,leczenie gancyklowirem (5 mg/kg) we wlewie dożylnym co 12 godzin rozpoczęto w dniu 8. Zgodnie z powyższym połączeniem z objawami klinicznymi (gorączka ustępuje), w dniu 8 zmieniono leczenie antybiotykami na moksyfloksacynę. Po 1 tygodniu terapii antywirusowej kaszel uporczywy. Przeszedł biopsję płuca przez tomografię komputerową. Przebadano biopsję płuc (ryc. 3C). Następnie pacjent leczy się doustnym steroidhormonem. Jednak jego objawy stopniowo się poprawiływw ciągu 1 tygodnia. Zdjęcie rentgenowskie klatki piersiowej wykazało, że dwa obicia były lepsze niż wcześniej (ryc. 2C).
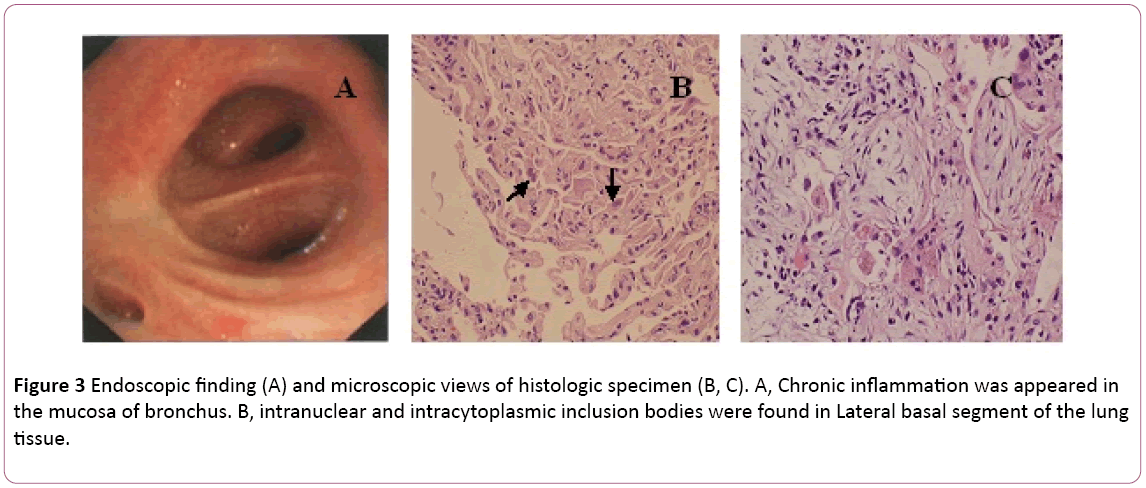
Rysunek 3: Badanie endoskopowe (a) i mikroskopowe widoki próbki histologicznej (B, C). A, pojawił się przewlekły stan zapalny wkłucie błony śluzowej oskrzeli. B, wewnątrzjądrowe i wewnątrzcytoplazmatyczne ciała inkluzywne znaleziono w bocznym, bazalnym segmencie lungtissue.
leczenie zmieniono na gancyklowir doustny, 0,6 g / d (co 12 h) przez 7 dni, wyładowanie. W jego obserwacji, cień siatki w obulungs znacznie regressed (rysunek 2F i 2G). Nadal przebywa w przychodni.
dyskusja
CMV jest wirusem DNA z rodziny Herpesviridae i jest częstym Rzeczywiście, 40% do 100% dorosłych jest zakażonych CMV na całym świecie . Zakażenia CMV w populacji ogólnej są zwykle subkliniczne. Objawowe zakażenie CMV występowało głównie u pacjentów z zaburzeniami odporności,w tym pacjentów z AIDS, nowotworami złośliwymi, biorców przeszczepów i noworodków . W przypadkach niedoboru odporności Cmkażenie może powodować zapalenie płuc, zapalenie siatkówki,zapalenie wątroby, zapalenie mózgu, polineuropatię demielinizacyjną,zapalenie mięśnia sercowego, zapalenie trzustki,choroby przewodu pokarmowego i choroby nadnerczy i tak dalej . Wręcz przeciwnie, ciężkie zagrażające życiu infekcje wywołane przez CMV, w tym CMV zapalenie płuc, sąidealne u osób z odpornością. W tym artykule opiszemy przypadek zapalenia płuc wywołanego przez CMV, związanego z boopinem immunokompetentnym gospodarzem i skutecznie leczonego gancyklowirem.
CMV zapalenie płuc często objawia się jako ciężkie wirusowe zapalenie płuc, z rozproszonymi naciekami śródmiąższowymi na RTG klatki piersiowej i niewydolnością oddechową . Diagnostyka laboratoryjna może byćtrudne, i są wykonane serologicznie lub patologicznie.Ogólnie rzecz biorąc,testy serologiczne w celu wykrycia infekcji CMV u ludzi obejmują miano przeciwciał CMV (IgM, IgG), białka cmvpp65 i CMV PCR . Co ważne, histopatologiczne wykrycie ciałek inkluzji CMV w biopsji przezoskrzelowej lub openlung jest patognomoniczne, ponieważ zapalenie płuc CMV u pacjentów niezakompetentnych stanowi rzadkie zdarzenie .
u naszego pacjenta wystąpiły niespecyficzne objawy (kaszel i gorączka), które rozwinęły się w ciągu 10 dni.Objawy pogorszyły się po 2 dniach pobytu w szpitalu(ciężka hipoksemia), pomimo empirycznej antybiotykoterapii. Diagnozę zapalenia płuc wywołanego przez CMV oparto na TBLB, który został odkryty wewnątrzjądrzastych i wewnątrzcytoplazmatycznych organów inkluzji wewnątrzgałkowych jako złoty standard. Co więcej, dodatni wynik przeciwciał IgG CMV w surowicy był kolejnym wskaźnikiem diagnostycznym. Obraz teradiologiczny, w tym RTG klatki piersiowej i tomografia komputerowa pokazująca cienie siateczkowe dwustronne w obu polach płuc, wsparł diagnozę wirusowego zapalenia płuc. W naszym przypadku zaobserwowano również mononukleozę rutyny krwi (ryc. 1). Jednak serumIgM CMV był negatywny w tym przypadku, co było zgodne z raportem Eddlestona . CMV PCR również było negatywne. Może to tłumaczyć fałszywie negatywnymi wynikami wywołanymi przemijającym charakterem wiremii .
podczas hospitalizacji liczba limfocytów zmniejszyła się znacząco. Limfopenia była spowodowana zakażeniem CMV, które uniemożliwiało bezpośrednie hamowanie wzrostu komórek progenitorowych i samoodnowę komórek macierzystych . Można zauważyć, że analiza funkcji immunologicznych, takich jak podgrupa limfocytów T, limfocyty B i NKcell, była normalna. W tym przypadku nie obserwowano przemijającej lub subklinicznej nieprawidłowości komórek T oraz inwersji stosunku limfocytów T CD4/CD8. W chorobie HIV zmniejszenie liczby komórek CD4+< 100 × 10 6 / l stanowi wysokie ryzyko wystąpienia choroby CMV. Ponadto, nasz pacjent nie wykazywał żadnych dowodów na inne niedobory odporności (HIV: negatywne) i chorób autoimmunologicznych (przeciwciała autoimmunologiczne: negatywne).
BOOP został po raz pierwszy opisany przez Eplera i wsp. od tego czasu były szeroko badane i raportowane na całym świecie . Istnieje wiele czynników zakaźnych może byćzwiązane z BOOP, takich jak wirus cytomegalii (CMV), wirus herpessimplex (HSV). Odnotowano również pasożytnicze i pneumocystis cariniiinfekcje. Ponieważ BOOPrepresent sposób, w którym płuca mogą reagować na bodziec zapalny, kluczowe ustalenia patofizjologiczne arerelated do szlaku zapalnego. Cechy histologiczne obejmują tkankę granulacyjną w ścianach pęcherzyków ioskrzelowe są znaczące, związane z infiltracją w jamie śródmiąższowej i tchawicy przez różne stopnie komórek jednojądrzastych i komórek piankowych. Można również zaobserwować rozrost nabłonka pęcherzykowego typu II . W obecnym pacjencie, Boop został zdiagnozowany w biopsji płuca tydzień później niż TBLB, co sugeruje, że CMV może być najbardziej probablepatogenem.
chociaż nie ma zalecanego standardowego czasu trwania leczenia forgancyklowirem u pacjentów z CMV zapaleniem płuc, leczenie można rozpocząć dopiero po ostatecznym rozpoznaniu i jest zwykle podawane przez dwa do trzech tygodni. Jak tylko leczenie gancyklowirem poprawiło stan kliniczny naszego pacjenta, z całkowitym ustąpieniem obrazu klinicznego iradiologicznego w ciągu miesiąca obserwacji.
wniosek
zgłaszamy przypadek ostrego zakażenia CMV, który wykazywał gorączkę, kaszel, plwocinę i tachypnea. Ten ostatni szybko się rozpada i wiąże się z niewydolnością oddechową.Tomografia wykazała niewielką zmianę zmielonego szkła na początku, ale zmiana szybko rozprzestrzeniła się wokół dwóch płuc. Po badaniu patologicznym (TBLB) potwierdzono rozpoznanie CMVpneumonia. W przypadku pacjentów z zaburzeniami niedoboru odporności bardzo łatwo jest błędnie zdiagnozować.W obecnym sprawozdaniu sugeruje się, że w przypadku tomografii komputerowej klatki piersiowej wykazującej zmiany śródmiąższowe,oprócz rozważenia gruźlicy, bakteryjnego zapalenia płuc iinnych chorób wirusowych, CMVpneumonia powinna zostać uwzględniona u pacjentów w podeszłym wieku zróżnorodnością podstawowej choroby. Co ważne, w tym przypadku wykazano, że zapalenie płuc wywołane wirusem cytomegalii może kojarzyć się z IMMUNOKOMPETENTNYM pacjentem BOOP. Leczenie gancyklowirem jestskuteczne. Konieczne są dalsze badania w celu przeanalizowania zależności i jej mechanizmu leżącego pomiędzy Cmvp i BOOP.
wkład autora
CXC napisał i napisał rękopis. WC, LL i LYH zajmowały się opieką nad pacjentem i przyczyniły się do koordynacji ich pracy. XL przeprowadził testy mikrobiologiczne. Lyhkontributed to the draft of the manuscript and revised themanuscript. Wszyscy autorzy zapoznali się z manuskryptem i zatwierdzili jego ostateczną wersję.
podziękowania
jesteśmy wdzięczni Prof. Zhiqiangowi Qinowi za jego teoretyczne wsparcie.
- Hamprecht K, Maschmann J, Vochem m, Dietz K, Speer CP, et al. (2001) Epidemiology of transmission of cytomegalovirus from mother to preterm infant by breastfeeding. Lancet 357:513-518.
- Carter D, Olchovsky D, Pokroy R, Ezra D (2006) Cytomegalovirus-associated colitis causing diarrhea in an immunocompetent patient. World J12:6898-6899.
- Kralickova P, Mala E, Vokurkova D, Krcmova I, Pliskova L, et al. (2014) Choroba cytomegalii u pacjentów z częstym zmiennym niedoborem odporności: trzy przypadki. International Archives of Allergy and Immunology 163: 69-74.
- Eddleston M, Peacock s, Juniper m, Warrell DA (1997) Severe cytomegalovirus infection in immunocompetent patients. Clin Infect Dis 24: 52-56.
- Cunha BA (2010) zapalenie płuc wywołane wirusem cytomegalii: zapalenie płuc nabyte we Wspólnocie u immunokompetentnych gospodarzy. Infect Dis Clin North Am 24: 147-158.
- Cohen JI, Corey GR(1991) Cytomegalovirus infection in the normal host. Medicine 1985; 64:100-114.
- Geddes DM. BOOP and COP. Thorax46:545-547.
- Hansell DM (1992) What are bronchiolitis obliterans organizing pneumonia (BOOP) and cryptogenic organizing pneumonia (COP)? ClinRadiol45:369-70.
- Cunha BA, Syed U, Mickail N(2012) Renal transplant with bronchiolitis obliterans organizing pneumonia (BOOP) attributable to tacrolimus and herpes simplex virus (HSV) pneumonia. Heart & Lung 41:310-315
- Bitzan m, Ouahed JD, Carpineta L, Bernard C, Bell LE (2010) Kryptogeniczne organizowanie zapalenia płuc po terapii rytuksymabem w przypadku domniemanej choroby limfoproliferacyjnej po przeszczepie nerki. Pediatric Nephrology 25: 1163-1167.
- de la Hoz RE, Stephens G, Sherlock C (2002) Diagnosis and treatment approaches of CMV infections in adult patients. J ClinVirol 25: 1-12.
- Sanadgol N, Ramroodi N, Ahmadi GA, Komijani M, Moghtaderi A, et al.(2011) częstość występowania zakażenia wirusem cytomegalii i jego rola w całkowitym wzorze immunoglobulin u irańskich pacjentów z różnymi podtypami stwardnienia rozsianego. New Microbiologica 34: 263-274.
- Chiotan C, Radu L, Serban R, Cornacel C, Cioboata m, et al. (2014) zapalenie siatkówki wywołane wirusem cytomegalii u pacjentów z HIV / AIDS. Journal of medicine and life 7: 237-240.
- Liu WL, Lai CC, Ko WC, Chen YH, Tang HJ i in. (2011) Clinical and microbiological characteristics of infections caused by various Nocardia species in Taiwan: a multicenter study from 1998 to 2010. Eur J ClinMicrobiol Infect Dis30: 1341-1347.
- Beam E, Razonable RR (2012) Cytomegalovirus in solid organ transplantation: epidemiology, prevention, and treatment. Curr Infect Dis Rep14: 633-641.
- Westman G, Berglund D, Widen J, Ingelsson m, Korsgren O, et al. (2014) zwiększona odpowiedź zapalna u seropozytywnych pacjentów z wirusem cytomegalii z chorobą Alzheimera. PloS one9: 96779.
- Carney WP, Rubin RH, Hoffman RA, Hansen WP, Healey K, et al. (1981) Analysis of T lymphocyte subsets in cytomegalovirus mononucleosis. J126:2114-2116.
- Boeckh M, Leisenring W, Riddell SR, Bowden RA, Huang ML, et al. (2003) Late cytomegalovirus disease and mortality in receivers of allogenic hematopoietic stem cell transplants: importance of viral load and T-cell immunity. Blood 101:407-414.
- Gunthard HF, Aberg JA, Eron JJ, Hoy JF, Telenti A, et al. (2014) Antiretroviral treatment of adult HIV infection: 2014 recommendations of the International Antiviral Society-USA Panel. JAMA 312:410-425.
- Epler GR, Colby TV, McLoud TC, Carrington CB, Gaensler EA (1985) N Engl J Med 312:152-158.
- Kute VB, Patel MP, Patil SB, Shah PR, Vanikar AV,et al. (2013) Bronchiolitis obliterans organizing pneumonia (BOOP) after renal transplantation. IntUrolNephrol 45:1517-1521.
- White KA, Ruth-Sahd LA (2007) Bronchiolitis obliterans organizing pneumonia. Crit Care Nurse27:53-66.
- Yale SH, Adlakha A, Sebo TJ, Ryu JH(1993)Bronchiolitis obliterans organizing pneumonia caused by Plasmodium vivax malaria. Chest 104:1294-1296.
- Kleindienst R, Fend F, Prior C, Margreiter R, Vogel W(1999)Bronchiolitis obliterans organizing pneumonia associated with Pneumocystis carinii infection in a liver transplant patient receiving tacrolimus. Clin Transplant13:65-67.
- Moore SL (2003)Bronchiolitis obliterans organizing pneumonia: a late complication of stem cell transplantation. Clin J OncolNurs 7:659-662.