소개
비알코올 지방간 질환은 간 질환의 가장 흔한 형태로서 인식되어 왔다(안굴로,2002;클락 외., 2002). 비 알콜 성 지방 간염(내쉬)은 음주의 병력이 없음에도 불구하고 알코올성 간염을 모방합니다(루드비히 외., 1980). 비만,인슐린 저항성,고지혈증 및 고혈압으로 인한 대사 증후군과 관련이 있습니다. 가장 흔한 간 질환으로 간주되며 일반적으로 단순 간 지방증(티니아코스 외)으로 나타납니다., 2010). 대조적으로,내쉬는 심한 지방증,소엽 염증 및 간 섬유증이 특징입니다(파월 외. 1990;베르토와 아담스,2016). 내쉬의 개발을 담당하는 메커니즘은 불분명하지만,내쉬는 염증,산화 스트레스 및 내 독소(틸그와 모센,2010)와 같은 간 지방증이’첫 번째 히트’로서의 후속 히트와 함께’다중 히트’과정에 의해 발생하는 것으로 제안됩니다. 내쉬는 대사 증후군과 밀접한 관련이 있으며,여러 임상 연구에서 당뇨병,고지혈증 및 고혈압의 증상에 초점을 맞추어 내쉬의 치료 적 치료를 조사했습니다. 2009;박 외. 2010;마하디 외., 2011). 그러나,일반적으로 받아들여지는 치료 대리인은 설치되지 않았습니다.
키 마제는 간 섬유증의 병인에 관여 할 수있다. 키 마제 활성은 섬유증 또는 간경변 환자의 간에서 유의하게 증가했으며 키 마제 수준과 섬유증 정도 사이에 유의 한 상관 관계가 있었다(코 메다 외., 2008). 내쉬 환자에서 증가된 키마제 활성은 보고되지 않았지만,내쉬(타시로 외)의 동물 모델에서 관찰되었다. 2010;마스부치 외. 2013;미야 오카 외., 2017). 대조적으로,저분자 억제제를 사용하는 키 마제의 억제는 쥐 및 햄스터 내쉬 모델에서 염증,지방증 및 섬유증의 유의 한 감소를 초래했다(타시로 외. 2010;마스부치 외. 2013;미야 오카 외., 2017). 이러한 결과는 내쉬(그림 1)의 발달과 진행 중에 키 마제가 염증,지방증 및 섬유증에 관여 할 수 있음을 나타냅니다.
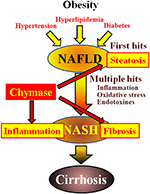
그림 1. 비만,인슐린 저항성,고지혈증 및 고혈압에 의해 대사 증후군과 관련이 있습니다. 내쉬는 간 지방증이”첫 번째 히트”와 염증,산화 스트레스 및 내 독소와 같은 후속 히트 인’다중 히트’과정을 통해 발생하는 것으로 생각되며 심한 지방증,염증 및 섬유증이 특징입니다. 키 마제는 간에서 지방증,염증 및 섬유증의 진행에 관여 할 수 있습니다.
비만 세포에서의 카이 마제
카이 마제의 다중 기능
카이 마제(적능력 3.4.21.39)는 비만 세포의 분비 과립으로 발현된다. 키 마제는 분비 과립 내에서 비활성 프로 키마 제로서 생성되며,활성화를 위해 디 펩티딜 펩 티다 제 1(디피)가 필요하다. 이 약은 100%안전하며 200%안전합니다. 이후 분 비과 립 내 산도 산도 5.5(드 젊은 외 알에서 조절 됩니다.,1987)(그림 2). 그러나,키마제는 이 산도에서 비만 세포 내에서 효소 활성이 없다,왜냐하면 키마제에 대한 최적의 산도는 7 과 9 사이이기 때문이다(타카이 외., 1996, 1997). 염증 및 손상과 같은 자극에 의한 비만 세포 과립의 활성화에 따라,키 마제가 방출되고 최적의 산도 7.4 에서 효소 기능을 나타낸다(그림 2).
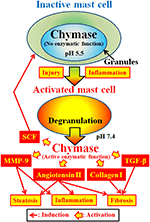
그림 2. 키 마제는 비활성 비만 세포의 분비 과립에 저장됩니다. 과립 내의 산도는 산도 5.5 로 유지되며,이는 키마제가 효소 활성이 없는 상태이다. 키마제는 염증과 상해에 의하여 활성화 다음 비만 세포 과립에서 방출에 안지오텐신 2 의 형성과 같은 그것의 효소 기능을 전시합니다.
키마제의 다중 효소 기능
키마제는 세린 프로테아제이며,일반적으로 페,티르,트루르프 등의 방향족 아미노산을 사용한 후 단백질의 씨-말단면을 절단한다. 키마제는 비생체활성 펩타이드 안지오텐신 1 의 페 8–히 9 결합을 절단하고,인간을 포함한 포유류 조직(우라타 외)에서 그 생리활성 펩타이드 안지오텐신 2 를 형성할 수 있다. 1990;타카이 외., 1996, 1997). 또한,키마제는 매트릭스 메탈로프로테이나제 -9 의 전구체를 효소 적으로 절단하여,성장 인자를 변형시킨다. 1997;타카이 외. 2003;후루바야시 외., 2008). 또한,키마제의 효소 기능은 비활성 막 결합 형태의 효소 절단에 의해 줄기 세포 인자를 생성 할 수 있으며,이는 미숙 한 비만 세포로부터 성숙한 비만 세포의 형성을 유도합니다., 1997). 따라서 키 마제는 안지오텐신 2 의 활성화를 포함한 여러 효소 기능을 가지고 있습니다.
안지오텐신 2 에서 키마제의 효소 기능은 동물 내쉬 모델(히로세 외)에서 안지오텐신 2 수용체의 자극에 따른 반응성 산소 종을 증가시킴으로써 간 지방증 및 염증을 촉진시킬 수 있다. 2007;나베시마 외., 2009). 안지오텐신 2 는 또한 간 성상 세포에서 평활근 액틴의 유도를 통해 간 섬유증을 유도했다., 2001). 호중구 및 대 식세포의 침윤을 유도하는 것으로보고되었다., 2006). 내쉬 환자의 경우,정상적인 대조군에 비해 간에서 유의 한 증가가 관찰되었다., 2004). 유전자 변형 생쥐에서 프로 콜라겐의 증가를 통해 심각한 간 섬유증을 생성했습니다., 1993). 간 섬유증을 유발하는 것으로 알려져 있습니다. 비만세포의 활성화는 비만세포 수의 증가를 유도하고,그 효소 기능은 섬유조직에서 키마제 활성의 증가를 초래할 수 있다(마루이치 외., 2004). 키 마제의 이러한 효소 기능은 지방증,염증 및 섬유증에 관여 할 수 있으며,모두 내쉬 환자 및 동물 모델의 간에서 관찰됩니다(그림 2).메티오닌 및 콜린 결핍식이 요법은 일반적인 내쉬 모델을 유도하는 데 널리 사용되었습니다. 햄스터에서 맥도날드 다이어트를 공급,총 빌리루빈,트리글리세리드,히알루 론산의 상당한 증가가 혈장에서 관찰되었다(타시로 외., 2010). 더욱,선동적인 세포의 축적 및 지질 예금 지역 및 섬유성 지역의 증가는 간에서 관찰되었습니다. 간 키마제 활성 및 관련 요인(예:안지오텐신 2 세,안지오텐신-9 세,콜라겐 1 세)이 유의하게 증가 하였다(타시로 외.2).간 키마제 활성 및 관련 요인(예:안지오텐신 2 세,안지오텐신 2 세,안지오텐신 2 세,안지오텐신 2 세). 2010;마스부치 외., 2013). 최근,새로운 내쉬 모델이 개발되어 뇌졸중이 발생하기 쉬운 자발적 고혈압 쥐에게 고지방 및 콜레스테롤(키타 모리 등)을 먹였다., 2012). 이 모델은 임상 적으로 내쉬 환자의 것과 유사한 생각 대사 증후군의 증상을 보여 주었다(기타 모리 외., 2012). 간에서 심한 지방증,섬유증 및 염증 세포 축적이 검출되었다., 2017). 또한,키 마제 활성의 유의 한 증가가 관찰되었다., 2017). 따라서,내쉬 동물 모델에서 키 마제와 내쉬 병인 사이에 밀접한 관계가있는 것으로 보인다.내쉬 동물 모델에서의 키마제 억제제의 효과
내쉬 동물 모델에서의 키마제 억제제의 효과
저분자 키마제 억제제는 키마제 활성을 현저하게 약화시키고,내쉬 다이어트-피드 내쉬 햄스터 모델에서 간에서의 안지오텐신 및 콜라겐 수준을 감소시켰다.알 2010;마스부치 외., 2013). 키 마제 억제제는이 내쉬 모델에서 간 지방증,섬유증 및 염증 세포 축적을 유의하게 예방했다(타시로 외. 2010;마스부치 외., 2013). 산화 스트레스는 내쉬 개발의’다중 히트’이론에 역할을 할 것으로 생각되며,산화 스트레스 마커 말 다이 디 알데히드의 증가는 키 마제 억제제(마스 부치 등)에 의해 간에서 유의하게 감쇠되었다., 2013). 햄스터 맥도널드식이 유도 내쉬 모델에서,키 마제 억제제는 확립 된 내쉬(마스 부치 등)에서 투여 될 때 개선 효과를 나타냈다., 2013). 간에서의 지방증 및 섬유증의 정도는 키마제 억제제 투여 전과 비교하여 감소되었다(마스부치 외., 2013).
고혈압 쥐의 간에서,저분자 키마제 억제제는 키마제 수준을 약화시켰다., 2017). 키 마제 억제제는 간 지방증 및 섬유증을 현저하게 약화 시켰고,염증의 마커,특히 호중구 침윤(미야 오카 외)으로서 골수 페 록시 다제를 감소시켰다., 2017). 위약치료군의 생존율은 위약치료군의 시작 후 14 주에 0%였고,심각한 간부전(미야오카 외)의 결과였다., 2017). 그러나,키마제 억제제-처리 그룹은,쥐를 키마제 억제제로 처리한 후,14 주에 100%생존율을 보였다. 또한,키마제 억제제로 치료받은 쥐에 대해 50%의 생존율이 보고되었다., 2017).
따라서,키마제 억제제는 동물 모델에서 내쉬의 예방 및 개선에 유용한 작용제가 될 수 있다. 간 염증,지방증 및 섬유증을 간접적으로 촉진한다. 그러나 이러한 인자들이 반드시 안지오텐신 2 세(타카이 외)에 의해서만 유도되는 것은 아니다., 2010). 안지오텐신 2 차 자극 이외의 인자는 유전자 발현(타카이 외)의 증가에 기여한다., 2010). 이러한 경우,안지오텐신 수용체 차단제(안지오텐신 수용체 차단제)는 안지오텐신 수용체 차단제(안지오텐신 수용체 차단제)를 감쇠시킬 수 없다.키마제 억제제에 의해 감쇠된 간 염증의 기전
키마제 억제제는 햄스터식이에서 염증을 감소시킬 수 있었다. 2010;마스부치 외. 2013;미야 오카 외., 2017). 키 마제 억제제 치료는 간에서 키 마제 활성을 현저하게 약화 시켰을뿐 아니라 안지오텐신 2 및 9 수준을 감소시켰다(타시로 외. 2010;마스부치 외. 2013;미야 오카 외., 2017). 안지오텐신은 니코틴아미드 아데닌 디뉴클레오티드 포스페이트의 활성화를 통해 과산화수소 및 슈퍼옥사이드와 같은 로스의 생성을 유도한다. Chymase 억제제의 결과에서 감소에서 유전자 발현 NADPH 산화 효소의 구성 요소 Rac-1 며 산화적 스트레스 마커 화학작용을 일으킬 때에만의 감소는 앤지오텐신 II 수준에 햄스터 MCD-유도 NASH 모델(Masubuchi et al., 2013). 이 연구는 호중구 및 대 식세포에서 유전자 발현을 촉진시키는 것으로 나타났습니다. 2011;구리하라 외., 2012). 따라서 키마 제 억제제는 안지오텐신 2 의 감소를 통해 유전자 발현을 간접적으로 감소시킨다. 간세포의 침윤을 유도하고,대 식세포 및 호중구의 침윤을 유도한다., 2006). 간에서 대식세포와 호중구에서의 골수 퍼 옥시 다제 발현의 유의 한 증가가 관찰되었고,키 마제 억제제(미야 오카 외)에 의해 감소되었다., 2017). 따라서,키 마제 억제제에 의해 감쇠 된 염증의 메커니즘은 간에서 안지오텐신 2 차 및 9 차 수준의 감소에 의존 할 수있다.키마제 억제제
에 의해 감쇠된 간 지방증의 기전 안지오텐신 2 는 로스 생산을 통해 간 지방증에 영향을 미칠 수 있다. 간 지방증의 개발을 둔화. 2007;기마르 2007;기마르 2007;기타., 2010). 다이어트 유도 내 쉬 마우스 모델에서 지방 증의 중요 한 감쇠 안지오텐신 2 수용 체 결핍 마우스에서 관찰 되었다(나베시마 외., 2009). In vivo 및 vitro 실험을 보여주는 앤지오텐신 II upregulated sterol regulatory element-binding protein(SREBP)-1c 과 지방산 synthase(FAS)유전자 발현,모두의 중요한 요소의 규정에 lipogenesis,다음과 같은 선생님 확대(Kim et al.,2001;혼고 외., 2009). 간 지방 증의 유전자 발현을 하향 조절과 함께 감쇠., 2012). 또한,저분자 키마제 억제제(마스부치 외)를 사용한 치료 후 유의한 감쇠가 관찰되었다., 2013). 따라서,키 마제 억제제에 의한 간 지방증의 개선 메커니즘은 간에서 감소 된 안지오텐신 2 세대를 통해 로스 생산의 감소에 의존 할 수있다.
키마제 억제제에 의해 감쇠된 간 섬유증의 기전
키마제는 조직 섬유증의 진행과 밀접한 관련이 있을 수 있는데,이는 비생물활성 전구체인 키마제-182>로부터 키마제-182>의 형성에 기여하기 때문이며,키마제-182>는 섬유아세포의 성장을 강하게 유도하는 것으로 알려져 있다. 2003;오야마다 외., 2011). 2013 년 11 월 15 일(토)~2013 년 11 월 15 일(일), 2000). 유전자 발현 및 신호 전달을 통한 간 섬유증 억제 기능은 실험 모델에서 개선 된 간 섬유증을 초래했습니다.,1999;아리아 등., 2003). 키마제 억제제에 의한 키마제 활성의 감쇠는 간에서 섬유화 수준 및 섬유화 영역의 감소를 초래하였다(미야오카 외., 2017). 따라서,키 마제 억제제에 의한 간 섬유증의 감소는 간 섬유증의 예방에 기여할 수있다.
안지오텐신 2 세는 또한 간 섬유증의 유도에 관여 할 수있다. 안지오텐신 2 세(안지오텐신 2 세)는 체외 섬유아세포의 수축 및 증식을 유도하고,또한 체외 섬유아세포의 유전자 발현을 유도한다. 1994;배틀러 외., 2000). 그러나,이들은 안지오텐신 2 수용 체 결핍 마우스에서 감쇠 했다., 2005). 쥐 내쉬 모델에서,원형질환의 감소를 통해 간 섬유증을 약화시켰다., 2007). 안지오텐신 2 와 간 섬유증 사이의 관계가있을 수 있습니다. 만성 간염 환자에서 콜라겐 유전자 발현을 감소시켰다., 2009). 간에서 콜라겐의 주요 생산 세포로 인식되고,간에서 평활근 액틴의 발현에 확대(스몰)강하게 세포 외 기질 침착을 유도,콜라겐 나는 포함(드 미니 시스와 브레너,2007). 안지오텐신 2 세 쥐의 유전자 발현을 유도 할 수 있습니다. 반면,안지오텐신 2 차 봉쇄는 간 섬유증의 감쇠와 함께 간 섬유증의 감소를 초래합니다., 2001). 내쉬 환자에서 평가 하지,비록 키 마 제와 안지오텐신 2 형성 활동 간 경 변,환자에서 간 섬유 성 영역에서 크게 증강 했다 및 키 마 제,안지오텐신 2 형성 활동 및 간 섬유 증 사이의 중요 한 상관 관계(코메 다 외.)관찰 되었다., 2008). 햄스터 테트라 클로라이드 유도 간경변 모델에서 키 마제 및 안지오텐신 2 형성 활성의 유의 한 증가가 관찰되었으며,이는 저분자 키 마제 억제제(코 메다 외)로 치료 한 후 간경변과 함께 유의하게 감쇠되었다., 2010).
비만세포 안정제 트라니라스트는 비만세포의 활성화를 억제하여 키마제의 방출을 차단하여 쥐의 당뇨병 및 간 섬유증의 발생을 예방할 수 있다., 2008). 키마제는 효소 기능에 의한 비만 세포 활성화를 통해 비만 세포의 증식을 촉진합니다(롱리 외., 1997). 내쉬 동물 모델에서,키 마제 억제제는 간에서 비만 세포 수의 증가를 감소시켜,키 마제 억제제에 의한 직접 억제 및 비만 세포에서의 키 마제 발현의 간접적 인 감소에 따른 키 마제 활성을 감소시켰다(마스 부치 외. 2013;미야 오카 외., 2017).
따라서,키마제 억제제는 안지오텐신 제 2 및 비만 세포 증식의 감소를 통한 키마제 억제 및/또는 키마제-제 2 수준의 감쇠에 의한 키마제-제 2 활성화의 억제를 통한 간 섬유증의 예방에 기여할 수 있다.
결론
비만,인슐린 저항성,고지혈증,고혈압을 포함하는 대사증후군은 내쉬의 발달과 밀접한 관련이 있으며,내쉬의 치료를 위해 항당뇨병,항고혈증,항고혈압제의 시험이 실시되었다. 이러한 에이전트 뒤에 개념은 대사 증후군의 증상을 감쇠하는 것입니다(게오르게스쿠 외. 2009;박 외. 2010;마하디 외., 2011). 이전 보고서는 키 마제 억제제가 당뇨병,고지혈증 및 고혈압의 동물 모델에서 혈당 및 지질 수준 및 혈압에 각각 영향을 미치지 않고 염증 및 섬유증을 약화 시킨다는 것을 입증했습니다(이노우에 외. 2009;타카이 외.,2014;장 외., 2016). 따라서 키 마제 억제의 개념은 내쉬 간 염증 및 섬유증을 직접 약화시키는 것입니다. 우리는 대사 증후군을 대상으로 하는 키 마 제 억제제는 내 쉬 진행의 감쇠에 대 한 잠재적으로 강력한 전략 제안.
저자 기여
세인트 디제이:원고를 썼다. 두 저자 모두 최종 원고를 읽고 승인했습니다.
이해 상충 성명
저자는 연구가 잠재적 인 이해 상충으로 해석 될 수있는 상업적 또는 재정적 관계가없는 상태에서 수행되었다고 선언합니다.