Abstract
cirrotische cardiomyopathie is een recent erkende aandoening bestaande uit myocardiale disfunctie die zich manifesteert bij cirrotische patiënten zonder voorafgaande hartziekte. De onderliggende pathogenetische mechanismen omvatten een” miocardiotoxische ” omgeving die leidt tot een afgestompte hartrespons op stress, hetzij fysiek of farmacologisch. Deze aandoening is nu beter begrepen en kan worden gediagnosticeerd ondersteund klinische, door laboratorium elektrocardiografie en echocardiografie criteria. Klinisch, systolische incompetentie is het meest duidelijk wanneer cirrotische patiënten onder stress worden geplaatst, of fysieke of farmacologische. Ondanks het feit dat goed begrepen, is er een gebrek aan kennis om een goede praktische toepassing. Recente case reports hebben gesuggereerd dat CCM vroeg moet worden behandeld omdat het een triggerende factor voor cirrose complicaties kan zijn. Er zijn Studies nodig om mogelijke behandelingen te identificeren die de natuurlijke geschiedenis van hartziekten bij cirrotische patiënten veranderen, vooral in de fasen waarin de patiënten asymptomatisch zijn.
sleutelwoorden
levercirrose, hartfalen, cardiomyopathie
Inleiding
cirrotische cardiomyopathie (CCM) is een cardiale disfunctie gekenmerkt door suboptimale contractiele respons op stress en een verstoorde diastolische functie in afwezigheid van een eerdere hartziekte . Tegenwoordig, heeft het onderzoek voorgesteld dat cirrotische patiënten een intrinsieke hartdysfunctie hebben die in de ontwikkeling van niermislukking in gevorderde leverziekte kan beà nvloeden .
sinds 2002 zijn de bevindingen over circulatoire dysfunctie bij leveraandoeningen geëvolueerd door middel van diagnostische methoden, waarbij het belang van identificatie van CCM in de klinische praktijk wordt benadrukt . Nochtans, is er nog een hiaat van kennis met betrekking tot beheer van deze voorwaarde . De aanwezigheid van myocardiale disfunctie bij cirrose verhoogt het risico op hepatorrenaal syndroom (HRS) en cardiale bijwerkingen en houdt verband met een hogere mortaliteit .
we hebben de beschikbare literatuur in PubMed bestudeerd met betrekking tot de markers voor cirrose complicaties en de interacties van het hart en de lever. Het doel van dit overzicht is om de noodzaak te bespreken om CCM vroegtijdig te volgen en te behandelen, aangezien het een triggerende factor voor cirrose complicaties kan zijn, waardoor nieuwe inzichten in de klinische praktijk worden gebracht.
definitie en prevalentie
CCM beschrijft chronische cardiale disfunctie bij cirrotische patiënten ondanks geen eerdere structurele hartziekte . Het wordt gedefinieerd door een of meer van de volgende: structurele afwijkingen in hartkamers; diastolische disfunctie; normale of verhoogde systolische functie in rust maar slechte contractiele reactie op stress; en elektrofysiologische veranderingen . Deze afwijkingen kunnen worden waargenomen bij maximaal 50% van de cirrotische patiënten .
fysiopathologie
cirrose fysiopathologie is bekend door overproductie van stikstofmonoxide (NO) in splanchnische vaten en de daaruit voortvloeiende systemische vasodilatatie. Dit mechanisme triggers rennin-angiotensine-aldosteron systeem (RAAS) en sympathische zenuwstelsel activering en verhoogt serum vasopressin niveau, wat leidt tot een hyperdinamische staat die van cellulaire tot klinische montages kan repercusseren.
deze patiënten hebben een verhoogd serumkoolmonoxide (CO) secundair aan sympathische hyperactiviteit en inflammatoire cytokines. Er is een stijging van CO, geassocieerd met hoge NO-spiegels, accumulatie van endocannabinoïden en andere vasodilatatoren. Deze stoffen verhogen cyclisch guanosine monofosfaat (cGMP) leves, die cyclisch adenosine monofosfaat (cAMP) remt in cardiomyocites, verantwoordelijk voor de instroom van calcium en een grotere contractiele kracht (figuur 1,2) . Myocardiale cellen analyse toont een vermindering van plasmateuze membraanvloeiing als gevolg van cholesteroldepositie, die de interactie van stoffen zoals bèta-adrenerge receptoren en G-eiwitten bemoeilijken . De ventriculaire myociet kan ook een afname van de kaliumkanalen functie, wat leidt tot een suboptimale cardiale ontspanning, en de daaruit voortvloeiende diastolische disfunctie .
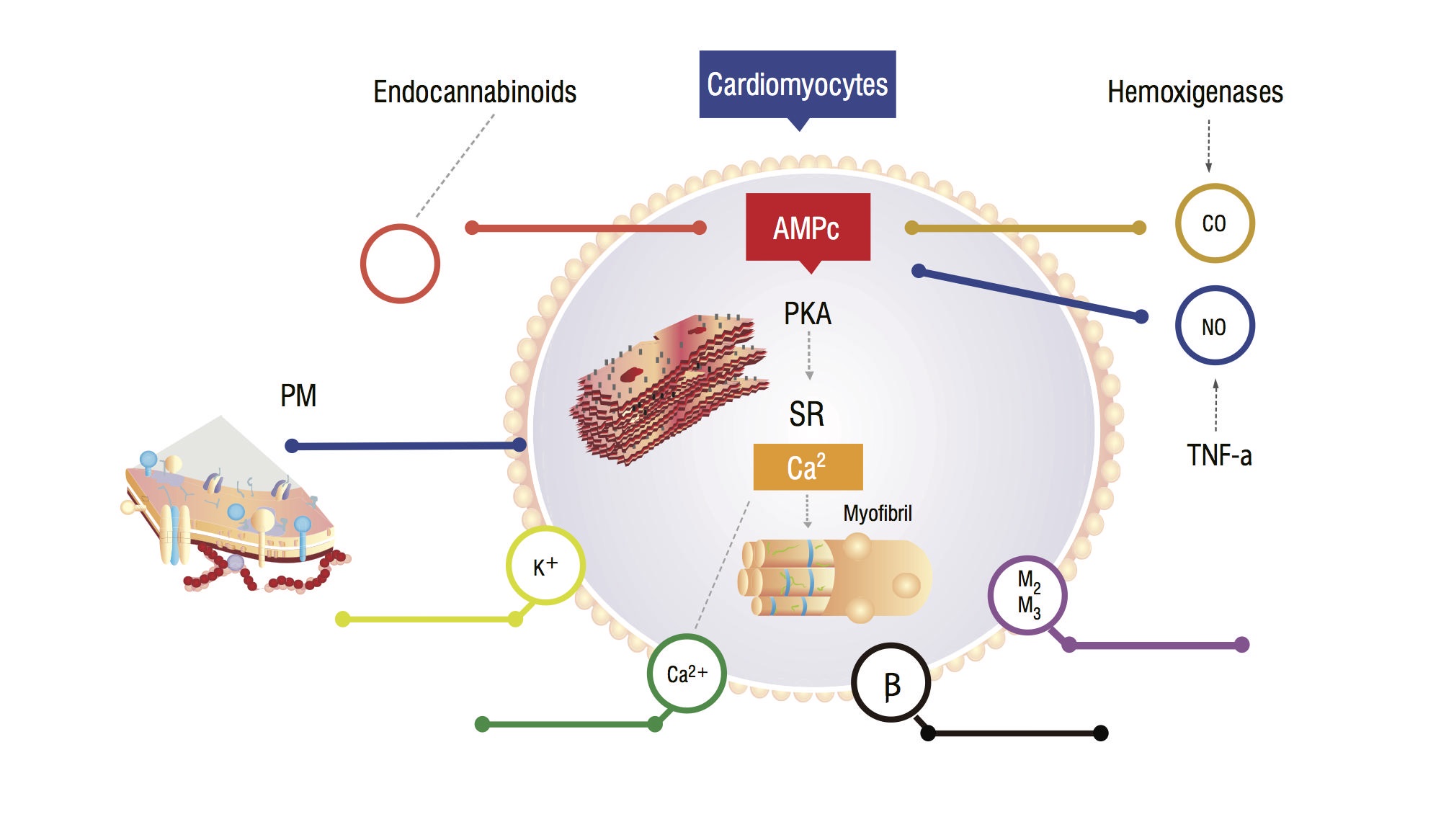
figuur 1. Physiopathologisch model van cardiomyocyte met belangrijke signaalwegen die leiden tot een afgestompte myocardiale respons op stress. PM: plasmamembraan; Co: Koolstofoxide; NO: stikstofmonoxide; TNF-a: tumornecrosefactor alfa; Sr: Sarcoplasmatische reticulum; AMPc: cyclisch adenosine monofosfaat; PKA: proteïne kinase A.
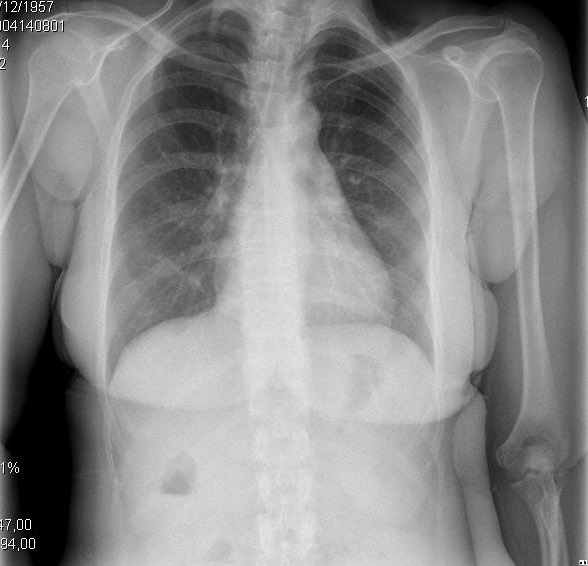
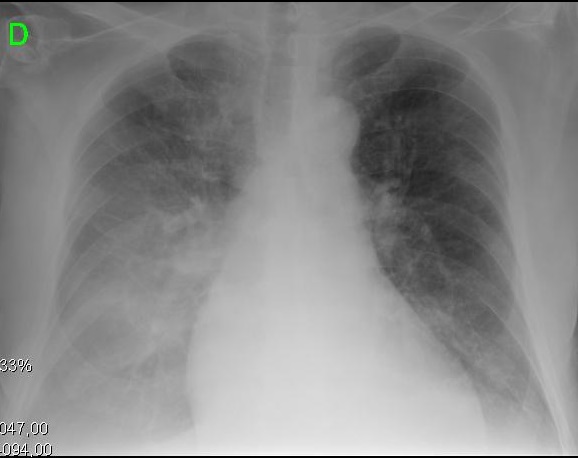
Figuur 2. Klinische en radiologische presentaties van verschillende evolutionaire stadia van cirrotische cardiomyopathie. A. linker afbeelding toont kleine pleurale effusie en CTI van 0,50. B. rechter afbeelding toont een ernstige pulmonale congestie en CTI van 0,67.
Tabel 1. Klinische en aanvullende criteria voor de diagnose van CCM. Aangepast van referentie 29 met toestemming.
de persisterende bèta-adrenerge stimuli induceren down-regulatie en verminderen de dichtheid van de cardiale receptoren, waardoor signaalcascades worden gewijzigd die verantwoordelijk zijn voor calciumkanaalactivering ; het resultaat is een verminderde contractiele functie . De klinische weerslag van deze weg is een afgestompte myocardiale functie en een verhoging van cardiale biomarkers .
de identificatie van CCM berust op subtiele klinische kenmerken die kunnen worden ontmaskerd naarmate de ziekte vordert, of die duidelijk zichtbaar kunnen worden in specifieke klinische scenario ‘ s van stam, en wordt een uitdaging met betrekking tot het al dan niet behandelen van CCM.
natuurlijke voorgeschiedenis en diagnose
diagnostische criteria zijn samengevat in Tabel 1 en zijn gebaseerd op klinische beeldvorming en biomarkers.
klinische kenmerken
klinische kenmerken van CCM kunnen optreden bij patiënten met een ogenschijnlijk normale hartfunctie, aangezien chronische aanpassing van de cardiomyocyt aan de cirrotische omgeving leidt tot al deze cellulaire wijzigingen .Cirrotische patiënten evolueren met natrium-en vochtretentie, perifere vasodilatatie, sympathische hyperactiviteit en accumulatie van “miocardiotoxische” stoffen , wat een adaptief proces van cardiomyocyten vereist. Deze continuümbalans kan worden verbroken en een latent hartfalen in stresssituaties, zoals levertransplantatie, transjugulaire intrahepatische portosystemische shunt of infecties aan het licht brengen .
hoewel cirrotische cardiomyopathie vaak een chronische aandoening is, blijkt uit onderzoeken dat klinische symptomen van myocardiale disfunctie binnen 15 maanden na een succesvolle levertransplantatie kunnen verdwijnen, evenals de QT-verlenging .
laboratoriumbevindingen
aangezien cardiale dysfunctie kan worden weerspiegeld door inflammatoire biomarkers, worden nieuwe cardiale en pro-inflammatoire markers onlangs bestudeerd en gecorreleerd aan de ontwikkeling van complicaties die leiden tot verhoogde mortaliteit .Recente studies beschrijven de correlatie tussen de niveaus van prohormoon van ANP (proANP) en B-type natriuretisch peptide (BNP), copeptine en hooggevoelige troponine T (HS-TnT), alsmede oplosbare urokinase-type plasminogeen activator receptor (suPAR) en hooggevoelige c-Reactieve proteïne (hs-CRP) en cardiovasculaire complicaties bij cirrose. Nochtans, wordt het klinische gebruik nog geëvalueerd .
natriuretisch peptide wordt uitgescheiden door de cardiomyocyten als reactie op volume-of drukoverbelasting, of myocardiale ischemie, om het RAAS-effect in de natrium-en waterbalans te compenseren . BNP kan een van de meest beschikbare biomarkers zijn die een vroege herkenning van cardiale betrokkenheid mogelijk maakt . De serumconcentratie is hoger naarmate de lever en hartziekten ernstiger worden .
veelbelovende studies tonen aan dat hoge adrenomedullinespiegels ook worden gezien bij cirrose met of zonder klinische cardiale betrokkenheid; deze stof wordt vrijgegeven in de bloedstroom als vasodilatator en heeft tot doel afterload te verminderen . Galectine-3, de meest recente bestudeerde biomarker verhoogd bij cirrotische patiënten, is geassocieerd met myocardiale fibrose en kan correleren met de ernst van cirrose. Deze marker blijkt gevoeliger te zijn dan BNP in de evaluatie van diastolische dysfunctie, maar is minder specifiek .Elektrocardiogram
elektrocardiogram
elektrocardiografische (ECG) afwijkingen kunnen vroeg worden opgemerkt bij een asymptomatische ccm-patiënt en kunnen correleren met ventriculaire aritmieën en plotseling overlijden . De meest voorkomende ECG-bevinding is verlenging van het QT-interval, die kan worden waargenomen bij ongeveer 30-40% van de cirrotische patiënten, voornamelijk Child-Pugh B of C, ongeacht cirrose-etiologie .
dit ECG-patroon kan secundair zijn aan cardiomyocyten – repolarisatieafwijkingen in kaliumkanalen en vermindering van de concentratie van deze kanalen in het plasmamembraan, als reactie op kleine wijzigingen in de portaaldruk . Ionische kanalen disfuncties veroorzaakt daardoor myocardiale cellen actie potentiële verlenging, wat resulteert in langere ventriculaire systole en QT . Langere contractietijd impliceert verminderde ontspanning, die diastolische dysfunctie veroorzaken .Elektromechanische ontkoppeling wordt beschreven als een dyssynchronie tussen elektrische stimulus en systolische mechanische reactie van het hart, waarbij bij deze patiënten progressief verlies van de myocardiale functie en congestief hartfalen optreedt .1 De chronotrope incompetentie wordt gekenmerkt door het onvermogen van de sinusknoop om te reageren op fysiologische of farmacologische stimuli , een determinant feit in ccm fysiopathologie. Deze veranderingen zijn ook secundair aan portale hypertensie, autonome dysfunctie, hyperdynamische circulatie en de aanwezigheid van de pro-inflammatoire factoren die het myocardium van de patiënt beïnvloeden .Echocardiogram
Echocardiogram
Echocardiogram geeft relevante gegevens over de hartfunctie en wordt gebruikt als diagnostische criteria voor cirrotische cardiomyopathie .
de belangrijkste bevindingen bij deze patiënten zijn vergroting van de end-diastolische linker ventrikel (LV), vermindering van de pieksnelheid en systolische deformiteit; verhoogde einddiastolische linkerventrikeldruk, zonder geschikte LVEF-expansie. Linker atrium (LA) vergroting voor meer dan 34 mL/m2may suggereert chronische diastolische disfunctie en, wanneer geassocieerd met vermindering van LV massa, kan wijzen op slechtere prognose . LA evaluatie kan worden gemaakt door middel van twee dimensie echocardiografie en speckle tracking .
vaak waargenomen bevindingen in de cardiale Doppler-echocardiografie duiden op verminderde myocardontspanning bij cirrotische patiënten: afname van de e / A-verhouding (<1), en verlengde e-golfvertragingstijd (DT) en isovolumetrische relaxatietijd (IVRT) > 80ms .De ernstigere is de diastolische disfunctie, korter is de ivrt en mitrale DT, en hoger is de e/A snelheidsverhouding, kenmerkend voor geavanceerde diastolische disfunctie, verhoogde la druk, en slechtere functionele klasse.
recente studies met global longitudinal strain (GLS) evaluatie tonen aan dat dit een nuttige methode kan zijn voor de vroege detectie van cardiale disfunctie bij cirrotische patiënt, voornamelijk de systolische disfunctie in rust .
E / A ratio kan een betrouwbare parameter zijn bij de diagnose van diastolische disfunctie bij cirrotische patiënten, zelfs bij waarden die worden beïnvloed door de mate van hydratatie van de patiënt, hoewel deze kan variëren als gevolg van ascites en een volumeoverbelasting . Ondertussen vertegenwoordigt de isovolumetrische relaxatietijd, hoewel zeer gevoelig, niet de LV-vulling en varieert naarmate de hartslag verandert .
een lichte systolische disfunctie en een diastolische disfunctie kunnen onafhankelijk van de mate van cirrose optreden. Nochtans, wordt de diastolische dysfunctie het meest gevonden in cirrotische patiënten en over het algemeen voorafgaat de eerstgenoemde .
discussie
dit overzicht richt zich op een toenemende identificatie en inzicht in de fysiopathologie van CCM, het is correlatie met een slechte prognose bij cirrotische patiënten en doet de bezorgdheid rijzen over de therapeutische benadering.
dit artikel vatte de diagnostische criteria (Tabel 1) samen die reeds in de medische literatuur zijn vastgesteld, met de nadruk op de nieuwe biomarkers die zijn bestudeerd voor diagnostische aanvulling. Studies hebben aangetoond dat myocardiale disfunctie bestaat in verschillende stadia van levercirrose. Er is beschreven dat als de patiënt een hoge BNP en ventriculaire disfunctie op het echocardiogram, de behandeling van het nierfalen is zeer moeilijk; aan de andere kant, vroege interventie bij patiënten die nog niet hebben vastgesteld hart-en vaatziekten is een gebied dat nog niet is onderzocht.
Tabel 1. Klinische en aanvullende criteria voor de diagnose van CCM. Aangepast van referentie 29 met toestemming.
Klinische kenmerken
Geen cardiopulmonale symptomen in rust
Lage functionele cardiale reserve
Hiperadrenergic staat met natrium-en vochtretentie
Biomarkers (troponin I, pro-BNP en BNP, anderen)
Eletrocardiography
Elektrofysiologische afwijkingen (QT verlenging en anderen)
Echocardiographic criteria
Diastolische evaluatie
E/A-ratio <1.0 (leeftijd gecorrigeerd)
Langdurige isovolumic ontspanning tijd (>80msec)
Langdurige vertraging van de tijd (>200msec)
Linker ventrikel hypertrofie
Systolische evaluatie
ejectiefractie in rust < 55%
Contractiele tekort in de stress
De tekenen en symptomen van leverfalen hebben de neiging te laat, met een subtiele klinische en laboratorium manifestaties, soms moeilijk te interpreteren. De specialist, of zelfs de huisarts, kan worden geconfronteerd met een patiënt met dyspneu klacht, zonder pathologische halsslagader zwelling, normale eerste cardiologie examens, maar met een hoge BNP, die een geval van CCM kan vertegenwoordigen.
in tegenstelling tot andere studies stelt onze groep een verbetering op dit gebied voor, aangezien de kennis van hartziekten die gepaard gaan met cirrose een vroege therapeutische interventie van complicaties die kunnen worden toegeschreven aan niet-gediagnosticeerd myocardfalen mogelijk kan maken. Levertransplantatie en TIPS zijn speciale klinische omgevingen die hartfalen bij deze patiënten kunnen deflagreren. Aangezien patiënten langer na deze procedures overleven, zouden artsen geconfronteerd worden met verslechterende hartparameters .
wij geloven dat vroege therapeutische interventie bij CCM veelbelovend is, wanneer het zich manifesteert door complicaties zoals refractaire uren, alvorens duidelijke pulmonale congestie te vertonen die kan worden toegeschreven aan myocardiaal falen. De literatuur ondersteunt dat situaties van fysieke of farmacologische stress, of infecties, geassocieerd met latente cirrotische cardiomyopathie, kunnen resulteren in uren, die refractair kunnen zijn voor conventionele behandelingen en geassocieerd kunnen worden met een slechtere prognose als systolische disfunctie aanwezig is .
onze ervaring suggereert dat de presentatie van HRS een aanwijzing is om de behandeling van de myocardiale component te starten. Deze progressie naar HRS wordt begrepen aangezien het bestaan van CCM een trigger en bestendigende factor van HRS is, dus als CCM vroeg in deze context wordt benaderd, kan HRS een betere prognose hebben .
onze groep is pionier in de behandeling van patiënten met een klinische diagnose van ccm in progressie tot SHR refractair voor conventionele behandelingen, waarbij het gebruik van dobutamine als rescue therapie voor de nierfunctie succesvol was. Het doel is om deze theoretische kennis anticiperen op deze complicatie in eindstadium leverziekte patiënten toe te passen .
ondanks het feit dat het goed wordt begrepen, is er een gebrek aan kennis voor een goede praktische toepassing. Een hoge mate van klinische verdenking is vereist om CCM te herkennen bij de asymptomatische patiënt zonder duidelijke functionele beperkingen, maar met subklinische cellulaire en structurele hartziekte.
Studies zijn nodig om mogelijke behandelingen te identificeren die de natuurlijke voorgeschiedenis van hartaandoeningen bij cirrotische patiënten veranderen, met name in de fasen waarin de patiënten asymptomatisch zijn. Dit vertegenwoordigt een gebied van kennis dat nog niet is onderzocht, vooral met betrekking tot toekomstige therapeutische opties.
belangenconflicten
de auteurs verklaarden dat er geen belangenconflicten zijn met betrekking tot de publicatie van dit artikel.
financiële steun
geen.
- Sampaio F, Pimenta J (2016) Left ventricular function assessment in cirrosis: Current methods and future directions. Wereld J Gastroenterol 22: 112-125.
- Shin WJ, Song JG, Jun IG, Moon YJ, Kwon HM, et al. (2016) Effect van ventriculo-arteriële koppeling op transplantatieresultaten bij cirrose: analyse van Druk-volume curve relaties. J Hepatol.
- Carvalheiro F, Rodrigues C, Adrego T, Viana J, Vieira H, et al. (2016) diastolische dysfunctie bij levercirrose: prognostische voorspeller bij levertransplantatie? Transplantatieproc 48: 128-31.
- Merli M, Torromeo C, Giusto M, Iacovone G, Riggio O, et al. (2016) overleving na 2 jaar bij levercirrotische patiënten wordt beïnvloed door het linker atriale volume en de linker ventriculaire massa. Lever Int.
- Møller s, Henriksen JH (2002) Cirrotic cardiomyopathy: a pathophysiological review of circulatory dysfunctie in liver disease. Hart 87: 9-15.
- Mocarzel LO, Bicca J, Jarske L, Oliveira T, Lanzieri P, et al. (2016) cirrotische cardiomyopathie: een ander geval van een succesvolle aanpak van de behandeling van hepatorenaal syndroom. Gastroenterol 10: 531-7.
- Timoh T, Protano MA, Wagman G, Bloom M, Vittorio TJ (2011) A perspective on cirrotic cardiomyopathy. Transplantatieproc 43: 1649-1653.
- Ma Z, Lee SS (1996) cirrotische cardiomyopathy: getting to the heart of the matter. Hepatologie 24: 451-459.
- Zardi EM, Abbate A, Zardi DM, Dobrina A, Margiotta D, et al. (2010) cirrotische cardiomyopathie. J Am Coll Cardiol 56: 539-549.
- Myers RP, Lee SS (2000) cirrotische cardiomyopathie en levertransplantatie. Levertranspl 6: S44-52.
- Wiese S, Mortensen C, Gøtze JP, Christensen E, Andersen O, et al. (2014) cardiale en pro-inflammatoire markers voorspellen prognose bij cirrose. Lever Int 34: e19-30.
- Fattouh AM, El-Shabrawi MH, Mahmoud EH, Ahmed WO (2016) Evaluation of cardiac functions of cirrotic children using serum brain natriuretic peptide and tissue Doppler imaging. Ann Pediatr Cardiol 9: 22-8.
- Rahman S, Mallett S V (2015) cirrotische cardiomyopathie?: Implicaties voor de perioperatieve behandeling van levertransplantatiepatiënten 7: 507-20.
- Farr M, Schulze PC (2015) Recent Advances in the Diagnosis and Management of Cirrhosis-Associated Cardiomyopathy in Liver Transplantation Candidates: Advanced Echo Imaging, Cardial Biomarkers, and Advanced Heart Failure Therapie. Clin Med Insights Cardiol 8: 67-74.
- Licata A, Corrao s, Petta s, Genco C, Cardillo M, et al. (2013) nt pro BNP plasma niveau en atriale volume zijn gekoppeld aan de ernst van levercirrose. PLoS One 8: e68364.
- Abbas WA, Kasem Ahmed SM, Abdel Aa AM, Mahmoud AA, Abdelmalek MO, Mekky MA, et al. Galactin-3 en Brain natriuretic peptide versus conventionele echocardiografie in de vroege detectie van cirrotische cardiomyopathie. Turk J Gastroenterol 27: 367-74. Wong F, Siu S, Liu P, Blendis LM (2001) Brain natriuretic peptide: is it a predictor of cardiomyopathy in cirrhosis? Clin Sci (Lond) 101: 621-628. Wong F (2009)cirrotische cardiomyopathie . Hepatol Int 3: 294-304.
- Mimidis K, Papadopoulos V, Thomopoulos K, Tziakas D, Ritis K, et al. (2003) verlenging van het QTc-interval bij patiënten met cirrose. Ann Gastroenterol 16: 155-8.
- Mozos I (2015) risico op aritmie bij levercirrose. Wereld J Hepatol 7: 662-672.
- Mocarzel LO, Bicca J, Jarske L, Oliveira T, Lanzieri P, et al. (2016) cirrotische cardiomyopathie: een ander geval van een succesvolle aanpak van de behandeling van hepatorenaal syndroom. Gastroenterol 10: 531-537.
- Batchvarov V, Camm AJ (2014) QT dispersion: Measurement and interpretation.
- Páll a, Czifra A, Vitális Z, Papp M, Paragh G, et al. (2014) pathofysiologische en klinische benadering van cirrotische cardiomyopathie. J Gastrointestin Liver Dis 23: 301-310.
- Castro Hevia J, Antzelevitch C, Tornés Bárzaga F, Dorantes Sánchez M, Dorticós Balea F, et al. (2006) tpeak-Tend en tpeak-Tend dispersie als risicofactoren voor ventriculaire tachycardie/ventriculaire fibrillatie bij patiënten met het Brugada-syndroom. J Am Coll Cardiol 47 (9): 1828-34.
- Demir C, Demir M (2013) Evaluation of TP-e interval and TP-e/QT ratio in patients with chronic hepatitis B. Prague Med Rep 114: 239-245. Jewell DP (2006)New patients, new lessons, new thinking in inflammatory bowel disease: World Congress of Gastroenterology Symposium, Montreal, Canada. Colorectale Dis 8 Suppl 1 (s1): 1-2.
- Gassanov N, Caglayan E, Semmo N, Massenkeil G, Er f (2014) Cirrotic cardiomyopathy: a cardiologist ‘ s perspective. Wereld J Gastroenterol 20: 15492-15498.
- Chayanupatkul M, Liangpunsakul S (2014) cirrotische cardiomyopathie: review of pathophysiology and treatment. Hepatol Int 8: 308-315.
- Møller S, Henriksen JH, Bendtsen F (2014) Extrahepatic complications to cirrhosis and portal hypertension: haemodynamic and homeostatic aspects. World J Gastroenterol 20: 15499–517.
- Møller S, Bendtsen F (2015) Cirrhotic Multiorgan Syndrome. Dig Dis Sci 60: 3209-3225.