- Introduzione
- Materiali e metodi
- Raccolta di ovociti e microiniezione cRNA
- Isolamento di Frazioni di Membrana e Immunoblotting
- Immunoistochimica
- Microscopia elettronica a frattura congelata
- Paired-Oocyte Assay and Quantification of Contact Areas
- Saggio di impulso di pressione idrostatica
- Incubazione di caprato
- Analisi statistica
- Risultati
- Espressione di Claudin-5 e integrazione in X. membrana plasmatica dell’ovocita di laevis
- Patch di fili a giunzione stretta sono visibili negli ovociti che esprimono Claudin-5
- Analisi accoppiata di ovociti per l’analisi della trans-interazione di Claudina
- Il test dell’impulso di pressione idrostatica rivela la giunzione claudina-specifica delle coppie di ovociti
- Incubazione con caprato
- Discussione
- Le claudine contribuiscono a rafforzare le proprietà di adesione
- Conclusione
- Dichiarazione di disponibilità dei dati
- Dichiarazione etica
- Contributi dell’autore
- Finanziamento
- Conflitto di interessi
- Ringraziamenti
- Materiale Supplementare
Introduzione
Il tight junction famiglia di proteine è fondamentale per la fisiologia cellulare, come la mancanza o insufficienza è associato con malattie e disfunzioni di molti organi e tessuti, come mostrato ad esempio, nell’orecchio interno (Wilcox et al., 2001; Florian et al., 2003), rene (Konrad et al., 2006; Günzel et al., 2009), tratto gastrointestinale (Resnick et al., 2005; Amasheh et al., 2009), epidermide (Furuse et al., 2002; Tebbe et al., 2002), e capillari cerebrali (Nitta et al., 2003; Wolburg et al., 2003). Le claudine rappresentano una famiglia di proteine transmembrana comprendente almeno 27 membri (Mineta et al., 2011). Oltre ai loro quattro domini a elica transmembrana, contengono due anelli extracellulari (ECL1 ed ECL2), un breve N-terminale e un C-terminale (Suzuki et al., 2014). Specifici modelli di espressione di claudina determinano e riflettono la permeabilità selettiva degli epiteli e la capacità delle proteine di claudina di interagire in cis (all’interno della stessa membrana) e in trans (tra le membrane della cellula vicina) consente la formazione di formazione di barriera e formazione di filamenti di giunzione stretti (Van Itallie e Anderson, 2006).
Claudin-5 è fortemente espresso nell’endotelia capillare e domina la giunzione stretta (TJ) della barriera emato-encefalica (BBB) poiché l’espressione è >100 volte superiore rispetto a qualsiasi altro claudin (Ohtsuki et al., 2007). Inoltre, è espresso in una varietà di tessuti epiteliali tra cui polmone (Soini, 2011), tessuti esocrini (Comper et al., 2009), intestinale (Garcia-Hernandez et al., 2017), e del tratto urinario (Koda et al., 2011). Tuttavia, claudin-5 causa una barriera più forte nei capillari cerebrali rispetto ad altri tessuti (Reinhold e Rittner, 2017) e la sua funzione è compromessa nei disturbi neurodegenerativi e neuroinfiammatori (Greene et al., 2019). Quindi, claudin-5 è cruciale per mantenere il BBB. Ma il BBB non è solo protettivo, limita anche le opzioni terapeutiche in quanto i farmaci sono ostacolati a permeare questa barriera.
Nitta et al. (2003) ha riferito che il BBB è più permeabile alle molecole di 800 Da in dimensioni nei topi carenti di claudina-5 rispetto ai topi di tipo selvaggio (Nitta et al., 2003). Ciò era in accordo con gli esperimenti di trasfezione che dimostravano un effetto di tenuta di claudin-5 in monostrati di cellule Caco-2 (Amasheh et al., 2005).
Un altro importante claudina che forma barriere è claudina-3, che è stato segnalato per sigillare selettivamente la barriera contro il passaggio di ioni di carica e soluti non caricati (Milatz et al., 2010). Si esprime anche nella giunzione stretta endoteliale dei capillari cerebrali e la sua perdita funzionale è osservata nelle fasi di infiammazione del microvaso, glioblastoma e plesso coroide di pazienti con sclerosi multipla (Engelhardt et al., 2001; Wolburg et al., 2003).
Le proprietà della barriera possono essere modificate dinamicamente, come ad esempio, l’incubazione con caprato di sodio è stata dimostrata per diminuire rapidamente e reversibilmente la resistenza elettrica transepiteliale nella linea cellulare intestinale umana HT-29 / B6 (Krug et al., 2013). Il caprato di sodio apre transitoriamente le barriere contenenti claudin-5 alle giunzioni strette delle cellule epiteliali ed endoteliali (Del Vecchio et al., 2012).
Ciò indica che claudin-5 è un obiettivo promettente per il miglioramento della somministrazione di farmaci nel BBB.
In questo studio, abbiamo mirato ad impiegare il sistema di espressione eterologa degli ovociti di Xenopus laevis (Vitzthum et al., 2019) per l’analisi dell’interazione e della pertubazione di claudin-5 e claudin-3. A causa della mancanza di contatti cellula-cellula endogeni, questo sistema di espressione unicellulare consente l’analisi di claudine specifiche senza interferenze di altre proteine a giunzione stretta.
Materiali e metodi
Raccolta di ovociti e microiniezione cRNA
Gli ovociti sono stati raccolti da rane artiglio africano femmina adulta mediante laparotomia chirurgica. Per l’anastesia, 0.2% MS222 (etil 3-aminobenzoato metanesolfonato, Sigma-Aldrich, Taufkirchen, Germania) è stato utilizzato come soluzione da bagno per 5-10 min a 20°C. Una volta raggiunta l’anastesia chirurgica, sono state effettuate incisioni cutanee e muscolari addominali e la massa ovarica è stata esteriorizzata e il tessuto ovarico rimosso. L’isolamento degli ovociti è stato condotto mediante digestione enzimatica a temperatura ambiente per 90 min in 1,5 mg/ml collagenasi Fisher BioReagents BP2649-1 (Fisher Scientific, Schwerte, Germania) disciolti in soluzione di Ringer di ovociti (ORi) come descritto da Vitzthum et al. (2019). Le cellule follicolari sono state rimosse per incubazione in ORI liberi da Ca2+contenenti (in mm): NaCl (90), KCl (1), EGTA (trietilenglicole diammina acido tetraacetico) (1), 5 HEPES (5); pH 7,4 per 10 min su uno shaker meccanico a 50 giri / min. Sono stati iniettati ovociti di stadi V e VI (>1000 µm) (Nanoliter 2010, World Precision Instruments, Sarasota, FL, Stati Uniti) con 1 ng cRNA che codifica per l’acqua umana claudin-5, claudin-3 o RNase-free come controlli. Il volume di iniezione è stato di 50,6 nl per ovocita. Dopo l’iniezione, gli ovociti sono stati incubati a 16°C in ORi 3 giorni per l’espressione proteica.
Isolamento di Frazioni di Membrana e Immunoblotting
Dieci iniettato ovociti sono stati aggregati per l’analisi western blot e risospeso in 500 µl di omogeneizzazione tampone contenente (in mM) MgCl2 (5), NaH2PO4 (5), EDTA (acido etilendiamminotetracetico) (1), saccarosio (80), Tris (Tris(idrossimetil)amminometano) (20); il pH 7.4. Gli estratti di ovociti sono stati centrifugati due volte a 200 giri / min per 10 minuti a 4°C per eliminare i detriti cellulari. Il surnatante è stato centrifugato a 13.000 giri / min per 30 min a 4°C per pellet la membrana cellulare come descritto da Leduc-Nadeau et al. (2007). I pellet sono stati risospesi in un tampone di omogeneizzazione da 80 µl. La quantificazione delle proteine è stata effettuata colorimetricamente utilizzando il kit di analisi delle proteine Pierce 600 nm (Thermo Fisher Scientific, Hennigsdorf, Germania) secondo le istruzioni del produttore in una piastra a pozzetto 96. Il lettore di lastre (PerkinElmer EnSpire Multimode Plate Reader, Waltham, MA, Stati Uniti) è stato regolato a 562 nm e lo standard di albumina sierica bovina (Thermo Fisher Scientific, Hennigsdorf, Germania) che varia da 125 a 2000 µg/ml è stato impiegato per la valutazione. Prima di immunoblotting, i campioni sono stati mescolati con tampone 4× Laemmli (Bio-Rad Laboratories, Monaco di Baviera, Germania), caricati su un gel di poliacrilammide 10% SDS e elettroforesi. Per il trasferimento di proteine, le membrane PVDF sono state utilizzate e bloccate in latte secco non grasso al 5% in soluzione salina tamponata con Tris per 120 min. Le proteine sono state rilevate mediante immunoblotting utilizzando anticorpi primari sollevati contro claudin-3 o claudin-5 (invitrogen #35-2500, #34-1700, #34-1600, Life Technologies, Carlsbad, CA, Stati Uniti).
Anticorpi anti-coniglio e anti-topo di capra coniugati con perossidasi (#7074, # 7076 Cell Signaling Technology, Danvers, MA, Stati Uniti) sono stati utilizzati per legarsi agli anticorpi primari e quindi incubati per un minimo di 45 min a temperatura ambiente. Per il rilevamento è stato utilizzato Clarity Western ECL Blotting Substrate (#1705061, Bio-Rad Laboratories GmbH, Monaco di Baviera, Germania) e i segnali sono stati visualizzati da un sistema ChemiDoc MP (Bio-Rad Laboratories).
Immunoistochimica
Iniettato ovociti sono stati corretti con il 4% PFA (16% paraformaldeide, E15700, Scienza, Servizio, Monaco di baviera, Germania) per 4 ore a temperatura ambiente, seguita da disidratazione gradiente da etanolo al 70% per xilolo (Carl Roth, Karlsruhe, Germania) entro 48 h. I campioni sono stati incorporati nella paraffina e cross-sezionato (5 µm) utilizzando una Leica RM 2245 microtomo (Leica Microsystems Heidelberg, Germania). Poco prima del trattamento immunoistochimico, la paraffina è stata rimossa tramite gradiente di xilolo in etanolo. I siti di legame non specifici sono stati bloccati utilizzando siero di capra al 5% in soluzione salina tamponata con fosfato e incubati con gli stessi anticorpi primari di immunoblotting. I campioni sono stati incubati con gli anticorpi secondari Alexa Fluor-488 goat anti-rabbit e Alexa Fluor-594 goat anti-mouse (Life Technologies, Carlsbad, CA, Stati Uniti) ed esaminati mediante microscopia a immunofluorescenza a scansione laser confocale (LSM 710, Zeiss, Oberkochen, Germania).
Microscopia elettronica a frattura congelata
La microscopia elettronica a frattura congelata è stata eseguita come riportato di recente (Greene et al., 2019). Per la fissazione, gli ovociti iniettati sono stati incubati in glutaraldeide (2,5% in 0,1 M di tampone cacodilato) durante la notte a 4°C. Dopo il lavaggio con tampone cacodilato, gli ovociti sono stati preparati per la fratturazione da congelamento. I campioni sono stati crioprotetti in glicerolo al 30% e congelati in azoto liquido. Dopo la fratturazione e l’ombreggiatura con platino e carbonio (BAF400D; Balzers, Liechtenstein), il materiale organico rimanente è stato rimosso da un lavaggio con ipoclorito di sodio. Gli ovociti sono stati analizzati in un microscopio elettronico a trasmissione (EM-10, Zeiss, Oberkochen, Germania) e fotografati con una fotocamera digitale (Tröndle GmbH). L’analisi morfometrica dei fili di giunzione stretti è stata eseguita con un ingrandimento di 20.000×.
Paired-Oocyte Assay and Quantification of Contact Areas
Il mannitolo è stato implementato per ridurre gli ovociti iniettati e consentire una rimozione meccanica della membrana vitellina utilizzando una pinza senza danneggiare la membrana plasmatica. 5-10 ovociti sono stati collocati in una capsula di petri (35 mm di diametro, Thermo Fisher, Henningsdorf, Germania, #153066) piena di ORI. Il mannitolo è stato aggiunto e sciolto fino a quando non è stato raggiunto il restringimento ipertonico delle cellule (circa 400 mOsmol/l per 10 min). Dopo la devitellinizzazione manuale, gli ovociti sono stati immediatamente trasferiti in una piastra da 24 pozzetti (1. 86 cm2 di superficie, TPP Techno Plastic Products, Trasadingen, Svizzera, # 92024) contenente 2 ml di ORi. In ogni pozzetto, due celle sono state raggruppate delicatamente spingendole insieme a una pipetta Pasteur (1 ml, Thermo Fisher, Henningsdorf, Germania, #PP88SB) e una sonda bulbosa.
Ovocita coppie di claudin-5-esprimere (cldn5 − cldn5), claudin-3-esprimere (cldn3 − cldn3), claudin-3 e claudin-5 coexpressing (cldn3,5 − cldn3,5) e di controllo di ovociti (control − controllo) sono stati tenuti insieme per 48 h in ORi di 16°C.
microscopia in campo chiaro è stato impiegato per la quantificazione della superficie di contatto del cluster ovociti dopo 1, 24 e 48 h. Immagini di naive ovocita coppie in 24 piatti di coltura sono state scattate a questi punti di tempo, utilizzando una Leica DMI6000 B Microscopio Leica Microsystems, Wetzlar, Germania). Il diametro dell’area di contatto è stato misurato utilizzando la scala micron (LAS-AF 3.2.0). Le aree di contatto sono considerate circolari e quindi l’area di contatto è stata calcolata utilizzando l’equazione del cerchio A=π∙r2.
Saggio di impulso di pressione idrostatica
Le membrane vitelline sono state rimosse meccanicamente come descritto in precedenza e gli ovociti raggruppati analagous al test di ovociti accoppiati. Inoltre, le coppie miste di ovociti (control-cldn5 e control-cldn3) sono state testate nel test HPI (Hydrostatic Pressure Impulse). Dopo 24 ore di stabilizzazione, è stato creato un impulso idrostatico definito utilizzando una pipetta elettronica a canale singolo (EE-300R, Eppendorf Research Pro, versione software 2.06.00, Amburgo, Germania).
Gli ovociti sono stati conservati in 24 pozzetti contenenti 2 ml ORi e il posizionamento centrale è stato controllato prima dell’applicazione del volume di pipettaggio 250 µl ORi. La velocità di erogazione è stata impostata uniformemente sulla velocità massima, pari a una velocità di erogazione di 0,9 s. Inoltre, l’angolo (45°) e la distanza di applicazione (∼1,3 cm) sono stati applicati uniformemente. La pressione ambiente, la viscosità degli ORI e il diametro dell’apertura della punta della pipetta sono stati mantenuti in condizioni costanti. La microscopia del campo luminoso è stata impiegata per la quantificazione delle aree di contatto 30 min dopo che la pressione idrostatica è stata applicata e confrontata alle aree di contatto prima dell’applicazione. La configurazione sperimentale è descritta nella Figura 1.
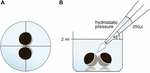
Figura 1. Configurazione sperimentale del test di impulso di pressione idrostatica (A) vista schematica dall’alto del pozzo: il posizionamento centrale della coppia di ovociti è stato controllato prima dell’applicazione della pressione idrostatica. (B) Vista laterale schematica del pozzo: 250 µl di ORI sono stati aggiunti utilizzando una pipetta elettronica a canale singolo. La velocità di erogazione è stata impostata uniformemente sulla velocità massima. L’angolo (45°) e la distanza di applicazione sono stati applicati in modo uniforme. La pressione ambiente, la viscosità degli ORI e il diametro dell’apertura della punta della pipetta sono stati mantenuti in condizioni costanti.
Incubazione di caprato
Per l’incubazione di caprato, il caprato di sodio (#C4151, Sigma Aldrich, Taufkirchen, Germania) in concentrazioni finali di 50, 100 e 500 µM, o ORi come gruppo di riferimento, è stato aggiunto agli ovociti 24 h dopo l’associazione. Gli ovociti sono stati conservati in 24 piastre di pozzetto contenenti 2 ml di ORI e la soluzione di caprato è stata sciolta in un volume di addizione definito di 250 µl di ORi per pozzetto. La larghezza dell’area di contatto è stata quantificata a 30, 60 e 120 minuti dopo l’aggiunta.
Analisi statistica
L’analisi statistica è stata eseguita con JMP Pro 14.0.0 (NC, Stati Uniti). I dati sono presentati come mediane e visualizzati come variazione percentuale in base alla combinazione raggruppata nei primi punti di esame. Le figure 4, 5 sono presentate come riquadri, raffiguranti il primo quartile (25%), la mediana (50%) e il secondo quartile (75%). I baffi sono disegnati fino al 10 ° percentile e fino al 90 ° percentile. La distribuzione normale è stata controllata utilizzando Shapiro-Wilk-test.
Il test Kruskal–Wallis è stato utilizzato per il confronto multiplo, seguito da una correzione Dunn-Bonferroni. i valori p sono dati come numeri continui.
Risultati
Espressione di Claudin-5 e integrazione in X. membrana plasmatica dell’ovocita di laevis
Per testare l’espressione e l’integrazione della proteina a giunzione stretta claudin-5 nella membrana plasmatica dell’ovocita, 3 giorni dopo l’iniezione di claudin-5 cRNA, le frazioni di membrana sono state analizzate mediante immunoblotting. Tutti i campioni di tre singoli animali (d1–d3) hanno rivelato segnali specifici di claudin-5 a 23 kDa, mentre gli ovociti iniettati in acqua senza RNasi non hanno mostrato alcun segnale specifico per l’espressione di claudin-5 (Figura 2A).
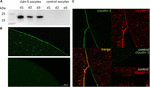
Figura 2. Rilevazione di claudine eterologicamente espresse negli ovociti di Xenopus laevis. (A) Analisi immunoblot della proteina a giunzione stretta claudin-5 in ovociti di X. laevis di tre animali (d1–d3). I lisati della membrana cellulare sono stati sottoposti a SDS-PAGE seguito da immunoblot sulle membrane PVDF. Le membrane sono state incubate con anticorpi primari e anticorpi secondari coniugati con perossidasi (n = 3). B) La colorazione immunofluorescente ha rivelato segnali specifici di claudina-5 (verde) nelle membrane degli ovociti di tutti gli ovociti iniettati con cRNA, mentre nei controlli iniettati con acqua non sono stati rilevati segnali specifici di claudina in microscopia confocale. Immagini rappresentative di ovociti derivati da tre animali. Barre di scala: 50 µm. (C) La colorazione immunofluorescente degli ovociti che esprimono claudina-5 e claudina-3 ha rivelato segnali specifici di claudina-3 (verde) e segnali di claudina-5 (rosso) nelle membrane degli ovociti iniettati con cRNA, mentre nei controlli iniettati con acqua non sono stati rilevati segnali specifici di claudina. La colocalizzazione delle proteine claudin espresse all’interno della membrana plasmatica dell’ovocita è rivelata da una doppia colorazione immunofluorescente (gialla). Barra di scala: 10 µm.
Per la visualizzazione delle proteine espresse all’interno della membrana plasmatica, sono state eseguite colorazioni immunoistochimiche e analizzate mediante microscopia confocale a scansione laser (Figura 2B). Sono stati rilevati segnali specifici e distribuiti uniformemente su tutta la membrana plasmatica degli ovociti che esprimono claudina-5. In accordo con gli immunoblot, non sono stati rilevati segnali specifici nelle membrane plasmatiche degli ovociti di controllo.
Pertanto, dopo l’iniezione di cRNA, claudin-5 è stato espresso con successo e integrato nella membrana plasmatica degli ovociti di X. laevis.
La co-espressione di claudin-3 e claudin-5 in coppie di ovociti ha rivelato segnali specifici per claudin-5 (rosso) e claudin-3 (verde) in entrambe le cellule (Figura 2C). Le membrane plasmatiche degli ovociti hanno mostrato una fusione delle cellule vicine fornite dall’interazione diretta cldn3, 5-cldn3, 5 (giallo).
Patch di fili a giunzione stretta sono visibili negli ovociti che esprimono Claudin-5
Sono state analizzate le membrane plasmatiche degli ovociti e la visualizzazione dei fili a giunzione stretta ha avuto successo (Figura 3). La microscopia elettronica a frattura da congelamento ha mostrato macchie di morfologia del filamento nelle membrane plasmatiche degli ovociti iniettati da claudina-5 e l’organizzazione del filamento degli ovociti che esprimono claudina-5 era altamente organizzata e di forma angolare (Figura 3A). I fili di giunzione stretti sono stati rilevati principalmente nella faccia protoplasmatica (P -) della membrana. Gli ovociti iniettati Claudin-3 hanno mostrato fili di giunzione stretti altamente organizzati arrotondati come riportato in precedenza (Vitzthum et al., 2019; Figura 3B). La microscopia elettronica a frattura da congelamento degli ovociti coesprimenti claudin – 3 e claudin-5 ha rivelato fibrille che portano entrambe le proprietà di claudin-3 e claudin-5. L’architettura del filamento fibrile degli ovociti coespressivi è apparsa sia arrotondata che complessa come gli ovociti che esprimono claudin-3, ma anche discontinua e più angolata come mostrato per le cellule che esprimono claudin-5 (Figura 3C). Gli ovociti di controllo avevano una tipica superficie liscia (Figura 3D).
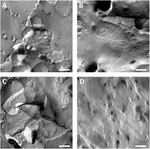
Figura 3. Microscopia elettronica a frattura congelata. (A) La microscopia elettronica a frattura da congelamento rivela la proteina a giunzione stretta cldn-5 come una rete di fibrille discontinue angolari in file negli ovociti di Xenopus laevis. (B) La microscopia elettronica a frattura da congelamento rivela la proteina a giunzione stretta cldn-3 come una rete di fibrille arrotondate negli ovociti di X. laevis. (C) La microscopia elettronica della frattura del congelamento degli ovociti coesprimenti claudin-3 e claudin-5 rivela le fibrille che entrambe portano le proprietà di claudin-3 e claudin-5. (D) Gli ovociti di controllo iniettati con acqua hanno una superficie liscia. Immagini rappresentative di ovociti derivati da tre animali. Scala bar: 250 nm.
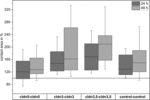
Figura 4. Aree di contatto mediane delle combinazioni di ovociti cldn5–cldn5, cldn3–cldn3, cldn3,5–cldn3,5 e controllo–controllo 24 e 48 h dopo il clustering in % delle aree di contatto iniziali poco dopo il clustering (n = 8-38).

Figura 5. Aree di contatto di claudin-5, claudin-3, e coesprimendo claudin-3 e claudin-5 ovociti in pressione idrostatica impulso (HPI) sfida dopo periodo di stabilizzazione e 30 min dopo HPI (n = 16-70, * p < 0.05, * * p < 0.01, Kruskal-Wallis seguito da una correzione Dunn-Bonferroni).
Analisi accoppiata di ovociti per l’analisi della trans-interazione di Claudina
Tutte le combinazioni raggruppate hanno mostrato un aumento dell’area di contatto dipendente dal tempo durante il periodo di tempo misurato (Figura 4 e Tabella 1).
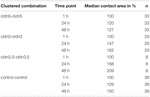
Tabella 1. Aree di contatto dell’ovocita entro 48 h dopo il clustering.
L’area di contatto degli ovociti di controllo iniettati con acqua è aumentata al 129% dopo 24 ore e al 150% dopo 48 ore. Coppie raggruppate di ovociti che esprimono claudin-3 hanno anche mostrato un aumento delle aree di contatto a 147% (24 h) e 162% (48 h). Coppie raggruppate di ovociti che coesprimono claudin – 3 e claudin-5 hanno mostrato aree di contatto del 168% (24 h) e del 209% (48 h). Coppie raggruppate di ovociti che esprimono claudin – 5 da solo hanno mostrato aree di contatto di 120% (24 h) e 127% (48 h). Pertanto le aree di contatto in tutte le combinazioni testate erano comparabili.
Il test dell’impulso di pressione idrostatica rivela la giunzione claudina-specifica delle coppie di ovociti
In un approccio separato, gli ovociti che esprimono claudina-3 o claudina-5 o coesprimono entrambe le claudine sono stati raggruppati dopo la devitellinizzazione meccanica. Gli ovociti sono stati sfidati impiegando un HPI e le aree di contatto sono state misurate e calcolate 30 min dopo la sfida e confrontate con le aree iniziali dopo il periodo di stabilizzazione di 24 h (Figura 5 e Tabella 2). Dopo la sfida di pressione idrostatica, l’area di contatto degli ovociti di controllo iniettati con acqua è diminuita all ‘ 89%. Le coppie raggruppate di ovociti che esprimono claudin-5, claudin-3 o che coesprimono claudin-3 e claudin-5 hanno mantenuto aree di contatto più grandi (97%, p = 0,0235; 96%, p = 0,003; 98%, p = 0,0253). Le aree di contatto degli ovociti di controllo iniettati con acqua mista e degli ovociti che esprimono claudina (control-cldn5 e control-cldn3) non differivano significativamente dagli ovociti di controllo (93%, p = 0,2900; 83%, p = 0,4455).
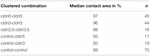
Tabella 2. Analisi dell’impulso di pressione idrostatica.
Incubazione con caprato
In un esperimento pilota di incubazione, gli ovociti sono stati iniettati e accoppiati in combinazioni che esprimono claudin-5 (cldn5–cldn5) o iniettati con acqua libera da RNasi come controlli (controllo–controllo). Le coppie sono state incubate con concentrazioni finali di caprato di sodio di 50, 100 o 500 µM. L’incubazione di coppie di ovociti con ORI è servita come gruppo di riferimento. Gli ovociti sono stati raggruppati e dopo 24 ore di stabilizzazione, l’incubazione è iniziata e le larghezze di contatto sono state misurate 30, 60 e 120 min dopo l’aggiunta (figura supplementare S1).
L’aggiunta di ORI ha determinato una diminuzione iniziale delle aree di contatto sia nelle coppie di ovociti che esprimono claudina che iniettate con acqua, che viene dispersa 60 o 120 minuti dopo l’aggiunta. Ciò è delineato dalla forma parabolica della linea di collegamento tra le aree di contatto mediane nel tempo (curve rosse nella figura supplementare S1). Tuttavia, l’incubazione con caprato di sodio da 100 e 500 µM ha aumentato leggermente le aree di contatto (100 µM) o fortemente (500 µM) 30 min dopo l’aggiunta di caprato da 5,1 × 105 a 5,2 × 105 µm2 e da 4,3 × 105 a 4,9 × 105 µm2.
Discussione
Nel presente studio, abbiamo impiegato il modello classico per i trasportatori e la modellazione delle malattie umane (Tammaro et al., 2009; Nenni et al., 2019), gli ovociti di X. laevis, per un’analisi approfondita dell’interazione claudina-5 e del contributo funzionale alla guarnizione di giunzione. A tal fine, è stato stabilito un nuovo approccio, introducendo un HPI per l’interazione stimolante all’interno dell’area di contatto degli ovociti di Xenopus raggruppati.
Le claudine contribuiscono a rafforzare le proprietà di adesione
In conformità con i precedenti risultati di Vitzthum et al. (2019), le singole claudine espresse negli ovociti non hanno portato ad un aumento delle aree di contatto di interazione rispetto agli ovociti di controllo. Tuttavia, la visualizzazione immunoblot e immunoistochimica ha dimostrato il successo dell’espressione e dell’integrazione nella membrana plasmatica dell’ovocita di X. laevis. Inoltre, l’uso della microscopia confocale a scansione laser ha permesso una localizzazione precisa delle claudine espresse nella membrana plasmatica poiché il foro stenopeico bloccava la fluorescenza fuori fuoco. Una quantificazione dei segnali immunoistochimici non è stata perseguita, poiché l’affinità degli anticorpi per legare i loro obiettivi differisce.
Vedula et al. (2009) ha utilizzato una tecnica di aspirazione a micropipetta per studiare aspetti dell’interazione claudina-claudina utilizzando L-fibroblasti trasfettati con occludina GFP, cldn-1 e cldn-2. La forza di separazione necessaria per staccare due cellule l’una dall’altra era maggiore nelle cellule trasfette cldn-1 e cldn-2 (∼2.8 e 2.3 Nn, rispettivamente). Anche se questo approccio potrebbe sembrare promettente anche per l’analisi claudina-claudina – interazione di esprimere gli ovociti, test preliminari hanno rivelato che un distacco di ovociti raggruppati non è possibile senza interruzione delle membrane plasmatiche degli ovociti.
Pertanto, come nuovo approccio, la forza delle connessioni è stata misurata da un HPI. Sebbene l’HPI non fornisca una quantificazione della forza di separazione in valori assoluti (ad esempio, in newton), consente un’analisi rapida ed economica dell’interazione di claudina senza disturbi di altre proteine a giunzione stretta (ad esempio, occludina, tricellulina, MARMELLATA-A). Le claudine contribuiscono alla giunzione delle coppie di ovociti in quanto mostrano un’area di contatto più ampia rispetto agli ovociti iniettati con acqua dopo HPI. Ciò indica una forte trans-interazione omofila tra le cellule che esprimono claudina.
L’architettura Strand fibril è specifica per singoli claudins (Colegio et al., 2002). Nella microscopia elettronica a frattura da congelamento, claudin-3 è stato segnalato per assemblare una rete di fili più arrotondata in forme ad anello negli ovociti di Xenopus (Vitzthum et al., 2019; Figura 3B) mentre nel nostro studio, claudin-5 formava una rete più angolare e ordinata in file. Le immagini hanno rivelato che la proteina a giunzione stretta claudin-5 forma una rete di fibrille in file discontinue e angolari negli ovociti di X. laevis. Questo è in accordo con i fili di claudin-5 noti per verificarsi come catene di particelle associate alla fase P (Piontek et al., 2011). Nei nostri esperimenti, la forma geometrica delle fibrille sembrava non avere alcun effetto sulle proprietà di adesione degli ovociti. In accordo con ciò, la resistenza paracellulare è stata segnalata non correlata al numero di fibrille e alle proprietà di formazione di fibrille (Colegio et al., 2002). Inoltre, claudin-3 e claudin-5 hanno dimostrato di avere una capacità simile per la trans-interazione omofila nelle cellule HEK293 (Piontek et al., 2011).
Questo modello di ovociti di X. laevis, che esprimono proteine a giunzione singola stretta, consente di osservare l’effetto di sostanze come il caprato di sodio sulla formazione di aree di contatto tra ovociti raggruppati. Può quindi fornire uno strumento utile per uno screening efficiente in termini di tempo e costi per le sostanze che influenzano la barriera di giunzione stretta.
Le concentrazioni di caprato di sodio di 100 e 500 µM possono trasmettere un effetto protettivo sugli ovociti che esprimono claudina-5, con conseguente aumento delle aree di contatto dopo 30 minuti di incubazione.
Krug et al. (2013) ha dimostrato che l’incubazione con caprato di sodio ha portato a una diminuzione rapida e reversibile della resistenza transepiteliale nella linea cellulare intestinale umana HT-29/B6. Inoltre, la microscopia confocale a scansione laser ha rivelato una marcata riduzione di claudin-5 nelle cellule HT-29/B6 trattate con il laurato di acidi grassi a catena media (Dittmann et al., 2014). Il primo ciclo extracellulare di claudine (ECL1) è importante per le proprietà di barriera della giunzione stretta, mentre il secondo ciclo extracellulare (ECL2) è coinvolto nella formazione di filamenti di trans-interazione (Piontek et al., 2008; Rossa et al., 2014; Greene et al., 2019). I leganti Claudin-5 mirati a ECL1 o ECL2 di claudin-5 possono indurre l’assorbimento intracellulare della proteina a giunzione stretta, ostacolando così le trans-interazioni claudin-5 nella tenuta a giunzione stretta tra cellule adiacenti e allentando lo spazio paracellulare (Hashimoto et al., 2017).
Quindi, abbiamo ipotizzato che l’incubazione con caprato di sodio avrebbe portato a una diminuzione dell’area di contatto di claudin-5 raggruppato che esprime gli ovociti di X. laevis. Inaspettatamente, l’aumento delle concentrazioni di caprato di sodio (100 e 500 µM) ha portato ad aumentare le aree di contatto degli ovociti raggruppati che esprimono claudina-5 indicando un effetto protettivo del caprato di sodio sulla tenuta di giunzione stretta. Inoltre, il caprato di sodio è descritto per indurre la contrazione dell’anello perijunctional actomyosina, allargando lo spazio paracellulare (Lindmark et al., 1998; Maher et al., 2009). Questo effetto si basa sulla fosforilazione della catena leggera regolatrice della miosina attraverso un’attivazione della fosfolipasi C che porta ad una scissione del fosfatidilinositolo 4,5-bifosfato (PIP2) in inositolo trifosfato (IP3) e diacilglicerolo (Tomita et al., 1995). Il complesso della giunzione stretta collegato dalla proteina ZO-1 dell’armatura al citoscheletro dell’actina poi è ridistribuito dalla giunzione stretta al citoplasma (Lindmark et al., 1998; Turner, 2000). La citoarchitettura dell’ovocita X. laevis è cruciale per la regionalizzazione citoplasmatica durante l’oogenesi (Wylie et al., 1985). Sebbene, prima della fecondazione, l’espressione genica tjp-1, il gene che codifica per ZO–1 sia espresso solo 1,9 TPM negli stadi degli ovociti V-VI (Session et al., 2016). Una ridotta interazione delle claudine con lo scaffold citoscheletrico può quindi spiegare il risultato inaspettato dell’incubazione del caprato. È lo scopo degli studi futuri per verificare la base meccanicistica del risultato.
Tuttavia, un effetto variante del caprato di sodio sulla permeabilità paracellulare è stato descritto in letteratura prima. Nel tessuto Patch di Peyer prelevato dall’intestino dei maiali adulti, è stato rilevato un effetto rinforzante simile. Claudin-5 è stato significativamente aumentato dopo incubazione con caprate di 5 mm. In questo studio caprate ha portato ad una resistenza elettrica transepiteliale significativamente più elevata (TEER) nell’epitelio associato al follicolo (Radloff et al., 2019).
Conclusione
In conclusione, espressione eterologa della proteina a giunzione stretta claudin-5 in X. laevis oocytes consente nuove intuizioni sul contributo delle singole claudine all’interazione cellula-cellula e alle proprietà di adesione delle cellule adiacenti. Pertanto, l’uso del modello a giunzione stretta X. laevis per claudin-5 consente l’analisi dei componenti BBB in un modello a cella singola.
Dichiarazione di disponibilità dei dati
I set di dati generati per questo studio sono disponibili su richiesta all’autore corrispondente.
Dichiarazione etica
I trattamenti sugli animali erano conformi alle linee guida della legislazione tedesca, con l’approvazione del responsabile del benessere degli animali per la Freie Universität Berlin e sotto il governo dell’Ispettorato sanitario veterinario di Berlino (Landesamt für Gesundheit und Soziales Berlin, permesso G0025/16).
Contributi dell’autore
Tutti gli autori hanno letto e approvato il manoscritto. NB e SA progettarono, pianificarono e supervisionarono gli esperimenti e scrissero il manoscritto. NB, LS, VC, RK e PF-B hanno eseguito gli esperimenti e l’analisi dei dati.
Finanziamento
Questo studio è stato finanziato dalla Deutsche Forschungsgemeinschaft, Sovvenzione n. AM141 / 11-1 e la H. Wilhelm Schaumann Stiftung.
Conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di rapporti commerciali o finanziari che potrebbero essere interpretati come un potenziale conflitto di interessi.
Ringraziamenti
Ringraziamo Martin Grunau, Gisela Manz, Katharina Söllig e Susanne Trappe per l’eccellente assistenza tecnica. Riconosciamo il sostegno dell’Open Access Publication Initiative della Freie Universität Berlin.
Materiale Supplementare
Il Materiale Supplementare per questo articolo può essere trovato on-line a: https://www.frontiersin.org/articles/10.3389/fphys.2020.00857/full#supplementary-material
FIGURA S1 | zone di Contatto di claudin-5 esprimendo ovocita coppie in µm2 durante l’incubazione con sodio caprate in diverse concentrazioni (n = 6-8, rispettivamente) e iniezione d’acqua ovociti come controlli (n = 5-7, rispettivamente).
Amasheh, S., Dullat, S., Fromm, M., Schulzke, JD, Buhr, HJ, e Kroesen, AJ (2009). La mucosa della sacca infiammata possiede giunzioni strette alterate che indicano la ricorrenza della malattia infiammatoria intestinale. Int. J. Colore. Dis. 24, 1149–1156. doi: 10.1007 / s00384-009-0737-8
PubMed Abstract / CrossRef Testo completo / Google Scholar
Amasheh, S., Schmidt, T., Mahn, M., Florian, P., Mankertz, J., Tavalali, S., et al. (2005). Contributo di claudin-5 alle proprietà di barriera nelle giunzioni strette delle cellule epiteliali. Tessuto cellulare Res. 321, 89-96. doi: 10.1007 / s00441-005-1101-0
PubMed Abstract / CrossRef Testo completo / Google Scholar
Nel 2002 è stato pubblicato il primo album in studio della band. Il ruolo dei domini extracellulari di claudina nell’architettura delle fibrille a giunzione stretta e nella selettività della carica paracellulare. Cella Mol Biol. 13:286.
Google Scholar
Comper, F., Antonello, D., Beghelli, S., Gobbo, S., Montagna, L., Pederzoli, P., et al. (2009). Il modello di espressione delle claudine 5 e 7 distingue lo pseudopapillare solido dal pancreatoblastoma, dalle cellule acinari e dai tumori endocrini del pancreas. Essere. J. Surg. Pathol. 33, 768–774. doi: 10.1097 / pa.0b013e3181957bc4
PubMed Abstract / CrossRef Testo completo / Google Scholar
Del Vecchio, G., Tscheik, C., Tenz, K., Helms,H. C., Winkler, L., Blasig, R., et al. (2012). Il caprato di sodio apre transitoriamente le barriere contenenti claudina-5 alle giunzioni strette delle cellule epiteliali ed endoteliali. Mol. Farmaceutica. 9, 2523–2533. doi: 10.1021 / mp3001414
PubMed Abstract / CrossRef Testo completo / Google Scholar
Dittmann, I., Amasheh, M., Krug, S. M., Markov, A. G., Fromm, M., e Amasheh ,S. (2014). Il laurato permea la via paracellulare per piccole molecole nel modello di cellule epiteliali intestinali HT-29/B6 attraverso l’apertura delle giunzioni strette mediante delocalizzazione reversibile di claudin-5. Farmaceutica. Res. Dordr. 31, 2539–2548. doi: 10.1007 / s11095-014-1350-2
PubMed Abstract / CrossRef Testo completo / Google Scholar
Engelhardt, B., Wolburg-Buchholz, K., e Wolburg, H. (2001). Coinvolgimento del plesso coroide nell’infiammazione del sistema nervoso centrale. Microsc. Res. Techniq. 52, 112–129. doi: 10.1002/1097-0029(20010101)52:1<112::aiuto-jemt13>3.0.co;2-5
CrossRef Testo Completo | Google Scholar
Florian, P., Amasheh, S., Lessidrensky, M., Todt, I., Bloedow, A., Ernst, A., et al. (2003). Claudine nelle giunzioni strette delle cellule marginali di stria vascularis. Biochimica. Biophys. Res. Co. 304, 5–10. doi: 10.1016 / s0006-291x(03)00498-4
CrossRef Testo completo / Google Scholar
Furuse, M., Hata, M., Furuse, K., Yoshida, Y., Haratake, A., Sugitani, Y., et al. (2002). Le giunzioni strette basate su Claudin sono cruciali per la barriera epidermica dei mammiferi: una lezione dai topi claudin-1-carenti. J. Cell Biol. 156, 1099–1111. doi: 10.1083 / jcb.200110122
PubMed Abstract | CrossRef Testo completo / Google Scholar
Garcia-Hernandez, V., Quiros, M. e Nusrat, A. (2017). Claudine epiteliali intestinali: espressione e regolazione nell’omeostasi e nell’infiammazione. Ann. N. Y. Acad. Sic. 1397, 66–79. doi: 10.1111 / nyas.13360
PubMed Abstract / CrossRef Testo completo / Google Scholar
Nel 2019 è stato pubblicato il primo album in studio. Claudin-5: gatekeeper della funzione neurologica. Fluidi Barr. CNS 16: 4321.
Google Scholar
Günzel, D., Amasheh, S., Pfaffenbach, S., Richter, J. F., Kausalya, P. J., Hunziker, W., et al. (2009). Claudin-16 colpisce la secrezione transcellulare di Cl nelle cellule MDCK. J. Physiol. Lond. 587, 3777–3793. doi: 10.1113 / jphysiol.2009.173401
PubMed Abstract | CrossRef Testo completo / Google Scholar
Hashimoto, Y., Shirakura, K., Okada, Y., Takeda, H., End, K., Tamura, M., et al. (2017). I leganti Claudin-5 migliorano la permeazione dei soluti attraverso la barriera emato-encefalica in un modello di mammifero. J. Pharmacol. Scad. Ther. 363, 275–283. doi: 10.1124 / jpet.117.243014
PubMed Abstract | CrossRef Testo completo / Google Scholar
Il suo nome deriva dal latino “Koda”, “Zhao”, “L. N.”, “Yaoita”, “E.”, “Yoshida”, “Tsukita”, “S.”, “Tamura”, “A.”, et al. (2011). Nuova espressione di claudin – 5 nei podociti glomerulari. Tessuto cellulare Res. 343, 637-648. doi: 10.1007 / s00441-010-1117-y
PubMed Abstract / CrossRef Testo completo / Google Scholar
Konrad, M., Schaller, A., Seelow, D., Pandey,A. V., Waldegger, S., Lesslauer, A., et al. (2006). Le mutazioni nel gene a giunzione stretta claudina 19 (CLDN19) sono associate a spreco di magnesio renale, insufficienza renale e grave coinvolgimento oculare. Essere. J. Hum. Genet. 79, 949–957. doi: 10.1086/508617
PubMed Abstract / CrossRef Testo completo / Google Scholar
Krug, S. M., Amasheh, M., Dittmann, I., Christoffel, I., Fromm, M., e Amasheh, S. (2013). Caprato di sodio come potenziatore della permeazione delle macromolecole attraverso le giunzioni strette tricellulari delle cellule intestinali. Biomateriali 34, 275-282. doi: 10.1016 / j.biomateriali.2012.09.051
PubMed Abstract | CrossRef Testo completo / Google Scholar
Leduc-Nadeau, A., Lahjouji, K., Bissonnette, P., Lapointe, J. Y., e Bichet, D. G. (2007). Elaborazione di una nuova tecnica per la purificazione delle membrane plasmatiche dagli ovociti di Xenopus laevis. Essere. J. Physiol. Cellula. 292, C1132–C1136.
Google Scholar
Lindmark, T., Kimura, Y., e Artursson, P. (1998). Miglioramento dell’assorbimento attraverso la regolazione intracellulare della permeabilità della giunzione stretta da parte degli acidi grassi a catena media nelle cellule Caco-2. J. Pharmacol. Scad. Ther. 284, 362–369.
Google Scholar
Maher, S., Leonard, T. W., Jacobsen, J., e Brayden, D. J. (2009). Sicurezza ed efficacia del caprato di sodio nel promuovere l’assorbimento orale della droga: da in vitro alla clinica. Adv. Farmaco consegnare. Apoc 61, 1427-1449. doi: 10.1016 / j.addr.2009.09.006
PubMed Abstract / CrossRef Testo completo / Google Scholar
Milatz, S., Krug, S. M., Rosenthal, R., Gunzel, D., Muller, D., Schulzke, JD, et al. (2010). Claudin-3 funge da componente di sigillamento della giunzione stretta per gli ioni dei soluti non caricati e della tassa. Biochim. Biophys. Acta 1798, 2048-2057. doi: 10.1016 / j.bbamem.2010.07.014
PubMed Abstract | CrossRef Testo completo / Google Scholar
Il suo nome deriva dal latino “K.”, “K.”, “Yamamoto”, “Y.”, “Yamazaki”, “Y.”, “Tanaka”, “H.”, “Tada”, “Y.”, “Saito”, “K.”, et al. (2011). Espansione prevista della famiglia claudin multigene. FEBS Lett. 585, 606–612. doi: 10.1016 / j. febslet.2011.01.028
PubMed Abstract | CrossRef Testo completo / Google Scholar
Nenni, M. J., Fisher, M. E., James-Zorn, C., Pells,T. J., Ponferrada, V., Chu, S., et al. (2019). Xenbase: facilitare l’uso di Xenopus per modellare la malattia umana. Anteriore. Physiol. 10:154. doi: 10.3389 / fphys.2019.00154
PubMed Abstract | CrossRef Testo completo / Google Scholar
Il sito utilizza cookie tecnici e di terze parti per migliorare la tua esperienza di navigazione. (2003). Allentamento selettivo della barriera emato-encefalica nei topi claudin-5-carenti. J. Cell Biol. 161, 653–660. doi: 10.1083 / jcb.200302070
PubMed Abstract / CrossRef Testo completo / Google Scholar
Nel 2007 è stato pubblicato il primo album in studio della band, intitolato ” H., Kamoi, M., Asashima, T., e Terasaki, T. (2007). L’espressione esogena di claudin-5 induce le proprietà della barriera in cellule endoteliali capillari coltivate del cervello del ratto. J. Cell Physiol. 210, 81–86. doi: 10.1002 / jcp.20823
PubMed Abstract / CrossRef Testo completo / Google Scholar
Piontek, J., Fritzsche, S., Cording, J., Richter, S., Hartwig, J., Walter, M., et al. (2011). Chiarire i principi dell’organizzazione molecolare dei fili di giunzione stretti eteropolimerici. Cella Mol. Sci vita. 68, 3903–3918. doi: 10.1007 / s00018-011-0680-z
PubMed Abstract / CrossRef Full Text / Google Scholar
Piontek, J., Winkler, L., Wolburg, H., Muller, S. L., Zuleger, N., Piehl, C., et al. (2008). Formazione di giunzione stretta: determinanti dell’interazione omofila tra claudine classiche. FASEB J. 22, 146-158. doi: 10.1096 / fj.07-8319com
PubMed Abstract | CrossRef Testo completo / Google Scholar
Nel 2019 è stato nominato presidente del Consiglio dei Ministri. Caprate modula la funzione di barriera intestinale nell’epitelio follicolo-associato della toppa di Peyer suina. Int. J. Mol. Sic. 20:1418. doi: 10.3390 / ijms20061418
PubMed Abstract / CrossRef Full Text / Google Scholar
Reinhold, A. K., e Rittner, H. L. (2017). Funzione di barriera nel sistema nervoso periferico e centrale-una revisione. Pflug. Arco. EUR. J. Phys. 469, 123–134. doi: 10.1007/s00424-016-1920-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Resnick, M. B., Gavilanez, M., Newton, E., Konkin, T., Bhattacharya, B., Britt, D. E., et al. (2005). Claudin expression in gastric adenocarcinomas: a tissue microarray study with prognostic correlation. Hum. Pathol. 36, 886–892. doi: 10.1016/j.humpath.2005.05.019
PubMed Abstract | CrossRef Full Text | Google Scholar
Rossa, J., Ploeger, C., Vorreiter, F., Saleh, T., Protze, J., Gunzel, D., et al. (2014). Il ripiegamento e l’assemblaggio delle proteine Claudin-3 e Claudin-5 nella giunzione stretta sono controllati da residui non conservati nei segmenti transmembrana 3 (TM3) e extracellulare loop 2 (ECL2). J. Biol. Chimica. 289, 7641–7653. doi: 10.1074 / jbc.m113. 531012
PubMed Abstract | CrossRef Testo completo / Google Scholar
Il sito utilizza cookie tecnici e di terze parti per migliorare la tua esperienza di navigazione. (2016). Evoluzione del genoma nella rana allotetraploide Xenopus laevis. Natura 538, 336-343.
Google Scholar
Soini, Y. (2011). Claudins nelle malattie polmonari. Resp. Res. 12:70.
Google Scholar
Il suo nome deriva dal latino “Tani”, “Tani”, “Yamazaki”, “Y”, “Tamura”, “A”, “Ishitani”, “R”, et al. (2014). La struttura cristallina di un claudin fornisce informazioni sull’architettura delle giunzioni strette. Scienza 344, 304-307. doi: 10.1126 / scienza.1248571
PubMed Abstract | CrossRef Testo completo / Google Scholar
Tammaro, P., Shimomura, K., e Proks, P. (2009). “Xenopus Oocytes as a heterologous expression system for studying ion channels with the patch-clamp technique,” in Potassium Channels: Methods and Protocols, ed. Il suo nome deriva dal greco antico.
Google Scholar
Tebbe, B., Mankertz, J., Schwarz, C., Amasheh, S., Fromm, M., Assaf, C., et al. (2002). Proteine a giunzione stretta: una nuova classe di proteine integrali di membrana-espressione nell’epidermide umana e nei cheratinociti di HaCaT. Arch Dermatol. Res. 294, 14-18. doi: 10.1007 / s00403-001-0290-y
PubMed Abstract / CrossRef Testo completo / Google Scholar
Tomita, M., Hayashi, M., e Awazu, S. (1995). Meccanismo di miglioramento dell’assorbimento del caprato di sodio e della decanoilcarnitina nelle cellule Caco-2. J. Pharmacol. Scad. Ther. 272, 739–743.
Google Scholar
Turner, J. R. (2000). “Mettere la compressione” sulla giunzione stretta: comprendere la regolazione del citoscheletro. Sperma. Cella Dev. Biol. 11, 301–308. doi: 10.1006 / scdb.2000.0180
PubMed Abstract / CrossRef Testo completo / Google Scholar
Nel 2006 si trasferisce a New York. Claudine e trasporto paracellulare epiteliale. Annu. Rev. Physiol. 68, 403–429. doi: 10.1146 / annurev.physiol.68.040104.131404
PubMed Abstract / CrossRef Testo completo / Google Scholar
La maggior parte di essi è costituita da un gruppo di persone. (2009). Forze quantificanti mediate da proteine integrali a giunzione stretta nell’adesione Cellula-cellula. Esper. Mech. 49, 3–9. doi: 10.1007/s11340-007-9113-1
CrossRef Full Text | Google Scholar
Vitzthum, C., Stein, L., Brunner, N., Knittel, R., Fallier-Becker, P., and Amasheh, S. (2019). Xenopus oocytes as a heterologous expression system for analysis of tight junction proteins. FASEB J. 33, 5312–5319. doi: 10.1096/fj.201801451rr
PubMed Abstract | CrossRef Full Text | Google Scholar
Wilcox, E. R., Burton, Q. L., Naz, S., Riazuddin, S., Smith, T. N., Ploplis, B., et al. (2001). Le mutazioni nel gene che codifica la giunzione stretta claudin-14 causano sordità autosomica recessiva DFNB29. Cella 104, 165-172. doi: 10.1016/s0092-8674(01)00200-8
CrossRef Testo Completo | Google Scholar
Wolburg, H., Wolburg-Buchholz, K. Kraus, J., Rascher-Eggstein, G., Liebner, S., Hamm, S., et al. (2003). La localizzazione di claudin-3 in giunzioni strette della barriera emato-encefalica viene selettivamente persa durante l’encefalomielite autoimmune sperimentale e il Glioblastoma umano multiforme. Acta Neuropatolo. 105, 586–592. doi: 10.1007 / s00401-003-0688-z
PubMed Abstract / CrossRef Full Text / Google Scholar
Wylie, C. C., Brown, D., Godsave, S. F., Quarmby, J., e Heasman, J. (1985). Il citoscheletro degli ovociti di Xenopus e il suo ruolo nello sviluppo. J. Embryol. Scad. Morphing. 89, 1–15.
Google Scholar