a genetikai anyag a sejtek belsejében tárolódik kromoszómáknak nevezett struktúrákban, amelyek mindkét végén telomer néven ismert ismétlődő szekvenciával rendelkeznek. Speciális fehérjék kötődnek ezekhez a szekvenciákhoz, hogy védő sapkát képezzenek, amely megvédi a kromoszómát, és megakadályozza, hogy más kromoszómákkal összeolvadjon. A telomeráz enzim a kromoszómák fenntartásában is segít azáltal, hogy ismétlődő DNS-szekvenciákat ad a telomerek végéhez.
az egyik legszélesebb körben tanulmányozott capping molekula a Cdc13 nevű fehérje, amely kötődik bizonyos típusú egyszálú DNS-hez a bimbózó élesztőben, és komplexet képez két másik fehérjével (Stn1 és Ten1), amelyek telomerázt toboroznak (Wellinger and Zakian, 2012). Számos bizonyíték arra utal, hogy ez a CST komplex egy primase-Pola nevű DNS-replikációs enzimet is felvesz, és szabályozhatja ennek az enzimnek az aktivitását a kromoszómák végein és a genom más helyein (Giraud-Panis et al., 2010; Price et al., 2010; Barbero Barcenilla and Shippen, 2019).
hasonló komplexeket azonosítottak más eukariótákban is, beleértve az emlősöket is, amelyek Stn1-et, Ten1-et és egy másik, CTC1 nevű fehérjét tartalmaznak CST komplexükben (Giraud-Panis et al., 2010; Price et al., 2010). Kihívást jelentett azonban a különböző fehérjék által a CST komplexben betöltött szerepek kidolgozása, mivel azok a sejtek, amelyekből csak egy hiányzik ezekből a fehérjékből, küzdenek a túlélésért (1a.ábra). Most, az eLife-ban, Jin-Qiu Zhou és munkatársai a Kínai Tudományos Akadémián és a ShanghaiTech egyetemen – beleértve Zhi-Jing Wu – t, mint első szerzőt-beszámolnak azoknak a kísérleteknek az eredményeiről, amelyek segítenek jobban megérteni a CST komplexet (Wu et al., 2020).
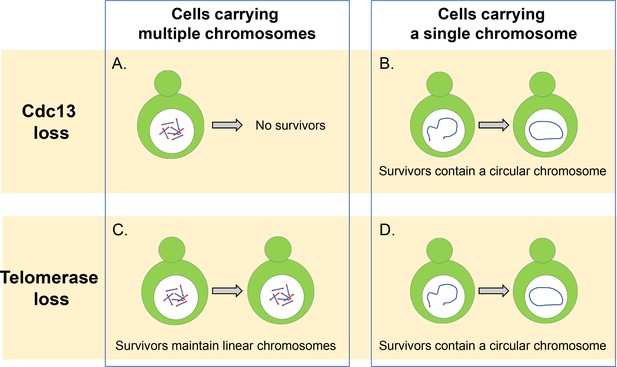
a Cdc13 és a telomeráz elengedhetetlen a lineáris kromoszómák fenntartásához.
(a) A több lineáris kromoszómával rendelkező Élesztősejteknek szükségük van a cdc13 zárófehérjére, hogy megvédjék telomerjeiket és megakadályozzák a kromoszómák összeolvadását. E fehérje nélkül ezek a sejtek nem tudnak túlélni. (B) az egyetlen lineáris kromoszómával rendelkező sejtek Cdc13 nélkül is fennmaradhatnak, ha kromoszómájuk végeit összeolvasztják, hogy kör alakú gyűrűt képezzenek. C) a telomeráz enzim hiányában a több lineáris kromoszómával rendelkező sejtek DNS rekombinációs útvonalak alkalmazásával képesek túlélni, amelyek felerősíthetik a telomer szekvenciát vagy a kromatin és a telomer szekvencia között elhelyezkedő DNS-szegmenseket. (D) az egyetlen lineáris kromoszómával rendelkező sejtek túlélik a telomeráz elvesztését azáltal, hogy összeolvadnak, hogy kör alakú kromoszómát képezzenek homológ rekombináció alkalmazásával, hasonlóan ahhoz, ami a Cdc13 fehérjét nem tartalmazó sejtekben történik.
kép jóváírás: Constance Nugent és Katsunori Sugimoto.
első, Wu et al. megvizsgálták, hogy a CST komplex törlése hogyan befolyásolta a bimbózó élesztő törzsének életképességét, amelyben mind a 16 kromoszómája összeolvadt, hogy egyetlen kör alakú kromoszómát képezzen (Shao et al., 2019). Megállapították, hogy a CST eltávolítása nem akadályozta meg a sejtek szaporodását vagy több sejthalálhoz vezetett, még akkor sem, ha a kör alakú kromoszóma tartalmazta az ismétlődő telomer szekvenciákat. Ezért úgy tűnik, hogy a CST komplex fő szerepe a lineáris kromoszómák fenntartása és a kromoszómák más kromoszómákkal való összeolvadásának megakadályozása, és hogy ez nem elengedhetetlen a belső telomer szekvenciák replikációjához.
a kör alakú gyűrű kialakítása mellett A kezdő élesztő 16 kromoszómája is összeolvadhat, hogy egyetlen lineáris kromoszómát képezzen (Shao et al., 2018). Wu et al. megállapította, hogy a CST komplex eltávolítása nagymértékben csökkentette ezeknek a sejteknek az életképességét, de ezeknek a sejteknek egy része képes volt túlélni azáltal, hogy lineáris kromoszómájuk végeit kör alakú gyűrűvé olvasztotta (1b ábra). A CST komplex különböző fehérjéit kódoló gének egyedi törlése azt mutatta, hogy a Cdc13-ból hiányzó sejtek nagyobb fúziós sebességet mutatnak, mint az Stn1 és a Ten1 génjeiből hiányzó sejtek. Ez arra utal, hogy a Cdc13 domináns szerepet játszik a kromoszómák fúziójának gátlásában, és hogy az Stn1 és a Ten1 hozzájárul a telomerek védelméhez a Cdc13-tól függetlenül. Ennek a mechanizmusnak a részletei azonban továbbra sem tisztázottak, és további vizsgálatot igényelnek.
a több kromoszómát tartalmazó vad típusú sejtekben ritkán találnak fuzionált vagy kör alakú kromoszómákat, még akkor is, ha a telomeráz aktivitása veszélybe került: ez azért van, mert a sejtek meghosszabbíthatják és fenntarthatják a telomereket egy homológia-irányított rekombinációnak nevezett mechanizmus alkalmazásával, amely javítja a DNS kettős szálú töréseit (1C ábra). Azonban, Wu et al. megállapította, hogy a kromoszómák számának csökkentése több fúziót mutatott ki a telomeráz enzimet nem tartalmazó sejtekben. Ez arra utal, hogy a kromoszómák számának csökkentése növeli annak valószínűségét, hogy a sejtek képesek lesznek kör alakú kromoszómákat előállítani és túlélni a telomeráz elvesztését.
úgy gondolták, hogy a szinguláris lineáris kromoszóma két végének összeolvadása a nem homológ végcsatlakozó (NHEJ) útvonalnak nevezett DNS-javítási útvonalra támaszkodik (Haber, 2016). Azonban, Wu et al. kimutatták, hogy telomeráz hiányában a kromoszóma fúzió a Rad52-től függ, amely kritikus szerepet játszik a DNS-szünetek homológ rekombinációjában A kezdő élesztőben (1D ábra). Lehetséges, hogy az ebben a vizsgálatban használt sejtek a rad52 útvonalra támaszkodnak a kromoszóma körforgásában, mivel az egyetlen kromoszómának fordított telomer szekvenciája van a kromoszóma egyik vége közelében. Ha egy ilyen szekvenciát törölnénk, a sejtek végpontok közötti fúzión mennek keresztül az NHEJ útvonalon, amely gyakoribb az emberi sejtekben (Palm and de Lange, 2008). További kísérletek azt mutatták, hogy ez a megállapítás nem az NHEJ aktivitás csökkenésének volt köszönhető, és hogy ez az út képes összeolvasztani a linearizált plazmidokat A kezdő élesztősejtekben.
Wu et al. új betekintést nyújt abba, hogy a kromoszómák hogyan olvadnak össze, és hogyan tartják fenn a telomereket a telomeráz enzimtől függetlenül. Ezen túlmenően a tanulmány eredményei túlmutathatnak az élesztőn, és javíthatják a különböző emberi orvosi szindrómák megértését, amelyeket a kromoszómák végei gyűrű alakúvá válnak (Pristyazhnyuk and Menzorov, 2018).