az egészséges szövetek sérülésével a fiziológiai események kiszámítható előrehaladása bontakozik ki. Ez a progresszió a gyulladás, a proliferáció és az érés fázisaira osztható. Minden fázist a megkülönböztető citokinek szekvenciális kidolgozása jellemez specifikus sejtek által. Lásd az alábbi képeket.
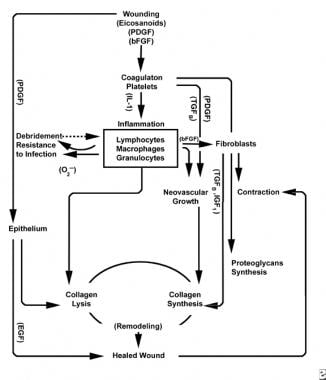 a sebgyógyulási folyamat rendszerei.
a sebgyógyulási folyamat rendszerei. 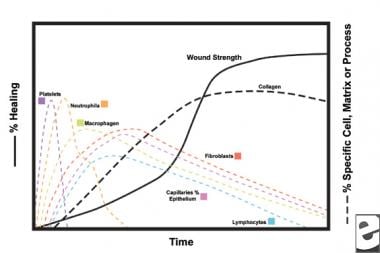 a sebgyógyulási folyamat celluláris jellemzői.
a sebgyógyulási folyamat celluláris jellemzői. a gyulladásos fázis
a gyulladásos fázis egyidejűleg elindítja a vérzéscsillapító mechanizmusokat és útvonalakat, amelyek a gyulladás klinikailag felismerhető kardinális jeleit hozzák létre: rubor (vörösség), calor (melegség), tumor (duzzanat), dolor (fájdalom) és functio laesa (funkcióvesztés).
a vaszkuláris szövet sérülése az intracelluláris kalcium és a VII-es faktort aktiváló szöveti faktor felszabadításával indítja el az extrinsic koagulációs kaszkádot. a kapott fibrin dugó a reflex vazokonstrikcióval segíti a hemosztázist. Ez a dugó rácsként működik a vérlemezkék aggregációjához, amely a korai gyulladásos fázis leggyakoribb és “aláíró” sejttípusa.
a vérlemezkék számos proinflammatorikus anyagot fejlesztenek ki, mint például az adenozin-difoszfát, a béta-szöveti növekedési faktor (TGF -) és a thrombocyta-eredetű növekedési faktorok (PDGF). Ezek a növekedési faktorok a környező sejtekre hatnak, és stimulálják a neutrofilek, monociták és fibroblasztok kemotaxisát a sérülés területére.
a sérült szövetek az aktivált foszfolipáz A-n keresztül egyidejűleg katalizálják az arachidonsavakat, hogy vazoaktív prosztaglandinokat és tromboxánt termeljenek, amelyek együttesen eikozanoidok. Az eikozanoidok közvetítik a thrombocyta dugó kialakulását befolyásoló aktivitást, az érpermeabilitást és a celluláris kemotaxist, hogy befolyásolják a sebgyógyulást. Például a tromboxán A2 közvetíti az érszűkületet és a thrombocyta aggregációt.
a kezdeti vazokonstrikció után a gyulladás klasszikus jelei a megnövekedett vaszkuláris permeabilitásból fakadnak. A Rubor a prosztaciklin (OFJ2), a prosztaglandin A (PGA), a prosztaglandin D (PGD) és az e prosztaglandin (PGE) által mediált értágulat eredménye. A Tumor és a calor fejlődik, amikor a vaszkuláris endoteliális rések megnövekednek, lehetővé téve a plazmafehérje és a folyadék kilépését az intersticiális térbe. Ezeket a változásokat a PGE2 és a prosztaglandin F2a (PGF2a) fokozza, és lehetővé teszi a gyulladásos sejtek bejutását a sérülés területére, beleértve a bonyolult sejteket is. A Dolor-t úgy érzékeljük, hogy a pgi2, a PGE és a PGE2 perifériás nociceptorokra hat.
a gyulladásos fázis második szakaszában a leukociták domináns sejttípusként helyettesítik a vérlemezkéket, amelyeket kemotaxis vonz. A fehérvérsejtek (WBC-k) a sérülés utáni első 3 napban a domináns sejtek; számuk körülbelül 48 óra múlva tetőzik. A polimorfonukleociták (pmns) az elsők, amelyek baktériumölő hatást fejtenek ki gyulladásos mediátorok és oxigén szabad gyökök metabolitok felhasználásával. A normális sebgyógyulás azonban pmns nélkül is előfordulhat. Egy másik leukocita, a segítő T-sejt, kidolgozza az interleukin–2-t (IL-2). Az IL-2 elősegíti a T-sejtek további proliferációját a sérülésre adott immunogén válasz fokozása érdekében.
mivel a PMN leukociták 24-36 óra elteltével csökkennek, a keringő monociták belépnek a sebbe, és szöveti makrofágokba érnek. Ezek a sejtek mikroszkopikus szinten eltávolítják a sebet, és számos fontos anyagot termelnek, mint például az IL-1 és a bázikus fibroblaszt növekedési faktor (bFGF). Az IL-1 stimulálja a gyulladásos sejtek proliferációját és elősegíti az angiogenezist az endothel sejtek replikációján keresztül. a bFGF egy kemotaktikus és mitogén faktor a fibroblasztok és endothel sejtek számára. A pmns-től eltérően a makrofágok kimerülése súlyosan rontja a sebgyógyulást, mivel a debridement, a fibroblaszt proliferáció és az angiogenezis mind csökken.
a gyulladásos ciklus vége felé az eikozanoidok fejlődő környezete a sebben kölcsönhatásba lép a jelenlévő sejttípusokkal, ami a kollagén és az őrölt anyag fibroblaszt szintézisét eredményezi (a pgf2a megnövekedett arányától a PGE2-ig). Ezenkívül a makrofágokból származó növekedési faktorok optimális szinten vannak, erősen befolyásolják a fibroblasztok, majd a keratinociták és az endothel sejtek beáramlását a sebbe. Mivel a mononukleáris sejtek továbbra is helyettesítik a WBC-ket és a makrofágokat, megkezdődik a proliferációs fázis.
a proliferatív fázis
két-három nappal a sebzés után a fibroblasztok befelé vándorolnak a sebszélektől a gyulladásos fázis során kialakult fibrinos mátrix felett. Az első héten a fibroblasztok glikozaminoglikánokat és proteoglikánokat, a granulációs szövet őrölt anyagát, valamint kollagént termelnek, válaszul a makrofágok által szintetizált bFGF és TGF-xhamsterre, valamint a PDGF-re.
a fibroblasztok hamarosan domináns sejttípussá válnak, 1-2 héten belül tetőznek. Nem csak kollagén molekulákat termelnek, hanem citokineket is , mint például a PDGF, a TGF-6, a bfgf, a keratinocita növekedési faktor és az inzulinszerű növekedési faktor-1. A fibroblasztok a kollagén molekulákat szálakká is összeállítják, amelyek térhálósak és kötegekké szerveződnek. A kollagén az akut seb kötőszövet fő alkotóeleme, a nettó termelés a következő 6 hétben folytatódik. A seb kollagén növekvő tartalma korrelál a növekvő szakítószilárdsággal.
a keratinociták és az endothel sejtek is szaporodnak ez idő alatt, végül autokrin növekedési faktorokat termelnek, amelyek fenntartják növekedésüket. Az endothel tágulása hozzájárul az angiogenezishez, mivel az ép erek rügyeket generálnak a granulációs szövetben. A neovaszkularizáció elősegíti a fibroblasztok előrehaladó vonalának növekedését a sebbe, biztosítva számukra a szükséges tápanyagokat és citokineket.
a fibrinrög és az ideiglenes mátrix lebomlását a granulációs szövet (őrölt anyag, kollagén, kapillárisok) lerakódása kíséri, amely a seb lefedéséig folytatódik. A hialuronsav (őrölt anyagban) szintjének csökkenése és a kondroitin-szulfát szintjének emelkedése lassítja a fibroblaszt migrációját és proliferációját, miközben indukálja a fibroblaszt differenciálódását, áttérve a sebgyógyulás érési szakaszára.
az érési szakasz
az első 6 hétben az új kollagéntermelés uralja a sebgyógyulási folyamatot, véletlenszerűen lerakódik az akut sebgranulációs szövetbe. Ahogy a seb érlelődik, a kollagén szervezettebb szerkezetté alakul át, megnövekedett szakítószilárdsággal. Fokozatosan az I. típusú kollagén helyettesíti a III. Ahogy az átalakítás folytatódik, a mátrix metalloproteináz kollagenolízise egyensúlyi állapotot ér el kollagén szintézissel. Szakítószilárdság fennsíkok 80% – a az eredeti szilárdság körülbelül 1 év postinjury.
felületes erre a tevékenységre, a hámsejtek továbbra is befelé vándorolnak a seb szélétől, amíg a hibát el nem fedik. Ezen a ponton az érintkezési gátlás indukálja a fibroblasztok myofibroblasztokká történő átalakulását, amelyek kontraktilis aktinrostokat tartalmaznak. A seb összehúzódása következik, a sérült szövet térfogatát új szövetekkel helyettesítve, bár a myofibroblast pontos szerepe nem teljesen tisztázott.
az akut sebek általában rendezett és időszerű javítási folyamaton mennek keresztül, amely az anatómiai és funkcionális integritás tartós helyreállítását eredményezi. Azonban különböző fiziológiai és mechanikai tényezők ronthatják a gyógyulási reakciót, ami krónikus sebet eredményez, amely nem halad át a szokásos fokozatos progresszión. Leggyakrabban helyi fertőzés, hipoxia, trauma, idegen testek vagy szisztémás problémák, például diabetes mellitus, alultápláltság, immunhiány vagy gyógyszerek felelősek.
minden seb szennyezett, de a legeredményesebben ellenáll az invazív fertőzésnek. Ha a koncentráció meghaladja a 100 000 (105) organizmust egy gramm szövetben, vagy az immunrendszer veszélybe kerül, a fertőzés gyakran bekövetkezik. A Cellulitis meghosszabbítja a gyulladásos fázist a proinflammatorikus citokinek és szöveti proteázok magas szintjének fenntartásával, amelyek lebontják a granulációs szövetet és a szöveti növekedési faktorokat, és késleltetik a kollagén lerakódását.
a Debridement (sebészeti, enzimatikus és / vagy öltözködési változások) és az antibiotikumok az antibiotikus kezelés alappillérei. A Debridement eltávolítja a devitalizált szövetet, amely endotoxinok forrása lehet, amelyek gátolják a fibroblasztot és a keratinocita migrációt a sebbe. Az idegen testek eltávolítását is igényelhetik, mivel a selyemvarrat jelenléte 10 000-szeresére csökkenti a fertőzés kiváltásához szükséges baktériumok számát. (A technika részletes leírását lásd Medscape referencia cikk seb idegen test eltávolítása.)
a celluláris hipoxia különböző eszközökkel késlelteti a sebgyógyulást. A kollagén fibrill térhálósítása oxigént igényel a prolin és a lizin hidroxilálásához, és sikertelen, ha a szöveti nyomás 40 Hgmm alatt van. A leukocita oxidatív foszforiláció baktericid hatása hipoxiás környezetben is szenved, csökkentve a fertőzés küszöbét. Az oxigénellátás javítására irányuló intézkedések az etiológiától függenek. A dohányzást, amely érszűkületet okoz és növeli a vérlemezkék tapadását, le kell állítani. Perifériás érbetegség esetén angioplasztikára vagy artériás bypass oltásra lehet szükség. Szívelégtelenség esetén kiegészítő intézkedésekre lehet szükség a szisztémás perfúzió javítására. A hematokrit értéke kevesebb, mint 15% – ot kell kezelni, és szükség szerint vissza kell állítani az euvolémiát. A vénás pangás vagy a nyirokrendszeri elégtelenség kompressziós ruhákkal javítható.
a szisztémás betegség drámai módon meghosszabbíthatja vagy megszakíthatja a sebgyógyulást. A cukorbetegség glikozilezése rontja a baktériumok neutrofil és makrofág fagocitózisát, meghosszabbítva a gyulladásos fázist. A proliferatív fázis ugyanabban a betegségben is elhúzódik, mivel az eritrociták kevésbé hajlékonyak és kevésbé képesek oxigént szállítani a sebbe a szövetek anyagcseréjéhez és a kollagén szintéziséhez.
az alultápláltság csökkent fibroblaszt proliferációt, csökkent neovaszkularizációt, valamint csökkent sejt-és humorális immunitást eredményez. A sebek fokozott anyagcsere-igényeket támasztanak, különösen a granulációs szövetben. Az olyan aminosavak, mint a metionin, a prolin, a glicin és a lizin, elengedhetetlenek a normális sejtfunkcióhoz és a bőr sebek javításához. A zsírsavak a sejtmembránok kritikus alkotóelemei, és a gyulladásos folyamatot közvetítő eikozanoidok szubsztrátjai. Esszenciális zsírsavak linolén és linolsav kell biztosítani az étrendben, mivel az emberi test nem képes de novo szintézisét ezek a molekulák.
a sejtek anyagcseréjéhez megfelelő vitaminoknak és ásványi anyagoknak kell rendelkezésre állniuk, amelyek celluláris jelekként és kofaktorokként működnek. A C-Vitamin (aszkorbinsav) és a vas szükséges a lizin és a prolin hidroxilezéséhez, amelyek keresztkötik és stabilizálják a kollagén hármas spirálszerkezetét; a réz szintén szerepet játszik a kollagén stabilizálásában. Az A-Vitamin (retinsav) fontos szerepet játszik a kollagén termelés és lebomlás modulálásában, és különösen fontos az epithelializációban. Úgy tűnik, hogy egy erős antioxidáns, az E-vitamin (alfa-tokoferol) felgyorsítja az állatok bőr-és csontgyógyulását, és a kiegészítés szerepet játszhat az emberekben. A nyomfém, különösen a cink hiánya szintén rossz sebgyógyulással jár; ezt szükség szerint pótolni kell.
Ovidius állítólag azt írta: “a gyógyszerek néha gyógyítanak, néha megölnek.”Ez minden bizonnyal igaz a sebgyógyulásra. A kortikoszteroidok tompítják a teljes gyulladásos fázis folyamatait. Az A-Vitamin (helyileg vagy 25 000 NE/D orálisan) enyhíti a kortikoszteroidok káros gyógyító hatásait, de a hepatotoxicitás hosszan tartó használatból eredhet (azaz >1 mo). A nem szteroid gyulladásgátló gyógyszerek (NSAID-ok) szintén befolyásolják az arachidonsav anyagcserét, ezért a sebgyógyulást. Ezenkívül az NSAID-ok gátolják a vérlemezke funkciót, amely a gyulladásos fázis egyik legkorábbi folyamata.
egy tanulmány szerint Sutcliffe et al azt javasolta, hogy a gap junction protein connexin szabályozása gyakori a krónikus sebeknél. A connexin vizsgálata három sebtípusban-vénás láb, diabéteszes láb és nyomásfekély-a kutatók azt találták, hogy minden típusú seb az epidermális connexin 43, a connexin 26 és a connexin 30, valamint a dermális connexin 43 szabályozását mutatta.