általános név: klonidin-hidroklorid
adagolási forma: tabletta
orvosilag felülvizsgálta Drugs.com. Utoljára 1.július 2020-én frissült.
- áttekintés
- mellékhatások
- adagolás
- szakmai
- tippek
- kölcsönhatások
- több
- klonidin-hidroklorid tabletta, USP
- klonidin leírás
- klonidin – Klinikai farmakológia
- farmakokinetika
- javallatok és használat klonidin
- ellenjavallatok
- figyelmeztetések
- megvonás
- óvintézkedések
- Általános
- perioperatív alkalmazás
- információk a betegek számára
- Gyógyszerkölcsönhatások
- toxikológia
- karcinogenezis, mutagenezis, fertilitás károsodás
- vemhesség
- szoptató anyák
- gyermekgyógyászati alkalmazás
- mellékhatások
- túladagolás
- klonidin Adagolás és alkalmazás
- hogyan szállítják a klonidint
- fő kijelző PANEL
- fő kijelző PANEL
- PRINCIPAL DISPLAY PANEL
- További információ a klonidinről
- fogyasztói források
- szakmai források
- kapcsolódó Kezelési Útmutatók
klonidin-hidroklorid tabletta, USP
orális vérnyomáscsökkentő
0, 1 mg, 0, 2 mg és 0 tabletta.3 mg
csak Rx
alkalmazási előírás
klonidin leírás
a klonidin-hidroklorid, az USP egy centrálisan ható alfa-agonista hipotenzív szer, amely tabletta formájában kapható orális beadásra három dóziserősségben: 0,1 mg, 0,2 mg és 0,3 mg. A 0, 1 mg-os tabletta 0, 087 mg szabad bázisnak felel meg.
nem aktív összetevők: kolloid szilícium-dioxid, kukoricakeményítő, kétbázisú kalcium-foszfát, hidroxipropil-cellulóz, mikrokristályos cellulóz, laktóz-monohidrát és magnézium-sztearát. Továbbá, a 0.Az 1 mg-os tabletta FD&C Red No.40-et tartalmaz, a 0, 2 mg-os és 0, 3 mg-os tabletta FD&C sárga No. 6-ot tartalmaz színadalékként.
a klonidin-hidroklorid egy imidazolin-származék, mezomer vegyületként létezik. A kémiai név 2-(2,6-diklór-fenil-amino) – 2-imidazolin-hidroklorid. A következő a szerkezeti képlet:
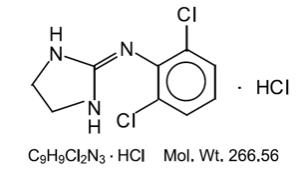
a klonidin-hidroklorid szagtalan, keserű, fehér, kristályos anyag, amely vízben és alkoholban oldódik.
klonidin – Klinikai farmakológia
a klonidin stimulálja az alfa-adrenoreceptorokat az agytörzsben. Ez a hatás csökkenti a szimpatikus kiáramlást a központi idegrendszerből, és csökkenti a perifériás rezisztenciát, a vese vaszkuláris rezisztenciáját, a pulzusszámot és a vérnyomást. A klonidin-hidroklorid tabletták viszonylag gyorsan hatnak. A beteg vérnyomása az orális adag beadása után 30-60 percen belül csökken, a maximális csökkenés 2-4 órán belül következik be. A vese véráramlása és a glomeruláris filtrációs ráta lényegében változatlan marad. A normális testtartási reflexek sértetlenek, ezért az ortosztatikus tünetek enyhék és ritkák.
humán klonidin-hidrokloriddal végzett akut vizsgálatok a szívteljesítmény mérsékelt (15-20% – os) csökkenését mutatták fekvő helyzetben, a perifériás rezisztencia változása nélkül: 45′ dőlésszögnél a szívteljesítmény kisebb mértékű csökkenése és a perifériás rezisztencia csökkenése figyelhető meg. A hosszú távú terápia során a szívteljesítmény hajlamos visszatérni a kontroll értékekhez, míg a perifériás ellenállás továbbra is csökken. A pulzusszám lassulását figyelték meg a legtöbb klonidint kapó betegnél, de a gyógyszer nem változtatja meg a testmozgásra adott normális hemodinamikai választ.
egyes betegeknél kialakulhat a vérnyomáscsökkentő hatás toleranciája, ami a terápia átértékelését teszi szükségessé.
más, betegeken végzett vizsgálatok igazolták a plazma reninaktivitás csökkenését, valamint az aldoszteron és a katekolaminok kiválasztását. Ezen farmakológiai hatások és a klonidin antihipertenzív hatása közötti pontos összefüggés nem tisztázott teljesen.
a klonidin akutan stimulálja a növekedési hormon felszabadulását mind gyermekeknél, mind felnőtteknél, de hosszú távú alkalmazás esetén nem okoz krónikus növekedési hormon emelkedést.
farmakokinetika
a klonidin farmakokinetikája a 100-600 mcg tartományban dózisarányos. A klonidin abszolút biohasznosulása orális alkalmazás esetén 70-80%. A plazma klonidin-csúcskoncentrációja körülbelül 1-3 óra alatt alakul ki.
intravénás alkalmazást követően a klonidin kétfázisú diszpozíciót mutat, megoszlási felezési ideje körülbelül 20 perc, eliminációs felezési ideje pedig 12-16 óra. A felezési idő 41 órára nő súlyos veseműködési zavarban szenvedő betegeknél. A klonidin átjut a placentán. Kimutatták, hogy patkányokban átjut a vér-agy gáton.
szájon át történő beadást követően az abszorbeált dózis körülbelül 40-60% – a nyerhető vissza a vizeletben változatlan formában 24 óra alatt. Az abszorbeált dózis körülbelül 50% – a metabolizálódik a májban. Sem az étel, sem a beteg faja nem befolyásolja a klonidin farmakokinetikáját.
az antihipertenzív hatás 0, 2 és 2, 0 ng/mL közötti plazmakoncentráció mellett érhető el normál kiválasztó funkcióval rendelkező betegeknél. A plazmaszintek további emelkedése nem fokozza az antihipertenzív hatást.
javallatok és használat klonidin
klonidin-hidroklorid tabletta, USP javallt a magas vérnyomás kezelésére. Klonidin-hidroklorid tabletta, USP alkalmazható önmagában vagy egyidejűleg más vérnyomáscsökkentő szerekkel.
ellenjavallatok
a klonidin-hidroklorid tablettát nem szabad alkalmazni olyan betegeknél, akik ismerten túlérzékenyek a Klonidinre (lásd óvintézkedések).
figyelmeztetések
megvonás
a betegeket utasítani kell, hogy ne hagyják abba a kezelést anélkül, hogy kezelőorvosukkal konzultálnának. A klonidin-kezelés hirtelen abbahagyása néhány esetben olyan tüneteket eredményezett, mint idegesség, izgatottság, fejfájás és tremor, melyet a vérnyomás gyors emelkedése és a plazma katekolamin-koncentrációjának emelkedése kísér vagy követ. Nagyobb dózisok adása vagy az egyidejűleg Adott béta-blokkoló kezelés folytatása után a klonidin-kezelés abbahagyásával járó ilyen reakciók valószínűsége nagyobbnak tűnik, ezért ezekben a helyzetekben különös óvatosság javasolt. A klonidin megvonását követően ritkán hypertoniás encephalopathiát, cerebrovascularis eseményeket és halált jelentettek. A klonidin-kezelés abbahagyásakor az orvosnak 2-4 nap alatt fokozatosan csökkentenie kell az adagot az elvonási tünetek elkerülése érdekében.
a klonidin-kezelés abbahagyását követő túlzott vérnyomás-emelkedés visszafordítható orális klonidin-hidroklorid vagy intravénás fentolamin alkalmazásával. Ha béta-blokkolót és klonidint egyidejűleg kapó betegeknél a kezelést abba kell hagyni, a béta-blokkolót néhány nappal a klonidin fokozatos abbahagyása előtt fel kell függeszteni.
mivel a gyermekek gyakran gyomor-bélrendszeri betegségekben szenvednek, amelyek hányáshoz vezetnek, különösen érzékenyek lehetnek hipertóniás epizódokra, amelyek hirtelen képtelenek gyógyszert szedni.
óvintézkedések
Általános
azoknál a betegeknél, akiknél a transzdermális klonidinnel szembeni lokális kontakt szenzibilizáció alakult ki, a transzdermális klonidin-kezelés folytatása vagy az orális klonidin-hidroklorid-terápia helyettesítése generalizált bőrkiütés kialakulásával járhat.
azoknál a betegeknél, akiknél a transzdermális Klonidinre allergiás reakció alakul ki, az orális klonidin-hidroklorid helyettesítése allergiás reakciót is kiválthat (beleértve a generalizált kiütést, urticariát vagy angiooedemát.)
a klonidin szimpatolitikus hatása súlyosbíthatja a szinuszcsomó diszfunkcióját és az atrioventrikuláris (AV) blokkot, különösen más szimpatolitikus gyógyszereket szedő betegeknél. A forgalomba hozatalt követően vezetési rendellenességben szenvedő és/vagy egyéb szimpatolítikus gyógyszereket szedő betegekről számoltak be, akiknél súlyos bradycardia alakult ki, amely klonidin szedése alatt IV.atropint, IV. izoproterenolt és átmeneti szívritmust igényelt.
feokromocitóma által okozott magas vérnyomás esetén a klonidin-hidroklorid tabletták terápiás hatása nem várható.
perioperatív alkalmazás
a klonidin-hidroklorid tabletta alkalmazását a műtétet követő négy órán belül folytatni kell, majd ezt követően a lehető leghamarabb folytatni kell. A vérnyomást a műtét során gondosan ellenőrizni kell, és szükség esetén további vérnyomáscsökkentő intézkedéseknek is rendelkezésre kell állniuk.
információk a betegek számára
a betegeket figyelmeztetni kell arra, hogy ne szakítsák meg a klonidin-hidroklorid tabletta kezelését orvosuk tanácsa nélkül.
mivel a betegek szedatív hatást, szédülést vagy alkalmazkodási zavarokat tapasztalhatnak a klonidin alkalmazása során, óvatosan kell eljárni olyan tevékenységekkel kapcsolatban, mint a járművezetés vagy a készülékek vagy gépek kezelése. Tájékoztassa a betegeket arról is, hogy ez a nyugtató hatás fokozható alkohol, barbiturátok vagy más nyugtató gyógyszerek egyidejű alkalmazásával.
a kontaktlencsét viselő betegeket figyelmeztetni kell arra, hogy a klonidin-hidroklorid tablettával történő kezelés szemszárazságot okozhat.
Gyógyszerkölcsönhatások
a klonidin fokozhatja az alkohol, barbiturátok vagy más nyugtató gyógyszerek központi idegrendszeri depressziós hatásait. Ha a klonidin-hidrokloridot kapó beteg triciklikus antidepresszánsokat is szed, a klonidin vérnyomáscsökkentő hatása csökkenthető, ami szükségessé teszi a klonidin adagjának növelését. Ha a klonidint kapó beteg neuroleptikumokat is szed, ortosztatikus szabályozási zavarok (pl. ortosztatikus hipotenzió, szédülés, fáradtság) kiválthatók vagy súlyosbodhatnak.
a szívfrekvencia monitorozása azoknál a betegeknél, akik klonidint és ismerten a sinus Nodus működését vagy AV Nodus vezetőképességét befolyásoló szereket (pl. digitálisz, kalciumcsatorna-blokkolók és béta-blokkolók) kapnak egyidejűleg. Hospitalizációt és pacemaker behelyezést eredményező Sinus bradycardiáról számoltak be klonidin és diltiazem vagy verapamil együttes alkalmazásával összefüggésben.
az amitriptilin klonidinnel kombinálva fokozza a szaruhártya-elváltozások megnyilvánulását patkányokban (lásd toxikológia).
alkoholos delíriumban szenvedő betegek megfigyelései alapján azt javasolták, hogy a klonidin nagy intravénás dózisai növelhetik a nagy intravénás dózisú haloperidol aritmogén potenciálját (QT-megnyúlás, kamrai fibrilláció). OKI összefüggést és relevanciát a klonidin orális tabletta esetében nem állapítottak meg.
toxikológia
orális klonidin-hidrokloriddal végzett számos vizsgálatban a spontán retinadegeneráció előfordulási gyakoriságának és súlyosságának dózisfüggő növekedését figyelték meg hat hónapig vagy tovább kezelt albínó patkányokban. Kutyákon és majmokon végzett szöveti eloszlási vizsgálatok a klonidin koncentrációját mutatták a choroidban.
a patkányoknál megfigyelt retina degeneráció miatt 908 betegen végeztek szemvizsgálatot a klinikai vizsgálatok során a klonidin-kezelés megkezdése előtt és után időszakosan. 353 ilyen 908 betegnél a szemvizsgálatokat 24 hónapos vagy annál hosszabb időszakokon keresztül végezték. Néhány szemszárazság kivételével nem regisztráltak gyógyszerrel kapcsolatos abnormális szemészeti leleteket, és speciális vizsgálatok, például elektroretinográfia és makula vakítás szerint a retina funkciója változatlan maradt.
amitriptilinnel kombinálva a klonidin-hidroklorid beadása patkányokban 5 napon belül szaruhártya-elváltozások kialakulásához vezetett.
karcinogenezis, mutagenezis, fertilitás károsodás
a klonidin krónikus étrendi alkalmazása nem volt karcinogén azoknál a patkányoknál (132.hét) vagy egereknél (78. hét), amelyek a mg/kg-ban kifejezett maximális ajánlott napi humán dózis 46-szorosát vagy 70-szeresét kapták (mg/m2 alapon az MRDHD 9-szeresét vagy 6-szorosát). Az Ames mutagenitási tesztben vagy egér micronucleus klasztogenitási tesztben nem volt genotoxicitásra utaló bizonyíték.
hím vagy nőstény patkányok fertilitását nem befolyásolta a 150 mcg/kg-os klonidin dózis (az MRDHD körülbelül 3-szorosa). Egy másik kísérletben úgy tűnt, hogy a nőstény patkányok termékenysége 500-2000 mcg/kg dózisszint mellett érintett (mg/kg alapon az orális MRDHD 10-40-szerese; mg/m alapon az mrdhd 2-8-szorosa.)
vemhesség
teratogén hatások: vemhességi kategória C. nyulakon a klonidin-hidroklorid tabletta orális maximális ajánlott napi humán dózisának (mrdhd) legfeljebb 3-szorosát elérő dózisokkal végzett reprodukciós vizsgálatok nem mutattak ki teratogén vagy embriotoxikus potenciált nyulakban. Patkányokban azonban a klonidin orális MRDHD 1/3-a (mg/m2 alapon mrdhd 1/15-e) dózisa fokozott reszorpcióval társult egy olyan vizsgálatban, amelyben az anyákat a párzást megelőző 2 hónaptól folyamatosan kezelték. A megnövekedett reszorpciók nem társultak a kezeléssel egyidejűleg vagy magasabb dózisszinteken (az orális MRDHD legfeljebb 3-szorosa), amikor a gátakat a terhesség 6-15. A reszorpció növekedését sokkal magasabb dózisszinteknél figyelték meg (mg / kg alapon az orális MRDHD 40-szerese; Az MRDHD 4-8-szorosa mg / m2 alapon) az 1-14.vemhességi napon kezelt egerekben és patkányokban (a vizsgálatban alkalmazott legalacsonyabb dózis 500 mcg/kg volt).
terhes nőkön nem végeztek megfelelő, jól kontrollált vizsgálatokat. A klonidin átjut a placentán (lásd klinikai farmakológia, farmakokinetika). Mivel az állatokon végzett reprodukciós vizsgálatok nem mindig jelzik előre az emberi választ, ezt a gyógyszert terhesség alatt csak akkor szabad alkalmazni, ha erre egyértelműen szükség van.
szoptató anyák
mivel a klonidin-hidroklorid kiválasztódik az anyatejbe, óvatosan kell eljárni, ha a klonidin-hidroklorid tablettát szoptató nőnek adják be.
gyermekgyógyászati alkalmazás
biztonságosságát és hatékonyságát gyermekgyógyászati betegeknél nem igazolták megfelelő és jól kontrollált vizsgálatokban (lásd figyelmeztetések, megvonás).
mellékhatások
a legtöbb mellékhatás enyhe, és a kezelés folytatásával csökken. A leggyakoribb (amelyek úgy tűnik, hogy dózisfüggő) szájszárazság, előforduló mintegy 40 100 beteg; álmosság, körülbelül 33: 100; szédülés, körülbelül 16: 100; székrekedés és szedáció, mindegyik körülbelül 10: 100.
a klonidin-hidroklorid tablettát kapó betegeknél az alábbi, kevésbé gyakori mellékhatásokról is beszámoltak, de sok esetben a betegek egyidejűleg gyógyszeres kezelést is kaptak, és ok-okozati összefüggést nem állapítottak meg.
a test egésze: fáradtság, láz, fejfájás, sápadtság, gyengeség és megvonási szindróma. Szintén gyengén pozitív Coombs-tesztet és fokozott alkoholérzékenységet jelentettek.
szív-és érrendszeri: Bradycardia, pangásos szívelégtelenség, elektrokardiográfiás rendellenességek (pl. sinus node leállás, junkciós bradycardia, magas fokú AV blokk és arrhythmiák), ortosztatikus tünetek, palpitáció, Raynaud-jelenség, ájulás és tachycardia.
sinus bradycardia és atrioventricularis blokk eseteit jelentették digitalis egyidejű alkalmazása mellett és anélkül is.
Központi Idegrendszer: Izgatottság, szorongás, delírium, téveszmés érzékelés, hallucinációk (beleértve a látást és hallást is), álmatlanság, mentális depresszió, idegesség, egyéb viselkedésbeli változások, paraesthesia, nyugtalanság, alvászavar és élénk álmok vagy rémálmok.
dermatológiai: Alopecia, angioneurotikus ödéma, csalánkiütés, viszketés, kiütés és urticaria.
gastrointestinalis: hasi fájdalom, anorexia, székrekedés, hepatitis, rossz közérzet, enyhe átmeneti eltérések a májfunkciós tesztekben, hányinger, parotitis, pszeudo-obstrukció (beleértve a vastagbél pszeudo-obstrukcióját), nyálmirigy fájdalom és hányás.
urogenitális rendszer: csökkent szexuális aktivitás, vizelési nehézség, erectilis dysfunctio, libidó elvesztése, nocturia és vizeletretenció.
Hematológiai: Thrombocytopenia.
metabolikus: Gynecomastia, a vércukorszint vagy a szérum kreatin-foszfokináz átmeneti emelkedése és súlygyarapodás.
mozgásszervi: lábgörcsök és izom-vagy ízületi fájdalom.
Oro-otolaryngealis: az orrnyálkahártya szárazsága.
szemészeti: alkalmazkodási zavar, homályos látás, szemégés, csökkent könnyezés és szemszárazság.
túladagolás
a hypertonia Korán kialakulhat, amelyet hypotonia, bradycardia, légzésdepresszió, hypothermia, álmosság, csökkent vagy hiányzó reflexek, gyengeség, ingerlékenység és miosis követhet. A központi idegrendszeri depresszió gyakorisága magasabb lehet gyermekeknél, mint felnőtteknél. A nagy túladagolás reverzibilis szívvezetési rendellenességeket vagy ritmuszavarokat, apnoét, kómát és görcsrohamokat okozhat. A túladagolás jelei és tünetei általában az expozíciót követő 30 perctől két óráig terjednek. Már 0,1 mg klonidin is toxikus tüneteket okozott gyermekeknél.
a klonidin túladagolásának nincs specifikus antidotuma. A klonidin túladagolása a központi idegrendszeri depresszió gyors kialakulását eredményezheti, ezért az ipecac szirup hányás kiváltása nem ajánlott. Gyomormosás indokolt lehet a közelmúltban történt és / vagy nagy adagok lenyelése után. Aktív szén és/vagy katartikus kezelés alkalmazása előnyös lehet. A szupportív kezelés magában foglalhatja az atropin-szulfátot bradycardia kezelésére, intravénás folyadékpótlást és / vagy vazopresszor szereket hypotonia kezelésére és értágítókat hypertonia kezelésére. A naloxon hasznos kiegészítő lehet a klonidin által indukált légzésdepresszió, hypotonia és/vagy kóma kezelésében; a vérnyomást monitorozni kell, mivel a naloxon alkalmazása esetenként Paradox hypertoniát eredményezett. A tolazolin alkalmazása ellentmondásos eredményeket hozott, és első vonalbeli kezelésként nem ajánlott. A dialízis valószínűleg nem fokozza jelentősen a klonidin eliminációját.
az eddigi legnagyobb túladagolás egy 28 éves férfit érintett,aki 100 mg klonidin-hidroklorid Port fogyasztott. Ebben a betegben magas vérnyomás alakult ki, amelyet hipotenzió, bradycardia, apnoe, hallucinációk, semicoma és korai kamrai összehúzódások követtek. A beteg intenzív kezelés után teljesen felépült. A plazma Klonidinszintje 60 ng/mL volt 1 óra után, 190 ng/mL 1, 5 óra után, 370 ng/mL 2 óra után, és 120 ng / mL 5, 5 és 6, 5 óra után. Egerekben és patkányokban a klonidin orális LD50 értéke 206, illetve 465 mg/kg.
klonidin Adagolás és alkalmazás
felnőttek
a klonidin-hidroklorid tabletta adagját a beteg egyéni vérnyomásválaszának megfelelően kell beállítani. Az alábbiakban bemutatjuk az adminisztráció általános útmutatóját.
kezdő adag
0, 1 mg tabletta naponta kétszer (reggel és lefekvés előtt). Idős betegek számára előnyös lehet az alacsonyabb kezdő adag.
fenntartó dózis
szükség esetén heti rendszerességgel további 0, 1 mg-os emelések végezhetők a kívánt hatás eléréséig. Az orális napi adag nagyobb részének lefekvéskor történő bevétele minimálisra csökkentheti a szájszárazság és az álmosság átmeneti kiigazító hatásait. A leggyakrabban alkalmazott terápiás dózisok napi 0, 2 mg és 0, 6 mg között mozogtak, osztva.
a vizsgálatok azt mutatták, hogy 2, 4 mg a maximális hatásos napi adag, de ilyen magas dózisokat ritkán alkalmaztak.
vesekárosodás
vesekárosodásban szenvedő betegeknél előnyös lehet az alacsonyabb kezdő dózis alkalmazása. A betegeket gondosan ellenőrizni kell. Mivel a rutin hemodialízis során csak minimális mennyiségű klonidint távolítanak el, dialízist követően nincs szükség kiegészítő Klonidinre.
hogyan szállítják a klonidint
klonidin-hidroklorid tabletták, az USP a következőképpen kerül forgalomba:
0, 1 mg: rózsaszín tabletta, “ “alakban.
“alakban.
NDC 58657-647-01 (100-as üveg)
NDC 58657-647-50 (500-as üveg)
NDC 58657-647-10 (1000-es üveg)
0, 2 mg: narancssárga tabletta, ”  “alakban.
“alakban.
NDC 58657-648-01 (100-as üveg)
NDC 58657-648-50 (500-as üveg)
NDC 58657-648-10 (1000-es üveg)
0, 3 mg: világos narancssárga tabletta, ”  “alakban.
“alakban.
NDC 58657-649-01 (Üveg 100)
NDC 58657-649-50 (Üveg 500)
NDC 58657-649-10 (Üveg 1000)
Tárolja 25°C (77°F); kirándulások megengedett 15°C-30°C (59°F-86°F) . Adja ki szűk, fényálló tartályban.
gyártó:
Yung Shin Pharmaceutical Ind. Sz., Kft.
Tachia, Taichung 43769
Tajvan
forgalmazó:
Method Pharmaceuticals, LLC
7333 Jack Newell Blvd. North, Suite 300
Fort Worth, Texas 76118
jelenteni a káros gyógyszer tapasztalat, kérjük, hívja módszer Pharmaceuticals at 1-877-250-3427
felülvizsgált: 06/20
fő kijelző PANEL
NDC 58657-647-10
klonidin
hidroklorid
tabletta, USP
0,1 mg
RX csak
1000 tabletta

fő kijelző PANEL
NDC 58657-648-10
klonidin
hidroklorid
tabletta, USP
0.2 mg
Rx Only
1000 Tablets

PRINCIPAL DISPLAY PANEL
NDC 58657-649-10
Clonidine
HYDROCHLORIDE
TABLETS, USP
0.3 mg
Rx Only
1000 Tablets

| Clonidine HYDROCHLORIDE Clonidine hydrochloride tablet |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
| klonidin-hidroklorid klonidin-hidroklorid tabletta |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
| klonidin-hidroklorid klonidin-hidroklorid tabletta |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Labeler-Method Pharmaceuticals, LLC (060216698)
További információ a klonidinről
- mellékhatások
- terhesség vagy szoptatás alatt
- adagolási információk
- Betegtippek
- Gyógyszerképek
- Gyógyszerkölcsönhatások
- alternatívák összehasonlítása
- támogató csoport
- árképzés & kuponok
- 619 vélemények
- kábítószer-osztály: antiadrenerg szerek, központi hatású
- FDA figyelmeztetések (1)
fogyasztói források
- betegtájékoztató
- … +5 további
szakmai források
- felírási információk
- klonidin (professzionális Betegtanácsadás)
- klonidin kiterjesztett hatóanyag-leadású tabletta (FDA)
- klonidin injekció (FDA)
- klonidin tapasz (FDA)
- klonidin tabletta (FDA)
egyéb márkák Catapres, kapvay, Catapres-TTS, Duraclon, Nexiclon XR
kapcsolódó Kezelési Útmutatók
- szorongás
- ADHD
- alkohol megvonása
- pitvarfibrilláció
- … +19 több
orvosi nyilatkozat