- Bevezetés
- Multipul funkciók Kimáz
- Kimáz hízósejtekben
- a Kimáz több enzimatikus funkciója
- a Kimáz enzimatikus funkciója NASH-ban
- a Kimáz bevonása a Nash Állatmodellekbe
- a Kimáz Inhibitor hatása Nash állatmodellekben
- a Kimáz Inhibitor hatása NASH állatmodellekben
- a májgyulladás mechanizmusa a Kimáz Inhibitor által gyengített
- a hepatikus Steatosis mechanizmusa Kimáz Inhibitor által attenuált
- a Kimáz Inhibitor által gyengített májfibrózis mechanizmusa
- következtetés
- szerzői hozzájárulások
- összeférhetetlenségi nyilatkozat
Bevezetés
alkoholmentes zsírmájbetegség (NAFLD) a májbetegség leggyakoribb formája (Angulo, 2002; Clark et al., 2002). Az alkoholmentes steatohepatitis (NASH) utánozza az alkoholos hepatitist annak ellenére, hogy korábban nem ivott (Ludwig et al., 1980). A NAFLD és a NASH összefüggésbe hozható az elhízás, az inzulinrezisztencia, a hiperlipidémia és a magas vérnyomás okozta metabolikus szindrómával. A NAFLD-t a leggyakoribb májbetegségnek tekintik, és általában egyszerű máj steatosisként jelenik meg (Tiniakos et al., 2010). Ezzel szemben a NASH-t súlyos steatosis, lobularis gyulladás és májfibrózis jellemzi (Powell et al., 1990; Bertot és Adams, 2016). Bár a NASH kifejlődéséért felelős mechanizmus még nem tisztázott, a NASH-t egy’ többszörös találat ‘okozza, a máj steatosis az első találat, és az azt követő találatok, mint például a gyulladás, az oxidatív stressz és az endotoxinok (Tilg and Moschen, 2010). A Nash szorosan kapcsolódik a metabolikus szindrómához, és számos klinikai vizsgálat vizsgálta a Nash terápiás kezelését a cukorbetegség, a hiperlipidémia és a magas vérnyomás tüneteire összpontosítva (Georgescu et al., 2009; Park et al., 2010; Mahady et al., 2011). Általánosan elfogadott terápiás szereket azonban nem állapítottak meg.
a Kimáz szerepet játszhat a májfibrózis patogenezisében. A fibrózisban vagy cirrhosisban szenvedő betegek májában szignifikánsan emelkedett a kimázaktivitás, és szignifikáns összefüggés volt a kimázszint és a fibrózis mértéke között (Komeda et al., 2008). Bár Nash-ban szenvedő betegeknél nem számoltak be fokozott kimázaktivitásról, a Nash állatmodelljeiben megfigyelték (Tashiro et al., 2010; Masubuchi et al., 2013; Miyaoka et al., 2017). Ezzel szemben a kimáz gátlása alacsony molekulájú inhibitorok alkalmazásával a gyulladás, a steatosis és a fibrosis jelentős csökkenését eredményezte patkány és hörcsög Nash modellekben (Tashiro et al., 2010; Masubuchi et al., 2013; Miyaoka et al., 2017). Ezek az eredmények azt mutatják, hogy a chymase szerepet játszhat a gyulladásban, a steatosisban és a fibrózisban a NASH kialakulása és progressziója során (1.ábra).
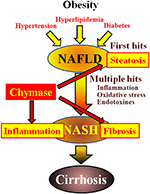
1. ÁBRA. A NAFLD és a NASH a metabolikus szindrómához kapcsolódik az elhízás, az inzulinrezisztencia, a hiperlipidémia és a magas vérnyomás miatt. Úgy gondolják, hogy a NASH egy “többszörös hit” folyamaton keresztül fejlődik ki, a máj steatosis az “első hit” és az azt követő találatok, mint például a gyulladás, az oxidatív stressz és az endotoxinok, és súlyos steatosis, gyulladás és fibrózis jellemzi. A Chymase szerepet játszhat a steatosis, a gyulladás és a máj fibrózisának progressziójában.
Multipul funkciók Kimáz
Kimáz hízósejtekben
Kimáz (EC 3.4.21.39) expresszálódik a szekréciós granulátum hízósejtek. A kimáz inaktív prokimázként termelődik a szekréciós granulátumokban, és aktiválásához dipeptidil-peptidáz I (DPPI) szükséges. A DPPI egy tiol-proteináz, optimális pH-ja 6,0. Az optimális pH-érték összhangban van a DPPI javasolt funkciójával a prochimáz aktiválására, mivel a szekréciós granulátumok pH – ja 5,5-nél van szabályozva (De Young et al., 1987) (2.ábra). A kimáz azonban ezen a pH-n belül nem rendelkezik enzimatikus aktivitással a hízósejtekben, mert a kimáz optimális pH-ja 7 és 9 között van (Takai et al., 1996, 1997). A hízósejt-granulátumok gyulladás és sérülés által történő aktiválását követően a kimáz felszabadul, és enzimatikus funkciót mutat az optimális pH 7,4-en (2.ábra).
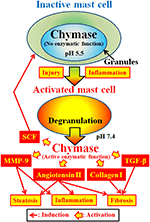
2. ÁBRA. A kimáz az inaktív hízósejtek szekréciós granulátumában tárolódik. A granulátum pH-ja 5,5 pH-n marad, ebben az állapotban a kimáznak nincs enzimatikus aktivitása. A hízósejtgranulátumból történő felszabaduláskor, gyulladás vagy sérülés által kiváltott aktivációt követően a kimáz enzimatikus funkciókat mutat, mint például angiotenzin II, MMP-9, TGF-6, kollagén I és SCF képződése.
a Kimáz több enzimatikus funkciója
a Kimáz egy szerin proteáz, amely az aromás aminosavak, például a Phe, a Tyr és általában a Trp után hasítja a fehérjék C-terminális oldalát. A kimáz képes hasítani a nem bioaktív peptid Phe8–His9 kötését angiotenzin I és bioaktív peptidjét angiotenzin II képezi emlős szövetekben, beleértve az embert is (Urata et al., 1990; Takai et al., 1996, 1997). Ezen túlmenően a kimáz enzimatikusan hasítja a -9 mátrix metalloproteináz (MMP)prekurzorait, átalakítva a növekedési faktort (TGF)-A .. és a kollagént az aktív formájukba (Koffford et al., 1997; Takai et al., 2003; Furubayashi et al., 2008). Ezenkívül a kimáz enzimatikus funkciója őssejt faktort (SCF) képes előállítani az SCF inaktív membránhoz kötött formájának enzimatikus hasításával, amely érett hízósejtek képződését indukálja éretlen hízósejtekből a c-kit receptor stimulálásával (Longley et al., 1997). Így a kimáz több enzimatikus funkcióval is rendelkezik, beleértve az angiotenzin II, az MMP-9, a TGF-6, a kollagén I és az SCF aktiválódását (2.ábra).
a Kimáz enzimatikus funkciója NASH-ban
az angiotenzin II elősegítheti a máj steatosisát és gyulladását azáltal, hogy növeli a reaktív oxigén fajtákat (ros) az angiotenzin II receptorok stimulálását követően állati Nash modellekben (Hirose et al., 2007; Nabeshima et al., 2009). Az angiotenzin II májfibrózist is indukált a hepaticus stellate sejtekben (hscs) lévő sima izom aktin (SMA) indukciója révén (Yoshiji et al., 2001). Beszámoltak arról, hogy az MMP-9 indukálja a neutrofilek és makrofágok infiltrációját az intercelluláris mátrixok, például a vitronektin és a fibronektin lebomlása révén, ami a gyulladás fokozódását eredményezi (Medina et al., 2006). NASH-betegeknél az MMP-9 génexpresszió jelentős növekedését figyelték meg a májban a normál kontrollokhoz képest (Ljumovic et al., 2004). A transzgenikus egerekben a TGF-adapterek hepatikus túlexpressziója súlyos májfibrózist okozott a procollagen I génexpresszió (Casini et al., 1993). Ismert, hogy mind a TGF-6 képződése, mind a kollagén I felhalmozódása májfibrózist indukál. Az SCF aktiválása növeli a hízósejtek számát, enzimatikus funkciója pedig a fibrotikus szövetekben a kimáz aktivitás növekedését eredményezheti (Maruichi et al., 2004). A kimáz ezen enzimatikus funkciói szerepet játszhatnak a steatosisban, a gyulladásban és a fibrózisban, amelyek mindegyike megfigyelhető a Nash-betegek májában és állatmodellekben (2.ábra).
a Kimáz bevonása a Nash Állatmodellekbe
a metionin – és kolinhiányos (MCD) étrendet széles körben alkalmazták egy tipikus NASH modell indukálására. Az MCD étrenddel táplált hörcsögökben a teljes bilirubin, a triglicerid és a hialuronsav szignifikáns növekedését figyelték meg a plazmában (Tashiro et al., 2010). Ezenkívül gyulladásos sejtek felhalmozódását, valamint a lipid lerakódási terület és a fibrotikus terület növekedését figyelték meg a májban. Ebben az MCD diéta által kiváltott Nash modellben a máj kimáz aktivitása és a kapcsolódó tényezők, mint például az angiotenzin II, az MMP-9 és a kollagén I, szignifikánsan emelkedtek (Tashiro et al., 2010; Masubuchi et al., 2013). Nemrégiben egy új Nash modellt fejlesztettek ki, amelyben a stroke-hajlamos spontán hipertóniás 5/Dmcr (SHRSP5 / Dmcr) patkányokat magas zsírtartalmú és koleszterin (hfc) étrenddel etették (Kitamori et al., 2012). Ez a modell azt mutatta, hogy a metabolikus szindróma tünetei klinikailag hasonlítanak a NASH-betegek tüneteire (Kitamori et al., 2012). A HFC diéta által kiváltott Nash modellben hipertóniát és hiperlipidémiát figyeltek meg, és súlyos steatosist, fibrózist és gyulladásos sejtfelhalmozódást észleltek a májban (Miyaoka et al., 2017). Továbbá a kimáz aktivitás szignifikáns növekedését figyelték meg az MMP-9, a TGF-6 és a kollagén I mellett a májban (Miyaoka et al., 2017). Így úgy tűnik, hogy szoros kapcsolat van a kimáz és a NASH patogenezis között a Nash állati modelljeiben.
a Kimáz Inhibitor hatása Nash állatmodellekben
a Kimáz Inhibitor hatása NASH állatmodellekben
az alacsony molekulájú kimáz inhibitor szignifikánsan gyengítette a kimáz aktivitást és csökkentette az angiotenzin II, MMP-9 és kollagén I szintjét a májban egy MCD diétával táplált Nash hörcsög modellben, amikor az inhibitor alkalmazását az MCD diétával egy időben kezdték meg (Tashiro et al., 2010; Masubuchi et al., 2013). A kimáz inhibitor szignifikánsan megakadályozta a máj steatosisát, fibrózisés gyulladásos sejtek felhalmozódása ebben a NASH modellben (Tashiro et al., 2010; Masubuchi et al., 2013). Úgy gondolják, hogy az oxidatív stressz szerepet játszik a Nash-fejlődés többszörös hit-elméletében, és az oxidatív stressz marker malondialdehid fokozódását jelentősen gyengítette a májban a kimáz inhibitor (Masubuchi et al., 2013). Egy hörcsög MCD diéta által kiváltott NASH modellben a kimáz inhibitor enyhítő hatást mutatott, ha bevett NASH-ben adják be (Masubuchi et al., 2013). Mind a steatosis, mind a fibrózis mértéke a májban csökkent a kimáz inhibitor beadása előtt (Masubuchi et al., 2013).
egy hipertóniás patkány hfc diéta által indukált Nash modelljének májában egy alacsony molekulájú kimáz inhibitor gyengítette a kimáz szintjét, valamint az MMP-9, a TGF-6 és a kollagén I szintjét ,amelyek mind a kimázhoz kapcsolódó tényezők (Miyaoka et al., 2017). A kimáz inhibitor jelentősen gyengítette a máj steatosisát és fibrózisát, és csökkentette a myeloperoxidázt, mint a gyulladás markerét, különösen a neutrofil infiltrációt (Miyaoka et al., 2017). Ebben a HFC diéta által indukált modellben a placebóval kezelt csoport túlélése 0% volt a HFC diéta kezdetét követő 14.héten, és súlyos májelégtelenségből származott (Miyaoka et al., 2017). Azonban a kimáz inhibitorral kezelt csoport, amelyben a patkányokat közvetlenül a HFC diéta megkezdése után a kimáz inhibitorral kezelték, 100% – os túlélést mutatott 14 héten belül. Ezenkívül 50% – os túlélési arányt jelentettek a kimáz inhibitorral kezelt patkányok esetében, 8 héttel a HFC diéta kezdete után, amikor Nash-t létrehozták (Miyaoka et al., 2017).
ezért a kimáz inhibitorok hasznos szerek lehetnek a Nash megelőzésében és javításában állatmodellekben. Másrészt az angiotenzin-II közvetetten elősegíti a májgyulladást, a steatosist és a fibrosist az MMP-9 és a TGF-6-génkifejeződés fokozódásával. Mind az MMP-9, mind a TGF-6 szorosan részt vesz a Nash patogenezisében, de ezeket a tényezőket nem feltétlenül csak az angiotenzin II indukálja (Takai et al., 2010). Az angiotenzin-II stimuláción kívül más tényezők is hozzájárulnak az MMP-9 és a TGF-gének expressziójának fokozásához (Takai et al., 2010). Ilyen esetekben az angiotenzin-II receptor blokkoló (ARB) nem képes az MMP-9 és a TGF-6-AK hatását csillapítani, azonban egy kimáz inhibitornak az MMP-9 és a TGF-Ca-N — A) aktiváció gátlása révén enyhítő hatása lehet, ami a Nash progressziójának megelőzését célzó lehetséges kezelési folyamatra utal.
a májgyulladás mechanizmusa a Kimáz Inhibitor által gyengített
a Kimáz inhibitor képes volt csökkenteni a gyulladást hörcsög MCD diéta és patkány hfc diéta által kiváltott Nash modellekben (Tashiro et al., 2010; Masubuchi et al., 2013; Miyaoka et al., 2017). A kimáz inhibitor kezelés szignifikánsan gyengítette a máj kimáz aktivitását, valamint csökkentette az angiotenzin II és az MMP-9 szintjét (Tashiro et al., 2010; Masubuchi et al., 2013; Miyaoka et al., 2017). HSC-ben az angiotenzin II a nikotinamid-adenin-dinukleotid-foszfát (NADPH) – oxidáz aktiválásával ROS-t, például hidrogén-peroxidot és szuperoxidot indukál (de Minicis and Brenner, 2007). A kimáz inhibitor a NADPH oxidáz komponens Rac-1 és az oxidatív stressz marker malondialdehid génexpressziójának csökkenését eredményezte az angiotenzin II szintjének csökkenése mellett egy hörcsög MCD által indukált Nash modellben (Masubuchi et al., 2013). Az angiotenzin II által kiváltott ros augmentáció elősegítette az MMP-9 gén expresszióját neutrofilekben és makrofágokban (Yaghooti et al., 2011; Kurihara et al., 2012). Ezért a kimáz inhibitor közvetlenül gátolja a proMMP-9-MMP-9-re történő aktiválódását, és közvetett módon csökkenti az MMP-9 génexpresszióját a csökkent angiotenzin II-n keresztül. Az MMP-9 hasítja az extracelluláris mátrix komponenseket, például a vitronektint és a fibronektint, ami a máj integritásának széteséséhez vezet, és indukálja a makrofágok és a neutrofilek infiltrációját (Medina et al., 2006). Egy hfc diéta által indukált Nash modellben a máj myeloperoxidáz expressziójának jelentős növekedését figyelték meg a makrofágokban és a neutrofilekben, és ezt a kimáz inhibitor csökkentette (Miyaoka et al., 2017). Ezért a kimáz inhibitor által gyengített gyulladás mechanizmusa függhet a máj angiotenzin-II és MMP-9 szintjének csökkenésétől.
a hepatikus Steatosis mechanizmusa Kimáz Inhibitor által attenuált
az angiotenzin II ros termelésen keresztül befolyásolhatja a hepatikus steatosis kialakulását. Egér HSC-ben a NADPH-oxidáz inhibitora szignifikánsan csökkentette a Ros-termelést, az ARB pedig lelassította a máj steatosis kialakulását a Ros-termelés csillapítása révén (Hirose et al., 2007; Guimar Xhames et al., 2010). Egy MCD diéta által kiváltott Nash egér modellben a steatosis jelentős gyengülését figyelték meg angiotenzin II receptor-hiányos egerekben (Nabeshima et al., 2009). Mind in vivo, mind in vitro kísérletek azt mutatták, hogy az angiotenzin II upregulált szterin szabályozó elem-kötő fehérje (SREBP)-1C és zsírsav-szintáz (FAS) génexpresszió, mindkettő fontos tényező a lipogenezis szabályozásában, a ROS augmentációt követően (Kim et al., 2001; Hongo et al., 2009). Ezzel szemben az ARB gyengítette a máj steatosisát, valamint a SREBP-1c és a FAS génexpressziójának csökkentését ros csillapítás útján egér Nash modellben (Kato et al., 2012). Egy hörcsög MCD diéta által kiváltott Nash modellben a SREBP-1c és a FAS génexpresszió jelentős csökkenését figyelték meg alacsony molekulájú kimáz inhibitorral végzett kezelést követően (Masubuchi et al., 2013). Ezért a máj steatosisának a kimáz inhibitor általi enyhítő mechanizmusa függhet a Ros termelés csökkent angiotenzin II generáció a májban.
a Kimáz Inhibitor által gyengített májfibrózis mechanizmusa
a Kimáz szorosan összefügghet a szöveti fibrózis progressziójával, mivel hozzájárul a nem bioaktív TGF-prekurzorból származó TGF- ^ -ok képződéséhez, és a TGF- ^ – ról ismert, hogy erősen indukálja a fibroblasztok növekedését (Takai et al., 2003; Oyamada et al., 2011). Ismert, hogy a TGF-ons központi szerepet játszik a Nash-betegek fibrózisának progressziójában az aktivált HSC-n keresztül (Williams et al., 2000). Gátlása a TGF-Ft funkció keresztül génexpresszió és jelátvitel eredményezett jobb májfibrózis kísérleti modellekben (George et al., 1999; Arias et al., 2003). Egy patkány hfc diéta által indukált Nash modellben a kimáz aktivitás csillapítása a kimáz inhibitorral a máj TGF-Ft-szintjének és fibrotikus területének csökkenését eredményezte (Miyaoka et al., 2017). Így a TGF-blokkok számának a kimáz inhibitorral történő csökkenése hozzájárulhat a májfibrózis megelőzéséhez.
az angiotenzin-II a májfibrózis indukciójában is szerepet játszhat. Az angiotenzin II indukálja a HSC összehúzódását és proliferációját, valamint in vitro a fibroblasztokban indukálja a TGF-gének expresszióját (Kagami et al., 1994; Bataller et al., 2000). Vad típusú egerekben az epevezeték lekötése során mind a TGF-6 szintet, mind a kollagén felhalmozódásának mértékét és a fibrotikus elváltozásokat megfigyelték, azonban angiotenzin II receptorhiányos egerekben ezek attenuáltak (Yang et al., 2005). Egy patkány Nash modellben az ARB a májfibrózist is gyengítette a TGF-6G gén expressziójának csökkentésével (Hirose et al., 2007). Az angiotenzin-II és a májfibrózis között az angiotenzin-II által indukált TGF-DNS-expresszió kivételével összefüggés is fennállhat. Krónikus hepatitis C-ben szenvedő betegeknél az ARB csökkentette a kollagén gén expresszióját a Rac – 1 gén expresszióján keresztül (Colmenero et al., 2009). A HSC-t a májban a kollagén fő termelő sejtjeiként ismerik el, és a HSC-ben a sima izom aktin (SMA) expressziójának növekedése erősen indukálja az extracelluláris mátrix lerakódását, beleértve a kollagén I-t (de Minicis and Brenner, 2007). Az angiotenzin-II indukálhatja a HSC patkányban a Homo-SMA gén expresszióját. Ezzel szemben az angiotenzin II blokád a májfibrózis csillapítását eredményezi, a csökkenés mellett a .. – SMA (Yoshiji et al., 2001). Bár NASH-ban szenvedő betegeknél nem vizsgálták, cirrhosisos betegek májfibrotikus régióiban mind a kimáz, mind az angiotenzin II-képző aktivitás szignifikánsan megnövekedett, és szignifikáns korrelációt figyeltek meg a kimáz, az angiotenzin II-képző aktivitás és a májfibrózis között (Komeda et al., 2008). Egy hörcsög tetraklorid által indukált májcirrhosis modellben a kimáz és az angiotenzin II-képző aktivitás szignifikáns emelkedését figyelték meg, amely a májcirrhosis mellett szignifikánsan attenuálódott egy alacsony molekulájú kimáz inhibitorral végzett kezelést követően (Komeda et al., 2010).
a hízósejt-stabilizátor, a tranilast gátolhatja a hízósejtek aktiválódását, blokkolja a kimáz felszabadulását, és ezáltal megakadályozza a májfibrózis kialakulását patkány cukorbetegségben és a HFC diéta által kiváltott Nash modellben (Uno et al., 2008). A kimáz enzimatikus funkciójával elősegíti a hízósejtek proliferációját az SCF aktiválásával (Longley et al., 1997). NASH állatmodellekben a kimáz inhibitor csökkentette a hízósejtek számának növekedését a májban, ami a kimáz inhibitor általi közvetlen gátlást követően csökkentette a kimáz aktivitást, és közvetett módon csökkentette a hízósejtekben a kimáz expresszióját (Masubuchi et al., 2013; Miyaoka et al., 2017).
ezért a kimáz-inhibitor hozzájárulhat a májfibrózis megelőzéséhez a TGF-aktiváció kimáz-gátlással történő gátlása és/vagy a TGF-ons-szintek csillapítása révén az angiotenzin II és a hízósejt proliferáció csökkentése révén.
következtetés
az elhízást, inzulinrezisztenciát, hiperlipidémiát és hipertóniát magában foglaló metabolikus szindróma szorosan összefügg a NASH kialakulásával, és a Nash kezelésére antidiabetikus, hiperlipidémiás és antihipertenzív szerekkel végeztek vizsgálatokat. Ezeknek a szereknek a koncepciója a metabolikus szindróma tüneteinek enyhítése (Georgescu et al., 2009; Park et al., 2010; Mahady et al., 2011). Korábbi jelentések kimutatták, hogy a kimáz inhibitor csillapítja a gyulladást és a fibrózist anélkül, hogy befolyásolná a vércukorszintet és a lipidszintet, valamint a vérnyomást a cukorbetegség, a hiperlipidémia és a magas vérnyomás állatmodelljeiben (Inoue et al., 2009; Takai et al., 2014; Zhang et al., 2016). Ezért a chymase gátlás mögött álló koncepció a májgyulladás és a Nash fibrózisának közvetlen csökkentése. Javasoljuk, hogy a metabolikus szindrómát célzó kimáz inhibitor potenciálisan hatékony stratégia a Nash progressziójának csillapítására.
szerzői hozzájárulások
ST And DJ: írta a kéziratot. Mindkét szerző elolvasta és jóváhagyta a végleges kéziratot.
összeférhetetlenségi nyilatkozat
a szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségnek tekinthetők.