- Bevezetés
- eredmények
- a DBH-Cre vezető jelek és korlátozódik TH-expresszáló noradrenerg régiók az agytörzsben, amelyek gátolják CNO adminisztráció
- CNO-hM4D által közvetített noradrenerg neuronok perturbációja felnőtt egerekben
- a DBH-Cre neuronok CNO-hM4D perturbációja Hiperkapnic hiányt eredményez
- a 10 mg/kg CNO-val injektált szokásos Testvérkontrollok Hiperkapnic szellőzési hiányt mutattak
- a sóoldattal beinjekciózott és nem élő vad típusú állatok nem mutattak változást Presaline és Postsaline
- a klozapin és a CNO koncentráció aránya magasabb az agyban, mint a szérumban
- megbeszélés
- anyagok és módszerek
- etikai jóváhagyás
- Egerek tenyésztése, genetikai háttere és fenntartása
- szövettan
- elektrofiziológia
- pletizmográfia
- folyadékkromatográfia-tömegspektrometria
- adatgyűjtés és elemzés
- Plethysmography
- statisztika
- Plethysmography
- folyadékkromatográfia-tömegspektrometria
- etikai nyilatkozat
- szerzői hozzájárulások
- finanszírozás
- összeférhetetlenségi nyilatkozat
- Köszönetnyilvánítás
Bevezetés
a légzőszervi kemoszenzoros reflex alapját képező neurális hálózatok elsődleges célpontja számos viselkedési és fiziológiai rendellenesség etiológiájának megértéséhez. A zavart kemoszenzoros reflexek feltételezik, hogy szerepet játszanak mind a veleszületett, mind a felnőttkori rendellenességekben, beleértve a hirtelen csecsemőhalál szindrómát (SIDS), veleszületett központi hipoventilációs szindrómát (CCHS), központi alvási apnoét, rendellenes légzést Rett-szindrómában és elhízásban hipoventilációs szindróma (Obonai et al., 1998; Ozawa et al., 2003; Amiel et al., 2009; Ramanantsoa et al., 2011; Lavezzi et al., 2013). A hamis fulladás riasztási hipotézis szerint a nem megfelelő kemoszenzoros aktiváció vagy túlérzékenység vélhetően szerepet játszik a pánikbetegségben szenvedő betegek részhalmazaiban (Klein, 1993). A kemoszenzoros diszfunkció szerepet játszhat a neurodegeneratív betegségekben is alvászavaros légzés, amely gyorsított progresszióval jár (Hakim et al., 2012; Verbraecken és McNicholas, 2013; Bahia és Pereira, 2015; Snyder et al., 2017). Így az agytörzsi kemoszenzoros hálózatok jobb megértése fontos nyomokat ad számos viselkedési és fiziológiai patológiára.
kizárólag designer drugs (DREADDs) által aktivált farmakogenetikai tervező receptorok (Armbruster et al., 2007) számos tanulmányban alkalmazták a légzőszervi chemoreflex idegi populációinak feltérképezésére (légzési válasz a megemelkedett vér CO2-szintjére). A DREADD technológiát az interszekcionális genetikai telepítéssel kombinálva arra használták, hogy elhallgattassák a magasan célzott neuronális populációkat, miközben laboratóriumunk és mások tudatos és féktelen egerekben megfigyelik a légzési funkciókat, elkerülve a korábbi áramkör-feltérképezési megközelítések sok zavarát (Ray et al., 2011, 2013; Brust et al., 2014; Hennessy et al., 2017; Sun and Ray, 2017; Sun et al., 2017). Ezek és a legtöbb más tanulmány szinte mindig csak CNO-t tartalmazott, amely nem mutatott kemoszenzoros vagy egyéb légzési hatásokat, azzal érvelve, hogy a CNO-nak nem volt célzott hatása a tudatos és féktelen egerek légzésére a nagy dózis ellenére, 10 mg/kg. Mindazonáltal számos más tanulmányban azt találták, hogy a CNO és a hátsó anyagcseretermékei különböző vizsgálatokban céltól eltérő hatást gyakorolhatnak a viselkedésre és a mozgásra, de a légzési kimenettel nem foglalkoztak (Guettier et al., 2009; Joober, 2010; MacLaren et al., 2016; Gomez et al., 2017; Ilg et al., 2018; Mahler és Aston-Jones, 2018; Manvich et al., 2018; Padovan-Hernandez és Knackstedt, 2018). Azt is kimutatták, hogy a CNO és metabolitjai nem egyenlően oszlanak meg a keringési rendszer és az agy között (Gomez et al., 2017).
egy második, cím nélküli aggodalom a kísérleti paradigma által kiváltott stressz miatt merül fel, beleértve az állatok egész testű barometrikus pletizmográfiai kamrában tartását, kezelését, peritoneális injekciót és rektális hőmérsékletmérést. A korábbi DREADD légzőszervi vizsgálatokban a na-ból származó egereket egy kis kamrába (140-400 mls) vezették be, és az adatgyűjtés előtt 20-40 perccel akklimatizálódtak (Ray et al., 2011, 2013; Brust et al., 2014; Hennessy et al., 2017; Sun and Ray, 2017; Sun et al., 2017). Nem világos azonban, hogy ez az idő elegendő-e a stressz által kiváltott légzési változások minimalizálására, amelyek kölcsönhatásba léphetnek a klozapin hatásaival.
tanulmányainkban a noradrenerg (NA) rendszer légzésszabályozásban betöltött szerepének vizsgálatára törekedtünk a jól bevált RC alkalmazására::P_hM4D raszta allél (Ray et al., 2011), hogy teszteljék a NA neuronok szerepét a kiindulási és hypercapnic légzésben féktelen felnőtt állatokban egész test pletizmográfiával. Mivel a noradrenalin és a NA neuronokról is ismert, hogy központi szerepet játszanak a stresszválaszokban (Valentino and Van Bockstaele, 2008; Chen et al., 2018), egy sor tanulmányt végeztünk a kiterjedt megszokás összehasonlítására (többszörös expozíció a kísérleti paradigmához, amelynek során az állat megtanulja, hogy a tapasztalat nem fenyegető vagy túlélhető) és magas vs. alacsony (1 mg/kg) CNO dózisok korábban közzétett DREADD protokollokkal (Ray et al., 2011, 2013; Brust et al., 2014; Hennessy et al., 2017; Sun and Ray, 2017; Sun et al., 2017). Itt először mutatjuk be, hogy a CNO nagy szisztémás dózisai képesek célzott hatásokat kiváltani az autonóm légzési funkcióra tudatos egerekben. Azt is feltárjuk, hogy a CNO nem célzott hatása a kemoszenzoros légzési teljesítményre hatékonyan leleplezi a kiterjedt megszokás, és ezért nem lenne nyilvánvaló a korábbi CNO kontroll vizsgálatokban, amelyek nem szoktatták meg az állatokat a légzésmérés előtt, csak egy rövid akklimatizációs periódus az adatgyűjtés előtt. Ezek az eredmények együttesen arra utalnak, hogy a korábban leképezett neuronális populációk közvetett módon befolyásolhatják a légzésszabályozást a stresszválaszok szabályozásában játszott potenciális szerepek révén. Nevezetesen, ezek az adatok összhangban vannak a legfrissebb jelentésekkel, amelyek arra utalnak, hogy a CNO nem biológiailag inert nagy dózisokban metabolikus konverzió révén klozapinná (MacLaren et al., 2016; Gomez et al., 2017), és hogy az off-target viselkedési hatások nemcsak a viselkedési áramkörök perturbációjából, hanem a mögöttes autonóm áramkörök és a homeosztázis zavaraiból is megnyilvánulhatnak.
eredmények
a DBH-Cre vezető jelek és korlátozódik TH-expresszáló noradrenerg régiók az agytörzsben, amelyek gátolják CNO adminisztráció
a DBH-Cre vonal expressziójának és specifitásának vizsgálatához egyetlen rekombináz tenyésztési sémát használtunk (1a ábra), amelyben átléptük a meghajtót az Ai9 vonalig (Madisen et al., 2010), amely floxolt tdTomato-t fejez ki. Tirozin-hidroxiláz (TH) antitesttel végzett festés azt mutatta, hogy a tdtomato expressziója az agytörzsben a TH-expresszáló régiókra korlátozódott, beleértve a locus coeruleus, A5, A1, A2, A7, SubCV és SubCD magokat a várakozásoknak megfelelően (1b.ábra). Annak megerősítésére, hogy a HM4D receptort expresszáló NA neuronok reagáltak a CNO-ra, felvételeket végeztünk locus coeruleus (LC) neuronok, ahol megfigyeltük a neuronok tüzelésének gátlását CNO fürdő alkalmazás esetén (n = 3, 1C ábra).
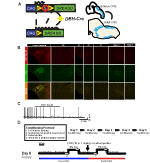
1. ábra. Tenyésztési sematikus és légzési protokollok. Az RC::A P_hM4D allélt egy dopamin-béta-hidroxiláz (DBH)-Cre vonallal kombinálják a hm4d receptor sejtspecifikus expressziójának elérése érdekében a noradrenerg (NA) neuronokban (a). A tdTomato fluoreszcens expressziója a DBH-Cre-ben; az AI9 koronális agyszakaszok tirozin-hidroxilázzal (TH) együtt expresszálódnak az agytörzs NA magjaiban (B). A szelet felvétel NA locus coeruleus előtt és után CNO alkalmazás, bemutatva DREADD receptor funkcionalitás célzott neuronok (C). Légzési protokoll. A szoktatott egereket 5 napos szokásos protokollnak vetik alá, amely a kezelésből, a rektális szonda hőmérsékletének méréséből, a sóoldat injekciójából és a pletizmográfiai kamrának való kitettségből áll. A hatodik napon mind a megszokottakat, mind a nem élő egereket hypercapnic vizsgálatnak vetették alá, ahol az állatot a légzőkamrába helyezték, és hagyták, hogy a kiindulási helyiség levegőjének körülményei között akklimatizálódjon. Az állatot ezután 20 perc 5% CO2-nak, majd 20 perc szobai levegőnek tesszük ki. Az állatot ezután intraperitoneálisan CNO-val vagy sóoldattal injektálják, majd további 20 perc injekció utáni szobai levegőt, 20 perc 5% CO2-t és 20 perc szobai levegőt. A nyitott négyzetek körülhatárolják az adatgyűjtés idejét (D).
CNO-hM4D által közvetített noradrenerg neuronok perturbációja felnőtt egerekben
a NA neuronok kiindulási és hiperkapnikus légzés alatti szerepének vizsgálatához az RC:P_hM4D gátló DREADD rendszert alkalmaztuk a DBH-Cre meghajtóval keresztezve. Az egész test pletizmográfiája (Ray et al., 2011), megmértük a levegőn (21% O2/79% N2) és hypercapnic (5% CO2/21% O2/74% N2) körülmények között a CNO beadása előtt és után (1D ábra). A kísérleti tervünk által kiváltott CNO adagolás és potenciális stressz kezelése érdekében az állatokat a következő négy feltétel egyikének vetettük alá: (1) nem élő és 10 mg/kg CNO-val injektáltuk; (2) megszoktuk és 10 mg/kg CNO-val injektáltuk; (3) nem élő és 1 mg/kg CNO-val injektáltuk; vagy (4) megszoktuk és 1 mg/kg CNO-val injektáltuk. A megszokás egy 5 napos folyamatból állt, amely kezelést, rektális hőmérséklet-szondát, sóoldatot tartalmazott injekció, valamint a pletizmográfiai kamrának való kitettség minden nap 30 percig, míg a na kb az állatokat csak 20-45 perces kamrai akklimatizációs periódusnak tették ki közvetlenül az adatgyűjtés előtt, amint azt a korábbi vizsgálatok (Ray et al., 2011, 2013; Brust et al., 2014; Hennessy et al., 2017; Sun and Ray, 2017; Sun et al., 2017). A mért légzési paraméterek között szerepelt az RR légzési sebesség, az árapály térfogata (VT), A perc szellőzés (VE), az oxigénfogyasztás (VO2), az oxigénfogyasztásra normalizált perc szellőzés (VE/VO2), az apnoe gyakorisága, a sóhaj frekvenciája, valamint a légzésközi intervallum és az amplitúdó variációs együtthatói (periodikus és térfogat instabilitás). Kiegészítő kontrollként összehasonlítottuk a megszokottakat és a nem élő vadon élő állatokat is, amelyeket sóoldattal injektáltunk.
a DBH-Cre neuronok CNO-hM4D perturbációja Hiperkapnic hiányt eredményez
három feltétel mellett, DBH-Cre; RC::A P_HM4D állatokban a Ve és a VE/VO2 értéke csökkent a CNO alkalmazása után, míg a testvér kontrollok nem mutattak különbséget a CNO előtti és utáni értékekben. A 10 mg/kg CNO-val injektált, nem élő állatoknál szignifikánsan csökkent az RR (-12,17%, p = 0,034) és a VT (-30,87%, p = 0,0016), ami a VE (-38,64%, p = 0,0031) csökkenését és a VO2 (-14,25%, p = 0,042) enyhe csökkenését eredményezte (2.ábra). A VE csökkenése nagyobb volt, mint a VO2 csökkenése, ami a VE/VO2 általános csökkenését eredményezte (-26,89%, p = 0,0095). Az 1 mg/ttkg CNO-val beadott, nem élő állatokban csökkent RR (-12,88%, p = 0,066) és szignifikánsan csökkent VT (-16,52%, p = 0,00085) és VE (-28,08%, p = 0,0070) tendencia mutatkozott, ami a VE/VO2 (-22,23%, p = 0,016) általános csökkenéséhez vezetett (3.ábra). Végül az 1 mg/kg CNO-val beinjekciózott állatok csökkent RR-t (-10,77%, p = 0,074), csökkent VE-t (-25,07%, p = 0,074) és csökkent ve/VO2-t (-23,70%, p = 0,024) mutattak (4.ábra). Az apnoe gyakoriságában, a sóhaj gyakoriságában, a periodikus vagy a térfogat instabilitásában vagy a hőmérsékletben nem észleltek jelentős változásokat kohorsz.
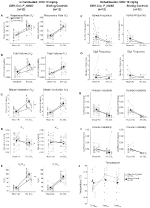
2. ábra. Nem élő DBH-Cre; RC::P_hM4D a 10 mg/kg CNO-ban beadott állatok hiperkapnic hiányt mutatnak, míg a testvér kontrollok nem mutatnak változást. CNO adminisztráció után, DBH – Cre; RC::P_hM4D az állatok nem mutatnak változást a helyiség levegőjének szellőzésében és az RR (a), A VT (B), A VE (C), a VO2 (D) és a Ve/VO2 (e) csökkenését hypercapnic körülmények között, az apnoe gyakoriságának (F), a sóhaj frekvenciájának (G), a periodikus (H) vagy a térfogat instabilitásának (I) és a hőmérséklet (J) változása nélkül. A testvérkontrollok nem mutattak különbséget az összes CNO előtti és utáni érték között.
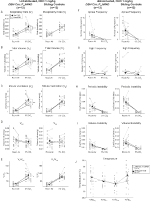
3. ábra. Nem élő DBH-Cre; RC::P_hM4D az 1 mg/kg CNO-ban beadott állatok hiperkapnic hiányt mutatnak, míg a testvér kontrolljai nem mutatnak változást. CNO adminisztráció után, DBH – Cre; RC::P_hM4D az állatok nem mutatnak szignifikáns változást a helyiség levegőjének szellőzésében vagy az RR (A) – ban, és a VT (B), VE (C) és Ve/VO2 (e) csökkenését mutatták hiperkapnikus körülmények között, a VO2 (D), az apnoe frekvencia (F), a sóhaj frekvencia (G), a periodikus (H) vagy a térfogat instabilitása (I) és a hőmérséklet (J) változása nélkül. A testvérkontrollok nem mutattak különbséget az összes CNO előtti és utáni érték között.
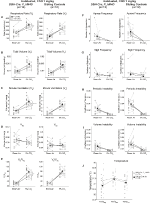
4. ábra. Szokásosan alkalmazott DBH-Cre; RC::P_hM4D az 1 mg/kg CNO-ban beadott állatok hiperkapnic hiányt mutatnak, míg a testvérkontrollok nem mutatnak változást. CNO adminisztráció után, DBH-Cre; RC:: P_hM4D az állatok nem mutatnak változást a helyiség levegőjének szellőzésében és az RR (A) és a VE/VO2 (e) csökkenését hiperkapnikus körülmények között,a VT (B), VE (C), VO2 (D), apnoe frekvencia (F), sóhaj frekvencia (G), periodikus (H) vagy térfogat instabilitás (I) és hőmérséklet (J) jelentős változása nélkül. A testvérkontrollok nem mutattak különbséget az összes CNO előtti és utáni érték között.
a 10 mg/kg CNO-val injektált szokásos Testvérkontrollok Hiperkapnic szellőzési hiányt mutattak
mindkét DBH-Cre-ben; RC::P_hM4D és testvér kontroll állatok 10 mg/kg CNO-val injektálva a VE/VO2 (p = 0,0235) szignifikáns csökkenését észleltük, amelyet az RR (p = 0,00036) és a VE (p = 0,037) csökkenése közvetített (5.ábra). A többi kohorsztól eltérően azonban nem volt különbség a DBH-Cre; RC::P_hM4D és a testvér kontroll állatok között ezekben a paraméterekben: RR (-12,72 vs.-10,22%, p = 0,6268), VE (-24,88 vs. -23,94%, p = 0,4150) vagy VE/VO2 (-15,4 vs. -22,55%, p = 0,4643).
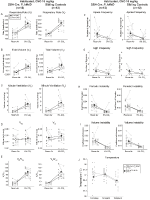
5. ábra. Mindkettő megszokta a DBH-Cre-t; RC::P_hM4D a 10 mg/kg CNO-t beadott állatok és testvérkontrollok hypercapnic hiányt mutatnak. CNO beadás után a DBH – Cre; RC::p_hm4d az állatok és a testvérkontrollok nem mutatnak változást a helyiség levegőjének szellőzésében és az RR (a), VE (C) és VE/VO2 (e) csökkenését hiperkapnic körülmények között, a VT (B), VO2 (D), apnoe frekvencia (F), sóhaj frekvencia (G), periodikus (H) vagy térfogat instabilitás (I) és hőmérséklet (J) jelentős változása nélkül.
a sóoldattal beinjekciózott és nem élő vad típusú állatok nem mutattak változást Presaline és Postsaline
bár az 1 mg/kg CNO-val beinjekciózott kontrolloknál nem figyeltek meg fenotípusokat, megvizsgáltuk annak lehetőségét, hogy maga az injekció okozta a 10 mg/kg CNO-val beinjekciózott kontrolloknál megfigyelt fenotípust a sóoldattal beinjekciózott és nem élő vad típusú állatok vizsgálatával (6.ábra). Mind a szokásostól függő, mind a nem élő kohorszokban az állatok nem mutattak különbséget a légzési paraméterek között a presaline és a postsaline alkalmazása között. Az apnoe gyakoriságában, a sóhaj gyakoriságában, a periodikus vagy a térfogat instabilitásában vagy a hőmérsékletben nem észleltek jelentős változásokat.
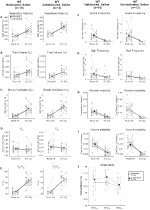
6. ábra. Mind a nem élő, mind a megszokottnál vad típusú állatok sóoldatban nem mutatnak különbséget az injekció előtti és utáni értékek között. Sóoldat beadását követően sem a nem ÉLŐ, sem a megszokottnál vad típusú állatok nem mutattak változást szobai levegő vagy hiperkapnikus körülmények között az RR (A), VT (B), VE (C), VO2 (D), VE/VO2 (E), apnoe frekvencia (F), sóhaj frekvencia (G), periodikus (H) vagy térfogat instabilitás (I), valamint hőmérséklet (J).
a klozapin és a CNO koncentráció aránya magasabb az agyban, mint a szérumban
a CNO és a klozapin biohasznosulásának meghatározásához tömegspektrometriával mértük koncentrációikat a szérumban és az agyban. Harminc perccel a CNO intraperitoneális injekciója után egerekben a CNO alacsonyabb relatív gyakorisággal jelenik meg a klozapin hátsó metabolitjához képest a szérumban és az agyban az összes vizsgált dózis esetében, 0,1 mg/kg (szérum p = 0,0054, agy p = 0,0001) (7a ábra), 1 mg/kg (szérum p > 0,05, agy p = 0,0197) (7b Ábra) és 10 mg/kg (szérum p = 0,0036, agy p = 0.0005) (7c. ábra). Amikor a teljes klozapin / CNO arányokat elemezték, azok mindig nulla felett voltak, és magasabbak voltak az agyban, mint a szérumban (vivőanyag p > 0,5, 0,1 mg/kg p > 0,5, 1 mg/kg p = 0,0018, 10 mg/kg p = 0,0160) (7d ábra).
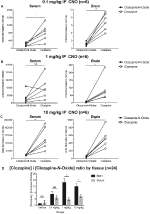
7. ábra. A klozapin-CNO koncentráció aránya magasabb az agyban, mint a szérumban. Szérum-és agymintákat vad típusú egerekből gyűjtöttünk 30 perccel a CNO beadása után 3 különböző dózisban 0,1 mg/kg (A), 1 mg/kg (B), 10 mg/kg (C). Az egyes adatpontok az LC-MS által kapott klozapin-N-oxid vagy klozapin relatív bőségét mutatják. klozapin-CNO arány minden dózisra és SEM is látható (D).
megbeszélés
A tanulmány kezdeti célja a DBH-CRE neuronok légzési fiziológiában betöltött szerepének vizsgálata volt féktelen és tudatos felnőtt állatok akut perturbációja után. Mivel a noradrenalin és a NA neuronok jól dokumentált szerepet játszanak a stressz viselkedésében (Valentino and Van Bockstaele, 2008; Chen et al., 2018) arra is törekedtünk, hogy megvizsgáljuk, vajon a valószínűleg stresszes fiziológiai protokollhoz való hozzászokás hatással lenne-e a korábban megfigyelt légzőszervi fenotípusokra. A laboratóriumunkban és másokban használt egész test plethysmography DREADD protokollban az állatokat kezelik, rektálisan vizsgálják a hőmérsékletet, új környezetnek (plethysmography chamber) vannak kitéve, és intraperitoneálisan injektálják. Korábbi tanulmányok kimutatták, hogy a kezelés és az injekcióhoz való hozzászokás és más “rutin” eljárások módosíthatják a viselkedési és fiziológiai paramétereket, beleértve a légzést (Misslin et al., 1982; Andrews and File, 1993; Lapin, 1995; Ryabinin et al., 1999). Más alkalmazott stresszorok szintén módosítják a légzést mind a kiindulási, mind a hiperkapnic szellőzési körülmények között (Isom and Elshowihy, 1982; Kinkead et al., 2001).
A CNO nagy dózisát alkalmazó vizsgálatainkban azt találtuk, hogy a DBH-Cre által definiált NA neuronok hM4D által közvetített gátlása csökkentette a hiperkapnic reflexet a VE/VO2-ben négy meghatározott kísérleti kohorszban, csökkent RR-vel, VT-vel és VE-vel, alátámasztva a korábbi vizsgálatokat (Biancardi et al., 2008; Viemari, 2008; Gargaglioni et al., 2010). A korábbi légzési vizsgálatokban alkalmazott CNO 10 mg/kg-os dózisát kapott szokásos testvérkontrollok azonban szellőzési hiányt mutattak hiperkapnic körülmények között ugyanolyan nagyságrendű, mint a DBH-Cre-ben; RC::P_hM4D állatok. Egyetlen más testvér kontrollcsoport sem mutatta ezt a fenotípust, beleértve a csak (1 mg/kg CNO) vagy sóoldatot kapott szokásos kohortot. Ezek az eredmények arra utalnak, hogy a magasabb CNO dózisok (10 mg/kg) hatással vannak a hiperkapnic válaszra, amelyet kiterjedt megszokás után lepleznek le, miközben feltehetően csökkentik az állati stressz szintjét, és hogy az alacsonyabb CNO dózisok nincsenek hatással a légzésszabályozásra a megszokottnál állatok. Ezek az eredmények összhangban vannak Korsak et al. a who bebizonyította, hogy az alacsony dózisú CNO (2 mg/kg) nem eredményez céltól eltérő hatást a munkaképességben egy olyan edzésvizsgálatban, amely előzetes edzést tartalmazott (Korsak et al., 2018) és Fleury Curado et al. a who nem mutatott alacsony dózisú CNO (1 mg/kg) specifikus hatást a légzési teljesítményre (Fleury Curado et al., 2018).
a klozapin és a CNO szintjének megnövekedett aránya a szérumban és az agyban (7.ábra) összhangban van a legújabb vizsgálatokkal, amelyek arra utalnak, hogy a CNO könnyen vissza metabolizálódik klozapinná, és nagyobb agyi permeabilitást mutat, mint a CNO egerekben és másutt (Jann et al., 1994; Chang et al., 1998; Guettier et al., 2009; Gomez et al., 2017; Raper et al., 2017). Nem világos azonban, hogy a megfigyelt célon kívüli hatások a CNO vagy a klozapin következményei-e. Mivel hypercapnic méréseink <30 perccel történtek CNO alkalmazás után valószínű, hogy a célon kívüli légzési hatásokat a klozapin közvetíti. Eredményeink (7. ábra) a klozapin magas relatív szintjét mutatják az agyban, bár a CNO nem hiányzik teljesen. Huckstepp és kollégái azonban közvetlen CNO alkalmazást alkalmaztak a ventrális medulla érzéstelenített patkányokban annak bizonyítására, hogy csak a szobai levegőben, és nem hiperkapniikus vagy hipoxiás kihívások alatt, a CNO alkalmazásnak kis hatása van, növekszik a gyakoriság és csökken a kilégzési időtartam, de a VT változatlan marad, a hypercapnia során nem figyelhető meg egyértelmű hatás (Huckstepp et al., 2015). Figyelembe véve az érzéstelenített patkányokban történő közvetlen alkalmazást és a kísérletek időkeretét, valószínű, hogy a megfigyelt kis céltól eltérő hatásokat a CNO közvetítette, nem pedig a klozapin.
a hátsó metabolit klozapin egy általánosan használt nyugtató és antipszichotikus gyógyszer skizofréniában, számos endogén célponttal, beleértve az alacsony affinitású antagonista hatásokat a D1, D2 és D4 dopaminerg receptorokon, az 5-HT2A, az 5-HT2C, az 5-HT3, az 5-HT6 és az 5-HT7 szerotonerg receptorokon, a H1 hisztamin receptorokon, valamint a stb. (Fitton and Heel, 1990; Ashby és Wang, 1996). Az itt látható off-target hatások Különböző vagy kombinált mechanizmusokból és célokból eredhetnek. A klozapin nyugtatóként befolyásolhatja a légzést. Egy korábbi vizsgálat azt mutatta, hogy az RR és a VT 5 és 10% CO2 alatt csökkent mind a lassú hullámú alvás, mind a gyors szemmozgás alvási állapotában, összehasonlítva az egerek csendes ébren állapotával (Nakamura et al., 2007). Alternatív megoldásként a célzott DREADD-expresszáló neuronok gátlása antianxiogén vagy szorongásoldó hatást eredményezhet a szokásunkhoz hasonló protokoll a CNO/klozapin által közvetített kemoszenzoros célon kívüli hatások feltárására. Mindkét magyarázatot számos tanulmány támasztja alá, amelyek kimutatták, hogy a CO2 szerepet játszik a veleszületett és tanult félelemre adott válaszokban és a szorongással kapcsolatos viselkedésekben (Ziemann et al., 2009; Feinstein et al., 2013; Taugher et al., 2014; Dlouhy et al., 2015; Winter et al., 2017). Így az e vizsgálatok némelyikében megcélzott neuronok valóban szerepet játszhatnak az anxiogén viselkedési válaszok vezetésében, nem pedig a fiziológiás kemoszenzoros reflexekben, mivel mind a katekolaminerg, mind a szerotonerg rendszerek részt vesznek a félelem/szorongás viselkedésében és a kemoszenzoros homeosztázisban (Brust et al., 2014; Hennessy et al., 2017).
ezzel szemben a magas CNO-szinttel megfigyelt kemoszenzoros fenotípusok valódiak lehetnek, mivel képesek voltunk összefoglalni az NA által közvetített hiperkapnic hiányt CNO dózisokban, a megszokottnál alacsonyabb nagyságrendű egerekben, míg a kontrollcsoportok nem mutattak CNO hatást. A korábbi vizsgálatok teljes összehasonlítása azonban nehéz, mivel egyes esetekben hiányzik a jelentett VO2, VT, RR és VE/VO2 adatok. Például a testhőmérséklet vagy az anyagcsere sebességének változása számos módon befolyásolhatja a légzőszervi és a kemoszenzoros kimenetet, és hogy a pletizmográf kamra hőmérséklete néhány esetben jelentősen eltérő volt (34 vs.30 C vizsgálatunkban), befolyásolva a hullámforma barometrikus komponensének dinamikus tartományát és így az árapály térfogatát. Nevezetesen, nem láttunk sem észrevehető változásokat a légzési hullámforma jellemzőiben egyik állapotunkban sem akut kardio-légzésleállás, amelyet a korábbi nagy dózisú, egész rombomér tanulmányainkban megfigyeltünk (Sun et al., 2017).
eredményeink először mutatják, hogy a CNO váratlan hatással van a hiperkapnic kemoszenzoros reflexre, amelyet kiterjedt megszokás leplez le. Fontos, hogy a magas szint ellenére a CNO célon kívüli hatását korábban kizárták a fenotípus hiánya miatt a testvérkontrollokban, de amit megmutatunk, a megszokáskor világossá válik. Kínálunk egy off-target jellemzése CNO az egér modell rendszer kiegészítésére vizsgálatok patkány és nem humán főemlősök. Az eredmények itt felvetik annak lehetőségét, hogy további CNO-közvetített, célon kívüli hatások a vizsgált áramkörökre vagy az autonóm vagy homeosztatikus áramkörökre létezhetnek, de más kontrollált kísérletekben elfedhetők. Fontos, hogy ezek az adatok azt mutatják, hogy a kutatóknak törekedniük kell arra, hogy az aktiváló ligandum minimális dózisát magas szintű megszokással kombinálva használják, és hogy a megfelelő kontrollokat be kell vonni a kémiai genetikai manipulációkba, hogy teljes mértékben értékeljék és értelmezzék a kísérleti adatokat.
anyagok és módszerek
etikai jóváhagyás
a vizsgálatokat a Baylor Orvostudományi Főiskola intézményi állatgondozási és Felhasználási Bizottsága hagyta jóvá az An-6171 protokoll szerint.
Egerek tenyésztése, genetikai háttere és fenntartása
az összes heterozigóta egér törzsünk kolóniáit c57bl/6J egerekre és homozigóta törzsekre keresztezve tartottuk fenn testvérkeresztekkel. Szövettani kísérletekhez a DBH-Cremice-t párosítottuk a homozigóta AI9 egérrel (Madisen et al., 2010) (JAX 007909). Pletizmográfiai kísérletekhez a DBH-Cre egereket homozigóta RC::P_hM4D-vel párosítottuk (Ray et al., 2011) egerek állatok levezetésére, amelyekben az összes egér hordozta az RC::P_hM4D allélt. Azok a testvérállatok, amelyek nem örökölték a Cre allélt, kontrollállatokként használták a CRE pozitív utódokat. A Rosa26 specifikus primerek az Ai9, RC::P_hM4D és RC::ePe egerek esetében 5′-GCACTTGCTCCCCAAAGTC, 5′-GGGCGTACTTGGCATATGAT és 5′-CTTTAAGCCTGCCCAGAAGA voltak, és 495 bp (célzott) és 330 bp (wt) sávot eredményeztek. Az összes rhombomere CRE driver CRE-specifikus alapozója 5 ‘- ATCGCCATCTTCCAGCAGGCCACCATTGCCC és 5 ‘ – GCATTTCTGGGGATTGCTTA volt, és 550 bp-es sávot adott, ha pozitív volt. Az LC-MS kísérletekhez C57BL / 6J egereket kaptunk a Baylor Orvostudományi Főiskola összehasonlító Orvostudományi központjából (CCM).
szövettan
négy-nyolc hetes DBH-Cre; az Ai9 felnőtt egereket transzkardiálisan perfundáltuk 0,1 M foszfát-pufferolt sóoldattal (PBS), majd 4% paraformaldehiddel (PFA) PBS-ben. Az agyat 2 órán át 4% PFA-ban lefejtettük, majd PBS öblítés és 20% szacharóz PBS-ben történő kiegyenlítése előtt. Az agyat ezután 30 darabra osztottuk, tárgylemezekre szereltük, és immunfluoreszcens antitestekkel jelöltük. Egy éjszakán át anti-tirozin-hidroxiláz antitesttel festettük a katekolaminerg neuronok (1:1000, Millipore AB152), majd 2 óra szamár anti-nyúl cy3 szekunder (1:500, Jackson 711-165-152) 0,1% Triton-X-ben PBS-ben (PBST) 5% szamár szérummal. A képeket Zeiss függőleges epifluoreszcens mikroszkópon gyűjtöttük össze.
elektrofiziológia
a locus coeruleust tartalmazó vízszintes agyszeleteket (300 Ft) felnőtt DBH-Cre-ből származó vibratómával (Leica VT 1000s, Leica Microsystems, Buffalo Grove, IL) vágtuk; RR2P; RC::ePe egerek (~1 hónaposak) 4 db C mesterséges cerebrospinális folyadékban (ACSF). A szeleteket oxigénezett acsf-fel (95% O2 és 5% CO2) perfundált kamrába merítettük, amely mM-ben: 124 NaCl, 2,0 KCl, 1,3 MgSO4, 2,5 CaCl2, 1,2 KH2PO4, 25 NaHCO3 és 10 glükózt (2-3 ml/perc) tartalmaz. A teljes cellás felvételeket 30 Kb-on végezték hagyományos patch-clamp technikákkal és MultiClamp 700B erősítővel (Molecular Devices, Union City, CA). A locus coeruleus GFP-pozitív neuronjait vizuálisan azonosítottuk, majd infravörös differenciál interferencia kontraszt videóval ábrázoltuk egy függőleges mikroszkóp színpadán (Axioskope FS2, Carl Zeiss, Oberkochen, Németország). A tapasz pipettákat (ellenállások 4-6 me) (mM-ben) 110 K-glükonáttal, 10 KCI-vel, 10 HEPE-vel, 10 Na2-foszfokreatinnal, 2 Mg3-ATP-vel és 0,2 Na3-GTP-vel töltöttük meg; a pH-t 7,2-re, az ozmolaritást pedig 300 mOsm-ra állítottuk be. A tartási potenciál -70 mV volt. CNO volt fürdő alkalmazott.
pletizmográfia
tudatos, féktelen egereken a Pletizmográfiát a 6-12 hetes felnőtt állatokon leírtak szerint végeztük (Ray et al., 2011). A szoktatott egereket 5 napos szokási protokollnak vetettük alá, minden nap több perc kezelésből állt, rektális szondával vett hőmérséklet, intraperitoneális sóoldat injekcióés 30 perc a plethysmography kamrában. Az egereket ezután a megszokás utolsó napjától számított 1 héten belül teszteltük. A nem élő egereket nem tették ki a kezelésnek vagy a plethysmograph kamrának. Minden egeret na-tól CNO-ig használtak, és csak egyszer használták.
a vizsgálat napján egereket vettek ki az otthoni ketrecből, lemérték, és a rektális hőmérsékletet vették. Az állatokat ezután egy átfolyó, szabályozott hőmérsékletű (vízköpenyes 30 6c) pletizmográfiás kamrába helyeztük, és hagyjuk, hogy legalább 20 percig akklimatizálódjanak a szoba levegőjében (21% O2/79% N2) körülmények között. A szobai levegő alatti akklimatizáció és mérés után a kamragázt 5% CO2/21% O2/74% N2 hiperkapnikus keverékre kapcsoltuk 20 percig. A kamragázt ezután 20 percig visszaváltottuk a helyiség levegőjére. Az egereket rövid ideig eltávolították a rektális hőmérséklet mérésére és a CNO (National Institute of Mental Health Chemical Synthesis and Drug Supply Program) sóoldatban (1 vagy 0,1 mg/ml) oldott intra-peritoneális injekciójára 10 vagy 1 mg/kg hatékony koncentráció érdekében. Az állatot visszatették a kamrába további 20 perc szobai levegőre, 20 perc hiperkapniára és 20 perc szobai levegőre. Az állatot ezután eltávolítottuk a kamrából, és a rektális hőmérsékletet közvetlenül a kísérlet befejezése után vettük fel.
folyadékkromatográfia-tömegspektrometria
huszonnégy vad típusú egeret, nemek szerint egyenletesen elosztva, lemértek és kezeltek 10 mg/kg CNO, 1 mg/kg CNO, 0,1 mg/kg CNO vagy vivőanyaggal. Harminc perccel az injekció beadása után a vérmintákat szívpunkcióval gyűjtötték és BD Mikrotainerekbe helyezték. A mintákat 4 6500 fordulat / perc sebességgel centrifugáltuk asztali centrifugában,majd felülúszókat gyűjtöttünk. A szérumot és az agyat -20 ft-on tartottuk az extrakcióig.
HPLC minőségű oldószerek víz, acetonitril kloroform, metanol és tömegspektrometriás hangyasav nyertük Sigma-Aldrich (St. Louis, MO). Az Agilent Technologies-tól (Santa Cruz, CA) több kalibráló anyagot tartalmazó kalibráló oldatot vásároltak acetonitril, trifluorecetsav és víz oldatában. Metabolitok és belső standardok, beleértve az N-acetil-aszparaginsav-d3, triptofán-15n2, glutaminsav-d5, timin-d4, gibberellinsav, transz-zeatin, jasmonsav, 15N antranilsav, és a tesztoszteron-D3 vásároltak Sigma-Aldrich (St. Louis, MO). Az R SST TM mikrotainert Becton Dickinson-tól (Franklin Lakes, NJ) nyerték.
az extrakció 750 db jéghideg metanolból állt:víz (4:1), amely 20 db (50 mg) adagolt belső standardot tartalmazott, amelyet minden egyes agymintához (50 mg) és minőségellenőrzéshez adtak, majd egyenként 1 percig homogenizáltak. Ezután 750 600% – os acetonitril, amely 20 ml-es tüskés belső standardot tartalmaz, hozzáadtunk a mosási mintához (100 ml) és a minőségellenőrzéshez, majd 5 percig ultrahanggal kezeltük. Az összes mintát 5000 fordulat / perc sebességgel centrifugáltuk 10 percig 4 6c-on. Az eredményül kapott felülúszót összegyűjtöttük, és 20 ml-t injektáltunk az LC-MS-be.
az összes mintát 6490 tripla kvadrupol tömegspektrométerrel (Agilent Technologies, Santa Clara, CA) elemeztük HPLC rendszerrel (Agilent Technologies, Santa Clara, CA) összekapcsolva többszörös reakció monitorozással (MRM). Detektált metabolitonként körülbelül 8-11 adatpontot szereztünk. A kimutatott metabolitok a klozapin, a CNO és a norklozapin (N-dezmetil-klozapin) voltak. ESI pozitív módot használtunk módszer. A HPLC oszlop ACQUITYUPLC C18 oszlop volt(100, 1,8 és 2,1 mm, 100 mm). Milford, MA, USA) 0,5 ml/perc áramlási sebességgel.
adatgyűjtés és elemzés
Plethysmography
Plethysmography a nyomásváltozásokat Validyne DP45 nyomáskülönbség-jelátalakítóval és referenciakamrával és CD15 vivő demodulátorral mértük, és a LabChartPro-val valós időben rögzítettük. A hullámformákat offline módon elemeztük LabChartPro és egyedi írott Matlab kód segítségével a légzési sebesség (RR), az árapály térfogat (VT) meghatározásához (Ray et al., 2011), perc szellőzés (VE), és mintaelemzés. A légzési hullámformákat offline állapotban gyűjtötték össze azokban az időszakokban, amikor az állat nyugalomban volt, és a leolvasások mentesek voltak a mozgás tárgyaitól. Legalább 1 perc kumulatív adatok, amelyeket legalább 10 másodperc hosszú nyomokból állítottak össze egy adott kísérleti állapot utolsó 10 percéből elemeztük. Az O2 fogyasztást úgy határoztuk meg, hogy összehasonlítottuk az üres kamrában végzett kalibrálás és az élő légzés gázösszetételét egy AEI oxigénérzékelő és analizátor segítségével. A kamra hőmérsékletét folyamatosan figyelték a ThermoWorks MicroThermo 2 és a szonda segítségével, és a LabChartPro segítségével valós időben rögzítették.
Poincar a méréseket, a sóhaj és az apnoe gyakoriságát 1 perc mozgásmentes nyomok felhasználásával határoztuk meg minden légzési állapotból. A sóhajokat olyan lélegzetként határozták meg, amelynek amplitúdója legalább kétszer akkora, mint az átlagos lélegzet. Az apneákat úgy határozták meg, mint egy interbreath interval (IBI), amely legalább kétszer akkora, mint az átlagos IBI. Az IBI és az amplitúdó variációs együtthatóját (CV) szintén az egyes légzési állapotok azonos 1 perces nyomkövetési összeállításából számítottuk ki (standard hiba IBI vagy amplitúdó/átlagos IBI vagy amplitúdó).
statisztika
Plethysmography
eredményeket (RR, VT, VE, VO2, ve/VO2, apneák és Sóhajok száma, valamint Ibi és amplitúdó CVs) a szobai levegőre és a hiperkapnic adatokra vonatkozóan összehasonlítottuk a DBH-Cre; RC::p_hm4d kohorszok és testvérkontrollok között egy lineáris vegyes hatású regressziós modell alkalmazásával állattípussal (kísérleti vs.kontroll) és CNO beadás (pre vs. post injection) Fix hatásként és Állatazonosító véletlenszerű hatásként. A hőmérsékleti adatokat lineáris vegyes hatású regressziós modell alkalmazásával hasonlítottuk össze az állat típusával (kísérleti vs. kontroll) rögzített hatásként. A P < 0,05 volt a statisztikai szignifikancia jelzésére, és az egyes adatpontok, az átlag és az átlag standard hibája minden diagramon látható.
folyadékkromatográfia-tömegspektrometria
az egyes minták csúcs alatti területet a belső kontroll, majd a vivőanyag normalizálta a statisztikai elemzés elvégzése előtt. Párosítatlan t-tesztet használtunk a klozapin és a CNO relatív bőségének összehasonlítására az egyes szövetekben koncentrációcsoportok szerint.
etikai nyilatkozat
minden kísérletet a Baylor Orvostudományi Főiskola intézményi állatgondozási és Felhasználási Bizottsága hagyott jóvá. A kísérletek megfeleltek a kísérleti állatok gondozására és felhasználására vonatkozó nemzeti szabványoknak, amelyeket a laboratóriumi állatok gondozásának és Akkreditálásának Szövetsége állított fel.
szerzői hozzájárulások
JS, FS-M, MC-M és RR fogant és tervezett kísérletek. JS, FS-M és PZ végezte a kísérleteket, és hozzájárult az adatok elemzéséhez. JS, FS-M, VM, MC – M és RR írta a dolgozatot.
finanszírozás
ezt a tanulmányt az R01hl130249 és az R01hl130249-S1 támogatások támogatták a Nemzeti Szív -, Tüdő-és Vérintézetből; Dimes Basil O ‘ Connor-díj márciusa; és a McNair Medical Institute.
összeférhetetlenségi nyilatkozat
a szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségnek tekinthetők.
Köszönetnyilvánítás
köszönjük Dr. Shaila K. Mani-nak és Benjamin Arenkiel-nek a hasznos beszélgetést. Köszönetet mondunk a Baylor Orvostudományi Főiskola proteomikai Alapintézményének a folyadékkromatográfia-tömegspektrometria végrehajtásáért.
Amiel, J., Dubreuil, V., Ramanantsoa, N., Fortin, G., Gallego, J., Brunet, J.-F., et al. (2009). PHOX2B a légzésszabályozásban: tanulságok a veleszületett centrális hipoventilációs Szindrómából és egérmodelljeiből. Respir. Physiol. Neurobiol. 168, 125–132. doi: 10.1016 / j.ill.2009.03.005
CrossRef teljes szöveg / Google Scholar
Andrews, N., and File, S. E. (1993). A patkányok kórtörténetének kezelése módosítja a gyógyszerek viselkedési hatásait a szorongás emelkedett plusz-labirintus tesztjében. Eur. J. Pharmacol. 235, 109–112. doi: 10.1016/0014-2999(93)90827-5
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
2007-ben a Magyar Tudományos Akadémia (M. H., M. H., Herlitze, S. és Roth, B. L.) tagja lett. A zár kialakítása, hogy illeszkedjen a kulcshoz, hogy létrehozzon egy inert ligandum által hatékonyan aktivált G-fehérjéhez kapcsolt receptorok családját. Proc. NAT. Acad. Sci. USA 104, 5163-5168. doi: 10.1073 / pnas.0700293104
PubMed absztrakt / CrossRef teljes szöveg / Google Scholar
Ashby, C. R. és Wang, R. Y. (1996). Az atipikus antipszichotikus gyógyszer klozapin farmakológiai hatásai: áttekintés. Synapse 24, 349-394. doi: 10.1002/(SICI)1098-2396(199612)24:4<349::AID-SYN5>3.0.CO; 2-D
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Bahia, C. M. C. D. S. és Pereira, J. S. (2015). Obstruktív alvási apnoe és neurodegeneratív betegségek: kétirányú kapcsolat. Dement. Neuropszichol. 9, 9–15. doi: 10.1590 / S1980-57642015DN91000003
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Biancardi, V., B, KC, Almeida, M. C. és Gargaglioni, L. H. (2008). A Locus coeruleus noradrenerg neuronok és a CO2 a légzéshez vezetnek. Pflugers Arch. – Eur. J. Physiol. 455, 1119–1128. doi: 10.1007 / s00424-007-0338-8
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Brust, R. D., Corcoran, A. E., Richerson, G. B., Nattie, E. és Dymecki, S. M. (2014). A légzési dinamika szabályozására szakosodott agyi szerotonerg neuron molekuláris altípusának funkcionális és fejlődési azonosítása. 9-Es Szám, 2152-2165. doi: 10.1016 / j. celrep.2014.11.027
PubMed absztrakt / CrossRef teljes szöveg / Google Scholar
Chang, W. H., Lin, S. K., Lane, H. Y., Wei, F. C., Hu, W. H., Lam, Y. W., et al. (1998). A klozapin és a klozapin N-oxid reverzibilis metabolizmusa schizophreniás betegeknél. Prog. Neuro-Pszichofarmakol. Biol. Pszichiátria 22, 723-739. doi: 10.1016 / S0278-5846(98)00035-9
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Chen, Y.-W., Das, M., Oyarzabal, E. A., Cheng, Q., Plummer, N. W., Smith, K. G., et al. (2018). A stresszel kapcsolatos válaszok csillapításában szerepet játszó noradrenerg neuronok populációjának genetikai azonosítása. Mol. Pszichiátria 1-16. doi: 10.1038 / s41380-018-0245-8
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Dlouhy, B. J., Gehlbach, B. K., Kreple, C. J., Kawasaki, H., Oya, H., Buzzaés mtsai. (2015). A légzés gátolt, amikor a rohamok átterjedtek az amygdalára és az amygdala stimulációjára. J. Neurosci. 35, 10281–10289. doi: 10.1523 / JNEUROSCI.0888-15. 2015
PubMed absztrakt / CrossRef teljes szöveg / Google Scholar
Feinstein, J. S., Buzzaaz, C., Hurlemann, R., Follmer, R. L., Dahdaleh, N. S., Coryell, W. H., et al. (2013). Félelem és pánik az emberekben kétoldalú amygdala károsodással. Nat. Neurosci. 16, 270–272. doi: 10.1038 / nn.3323
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Fitton, A. és Heel, R. C. (1990). Klozapin. Farmakológiai tulajdonságainak áttekintése, valamint a skizofrénia terápiás alkalmazása. Drogok 40, 722-747. doi: 10.2165/00003495-199040050-00007
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
B. A., T. A., Pho, H., Dergacheva, O., Berger, S., Lee, R., Freire, C., et al. (2018). A hipoglosszális motoneuronok elnémítása alvászavaros légzéshez vezet sovány egerekben. Elöl. Neurol. 9:962. doi: 10.3389 / fneur.2018.00962
CrossRef Teljes Szöveg / Google Scholar
Gargaglioni, L. H., Hartzler, L. K., és Putnam, R. W. (2010). A locus coeruleus és a központi kemoszenzitivitás. Respir. Physiol. Neurobiol. 173, 264–273. doi: 10.1016 / j.ill.2010.04.024
PubMed absztrakt / CrossRef teljes szöveg / Google Scholar
Gomez, J. L., Bonaventura, J., Lesniak, W., Mathews, W. B., Sysa-Shah, P., Rodriguez, L. A., et al. (2017). A kemogenetika feltárta: DREADD elfoglaltság és aktiválás átalakított klozapinon keresztül. Tudomány 357, 503-507. doi: 10.1126 / tudomány.Aan2475
PubMed absztrakt / CrossRef teljes szöveg / Google Scholar
Guettier, J. M., Gautam, D., Scarselli, M., Ruiz de Azua, I., Li, J. H., Rosemond, E., et al. (2009). Kémiai-genetikai megközelítés a béta-sejtek működésének G-fehérje szabályozásának tanulmányozására in vivo. Proc. NAT. Acad. Sci. USA 106, 19197-19202. doi: 10.1073 / pnas.0906593106
CrossRef teljes szöveg / Google Scholar
Hakim, F., Gozal, D. és Kheirandish-Gozal, L. (2012). Szimpatikus és katekolaminerg változások az alvási apnoéban, különös tekintettel a gyermekekre. Elöl. Neurol. 3:7. doi: 10.3389 / fneur.2012.00007
PubMed absztrakt / CrossRef teljes szöveg / Google Scholar
Hennessy, M. L., Corcoran, A. E., Brust, R. D., Chang, Y., Nattie, E. E. és Dymecki, S. M. (2017). A Tachykinin1-expresszáló Pet1 raphe neuronok aktivitása modulálja a légzőszervi kemoreflexet. J. Neurosci. 37, 1807–1819. doi: 10.1523 / JNEUROSCI.2316-16. 2016
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Huckstepp, R. T. R., Cardoza, K. P., Henderson, L. E. és Feldman, J. L. (2015). A parafaciális magok szerepe a felnőtt patkányok légzésének szabályozásában. J. Neurosci. 35, 1052–1067. doi: 10.1523 / JNEUROSCI.2953-14. 2015
PubMed absztrakt / CrossRef teljes szöveg / Google Scholar
Ilg, A.-K., Enkel, T., Bartsch, D., és B Enterprises, F. (2018). Az akut szisztémás alacsony dózisú klozapin viselkedési hatásai vad típusú patkányokban: következmények a DREADDs viselkedési idegtudományban történő alkalmazására. Elöl. Behav. Neurosci. 12:173. doi: 10.3389 / fnbeh.2018.00173
CrossRef teljes szöveg / Google Scholar
Isom, G. E. és Elshowihy, R. M. (1982). Az akut és krónikus stressz kölcsönhatása a légzéssel: a naloxon módosítása. Pharmacol. Biochem. Behav. 16, 599–603. doi: 10.1016/0091-3057(82)90422-1
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Jann, M. W., Lam, Y. W. és Chang, W. H. (1994). Klozapin gyors képződése tengerimalacokban és emberben klozapin-N-oxid adagolását követően. Arch. Int. Pharmacodyn. Ott. 328, 243–250.
PubMed Absztrakt / Google Scholar
Joober, R. (2010). Klozapin: különálló, kevéssé ismert és kevéssé használt molekula. J. Psychiatry Neurosci. 35, 147–149. doi: 10.1503 / jpn.100055
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Kinkead, R., Dupenloup, L., Valois, N. és Gulemetova, R. (2001). A hypercapnic lélegeztető válasz stressz okozta csillapítása ébren lévő patkányokban. J. Appl. Physiol. 90, 1729–1735. doi: 10.1152 / jappl.2001.90.5.1729
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Scholar
Klein, D. F. (1993). Hamis fulladásriasztások, spontán pánikok és kapcsolódó állapotok. Integratív hipotézis. Arch. Gen. Psychiatry 50, 306-317. doi: 10.1001 / archpsyc.1993.01820160076009
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Korsak, A., Sheikhbahaei, S., Machhada, A., Gourine, A. V. és Huckstepp, R. T. R. (2018). A parafaciális neuronok szerepe a légzés szabályozásában edzés közben. Sci. REP. 8: 400. doi: 10.1038 / s41598-017-17412-z
CrossRef teljes szöveg / Google Scholar
Lapin, I. P. (1995). Csak a kontrollok: a kezelés, a színlelt injekció és a sóoldat intraperitoneális injekciójának hatása az egerek viselkedésére emelkedett plusz labirintusban. J. Pharmacol. Toxicol. 34.módszer, 73-77. doi: 10.1016 / 1056-8719 (95) 00025-D
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Lavezzi, A. M., Alfonsi, G. és Matturri, L. (2013). Az emberi locus coeruleus komplex patofiziológiája magzati / újszülött hirtelen megmagyarázhatatlan halálban. Neurol. Res. 35, 44-53. doi: 10.1179/1743132812y. 0000000108
PubMed absztrakt | CrossRef teljes szöveg / Google Tudós
MacLaren, D. A. A., Browne, R. W., Shaw, J. K., Krishnan Radhakrishnan, S., Khare, P., Espa Ca, R. A., et al. (2016). A klozapin N-oxid beadása viselkedési hatásokat vált ki hosszú evans patkányokban: következmények a DREADD kísérletek megtervezéséhez. eNeuro 3, 1-14. doi: 10.1523 / EUR.0219-16. 2016
PubMed absztrakt / CrossRef teljes szöveg / Google Scholar
Madisen, L., Zwingman, T. A., Sunkin, S. M., Oh, S. W., Zariwala, H. A., Gu, H., et al. (2010). Robusztus és nagy áteresztőképességű Cre jelentési és jellemzési rendszer az egész egér agy számára. Nat. Neurosci. 13, 133–140. doi: 10.1038 / nn.2467
PubMed absztrakt / CrossRef teljes szöveg / Google Scholar
Mahler, S. V. és Aston-Jones, G. (2018). CNO gonosz? Megfontolások a dreadds használatára a viselkedési idegtudományban. Neuropszichofarmakológia 43, 934-936. doi: 10.1038 / atomerőmű.2017.299
PubMed absztrakt / CrossRef teljes szöveg / Google Scholar
Manvich, D. F., Webster, K. A., Foster, S. L., Farrell, M. S., Ritchie, J. C., Porter, J. H., et al. (2018). A DREADD agonista klozapin N-oxid (CNO) fordított metabolizálódik klozapinná, és klozapin-szerű interoceptív inger hatásokat eredményez patkányokban és egerekben. Sci. REP. 8, 3840. doi: 10.1038 / s41598-018-22116-z
CrossRef teljes szöveg / Google Scholar
Misslin, R., Herzog, F., Koch, B. és Ropartz, P. (1982). Az izoláció, a kezelés és az újdonság hatása az agyalapi mirigyre — mellékvese válasz az egérben. Pszichoneuroendokrinológia 7, 217-221. doi: 10.1016/0306-4530(82)90015-4
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
2007-ben az Egyesült Államokban, az Egyesült Államokban, az Egyesült Államokban, az Egyesült Államokban, az Egyesült Államokban, az Egyesült Államokban, az Egyesült Államokban, az Egyesült Államokban, az Egyesült Államokban, az Egyesült Államokban, az Egyesült Államokban, az Egyesült Államokban, az Egyesült Államokban, az Egyesült Államokban, az Egyesült Államokban. A hypercapnic chemoreflex és a túlzott alvási apnoe éberség állapotfüggő csillapítása orexin knockout egerekben. J. Appl. Physiol. 102, 241–248. doi: 10.1152 / japplphysiol.00679.2006
PubMed absztrakt / CrossRef teljes szöveg / Google Scholar
Obonai, T., Yasuhara, M., Nakamura, T. és Takashima, S. (1998). Katekolamin neuronok változása a hirtelen csecsemőhalál szindróma áldozatainak agytörzsében. Gyermekgyógyászat 101, 285-288. doi: 10.1542 / peds.101.2.285
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Ozawa, Y., Takashima, S. és Tada, H. (2003). Alfa2-adrenerg receptor altípus változások az agytörzsben a hirtelen csecsemőhalál szindrómában. Korai Zümmögés. Dev. 75 (kiegészítés.), S129-S138. doi: 10.1016 / j. kórképek.2004.01.015
CrossRef teljes szöveg / Google Scholar
Padovan-Hernandez, Y. és Knackstedt, L. A. (2018). A klozapin-N-oxid kokain által kiváltott mozgás dózisfüggő csökkenése patkányokban, akiknek kórtörténetében kokain önadagolás történt. Neurosci. Lett. 674, 132–135. doi: 10.1016 / j. neulet.2018.03.045
PubMed absztrakt / CrossRef teljes szöveg / Google Scholar
R. A., Thoby-Brisson, M., Dubreuil, V., Bouvier, J., Ruffault, P.-L., et al. (2011). Légzés CO (2) kemoszenzitivitás nélkül feltételes Phox2b mutánsokban. J. Neurosci. 31, 12880–12888. doi: 10.1523 / JNEUROSCI.1721-11.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
Raper, J., Morrison, R. D., Daniels, J. S., Howell, L., Bachevalier, J., Wichmann, T., et al. (2017). Metabolism and distribution of clozapine-N-oxide: implications for nonhuman primate chemogenetics. ACS Chem. Neurosci. 8, 1570–1576. doi: 10.1021/acschemneuro.7b00079
PubMed Abstract | CrossRef Full Text | Google Scholar
Ray, R. S., Corcoran, A. E., Brust, R. D., Soriano, L. P., Nattie, E. E., and Dymecki, S. M. (2013). Az Egr2-neuronok szabályozzák a felnőttkori légzési választ a hiperkapniára. Brain Res. 1511, 115-125. doi: 10.1016 / j. brainres.2012.12.017
PubMed absztrakt / CrossRef teljes szöveg / Google Scholar
Ray, R. S., Corcoran, A. E., Brust, R. D., Kim, J. C., Richerson, G. B., Nattie, E., et al. (2011). Akut szerotonerg neuron gátlás esetén a légzés és a testhőmérséklet csökkent szabályozása. Tudomány 333, 637-642. doi: 10.1126 / tudomány.1205295
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Tudós
Ryabinin, A. E., Wang, Y. M. és Finn, D. A. (1999). A Fos immunreaktivitás különböző szintjei ismételt kezelés és injekciós stressz után két beltenyésztett egér törzsben. Pharmacol. Biochem. Behav. 63, 143–151. doi: 10.1016 / S0091-3057(98)00239-1
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Snyder, B., Shell, B., Cunningham, J. T. és Cunningham, R. L. (2017). A krónikus intermittáló hypoxia oxidatív stresszt és gyulladást vált ki a korai stádiumú neurodegenerációval összefüggő agyi régiókban. Physiol. REP. 5, 1-13. doi: 10.14814 / phy2.13258
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Sun, J. J., Huang, T.-W., Neul, J. L. és Ray, R. S. (2017). Az embrionális hátsó agy mintázó gének megkülönböztetik a felnőtt cardio-respiratorikus és metabolikus homeosztatikus populációit. Sci. REP. 7:9117. doi: 10.1038 / s41598-017-08810-4
CrossRef teljes szöveg / Google Tudós
Sun, J. J. és Ray, R. S. (2017). A TG (Th-Cre)FI172Gsat (Th-Cre) meghatározza a teljes hiperkapnic és hipoxiás reflexekhez szükséges neuronokat. Biol. Nyitva 6, 1200-1208. doi: 10.1242 / bio.026823
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Tóth B., Tóth B., Tóth B., Tóth B., Tóth B., Tóth B., Tóth B., Tóth B., Tóth B., Tóth B., Tóth B., Tóth B., Tóth B., Tóth B., Tóth. (2014). A stria terminalis ágymagja kritikus a CO2 és az acidózis által kiváltott szorongással kapcsolatos viselkedés szempontjából. J. Neurosci. 34, 10247–10255. doi: 10.1523 / JNEUROSCI.1680-14. 2014
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Valentino, R. J. és Van Bockstaele, E. (2008). A locus coeruleus aktivitás konvergens szabályozása, mint adaptív válasz a stresszre. Eur. J. Pharmacol. 583, 194–203. doi: 10.1016 / j. ejfár.2007.11.062
CrossRef teljes szöveg / Google Scholar
Verbraecken, J. és McNicholas, W. T. (2013). Légzésmechanika és légzésszabályozás az átfedési szindrómában és az elhízás hipoventilációjában. Respir. Res. 14: 132. doi: 10.1186/1465-9921-14-132
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Viemari, J.-C. (2008). A légzőszervi neurális hálózat noradrenerg modulációja. Respir. Physiol. Neurobiol. 164, 123–130. doi: 10.1016 / j.ill.2008.06.016
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Winter, A., Ahlbrand, R., Naik, D. és Sah, R. (2017). Differenciális viselkedési érzékenység a szén-dioxid (CO2) inhalációval szemben patkányokban. Neuroscience 346, 423-433. doi: 10.1016 / j.idegtudomány.2017.01.003
PubMed absztrakt / CrossRef teljes szöveg / Google Scholar
Ziemann, A. E., Allen, je, Dahdaleh, N. S., Drebot, I. I., Coryell, M. W., Wunsch, A. M., et al. (2009). Az amygdala egy kemoszenzor, amely érzékeli a szén-dioxidot és az acidózist, hogy kiváltsa a félelem viselkedését. Cell 139, 1012–1021. doi: 10.1016/j.cell.2009.10.029
PubMed Abstract | CrossRef Full Text | Google Scholar