- Bevezetés
- anyagok és módszerek
- petesejtek begyűjtése és Crns mikroinjekció
- Membránfrakciók izolálása és Immunblotálás
- immunhisztokémia
- Freeze törés elektronmikroszkópia
- páros petesejt-vizsgálatot és az érintkezési területek számszerűsítését
- hidrosztatikus Nyomásimpulzus vizsgálat
- kaprát inkubáció
- statisztikai elemzés
- eredmények
- a Claudin-5 expressziója és az X-be való integráció. laevis oocita plazmamembrán
- tapaszok láthatók a Claudin-5-ben expresszáló Oocytákban
- páros Oocyta Assay a Claudin transz-interakció analíziséhez
- a hidrosztatikus Nyomásimpulzus vizsgálat a
- inkubáció
- Vita
- a Claudinok hozzájárulnak az erősebb tapadási tulajdonságokhoz
- következtetés
- Data Availability Statement
- etikai nyilatkozat
- szerzői hozzájárulások
- finanszírozás
- összeférhetetlenség
- Köszönetnyilvánítás
- Kiegészítő anyag
Bevezetés
a szűk csomópont fehérjecsalád döntő fontosságú a sejtfiziológia szempontjából, mivel a hiány vagy a károsodás számos szerv és szövet betegségével és diszfunkciójával jár, mint például a belső fülben (Wilcox et al., 2001; Florian et al., 2003), vese (Konrad et al., 2006; G., 2009), gyomor-bél traktus (Resnick et al., 2005; Amasheh et al., 2009), epidermis (Furuse et al., 2002; Tebbe et al., 2002) és az agykapillárisok (Nitta et al., 2003; Wolburg et al., 2003). A claudinok egy transzmembrán fehérjecsaládot képviselnek, amely legalább 27 tagból áll (Mineta et al., 2011). Négy transzmembrán hélix doménjük mellett két extracelluláris hurkot (ECL1 és ECL2), egy rövid N-terminust és egy C-terminust (Suzuki et al., 2014). A specifikus claudin expressziós minták meghatározzák és tükrözik az epithelia szelektív permeabilitását, valamint a claudin fehérjék azon képességét, hogy kölcsönhatásba lépjenek a cisz-ben (ugyanazon membránon belül) és a transz-ban (a szomszédos sejt membránjai között), lehetővé teszi a gátképző és pórusképző szoros csomópontokat (van Itallie and Anderson, 2006).
a Claudin-5 erősen expresszálódik a kapilláris endotheliában, és uralja a vér-agy gát (BBB) szoros csomópontját (TJ), mivel az expresszió > 100-szor nagyobb, mint bármely más claudin (Ohtsuki et al., 2007). Ezenkívül számos hámszövetben expresszálódik, beleértve a tüdőt is (Soini, 2011), exokrin szövetek (Comper et al., 2009), bél (Garcia-Hernandez et al., 2017), valamint a húgyúti (Koda et al., 2011). A claudin-5 azonban erősebb gátat okoz az agykapillárisokban, mint más szövetekben (Reinhold and Rittner, 2017), és funkciója károsodott neurodegeneratív és neuroinflammatorikus rendellenességekben (Greene et al., 2019). Ezért a claudin-5 elengedhetetlen a BBB fenntartásához. De a BBB nemcsak védő, hanem korlátozza a terápiás lehetőségeket is, mivel a gyógyszerek akadályozzák ezt a gátat.
Nitta et al. (2003) számolt be, hogy a BBB jobban áteresztő molekulák 800 Da méretű claudin – 5 hiányos egerek, mint a vad típusú egerek (Nitta et al., 2003). Ez összhangban volt a transzfekciós kísérletekkel, amelyek a claudin-5 tömítő hatását bizonyították Caco-2 sejt egyrétegekben (Amasheh et al., 2005).
egy másik jelentős gátképző claudin a claudin-3, amelyről beszámoltak arról, hogy szelektíven lezárja a gátat a töltés és a töltés nélküli oldott anyagok ionjainak áthaladása ellen (Milatz et al., 2010). Az agykapillárisok endoteliális szűk csomópontjában is kifejeződik, és funkcionális vesztesége a sclerosis multiplexben szenvedő betegek mikroveszélyes gyulladásának, glioblastomájának és choroid plexusának fázisaiban figyelhető meg (Engelhardt et al., 2001; Wolburg et al., 2003).
a Barrier tulajdonságok dinamikusan módosíthatók, pl. kimutatták, hogy a nátrium-kapráttal történő inkubáció gyorsan és reverzibilisen csökkenti a transzepitheliális elektromos ellenállást a humán bélsejtvonal HT-29/B6-ban (Krug et al., 2013). A nátrium-kaprát átmenetileg megnyitja a claudin-5-et tartalmazó akadályokat az epitheliális és endothel sejtek szoros csomópontjaiban (Del Vecchio et al., 2012).
ez azt jelzi, hogy a claudin-5 ígéretes célpont a gyógyszeradagolás fokozására a BBB-ben.
ebben a tanulmányban a Xenopus laevis petesejtek heterológ expressziós rendszerének alkalmazását tűztük ki célul (Vitzthum et al., 2019) a claudin-5 és claudin-3 kölcsönhatás és pertubáció elemzésére. Az endogén sejt-sejt-kontaktusok hiánya miatt ez az egysejtű expressziós rendszer lehetővé teszi specifikus claudinok elemzését más szoros csomóponti fehérjék interferenciája nélkül.
anyagok és módszerek
petesejtek begyűjtése és Crns mikroinjekció
petesejteket gyűjtöttek felnőtt nőstény afrikai karmos békákból műtéti laparotómiával. Anasthesia esetén, 0.2% MS222 (etil-3-amino-benzoát-metánszulfonát, Sigma-Aldrich, Taufkirchen, Németország) fürdőoldatként használták 5-10 percig 20 Kb-on.a műtéti anasthesia elérése után a bőr és a hasizom bemetszéseit elvégezték, a petefészek tömegét exteriorizálták és az ovariális szövetet eltávolították. A petesejtek izolálását enzimatikus emésztéssel végeztük szobahőmérsékleten 90 percig 1,5 mg / ml kollagenáz Fisher Bioreagensekben BP2649-1 (Fisher Scientific, Schwerte, Németország) oocyta Ringer oldatban (ORi) oldva, Vitzthum et al. (2019). A follikuláris sejteket Ca2+-mentes ORi-ben történő inkubálással távolítottuk el (mM-ben): NaCl (90), KCl (1), EGTA (trietilén-glikol-diamin-tetraecetsav) (1), 5 HEPE (5); pH 7,4 10 percig mechanikus rázógépen, 50 fordulat / perc sebességgel. Az V. és VI.stádiumú petesejteket (>1000 Ft) injektáltuk (Nanoliter 2010, World Precision Instruments, Sarasota, FL, Egyesült Államok) 1 ng crns-vel, amely kontrollként emberi claudin-5, claudin-3 vagy Rnázmentes vizet kódolt. Az injekció térfogata 50, 6 nl / oocyta volt. Az injekció beadása után a petesejteket 16-on inkubáltuk C-on ORi 3 nap alatt a fehérje expressziójához.
Membránfrakciók izolálása és Immunblotálás
tíz injektált petesejtet gyűjtöttünk össze western blot analízis céljából, és 500 (mm-ben) MgCl2 (5), NaH2PO4 (5), EDTA (etilén-diamin-tetraecetsav) (1), szacharóz (80) és trisz (trisz(hidroxi-metil) – amino-metán) (20) pH-értékű homogenizációs pufferben reszuszpendáltuk;. Az oocita kivonatokat kétszer centrifugáltuk 200 fordulat / perc sebességgel 10 percig 4 db-On kb a sejttörmelék eldobására. A felülúszót 13 000 fordulat / perc sebességgel centrifugáltuk 30 percig 4-en 6CC a sejtmembrán pelletálására, amint azt Leduc-Nadeau leírta et al. (2007). A pelleteket reszuszpendáltuk 80 MHz-es homogenizációs pufferben. A fehérje mennyiségi meghatározását kolorimetrikusan végeztük Pierce 600 nm-es Protein Assay Kit (Thermo Fisher Scientific, Hennigsdorf, Németország) alkalmazásával a gyártó utasításai szerint egy 96 kútlemezen. A lemezolvasót (PerkinElmer EnSpire Multimode Plate Reader, Waltham, MA, Egyesült Államok) 562 nm-re állítottuk be, és a Bovine szérumalbumin standardot (Thermo Fisher Scientific, Hennigsdorf, Németország) 125 és 2000 Ft/ml között alkalmaztuk az értékeléshez. Az immunoblotálás előtt a mintákat 4 db (Bio-Rad Laboratories, München, Németország) 60% – os SDS poliakrilamid gélre keverték, majd elektroforézist kaptak. A fehérje transzferhez PVDF membránokat használtunk és blokkoltunk 5% zsírmentes száraz tejben trisz-pufferolt sóoldatban 120 percig. A fehérjéket immunoblottálással detektáltuk claudin-3 vagy claudin-5 ellen emelt primer antitestek felhasználásával (invitrogen #35-2500, #34-1700, #34-1600, Life Technologies, Carlsbad, CA, Egyesült Államok).
peroxidáz-konjugált kecske-nyúl-és egérellenes antitesteket (#7074, #7076 Cell Signaling Technology, Danvers, MA, Egyesült Államok) használtak az elsődleges antitestekhez való kötődéshez, ezért szobahőmérsékleten legalább 45 percig inkubáltuk. A kimutatáshoz Clarity Western ECL blot szubsztrátot (#1705061, Bio-Rad Laboratories GmbH, München, Németország) használtunk, és a jeleket egy Chemidoc MP rendszer (Bio-Rad Laboratories) vizualizálta.
immunhisztokémia
az injektált petesejteket 4% PFA-ban (16% paraformaldehid, E15700, Science Service, München, Németország) 4 órán át szobahőmérsékleten rögzítettük, majd 70% – os etanolról xilolra (Carl Roth, Karlsruhe, Németország) dehidratációs gradienssel 48 órán belül. a mintákat paraffinba ágyaztuk és keresztmetszetben (5 km) Leica RM 2245 mikrotom alkalmazásával (Leica Microsystems Heidelberg, Németország). Röviddel az immunhisztokémiai kezelés előtt a paraffint xilollal etanol gradienssé távolítottuk el. A nem specifikus kötőhelyeket 5% – os kecske szérummal blokkoltuk foszfátpufferelt sóoldatban, és inkubáltuk ugyanazokkal az elsődleges antitestekkel, mint az immunoblotoláshoz. A mintákat Alexa Fluor-488 goat anti-rabbit és Alexa Fluor-594 goat Anti-mouse másodlagos antitestekkel inkubáltuk (Life Technologies, Carlsbad, CA, Egyesült Államok), és konfokális lézerszkennelő immunfluoreszcens mikroszkóppal vizsgáltuk (LSM 710, Zeiss, Oberkochen, Németország).
Freeze törés elektronmikroszkópia
Freeze törés elektronmikroszkópiát végeztünk a közelmúltban jelentett (Greene et al., 2019). A rögzítéshez az injektált petesejteket inkubáltuk glutáraldehid (2,5% 0,1 M-ben kakodilát puffer) egy éjszakán át, 4-en kb C. kakodilát pufferrel történő mosás után oocitákat készítettünk fagyasztásra repesztés. A mintákat 30% glicerinben krioprotektáltuk és folyékony nitrogénben fagyasztottuk. A platinával és szénnel (BAF400D; Balzers, Liechtenstein) történő repesztés és árnyékolás után a maradék szerves anyagot nátrium-hipoklorit mosással távolították el. A petesejteket transzmissziós elektronmikroszkóppal (EM-10, Zeiss, Oberkochen, Németország) elemezték, és digitális fényképezőgéppel (TR ons GmbH) lefényképezték. A szoros csomópont szálainak morfometriai elemzését 20 000-es nagyítással végeztük.
páros petesejt-vizsgálatot és az érintkezési területek számszerűsítését
mannitot hajtottak végre az injektált petesejtek zsugorítására, és lehetővé tették a vitellin membrán mechanikus eltávolítását csipesszel a plazmamembrán károsítása nélkül. 5-10 petesejtet helyeztünk egy petri-csészébe (35 mm átmérőjű, Thermo Fisher, Henningsdorf, Németország, #153066), Ori-val töltve. Mannitot adtunk hozzá és feloldottuk, amíg a sejtek hipertóniás zsugorodása el nem érte (körülbelül 400 mOsmol / l 10 percig). Kézi devitellinizálás után a petesejteket azonnal átvisszük egy 24 kútlemezre (1. 86 cm2 felület, TPP Techno Plastic Products, Trasadingen, Svájc, # 92024), amely 2 ml ORi-t tartalmaz. Mindegyik kútban két sejtet finoman csoportosítottunk össze egy Pasteur pipettával (1 ml, Thermo Fisher, Henningsdorf, Németország, #PP88SB) és egy hagymás szondával.
a claudin-5-expresszáló (cldn5 − cldn5), a claudin-3-expresszáló (cldn3 − cldn3), a claudin-3 és a claudin-5 koexpresszáló (cldn3,5 − cldn3,5) és a kontroll − kontroll oocitákat (kontroll-kontroll) oocita párokat Ori-ban 48 órán át együtt tartottuk 16 oc-on.
Bright field mikroszkópiát alkalmaztunk a klaszterezett petesejtek érintkezési területének számszerűsítése 1, 24 és 48 óra után.a na 6V oocita Párok felvételeit 24 kútkultúra-edényben készítettük Leica dmi6000 B mikroszkóppal (Leica Microsystems, Wetzlar, Németország). Az érintkezési felület átmérőjét mikron skála segítségével mértük (LAS-AF 3.2.0). Az érintkezési területeket körkörösnek kell tekinteni, ezért az érintkezési területet az a=R2 köregyenlet segítségével számítottuk ki.
hidrosztatikus Nyomásimpulzus vizsgálat
a vitellin membránokat a korábban leírtak szerint mechanikusan eltávolítottuk, és a petesejtek analagikusan csoportosultak a párosított petesejt-vizsgálathoz. Ezenkívül vegyes petesejtpárokat (kontroll–cldn5 és kontroll–cldn3) vizsgáltunk a hidrosztatikus nyomásimpulzus (HPI) vizsgálatban. 24 órás stabilizáció után egy meghatározott hidrosztatikus impulzust hoztak létre egycsatornás elektronikus pipettával (EE-300r, Eppendorf Research Pro, szoftververzió 2.06.00, Hamburg, Németország).
a petesejteket 24, 2 ml ORi-t tartalmazó kútlemezen tartottuk, és a 250 ml Ori pipettázási térfogat alkalmazása előtt ellenőriztük a központi pozícionálást. Az adagolási sebességet egységesen a maximális sebességre állítottuk be, ami 0,9 s adagolási sebességnek felel meg.ezenkívül a szöget (45 dB) és az alkalmazási távolságot (1,3 cm) is egységesen alkalmaztuk. A környezeti nyomást, az ORi viszkozitását és a pipetta csúcsnyílásának átmérőjét állandó körülmények között tartottuk. A hidrosztatikus nyomás alkalmazása után 30 perccel az érintkezési területek számszerűsítésére fényes mező mikroszkópiát alkalmaztunk, majd összehasonlítottuk az alkalmazás előtti érintkezési területekkel. A kísérleti beállítást az 1. ábra ismerteti.
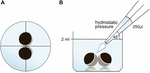
1. ábra. A hidrosztatikus nyomásimpulzus vizsgálat kísérleti beállítása (A) A kút sematikus Felülnézete: a petesejtpár központi elhelyezkedését ellenőriztük a hidrosztatikus nyomás alkalmazása előtt. (B) a kút sematikus oldalnézete: egycsatornás elektronikus pipettával 250 Ft Ori-t adtunk hozzá. Az adagolási sebességet egységesen a maximális sebességre állították. A szöget (45 dB) és az alkalmazási távolságot egységesen alkalmaztuk. A környezeti nyomást, az ORi viszkozitását és a pipetta csúcsnyílásának átmérőjét állandó körülmények között tartottuk.
kaprát inkubáció
a kaprát inkubáláshoz nátrium-kaprátot (#C4151, Sigma Aldrich, Taufkirchen, Németország) 50, 100 és 500 db végső koncentrációban, vagy referenciacsoportként ORi-t adtunk a petesejtekhez 24 órával a párosítás után. A petesejteket 24 kútlemezen tartottuk, amelyek 2 ml ORi-t tartalmaztak, a kaprátoldatot pedig egy meghatározott, 250 ml Ori / kút addíciós térfogatban oldottuk fel. Az érintkezési felület szélességét az adagolás után 30, 60 és 120 perccel határoztuk meg.
statisztikai elemzés
statisztikai elemzést végeztünk a JMP Pro 14.0.0 (NC, Egyesült Államok) programmal. Az adatok mediánként jelennek meg, és százalékos változásként jelennek meg az első vizsgálati pontokon a fürtözött kombináció alapján. A 4., 5. ábrákon az első kvartilis (25 százalék), a medián (50 százalék) és a második kvartilis (75 százalék) ábrázolása látható. A bajuszokat a 10.percentilisig, a 90. percentilisig húzzák le. A normális eloszlást Shapiro-Wilk-teszttel ellenőriztük.
Kruskal–Wallis tesztet használtunk többszörös összehasonlításhoz, amelyet Dunn-Bonferroni korrekció követett. a p-értékeket folyamatos számokként adjuk meg.
eredmények
a Claudin-5 expressziója és az X-be való integráció. laevis oocita plazmamembrán
a claudin-5 szoros csomópont fehérje sikeres expressziójának és az oocita plazmamembránba történő integrálásának teszteléséhez 3 nappal a claudin-5 crns injekció beadása után a membránfrakciókat immunoblottálással elemeztük. Három különálló állatból (d1–d3) vett minták mindegyike claudin-5 specifikus jeleket mutatott 23 kDa-nál, míg az rnázmentes, vízzel befecskendezett petesejtek nem mutattak specifikus jelet a claudin-5 expressziójára (2a.ábra).
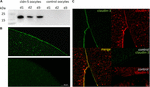
2. ábra. Heterológ módon expresszált claudinok kimutatása Xenopus laevis petesejtekben. (A) A claudin-5 szoros csomópont fehérje Immunoblot elemzése három állat X. laevis petesejtjeiben (d1–d3). A sejtmembrán lizátumokat SDS-PAGE-nek vetettük alá, majd immunoblot következett a PVDF membránokra. A membránokat primer antitestekkel és szekunder peroxidáz-konjugált antitestekkel inkubáltuk (n = 3). (B) az immunfluoreszcens festés specifikus claudin-5 jeleket (zöld) tárt fel az összes crns-injektált petesejt petesejtmembránjában, míg a vízzel injektált kontrollokban konfokális mikroszkópiában nem mutattak ki claudin-specifikus jeleket. Három állatból származó petesejtek reprezentatív képei. Scale bars: 50 6m. C) a claudin-5 és claudin-3 expresszáló petesejtek immunfluoreszcens festése specifikus claudin-3 jeleket (zöld) és claudin-5 jeleket (piros) mutatott ki a crns-injektált petesejtek petesejtmembránjaiban, míg a vízzel injektált kontrollokban nem észleltek claudin-specifikus jeleket. Az expresszált claudin fehérjék kolokalizációját az oocita plazmamembránon belül kettős immunfluoreszcens festéssel (sárga) tárjuk fel. Méretarány: 10 db.
az expresszált fehérjék plazmamembránon belüli megjelenítéséhez immunhisztokémiai festéseket végeztünk és konfokális lézeres pásztázó mikroszkóppal elemeztük (2b.ábra). Specifikus jeleket észleltek és egyenletesen oszlottak el a claudin – 5 expresszáló petesejtek plazmamembránjában. Az immunblotoknak megfelelően a kontroll oocita plazmamembránokban nem észleltek specifikus jeleket.
így a crns beadása után a claudin-5 sikeresen expresszálódott és integrálódott az X. laevis petesejtek plazmamembránjába.
a claudin-3 és a claudin-5 oocita párokban történő együttes expressziója mindkét sejtben specifikus jeleket mutatott a claudin-5 (piros) és a claudin-3 (Zöld) számára (2C ábra). Az oocita plazmamembránok a szomszédos sejtek fúzióját mutatták,amelyet közvetlen cldn3,5–cldn3, 5 kölcsönhatás biztosított (sárga).
tapaszok láthatók a Claudin-5-ben expresszáló Oocytákban
Oocyta plazmamembránokat elemeztünk, és a szoros csatlakozású szálak vizualizálása sikeres volt (3.ábra). A Freeze fracture elektronmikroszkópos vizsgálata a claudin-5 injektált petesejtek plazmamembránjában a szál morfológiájának foltjait mutatta, és a claudin-5 expresszáló petesejtek szálszervezése erősen szervezett és szögletes alakú volt (3a.ábra). A szoros csomópontokat elsősorban a membrán protoplazmatikus (P-) felületén detektálták. A Claudin – 3 injektált petesejtek lekerekített, jól szervezett szoros csatlakozási szálakat mutattak, amint azt korábban jeleztük (Vitzthum et al., 2019; 3b. ábra). A claudin-3 és claudin-5 koexpresszáló petesejtek freeze törés elektronmikroszkópos vizsgálata olyan fibrillákat mutatott ki, amelyek mind a claudin-3, mind a claudin-5 tulajdonságait hordozzák. A koexpresszáló petesejtek fibrillszál-architektúrája mind lekerekített, mind komplexnek tűnt, mint claudin – 3 expresszáló petesejt, de diszkontinózus és szögletesebb is, amint azt a claudin-5 expresszáló sejtek mutatják (3C ábra). A kontroll petesejtek tipikus sima felülettel rendelkeztek (3D ábra).
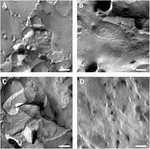
3. ábra. Freeze törés elektronmikroszkópia. (A) Freeze törés elektronmikroszkópia feltárja szoros csomópont fehérje cldn-5, mint a háló a szögletes szakaszos fibrillák sorokban Xenopus laevis petesejtek. (B) Freeze törés elektronmikroszkópia feltárja szoros csomópont fehérje cldn-3, mint a háló a lekerekített fibrillák X. laevis petesejtek. C) a claudin-3 és a claudin-5 koexpresszáló petesejtek fagyasztásos törés elektronmikroszkópos vizsgálata olyan rostokat tárt fel, amelyek mind a claudin-3, mind a claudin-5 tulajdonságait viselik. (D) a vízzel befecskendezett kontroll petesejtek sima felülettel rendelkeznek. Három állatból származó petesejtek reprezentatív képei. Skála sáv: 250 nm.
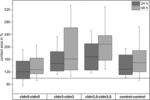
4. ábra. A cldn5–cldn5, cldn3–cldn3, cldn3,5–cldn3,5 és a kontroll–kontroll 24 és 48 h csoportosulás után a kezdeti érintkezési területek % – ában röviddel a csoportosulás után (n = 8-38).

5. ábra. A claudin-5, claudin-3 és a claudin-3 és claudin-5 petesejtek érintkezési területei a hidrosztatikus nyomásimpulzus (HPI) során a stabilizációs periódus után és 30 perccel a HPI után (n = 16-70, *p < 0,05, **p < 0.01, Kruskal-Wallis, majd egy Dunn-Bonferroni korrekció).
páros Oocyta Assay a Claudin transz-interakció analíziséhez
minden csoportosított kombináció az érintkezési terület időfüggő növekedését mutatta a mért időtartam alatt (4.ábra és 1. táblázat).
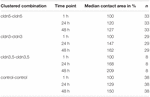
táblázat 1. A petesejtek érintkezési területei 48 órán belül a klaszterezés után.
a vízzel befecskendezett kontroll petesejtek érintkezési területe 129%-ra nőtt 24 óra után és 150% – ra 48 óra után. A claudin-3-at expresszáló petesejtek csoportosulása szintén az érintkezési területek 147% – os (24 óra) és 162% – os (48 óra) növekedését mutatta. A claudin-3-at és claudin-5-öt együtt expresszáló petesejtek csoportosulása 168% (24 óra) és 209% (48 óra) érintkezési területet mutatott. Az önmagában claudin-5-et expresszáló petesejtek csoportosulása 120% (24 óra) és 127% (48 óra) érintkezési területet mutatott. Ezért az összes vizsgált kombinációban az érintkezési területek összehasonlíthatók voltak.
a hidrosztatikus Nyomásimpulzus vizsgálat a
oocita Párok Claudin-specifikus csomópontját tárja fel külön megközelítésben a claudin-3-at vagy claudin-5-öt expresszáló vagy mindkét claudint expresszáló oocitákat csoportosítottuk mechanikus devitellinizálás után. A petesejteket HPI alkalmazásával kihívtuk, és az érintkezési területeket 30 perccel a provokáció után mértük és kiszámítottuk, és összehasonlítottuk a 24 órás stabilizációs periódus utáni kezdeti területekkel (5.Ábra és 2. táblázat). Hidrosztatikus nyomáskihívás után a vízzel befecskendezett kontroll petesejtek érintkezési területe 89% – ra csökkent. A claudin-5-öt, claudin-3-at vagy a claudin-3-at és claudin-5-öt expresszáló petesejtek csoportosított párjai nagyobb érintkezési területeket tartottak fenn (97%, p = 0,0235; 96%, p = 0,003; 98%, p = 0,0253). A kevert vízzel befecskendezett kontroll oociták és a claudint expresszáló oociták (kontroll-cldn5 és kontroll-cldn3) érintkezési területei nem különböztek szignifikánsan a kontroll oocitáktól (93%, p = 0,2900; 83%, p = 0,4455).
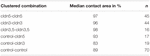
2. táblázat. Hidrosztatikus nyomásimpulzus vizsgálat.
inkubáció
Kapráttal egy kísérleti inkubációs kísérletben a petesejteket vagy claudin-5–t (cldn5–cldn5) expresszáló, vagy kontrollként Rnázmentes vízzel injektálták (kontroll-kontroll). A párokat inkubáltuk, a végső nátrium-kaprát-koncentráció 50, 100 vagy 500 MHz volt. Az oocita Párok inkubálása ORi-val referenciacsoportként szolgált. A petesejteket csoportosítottuk, majd 24 óra stabilizáció után megkezdtük az inkubációt és az érintkezési szélességet 30, 60 és 120 perccel az adagolás után mértük (S1 kiegészítő ábra).
az ORi hozzáadása az érintkezési területek kezdeti csökkenését eredményezte mind a claudint expresszáló, mind a vízzel injektált petesejtpárokban, amelyek 60 vagy 120 perccel az adagolás után diszpergálódnak. Ezt a medián érintkezési területek közötti összekötő vonal parabolikus alakja vázolja fel az idő múlásával (piros görbék az S1 kiegészítő ábrán). Azonban inkubációs 100 500 µM nátrium caprate nőtt a kapcsolatot területek kismértékben (100 µM), vagy erősen (500 µM) 30 perc után caprate kívül 5,1 × 105 5.2 × 105 µm2 4,3 × 105 4.9 × 105 µm2.
Vita
jelen tanulmányban a klasszikus modellt alkalmaztuk a transzporterek és az emberi betegségek modellezésére (Tammaro et al., 2009; Nenni et al., 2019), az X. laevis oocyták, a claudin-5 kölcsönhatásának és a csomópont tömítéséhez való funkcionális hozzájárulásának mélyreható elemzéséhez. Ebből a célból egy új megközelítés, amely HPI-t vezet be a csoportosított Xenopus petesejtek érintkezési területén belüli interakció kihívására, létrehozták.
a Claudinok hozzájárulnak az erősebb tapadási tulajdonságokhoz
a Vitzthum et al. (2019), az oocitákban expresszált egyetlen claudin nem vezetett az interakciós érintkezési területek növekedéséhez a kontroll oocitákhoz képest. Az immunoblot és az immunhisztokémiai vizualizáció azonban bizonyította a sikeres expressziót és integrációt az X. laevis oocita plazmamembránba. Ezenkívül a konfokális lézeres pásztázó mikroszkópia lehetővé tette a expresszált claudinok pontos lokalizációját a plazmamembránban, mivel a lyuk blokkolta a fókuszon kívüli fluoreszcenciát. Az immunhisztokémiai jelek számszerűsítését nem folytatták, mivel az antitestek affinitása a célok megkötésére különbözik.
Vedula et al. (2009) mikropipetta aspirációs technikát használt a claudin-claudin kölcsönhatás szempontjainak vizsgálatára a GFP-vel jelölt okkludinnal, cldn-1-vel és cldn-2-vel transzfektált L-fibroblasztok alkalmazásával. A két sejt egymástól való leválasztásához szükséges elválasztó erő nagyobb volt a cldn-1 és a cldn-2 transzfektált sejtekben (sorrendben 2,8, illetve 2,3 nn). Bár ez a megközelítés ígéretesnek tűnhet az expresszáló petesejtek claudin-claudin-interakciós elemzése szempontjából is, az előzetes vizsgálatok azt mutatták, hogy a fürtözött petesejtek leválása nem lehetséges az oocita plazmamembránok megzavarása nélkül.
ezért új megközelítésként a csatlakozások erejét HPI-vel mértük. Bár a HPI nem adja meg az elválasztó erő számszerűsítését abszolút értékekben (pl. newton-féle), lehetővé teszi a claudin kölcsönhatás gyors és költséghatékony elemzését anélkül, hogy más szűk csomópontú fehérjék (pl., okkludin, tricellulin, lekvár-a). A claudinok hozzájárulnak az oocita Párok találkozásához, mivel nagyobb érintkezési területet mutatnak, mint a HPI után a vízzel injektált oocitákhoz képest. Ez erős homofil transz-kölcsönhatást jelez a claudint expresszáló sejtek között.
a szál fibril architektúrája egyedi claudinokra jellemző (Colegio et al., 2002). Ban ben fagyott törés elektronmikroszkópia, a claudin – 3-ról beszámoltak arról, hogy egy lekerekített szálú hálót állít össze hurok alakzatokban Xenopus petesejtek (Vitzthum et al., 2019; 3B ábra) tanulmányunk során a claudin-5 egy szögletesebb és sorokba rendezett hálót alkotott. A képek azt mutatták, hogy a claudin-5 szoros csomópont fehérje fibrillák hálóját képezi az X. laevis oocitákban. Ez összhangban van a claudin-5 szálakkal, amelyekről ismert, hogy a P-fázishoz kapcsolódó részecskék láncaként fordulnak elő (Piontek et al., 2011). Kísérleteinkben úgy tűnt, hogy a fibrillák geometriai alakja nincs hatással a petesejtek adhéziós tulajdonságaira. Ennek megfelelően a paracelluláris rezisztencia nem függött össze a fibrilszámmal és a fibrilképző tulajdonságokkal (Colegio et al., 2002). Továbbá kimutatták, hogy a claudin-3 és a claudin-5 hasonló képességgel rendelkezik a homofil transz-interakcióra a HEK293 sejtekben (Piontek et al., 2011).
az X. laevis oociták ezen modellje, amely egyetlen szoros csomópont-fehérjéket expresszál, lehetővé teszi az olyan anyagok hatásának megfigyelését, mint a nátrium-kaprát a klaszterezett oociták közötti érintkezési területek kialakulására. Ezért hasznos eszköz lehet A szoros kereszteződés gátját befolyásoló anyagok idő-és költséghatékony szűréséhez.
a 100 és 500 MHz-es nátrium-kaprát-koncentráció védőhatást fejthet ki a claudin-5-öt expresszáló petesejtekre, ami 30 perc inkubálás után növeli az érintkezési területeket.
Krug et al. (2013) kimutatta, hogy a nátrium-kapráttal történő inkubáció a transzepitheliális rezisztencia gyors és reverzibilis csökkenéséhez vezetett az emberi bél sejtvonalában HT-29/B6. Ezenkívül a konfokális lézer-pásztázó mikroszkópia a claudin-5 jelentős csökkenését tárta fel a közepes láncú zsírsav-lauráttal kezelt HT-29/B6 sejtekben (Dittmann et al., 2014). A claudinok első extracelluláris hurka (ECL1) fontos a szoros csomópont gátló tulajdonságai szempontjából, míg a második extracelluláris hurok (ECL2) részt vesz a transz-interakció szálképződésében (Piontek et al., 2008; Rossa et al., 2014; Greene et al., 2019). A claudin-5 kötőanyagok, amelyek a claudin-5 ECL1-ét vagy ECL2-ét célozzák, indukálhatják a szoros csomópont fehérje intracelluláris felvételét, ezáltal meghiúsítva a claudin-5 transz-kölcsönhatásait a szomszédos sejtek közötti szoros csomópont tömítésben és lazítva a paracelluláris teret (Hashimoto et al., 2017).
így feltételeztük, hogy a nátrium-kapráttal történő inkubáció az X. laevis petesejteket expresszáló fürtözött claudin-5 érintkezési területének csökkenéséhez vezet. Váratlanul, a nátrium-kaprát növekvő koncentrációja (100 és 500 MHz) a claudin-5-öt expresszáló fürtözött petesejtek érintkezési területeinek növekedéséhez vezetett, ami a nátrium-kaprát védőhatását jelzi a szoros csomópont tömítésén. Ezenkívül a nátrium-kaprátot úgy írják le, hogy az aktomiozin perijunkcionális gyűrű összehúzódását indukálja, kiszélesítve a paracelluláris teret (Lindmark et al., 1998; Maher et al., 2009). Ez a hatás a miozin szabályozó könnyű láncának foszfolipáz C aktiváció útján történő foszforilációján alapul, amely a foszfatidilinozitol 4,5-biszfoszfát (PIP2) inozitol-trifoszfáttá (IP3) és diacil-glicerinré (Tomita et al., 1995). A zo-1 állványfehérje által az aktin citoszkeletonhoz kapcsolt szoros csomópont komplexet ezután újraelosztják a szoros csomópontból a citoplazmába (Lindmark et al., 1998; Turner, 2000). Az X. laevis petesejt citoarchitektúrája döntő fontosságú a citoplazmatikus regionalizáció szempontjából az oogenezis során (Wylie et al., 1985). Bár a megtermékenyítés előtt a Tjp-1 gén expressziója, a zo–1-et kódoló gén csak 1,9 TPM-et expresszál az oocita V-VI stádiumában (Session et al., 2016). A claudinok csökkent kölcsönhatása a citoszkeletális állványzattal ezért megmagyarázhatja a kaprát inkubáció váratlan eredményét. A jövőbeni tanulmányok köre a megállapítás mechanisztikus alapjának ellenőrzésére.
a nátrium-kaprátnak a paracelluláris permeabilitásra gyakorolt variáns hatását azonban az irodalomban korábban leírták. A felnőtt sertések béléből vett Peyer Tapaszszövetében hasonló erősítő hatást észleltek. Claudin-5 szignifikánsan nőtt inkubálás után 5 mM kaprát. Ebben a vizsgálatban a kaprát szignifikánsan magasabb transzepitheliális elektromos ellenálláshoz (TEER) vezetett a tüszőhöz kapcsolódó hámban (Radloff et al., 2019).
következtetés
összefoglalva, a claudin-5 szoros csomópont fehérje heterológ expressziója X-ben. a laevis petesejtek új betekintést nyújtanak az egyes claudinok hozzájárulásába a sejt-sejt kölcsönhatásban és a szomszédos sejtek adhéziós tulajdonságaiban. Így az X. laevis szoros csatlakozási modell használata a claudin-5 számára lehetővé teszi a BBB komponensek elemzését egycellás modellben.
Data Availability Statement
az ehhez a tanulmányhoz létrehozott adatkészletek kérésre rendelkezésre állnak a megfelelő szerző számára.
etikai nyilatkozat
az állatkezelések összhangban voltak a német jogszabályok iránymutatásaival, a berlini Freie Universit ons állatjóléti tisztviselőjének jóváhagyásával és a berlini állat-egészségügyi Felügyelőség irányítása alatt (Landesamt F KB Gesundheit und Soziales Berlin, engedély G0025/16).
szerzői hozzájárulások
minden szerző elolvasta és jóváhagyta a kéziratot. NB és SA tervezte, tervezte és felügyelte a kísérleteket és írta a kéziratot. NB, LS, VC, RK és PF-B végezte a kísérleteket és az adatok elemzését.
finanszírozás
ezt a tanulmányt a Deutsche Forschungsgemeinschaft finanszírozta, Grant No. AM141/11-1 és a H. Wilhelm Schaumann Stiftung.
összeférhetetlenség
a szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségnek tekinthetők.
Köszönetnyilvánítás
köszönjük Martin Grunau-nak, Gisela Manz-nak, Katharina S-nek és Susanne Trappe-nak a kiváló technikai segítséget. Elismerjük a Freie Universit Enterprises Berlin nyílt hozzáférésű publikációs kezdeményezését.
Kiegészítő anyag
a cikk kiegészítő anyaga megtalálható az interneten:: https://www.frontiersin.org/articles/10.3389/fphys.2020.00857/full#supplementary-material
S1. ábra / a claudin-5 érintkezési területei, amelyek oocita párokat fejeznek ki 6m2-ben, nátrium-kapráttal történő inkubálás során különböző koncentrációkban (n = 6-8), illetve kontrollként vízzel injektált oocitákkal (n = 5-7).
Amasheh, S., Dullat, S., Fromm, M., Schulzke, J. D., Buhr, H. J., and Kroesen, A. J. (2009). A gyulladt tasak nyálkahártyája megváltozott szoros csomópontokkal rendelkezik, amelyek a gyulladásos bélbetegség megismétlődését jelzik. Int. J. Colorect. Dis. 24, 1149–1156. doi: 10.1007 / s00384-009-0737-8
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Amasheh, S., Schmidt, T., Mahn, M., Florian, P., Mankertz, J., Tavalali, S., et al. (2005). A claudin-5 hozzájárulása a gát tulajdonságaihoz a hámsejtek szoros csomópontjaiban. Sejtszövet Res. 321, 89-96. doi: 10.1007 / s00441-005-1101-0
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Colegio, O. R., Van Itallie, C., Rahner, C. és Anderson, J. M. (2002). A claudin extracelluláris domének szerepe a szűk junction fibril architektúrában és a paracelluláris töltés szelektivitásában. Mol Biol Sejt. 13:286.
Google Scholar
P., Gobbo, S., Montagna, L., Pederzoli, P., et al. (2009). A claudins 5 és 7 expressziós mintája megkülönbözteti a szilárd pszeudopapillárisat a pancreatoblastomától, az acinar sejtektől és a hasnyálmirigy endokrin daganataitól. Am. J. Surg. Pathol. 33, 768–774. doi: 10.1097 / pas.0b013e3181957bc4
PubMed absztrakt / CrossRef teljes szöveg / Google Scholar
Del Vecchio, G., Tscheik, C., Tenz, K., Helms, H. C., Winkler, L., Blasig, R., et al. (2012). A nátrium-kaprát átmenetileg megnyitja a claudin-5-tartalmú gátakat az epitheliális és endothel sejtek szoros csomópontjaiban. Mol. Pharm. 9, 2523–2533. doi: 10.1021 / mp3001414
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Dittmann, I., Amasheh, M., Krug, S. M., Markov, A. G., Fromm, M. és Amasheh, S. (2014). A Laurát áthatja a ht-29/B6 bélhámsejt-modell kis molekuláinak paracelluláris útját a szoros csomópontok megnyitásával a claudin-5 reverzibilis áthelyezésével. Pharm. Res. Dordr. 31, 2539–2548. doi: 10.1007 / s11095-014-1350-2
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Engelhardt, B., Wolburg-Buchholz, K. és Wolburg, H. (2001). A choroid plexus bevonása a központi idegrendszer gyulladásába. Microsc. Res. Techniq. 52, 112–129. doi: 10.1002/1097-0029(20010101)52:1<112::támogatás-jemt13>3.0.co;2-5
CrossRef teljes szöveg / Google Tudós
E. Lessidrensky, M., Todt, I., Bloedow, A., Ernst, A., et al. (2003). Claudins a stria vascularis marginális sejtek szoros csomópontjaiban. Biochem. Biophys. Res.Co. 304, 5–10. doi: 10.1016 / s0006-291x(03)00498-4
CrossRef teljes szöveg / Google Tudós
Furuse, M., Hata, M., Furuse, K., Yoshida, Y., Haratake, A., Sugitani, Y., et al. (2002). A Claudin alapú szoros csomópontok kulcsfontosságúak az emlősök epidermális gátja szempontjából: claudin-1-hiányos egerek tanulsága. J. Sejt Biol. 156, 1099–1111. doi: 10.1083 / jcb.200110122
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Garcia-Hernandez, V., Quiros, M. és Nusrat, A. (2017). Intestinalis epithelialis claudins: expresszió és szabályozás a homeosztázisban és a gyulladásban. Ann. N. Y. Acad. Sci. 1397, 66–79. doi: 10.1111 / nyas.13360
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Greene, C., Hanley, N. és Campbell, M. (2019). Claudin-5: a neurológiai funkció kapuja. Folyadék Barr. CNS 16: 4321.
Google Scholar
G. D., Amasheh, S., Pfaffenbach, S., Richter, J. F., Kausalya, P. J., Hunziker, W., et al. (2009). A Claudin-16 befolyásolja a transzcelluláris CL – szekréciót az MDCK sejtekben. J. Physiol. Lond. 587, 3777–3793. doi: 10.1113 / jphysiol.2009.173401
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
H., H., Endo, K., Tamura, M., et al. (2017). A Claudin-5-kötőanyagok fokozzák az oldott anyagok áthatolását a vér-agy gáton egy emlős modellben. J. Pharmacol. Felh. Ott. 363, 275–283. doi: 10.1124 / jpet.117.243014
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Koda, R., Zhao, L. N., Yaoita, E., Josida, Y., Tsukita, S., Tamura, A., et al. (2011). A claudin – 5 újszerű expressziója glomeruláris podocitákban. Sejtszövet Res. 343, 637-648. doi: 10.1007 / s00441-010-1117-y
PubMed absztrakt / CrossRef teljes szöveg / Google Scholar
Konrad, M., Schaller, A., Seelow, D., Pandey, A. V., Waldegger, S., Lesslauer, A., et al. (2006). A claudin 19 (CLDN19) tight-junction gén mutációi a vese magnézium pazarlásával, veseelégtelenséggel és súlyos szemészeti érintettséggel járnak. Am. J. Hum. Genet. 79, 949–957. doi: 10.1086/508617
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Krug, S. M., Amasheh, M., Dittmann, I., Christoffel, I., Fromm, M. és Amasheh, S. (2013). Nátrium-kaprát, mint a makromolekulák permeációjának fokozója a bélsejtek tricelluláris szoros csomópontjain. Biológiai anyagok 34, 275-282. doi: 10.1016 / j.biológiai anyagok.2012.09.051
PubMed absztrakt / CrossRef teljes szöveg / Google Scholar
Leduc-Nadeau, A., Lahjouji, K., Bissonnette, P., Lapointe, J. Y. és Bichet, D. G. (2007). Új technika kidolgozása a plazmamembránok tisztítására Xenopus laevis petesejtekből. Am. J. Physiol. Cella. 292, C1132-C1136.
Google Scholar
Lindmark, T., Kimura, Y. és Artursson, P. (1998). Abszorpció fokozása a szűk csomópont permeabilitásának intracelluláris szabályozásával közepes láncú zsírsavak a Caco-2 sejtekben. J. Pharmacol. Felh. Ott. 284, 362–369.
Google Scholar
Maher, S., Leonard, T. W., Jacobsen, J. és Brayden, D. J. (2009). A nátrium-kaprát biztonságossága és hatékonysága az orális gyógyszer felszívódásának elősegítésében: in vitro a klinikáig. ADV. Gyógyszer Szállít. Rev. 61, 1427-1449. doi: 10.1016 / j.cím.2009.09.006
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Müller, Müller, Schulzke, J. D., Müller, Müller, Müller, Müller, Krug, S. M., Rosenthal, R. M., Schulzke, J. D., et al. (2010). A Claudin-3 a töltés és a töltés nélküli oldott anyagok ionjainak szoros csomópontjának tömítő komponenseként működik. Biochim. Biophys. Acta 1798, 2048-2057. doi: 10.1016 / j.2010.07.014
PubMed Absztrakt | CrossRef Teljes Szöveg | Google Tudós
Mineta, K., Yamamoto, Y., Yamazaki, Y., Tanaka, H., Tada, Y., Saito, K., et al. (2011). A claudin multigene család várható terjeszkedése. FEBS Lett. 585, 606–612. doi: 10.1016 / j. febslet.2011.01.028
PubMed absztrakt / CrossRef teljes szöveg / Google Scholar
Nenni, M. J., Fisher, M. E., James-Zorn, C., Pells, T. J., Ponferrada, V., Chu, S., et al. (2019). Xenbase: a Xenopus alkalmazásának megkönnyítése az emberi betegségek modellezésére. Elöl. Physiol. 10:154. doi: 10.3389 / fphys.2019.00154
PubMed absztrakt / CrossRef teljes szöveg / Google Scholar
Nitta, T., Hata, M., Gotoh, S., Seo, Y., Sasaki, H., Hashimoto, N., et al. (2003). A vér-agy gát méret-szelektív lazítása claudin-5-hiányos egerekben. J. Sejt Biol. 161, 653–660. doi: 10.1083 / jcb.200302070
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Ohtsuki, S., Sato, S., Yamaguchi, H., Kamoi, M., Asashima, T. és Terasaki, T. (2007). A claudin-5 exogén expressziója gát tulajdonságokat indukál a tenyésztett patkány agyi kapilláris endothel sejtekben. J. Sejt Fiziol. 210, 81–86. doi: 10.1002 / jcp.20823
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Tudós
Piontek, J., Fritzsche, S., Cording, J., Richter, S., Hartwig, J., Walter, M., et al. (2011). A heteropolimer szoros csatlakozási szálak molekuláris szerveződésének elveinek tisztázása. Cell Mol. Élet Sci. 68, 3903–3918. doi: 10.1007 / s00018-011-0680-z
PubMed absztrakt / CrossRef teljes szöveg / Google Scholar
Piontek, J., Winkler, L., Wolburg, H., Muller, S. L., Zuleger, N., Piehl, C., et al. (2008). Szoros csomópont kialakulása: a klasszikus claudinok közötti homofil kölcsönhatás meghatározói. FASEB J. 22, 146-158. doi: 10.1096 / fj.07-8319com
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Radloff, J., Cornelius, V., Markov, A. G. és Amasheh, S. (2019). A Caprate modulálja a bél gátfunkcióját a sertés Peyer tapasz follikulushoz kapcsolódó hámjában. Int. J. Mol. Sci. 20:1418. doi: 10.3390 / ijms20061418
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Reinhold, A. K. és Rittner, H. L. (2017). Barrier funkció a perifériás és központi idegrendszerben-áttekintés. Pflug. Arch. Eur. J. Phys. 469, 123–134. doi: 10.1007/s00424-016-1920-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Resnick, M. B., Gavilanez, M., Newton, E., Konkin, T., Bhattacharya, B., Britt, D. E., et al. (2005). Claudin expression in gastric adenocarcinomas: a tissue microarray study with prognostic correlation. Hum. Pathol. 36, 886–892. doi: 10.1016/j.humpath.2005.05.019
PubMed Abstract | CrossRef Full Text | Google Scholar
Rossa, J., Ploeger, C., Vorreiter, F., Saleh, T., Protze, J., Gunzel, D., et al. (2014). A Claudin-3 és Claudin-5 fehérje hajtogatását és a szoros csomópontba való összeszerelését a transzmembrán 3 (TM3) és az extracelluláris hurok 2 (ECL2) szegmensekben lévő nem konzervált maradékok szabályozzák. J. Biol. Kémia. 289, 7641–7653. doi: 10.1074 / jbc.m113. 531012
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Session, A. M., Uno, Y., Kwon, T., Hapman, J. A. C., Toyoda, A., Takahashi, S., et al. (2016). Genom evolúció az allotetraploid béka Xenopus laevis – ben. Természet 538, 336-343.
Google Scholar
Soini, Y. (2011). Claudins tüdőbetegségekben. Ill. Réz. 12:70.
Google Scholar
Szuzuki, H., Nisizava, T., Tani, K., Jamazaki, Y., Tamura, A., Ishitani, R., et al. (2014). A claudin kristályszerkezete betekintést nyújt a szoros csomópontok architektúrájába. Tudomány 344, 304-307. doi: 10.1126 / tudomány.1248571
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Tammaro, P., Shimomura, K. és Proks, P. (2009). “Xenopus oocyták, mint heterológ expressziós rendszer ioncsatornák tanulmányozására patch-clamp technikával” a Káliumcsatornákban: módszerek és protokollok, Szerk. J. D. Lippiat (Totowa, NJ: Humana Press), 127-139.
Google Scholar
B., B., Mankertz, J., Schwarz, C., Amasheh, S., Fromm, M., Assaf, C., et al. (2002). Tight junction fehérjék: az integrál membránfehérjék új osztálya-expresszió az emberi epidermiszben és a HaCaT keratinocitákban. Arch Dermatol. Res. 294, 14-18. doi: 10.1007 / s00403-001-0290-y
PubMed absztrakt / CrossRef teljes szöveg / Google Scholar
Tomita, M., Hayashi, M. és Awazu, S. (1995). A nátrium-kaprát és a dekanoil-karnitin felszívódást fokozó mechanizmusa a Caco-2 sejtekben. J. Pharmacol. Felh. Ott. 272, 739–743.
Google Scholar
Turner, J. R. (2000). ‘A szorítás’ a szoros csomóponton: a citoszkeletális szabályozás megértése. Semin. Cell Dev. Biol. 11, 301–308. doi: 10.1006 / scdb.2000.0180
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
van Itallie, C. M. és Anderson, J. M. (2006). Claudinok és epithelialis paracelluláris transzport. Annu. Physiol Tiszteletes. 68, 403–429. doi: 10.1146 / annurev.physiol.68.040104.131404
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Vedula, S. R. K., Lim, T. S., Kausalya, P. J., Lane, E. B., Rajagopal, G., Hunziker, W., et al. (2009). Az integrált szoros csomópont fehérjék által közvetített erők számszerűsítése a sejt-sejt adhézióban. Exper. Mech. 49, 3–9. doi: 10.1007/s11340-007-9113-1
CrossRef Full Text | Google Scholar
Vitzthum, C., Stein, L., Brunner, N., Knittel, R., Fallier-Becker, P., and Amasheh, S. (2019). Xenopus oocytes as a heterologous expression system for analysis of tight junction proteins. FASEB J. 33, 5312–5319. doi: 10.1096/fj.201801451rr
PubMed Abstract | CrossRef Full Text | Google Scholar
Wilcox, E. R., Burton, Q. L., Naz, S., Riazuddin, S., Smith, T. N., Ploplis, B., et al. (2001). A claudin-14 szoros csomópontot kódoló gén mutációi autoszomális recesszív süketséget okoznak DFNB29. 104-es cella, 165-172. doi: 10.1016 / s0092-8674(01)00200-8
CrossRef teljes szöveg / Google Tudós
E. A., A., A., A., A., A., A., A., A., A., A., A., A., A., A., A., A., A., A., A., A., A., A., A., A., A., A., A., A., A., A.. (2003). A claudin – 3 lokalizációja a vér-agy gát szoros csomópontjaiban szelektíven elveszett a kísérleti autoimmun encephalomyelitis és a humán Glioblastoma multiforme során. Acta Neuropathol. 105, 586–592. doi: 10.1007 / s00401-003-0688-z
PubMed absztrakt / CrossRef teljes szöveg / Google Scholar
Wylie, C. C., Brown, D., Godsave, S. F., Quarmby, J. és Heasman, J. (1985). A Xenopus petesejtek citoszkeletonja és szerepe a fejlődésben. J. Embriol. Felh. Morph. 89, 1–15.
Google Tudós