az 1-es típusú humán immundeficiencia vírus (HIV-1) okozta morbiditás és mortalitás drámai csökkenése ellenére a proteázgátlók felfedezését és a kombinált, nagyon aktív antiretrovirális (ARV) terápia megjelenését követően az 1990-es évek közepén sok beteg még mindig nem kezelte a terápiát rezisztencia és/vagy intolerancia miatt (1). Egyértelmű volt, hogy több ARV-re van szükség, amelyek a vírus életciklusának különböző lépéseire hatnak, rezisztens vírusokkal szemben aktívak és jobban tolerálhatók. A CCR5 és CXCR4 kemokin receptorok HIV-1-ben betöltött kulcsszerepének bemutatása felkeltette az érdeklődést ebben a folyamatban, mint új ARV célpont (2, 3). A CCR5 a HIV-1 törzsek többségének társreceptora, ezeket a vírusokat CCR5 tropicnak (R5) nevezik. A CXCR4-et használó vírustörzseket CXCR4-trópusnak (X4) nevezzük, míg a mindkét receptort használó törzsek kettős trópusúak (4). A betegből származó vírus gyakran tartalmazhat R5, X4 és kettős tropikus törzsek keverékeit, amelyeket együttesen CXCR4-nek neveznek.
a CCR5 kulcsszerepe a HIV-1 bejegyzésben, párosulva azzal a demonstrációval, hogy azok az egyének, akik homozigóták voltak a 32 bázispár delécióra a CCR5 génben (CCR5 632), és ezt követően nem expresszálják a funkcionális CCR5-et, erősen védettek voltak az R5 HIV-1 fertőzéssel szemben, a figyelmet a CCR5-re, mint vonzó célpontra összpontosították (5). Bár néhány tanulmány kimutatta a CCR5 632 mutáció finom hatásait az immunrendszer működésére, például csökkent gyulladásos pontszámokat hepatitis C-fertőzött egyéneknél és a hepatitis B-ből való felépülést heterozigótákban; míg a homozigóták hajlamosabbak a kullancs által okozott encephalitisre és a súlyos Nyugat-Nílusi vírusbetegségre, ezek az egyének kevés nyilvánvaló káros hatást gyakorolnak egészségükre (5, 6). Ez, valamint az a tény, hogy a G-fehérjéhez kapcsolt receptor szupercsalád tagjai gyakran képesek hatékony, szelektív és orálisan biológiailag hozzáférhető gyógyszerek kifejlesztésére (7), vezetett a CCR5 ligandumfelfedezési programok elindításához több csoport, köztük a Pfizer Global Research and Development csapata, amely az Egyesült Királyság Sandwich laboratories-ban található.
a Maravirokot (UK-427 857, MVC) a Pfizer compound library nagy áteresztőképességű szűrésével fedezték fel kemokin radioligand-kötő teszt alkalmazásával. A szűrési folyamat legígéretesebb vegyületét a receptor elleni hatékonyságra, az antivirális aktivitásra, a farmakokinetikai jellemzőkre és az emberi sejtes célpontokkal szembeni szelektivitásra optimalizálták egy nagy gyógyászati kémiai erőfeszítéssel, amelyben közel 1000 molekulát jellemeztek (7). Az MVC a CCR5 transzmembránzsebében kötődik, és lassú eltolódású funkcionális antagonista, amely megakadályozza az internalizációt (7, 8). Hatékony antivirális aktivitással rendelkezik a HIV-1 izolátumok széles skálájával szemben (7). Kiváló preklinikai biztonságossági profiljával és elfogadható farmakokinetikájával együtt ez azt eredményezte, hogy 2000 decemberében klinikai jelöltként jelölték (7).
mindig egyértelmű volt, hogy a CCR5 antagonisták klinikai fejlesztése kihívást jelent, mivel ezek lennének az első gazdaszervezet által célzott ARV gyógyszerek, ezért feltérképezetlen területre merészkedtünk. Annak érdekében, hogy megelőzzék a kulcsfontosságú kérdéseket, nem sokkal a discovery program kezdete után létrehoztak egy klinikai fejlesztőcsapatot, engem pedig felvettek a korai fejlesztőcsapat vezetésére, 1999 februárjában csatlakoztam a Pfizerhez. Számos kulcsfontosságú kihívást azonosítottunk a klinikai program megtervezése során, a biztonságosság és a hatékonyság bizonyítása mellett. Ezek közül az első az volt, hogy nem volt kereskedelmi forgalomban kapható, klinikailag validált vizsgálat az R5 HIV-1-vel fertőzött betegek azonosítására. Ez kritikus volt, mivel az MVC csak az R5 HIV-1 törzsek ellen aktív (7). Másodszor, a CCR5-ben szenvedő egyének látszólag egészséges fenotípusa ellenére (5, 6) továbbra is aggályok merültek fel a CCR5 antagonisták hosszú távú expozíciójának biztonságosságával kapcsolatban, mivel a CCR5 blokkolása eltérhet a CCR5 receptor veleszületett hiányától, ahol az immunrendszer a CCR5 hiányában érett, és kompenzációs mechanizmusok alakulhattak ki. Végül a HIV-1 fertőzött egyénekben a CXCR4-et használó HIV-1 törzsek incidenciája a betegség progressziójával és a CD4 sejtszám csökkenésével növekszik (9), bár nem mutattak ki ok-okozati összefüggést a CXCR4-et használó vírus és a CD4-sejtdepléció között. Ez aggodalomra ad okot, hogy a CCR5 antagonista szelektív nyomása a víruspopulációt a CXCR4 használatára késztetheti, és CD4 sejtcsökkenést eredményezhet.
az egészséges önkénteseken 2001-ben és 2002 első felében végzett 1.fázisú, egyszeri és többszöri dózisú vizsgálatok azt mutatták, hogy az MVC biztonságos és jól tolerálható a naponta kétszer 300 mg-ig terjedő többszöri dózisokban, farmakokinetikai profilja kompatibilis a napi egyszeri (QD) vagy kétszeri orális adagolással, kombinálható más ARV-kkel, és hogy a naponta kétszer 100 mg-os dózisok in vitro az antivirális IC90 mértani átlagát meghaladó expozíciót eredményeztek (7, 10). A farmakológia bizonyításának igazolására a CCR5 receptor telítettségét egy testre szabott ex vivo MIP-1-vel mértük. Dózisfüggő telítettséget mutattak ki, napi egyszeri 25 mg-os dózisokkal, amelyek közel maximális telítettségi szintet eredményeznek, felvetve annak érdekes lehetőségét, hogy az MVC hatékony lehet akár napi 25 mg-os dózisokban is. A Receptor telítettség az adagolás abbahagyása után néhány napig magas maradt, ami a receptor in vivo lassú eltolódását tükrözi (11).
mindketten izgatottak és bátorítottak minket az 1. fázis adatai, és gyorsan továbbléptünk a 2A. fázisú proof of concept programra. A HIV-1 fertőzött betegeket csak az R5 vírus jelenlétére szűrték, egy új fenotípusos tropism assay alkalmazásával (Trofile 6, Monogram Biosciences, South San Francisco, CA, USA), és MVC-t kaptak monoterápiában 10 napig (12). Ebben a vizsgálatban a CCR5 receptor telítettséget mértük annak értékelésére, hogy lehetséges-e ezt biomarkerként használni a hatékonyság és a terápiás monitorozás szempontjából. A várva várt adatok megfeleltek a várakozásainknak, és azt mutatták, hogy a napi kétszeri 100 mg-os dózisok átlagosan a HIV-1 RNS >1-es maximális csökkenését eredményezték.5log10 (1a. ábra), minden beteg esetében, kivéve egy olyan x4 vírussal rendelkező beteget, akit tévesen vettek be, a HIV-1 RNS redukciója legalább 1log10 (12). Ez bizalmat adott nekünk abban, hogy a vizsgálat helyesen azonosította azokat a betegeket, akik valószínűleg reagálnak az MVC-re. A HIV – 1 RNS mélypontja 1-5 nappal az MVC utolsó dózisa után következett be, összhangban az elhúzódó receptor telítettséggel, amint azt az 1.fázisú vizsgálatok kimutatták (12). A 25 mg QD-receptor telítettség kivételével minden dózisnál >80% – os telítettséget figyeltek meg az adagolás teljes időtartama alatt. Azonban nem volt összefüggés a vírusterhelés csökkenése és a receptor telítettség mértéke között. A legvalószínűbb magyarázat erre az, hogy a vírusellenes hatásossághoz nagyon magas receptor telítettség szükséges, és a vizsgálat inherens variabilitása nem teszi lehetővé a differenciálódást ilyen mértékben (11, 12).
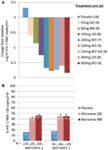
1. ábra. A maravirok proof of concept és a 3. fázisú hatásossági eredmények. (A) A HIV-1 RNS kiindulási értékhez viszonyított átlagos maximális változása MVC monoterápiában részesülő betegeknél. Az 1. fázis adatai, valamint a modellezés és szimuláció alapján napi 25 mg-tól napi kétszer 300 mg-ig terjedő dózisokat választottak ki (beleértve a napi kétszer 150 mg-ot és éhgyomorra). A HIV-1 RNS-t, a biztonságosságot és az MVC farmakokinetikáját értékelték (12). (B) motiválni 1 és 2 – a HIV-1 RNS <50 kópia/mL-t elérő betegek aránya a 48.héten. HIV-1 fertőzött, R5 HIV-1 és hármas osztályú tapasztalattal és/vagy rezisztenciával rendelkező betegeket randomizáltak MVC QD vagy BID vagy placebo kezelésre, optimalizált háttér antiretrovirális kezeléssel (OBT) kombinálva. P < 0.001 (13, 14).
a 2A fázisú adatok izgalmat keltettek az egész vállalatban, és szívesen haladtunk a klinikai fejlesztési program a lehető leggyorsabban, mivel nagy volt az orvosi igény új ARV-kre a nem vagy korlátozott kezelési lehetőségekkel rendelkező betegek kezelésére. A kiterjedt 1. fázisú program (beleértve a több gyógyszer-gyógyszer interakciós vizsgálatot is) és a koncepcióvizsgálatok 2A.fázisában értékelt széles dózistartomány, modellezéssel és szimulációval együtt nagyon jól megértettük az MVC valószínűleg hatékony dózisát más ARV-kkel kombinálva. Ezért képesek voltunk egyenesen áttérni a 3. fázisú hatékonysági vizsgálatokra, amelyek az MVC-t 300 mg-os (vagy azzal egyenértékű, az egyidejűleg alkalmazott gyógyszerektől függően) QD-vel és BID-vel értékelték, anélkül, hogy önálló 2B fázisú dózis-tartományú vizsgálatokat kellett volna végezni, ezáltal jelentősen lerövidítve a fejlesztési ütemtervet. 2004 végén négy nagy tanulmányt indítottunk; MOTIVATE 1 és 2 R5 HIV-1-ben (13, 14), MERIT-ben (3.fázisú vizsgálat 2B. fázisú roll-in-nel) R5 HIV-1-ben (15) szenvedő, na 6B-ben szenvedő betegeknél, és a4001029 vizsgálatban, egy 2B. fázisú biztonságossági vizsgálatban, nem CCR5 tropikus vírussal (CXCR4-et használó vagy nem fenotípusos vírussal) korábban már kezelt betegeknél (16).
ez hatalmas vállalkozás volt, 4794 beteget szűrtek több mint 200 helyszínen az Egyesült Államokban, Kanadában, Európában, Ausztráliában, Dél-Afrikában, Mexikóban és Argentínában. Két másik kis molekulájú CCR5 antagonistát (aplavirok és vicriviroc) szintén értékeltek a fázis 2B vizsgálatokban ebben az időben (17, 18). A nagy klinikai vizsgálatok kezelésének szokásos kihívásai mellett két görbe labdát dobtak nekünk, ezek közül az első az aplavirok abbahagyása volt az idioszinkratikus hepatotoxicitás miatt. Volt spekuláció, hogy ez a CCR5 antagonisták osztályhatása lehet, mivel a CCR5 kiütéses egerek hajlamosabbak a concanavalin-a által közvetített hepatoxicitásra (17). Ezenkívül a MERIT vizsgálatban egy betegnél súlyos hepatotoxicitás alakult ki. Az adatok arra utaltak, hogy valószínűleg az izoniazidhoz vagy a kotrimoxazolhoz kapcsolódott, de az MVC hozzájáruló szerepe nem zárható ki (15). Az MVC hepatotoxicitására utaló bizonyítékok és az esetleges jelekre való magas szintű éberség tekintetében az összes adat mélyreható vizsgálata nem talált bizonyítékot a májenzimek szisztematikus növekedésére vagy a hepatotoxicitás egyéb markereire. Röviddel ezután aggályok merültek fel bizonyos rosszindulatú daganatok potenciális megnövekedett kockázatával kapcsolatban, miután négy vicriviroc-ot kapó betegnél lymphoma jelentkezett az ACTG5211 vizsgálatban (18). Kezdetben aggályok merültek fel azzal kapcsolatban, hogy ez a CCR5 antagonisták immunmoduláló potenciálján alapuló osztályhatás lehet, de más vicriviroc-vizsgálatok adatainak áttekintése, valamint a folyamatban lévő MVC-vizsgálatok nem támasztották alá ezt az elméletet (18).
a MOTIVATE 1 és 2, valamint az A4001029 adatai A MERIT adatai előtt álltak rendelkezésre, mivel a vizsgálat időtartama jellemzően rövidebb a korábban már kezelt betegeken végzett vizsgálatok esetében. Nagy izgalommal vártuk a 24. hét időközi elemzését a MOTIVATE vizsgálatokhoz 2006 októberében, és örömmel láttuk, hogy szignifikánsan több MVC-t kapó betegnél volt HIV-1 RNS <50 kópia/mL (a hatékonyság legfontosabb markere) a placebo OBT-t kapókhoz képest. Ezt megerősítették a 48. heti adatok, amelyek a válasz tartósságát igazolták (1b.ábra) (13, 14). Ezzel szemben a nem CCR5 tropikus HIV-1-ben szenvedő betegek, akik MVC-t kaptak az A4001029-ben, nem tűntek szignifikáns virológiai előnynek a placebóhoz képest (16). A biztonságossági adatok elemzése nem vetett fel jelentős aggályokat. Pontosabban, nem volt bizonyíték az immunfunkcióra gyakorolt káros hatásra, az MVC-vel kezelt betegeknél nem nőtt a fertőzés vagy a rosszindulatú daganatok epizódjai. A vírus tropizmusának értékelése kudarc esetén azt mutatta, hogy az MVC-terápiában nem részesülő betegek >50%-ánál volt CXCR4-t használó vírus kudarc esetén, de nem volt bizonyíték a CD4 sejtszámra gyakorolt káros hatásra (14). A virológiai vizsgálat kimutatta, hogy a CXCR4-et használó vírus, amely MVC szelektív nyomás alatt jelent meg, egy már létező kisebbségi populációból származott, és nem jelent meg de novo (19). Összességében ezek az eredmények egyértelműen megmutatták az MVC előnyeit az R5 HIV-1 kezelésben már részesült betegek kezelésében. A csoport legnagyobb erőfeszítése azt eredményezte, hogy mind az USA-ban, mind Európában csak 2 hónappal az időközi adatok rendelkezésre állása után nyújtották be a dokumentációkat nyilvántartásba vétel céljából. Az MVC (BID 300 mg) 2007 augusztusában kapott jóváhagyást (más ARV-kkel kombinálva) az USA-ban, csak 6.5 évvel azután, hogy kinevezték a klinikai fejlesztés jelöltjévé. Egy hónappal később az EU-ban ezt a populációt is engedélyezték.
A MERIT vizsgálat 48.heti elemzése csalódást okozott, mivel az MVC plusz zidovudin/lamivudin (HIV-1 RNS <50 kópia/mL, 65, 3%) nem felelt meg az efavirenz plusz zidovudin/lamivudin (HIV-1 RNS <50 kópia/mL) nem-inferioritására vonatkozó előre meghatározott kritériumoknak (az 1 oldalas 97, 5 konfidencia intervallum alsó határa -10% alatt), 69, 3%) (15). A vizsgálatban részt vevő betegeket azonban az eredeti Trofile assay alkalmazásával R5 vírusra szűrtük. Ez a vizsgálat időközben javult, hogy érzékenyebb legyen a CXCR4-et használó vírus kisebbségi populációinak kimutatására. Ezt követően az érdemben kezelt betegek összes szűrőmintáját újra megvizsgálták az enhanced assay segítségével, és egy post hoc analízist végeztek, amelyben csak azokat a betegeket vonták be, akiknél az R5 vírus csak az érzékenyebb assay segítségével volt jelen. Ebben az elemzésben az MVC és az efavirenz válaszaránya 68,3%, illetve 68,5% volt, a 97,5% – os konfidencia intervallum alsó határa -10% felett volt (15). Ezen adatok alapján az MVC-t 2009 novemberében az Egyesült Államok Food and Drug Administration is jóváhagyta a kezelés NA-ban szenvedő betegeknél.
az MVC nemcsak értékes kiegészítőnek bizonyult az egyre növekvő ARV kábítószer-fegyverzethez, de ezeknek a tanulmányoknak az adatai javították a HIV tropizmusának és a tropizmus és a betegség progressziója közötti kapcsolat megértését. Nekem személy szerint ez az időszak nagy izgalmat és elégedettséget jelentett mind orvosként, mind tudósként.
szerzői hozzájárulások
ER ezt a kéziratot az MVC fejlesztői csapatának tagjaként szerzett személyes tapasztalatai alapján készítette. Az összes adatot másutt teljes egészében közzétették. Minden vizsgálatot a Helsinki Nyilatkozat elveivel, valamint a helyes klinikai gyakorlat harmonizációjáról szóló Nemzetközi Konferencia iránymutatásaival, valamint a helyi szabályozási és jogi követelményekkel összhangban végeztek. Minden vizsgálatot független etikai bizottságok hagytak jóvá, és minden beteg írásos beleegyezését adta.
összeférhetetlenségi nyilatkozat
Elna Van Der Ryst az MVC kifejlesztésekor a Pfizer Global Research and development alkalmazottja volt. Jelenleg tanácsadási szolgáltatásokat nyújt a Pfizer számára.
Köszönetnyilvánítás
szeretnék köszönetet mondani a Pfizer munkatársainak, akik hozzájárultak az MVC felfedezési és fejlesztési programjához, valamint azoknak a kutatóknak és betegeknek, akik részt vettek a klinikai vizsgálatokban.
1. E-mail cím:
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg / Google Tudós
2. Dragic T, Litwin V, Allaway GP, Martin SR, Huang Y, Nagashima KA és mtsai. A HIV-1 belépését a CD4+ sejtekbe a CC-CKR-5 kemokin receptor közvetíti. Természet (1996) 381:667-73. doi:10.1038/381667a0
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg / Google Tudós
3. Feng Y, Broder CC, Kennedy PE, Berger EA. HIV-1 belépési kofaktor: hét transzmembrán, G fehérjéhez kapcsolt receptor funkcionális cDNS-klónozása. Tudomány (1996) 272: 872-7. doi: 10.1126 / tudomány.272.5263.872
CrossRef Teljes Szöveg / Google Scholar
4. Berger EA, Doms RW, feny Kb, Korber BT, Littman DR, Moore JP és mtsai. A HIV-1 új osztályozása. Természet (1998) 391:240. doi:10.1038/34571
CrossRef teljes szöveg / Google Tudós
5. Samson M, Libert F, Doranz BJ, Rucker J, Liesnard C, Farber C és mtsai. A HIV-1 fertőzéssel szembeni rezisztencia kaukázusi egyénekben, amelyek a CCR5 kemokin receptor gén mutáns alléljait hordozzák. Természet (1996) 382:722-5. doi:10.1038/382722a0
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg / Google Tudós
6. Gilliam BL, Riedel DJ, Redfield RR. CCR5 inhibitorok klinikai alkalmazása HIV-ben és azon túl. J Transl Med (2011) 9(1.Kiegészítő): S9. doi: 10.1186 / 1479-5876-9-S1-S9
Pubmed absztrakt | Pubmed teljes szöveg | CrossRef teljes szöveg / Google Tudós
7. Dorr P, Westby M, Dobbs S, Griffin P, Irvine B, Macartney M és mtsai. Maravirok (UK-427,857), a CCR5 kemokin receptor hatékony, orálisan biológiailag hozzáférhető és szelektív kis molekulájú inhibitora, széles spektrumú anti-humán immundeficiencia vírus 1 típusú aktivitással. Antimikrobás Szerek Chemother (2005) 49:4721-32. doi: 10.1128 / AAC.49.11.4721-4732.2005
CrossRef Teljes Szöveg / Google Scholar
8. Dr. J. Csang, Ji C., Mirzadegan T., Rotstein D., Sankuratri S. és mtsai. A CCR5 molekuláris kölcsönhatásai a kis molekulájú anti-HIV-1 CCR5 antagonisták fő osztályaival. Mol Pharmacol (2008) 73:789-800. doi:10.1124 / mol.107.042101
Pubmed Absztrakt / Pubmed Teljes Szöveg / CrossRef Teljes Szöveg / Google Tudós
9. Berger EA, Murphy PM, Farber JM. A kemokin receptorok mint HIV-1 társreceptorok: szerepek a vírus bejutásában, a tropizmusban és a betegségben. Annu Rev Immunol (1999) 17:657-700. doi: 10.1146 / annurev.immunol.17.1.657
Pubmed Absztrakt / Pubmed Teljes Szöveg / CrossRef Teljes Szöveg / Google Tudós
10. Abel S, van der Ryst E, Rosario MC, I. Jakab, Ridgway C, Medhurst C és mtsai. A maravirok, egy új CCR5 antagonista farmakokinetikájának, biztonságosságának és tolerálhatóságának értékelése egészséges önkéntesekben. Br J Clin Pharmacol (2008) 65(S1): 5-18. doi:10.1111 / j. 1365-2125.2008. 03130.x
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg / Google Tudós
11. Rosario MC, Jacqmin P, Dorr P, I. Jakab, Jenkins T, Abel S és mtsai. A maravirok CCR5 receptor megszállottságának farmakokinetikai-farmakodinámiás elemzése egészséges önkéntesekben és HIV-pozitív betegekben. Br J Clin Pharmacol (2008) 65(S1): 86-94. doi:10.1111 / j. 1365-2125.2008. 03140.x
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg / Google Tudós
12. Fätkenheuer G, Pozniak AL, Johnson MA, Plettenberg Egy, Staszewski S, Hoepelman CÉLJA, et al. A rövid távú monoterápia hatékonysága maravirokkal, egy új CCR5 antagonistával HIV-1-fertőzött betegeknél. Nat Med (2005) 11:1170-2. doi: 10.1038 / nm1319
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg / Google Tudós
13. Gulick RM, Lalezari J, Goodrich J, Clumeck N, DeJesus E, Horban A, et al. Maravirok korábban R5 HIV-1 fertőzésben szenvedő betegeknél. N Engl J Med (2008) 359:1429-41. doi: 10.1056 | NEJMoa0803152
CrossRef teljes szöveg / Google Scholar
14. E. O. O., Nelson M., Lazzarin A., Konourina I., Hoepelman IM, Lampiris H., et al. A maravirok alcsoport analízise korábban kezelt R5 HIV-1 fertőzésben. N Engl J Med (2008) 359:1442-55. doi: 10.1056 / NEJMoa0803154
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg / Google Tudós
15. Cooper DA, Heera J, Goodrich J, Tawadrous M, Saag M, DeJesus E, et al. Maravirok versus efavirenz, mindkettő zidovudinnal / lamivudinnal kombinálva, a CCR5-tropikus HIV-1-ben szenvedő antiretrovirális na-val rendelkező betegek kezelésére. J Fertőz Dis (2010) 201: 803-13. doi:10.1086/650697
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg / Google Tudós
16. Saag M, Goodrich J, F Dzctkenheuer G, Clotet B, Clumeck N, Sullivan J és mtsai. A maravirok kettős-vak, placebo-kontrollos vizsgálata nem CCR5-tropikus HIV-1-gyel fertőzött, korábban már kezelt betegeken: 24 hetes eredmények. J Fertőz Dis (2009) 11:1638-47. doi:10.1086/598965
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg / Google Tudós
17. Nichols WG, acél HM, Bonny T, Adkison K, Curtis L, Millard J, et al. Az aplavirokkal végzett klinikai vizsgálatokban megfigyelt hepatotoxicitás (GW873140). Antimikrobás Szerek Chemother (2008) 52:858-65. doi: 10.1128 / AAC.00821-07
Pubmed Absztrakt / Pubmed Teljes Szöveg / CrossRef Teljes Szöveg / Google Tudós
18. Tsibris AM, Paredes R, Chadburn A, Su Z, Henrich TJ, Krambrink A és mtsai. Lymphoma diagnózis és plazma Epstein-Barr vírusterhelés a vicriviroc terápia során: az AIDS klinikai vizsgálati csoport a5211 eredményei. Clin Megfertőzi A Dis-T (2009) 48:642-9. doi:10.1086/597007
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg / Google Tudós
19. Lewis M, Simpson P, Fransen S, Huang W, Whitcomb J, Mosley M és mtsai. A III. fázisú MOTIVATE 1 és 2 vizsgálatokban maravirok-kezelésben részesülő betegeknél kimutatott CXCR4-használó vírus a CXCR4-et használó vírus már meglévő kisebbségéből származik. Vírusirtó (2007) 12:S65.
Google Scholar