- Bevezetés
- a ChREBP szerkezete és szabályozása a LID/Grace Doméneken keresztül
- a ChREBP aktiválása glükóz metabolitok által
- ChREBP társfaktorok és partnerek
- a ChREBP szerepe a szénhidrát anyagcserében és a Hepatokin termelésben
- a ChREBP a Májzsírsavszintézis és a VLDL szekréció szabályozójaként
- a fruktóz metabolizmusának szabályozása a májban és a bélben
- a BDK szabályozása:PPM1K tengely a májban
- ChREBP szükséges az FGF21 glükóz által közvetített szabályozásához
- a ChREBP szerepe az energia homeosztázist szabályozó szervek közötti hálózatban
- a máj ChREBP szerepe az inzulinérzékenységi egyensúly szabályozásában
- a zsírszövet ChREBP összekapcsolja a lipogenezist az inzulinérzékenységgel
- új kölcsönhatás a hormonérzékeny lipáz és a ChREBP között a zsírszövetben
- következtetés és jövőbeli irányok
- szerzői hozzájárulások
- finanszírozás
- összeférhetetlenségi nyilatkozat
Bevezetés
az egyszerű cukrok, például a szacharóz és a magas fruktóztartalmú kukoricaszirup fogyasztása az utóbbi években az anyagcsere-betegségek, például az elhízás, a diszlipidémia, a 2-es típusú cukorbetegség és / vagy a nem alkoholos zsírmájbetegség (NAFLD) fokozott kockázatához vezetett. A máj a fő szerv, amely felelős a felesleges étrendi szénhidrátok zsírrá történő átalakításáért. A kapott trigliceridek (TG) nagyon alacsony sűrűségű lipoproteinekbe (VLDL) csomagolhatók, vagy kiválasztódhatnak a keringésbe, lipidcseppekként tárolhatók, vagy a béta-oxidációs úton metabolizálódhatnak. Az emelkedett vércukorszintre adott válaszként szekretált inzulin stimulálja a De novo zsírsavszintézis (lipogenezis) génjeinek expresszióját a transzkripciós faktor szterin szabályozó elem kötő fehérje-1C (SREBP-1C) révén (Foretz et al., 1999). Az SREBP-1C szinergiában hat egy másik transzkripciós faktorral, az úgynevezett szénhidrát-válaszelem-kötő fehérjével (ChREBP), amely közvetíti az étrendi szénhidrátokra adott választ. A ChREBP fehérje szerkezete tartalmaz egy alacsony glükóz gátló domént (LID) és egy glükóz-válasz aktiváló konzervált elemet (GRACE), amely az N-terminálisában található (Li et al., 2006). A GRACE domén glükóz metabolitok általi aktiválása elősegíti a ChREBP transzkripciós aktivitását, és kötődik egy erősen konzervált szekvenciához, az úgynevezett szénhidrát válasz elemhez (ChoRE). A ChoRE jelen van a ChREBP célgének promoterein, amelyek a De novo lipogenezis kulcsfontosságú enzimeit kódolják, beleértve az L-piruvát-kinázt (L-pk), a glikolízis sebességkorlátozó enzimjét, a zsírsav-szintázt (Fas), az acetil-CoA karboxilázt (Acc) és a sztearoil-CoA deszaturázt (Scd1) (Kawaguchi et al., 2001). Egy nemrégiben készült tanulmány beszámolt a ChREBP (glükóz által aktivált) és az SREBP-1C (inzulin által aktivált) közötti kölcsönös függőségről a glikolitikus és lipogén génexpresszió teljes indukciójára a májban (Linden et al., 2018). A SREBP-1C nukleáris aktív formájának vírusos helyreállítása a májban ChREBP-hiányos egerek (ChREBPKO) normalizálta a lipogén génexpressziót, miközben nincs hatása a glikolitikus génexpresszió megmentésére. A tükörkísérlet, amelyben a ChREBP expressziót indukálták a SREBP-1C kiütéses egerek májában, megmentette a glikolitikus génexpressziót, de meglepő módon nem lipogén génexpressziót, annak ellenére, hogy a ChREBP jól ismert szerepet játszott a zsírsavszintézis gének szabályozásában. Mindazonáltal ez a tanulmány azt sugallja, hogy a ChREBP és az SREBP-1C kettős hatása fontos a zsírsavszintézis szabályozásában részt vevő kontroll génekben (Linden et al., 2018).
a ChREBP nagymértékben dúsul a májban, és a lipid metabolizmus fő szabályozójaként vizsgálták (Iizuka et al., 2004; Osorio et al., 2016). A ChREBP szignifikánsan expresszálódik a hasnyálmirigy-szigeteken, a vékonybélben, a vázizomban és kisebb mértékben a vesében és az agyban (lásd Richards et al., 2017 felülvizsgálatra). Érdekes módon a ChREBP egy másik izoformája, a ChREBP, amely egy alternatív első exon promoterből származik, először a zsírszövetben azonosították (Herman et al., 2012), majd később más sejttípusokban (lásd Abdul-Wahed et al., 2017 felülvizsgálatra). Amint megvitatjuk, a ChREBP-t a-ként írják le Konstitutívan aktív izoforma. Reméljük, hogy a jövőbeni munka foglalkozik majd a ChREBP és a ChREBP-nek a glükóz és lipid metabolizmus szabályozásában betöltött szerepével, valamint meghatározza azok specifikus és/vagy egymást átfedő céljait.
a ChREBP szerkezete és szabályozása a LID/Grace Doméneken keresztül
a ChREBP a bHLH/Zip transzkripciós faktorok Mondo családjába tartozik. Az N-terminális domén (1-251 maradék) két nukleáris export jelet (NES) és egy nukleáris lokalizációs jelet (NLS) tartalmaz, amelyek a szubcelluláris lokalizációt szabályozzák az 1.kromoszóma régió fenntartó 1 (CRM1) kölcsönhatásával, más néven exportin 1 és/vagy 14-3-3 fehérjékkel (Sakiyama et al., 2008). A C-terminális régió tartalmaz egy poliprolin domént, egy bHLH / LZ domént (660-737 maradék) és egy leucin cipzárszerű domént (Zip-szerű, 807-847 maradék), amelyek társfaktorokkal és DNS-kötéssel társulnak (Yamashita et al., 2001; Fukasawa et al., 2010; Ge et al., 2012). A ChREBP lokalizációját és transzkripciós aktivációját a tápanyagok rendelkezésre állása határozza meg. A ChREBP glükóz által közvetített szabályozása többnyire a glükózérzékelő modul (GSM) vagy a mondo konzervált régió (MCR) szintjén történik, amely a fedélből és a GRACE doménekből áll, amint azt a bevezetőben említettük (1a. ábra; Li et al., 2006; Singh and Irwin, 2016). 2012-ben Herman et al. (2012) leírt egy másik ChREBP izoformát, a ChREBP Xhamsteret, amelyet egy alternatív első exon promóter 1b-ről 2 exonra írnak át (1b ábra). Ez az átirat a 4. exonból származik, így egy rövidebb, 687 aminosavból álló fehérje jön létre (a teljes hosszúságú ChREBP izoforma, átnevezve) 664 aminosavat tartalmaz, amelyet a kéziratban ChREBP-nek neveznek), amelyből hiányzik a két NES, az NLS és a LID domén. A ChREBP a fehér zsírszövetben GLUT-4-függő módon nagyon aktív, és azt javasolják, hogy közvetlenül a ChREBPa szabályozza, mivel az exon promoter 1-ben egy házimunka-szekvenciát azonosítottak (Herman et al., 2012; 1b. ábra). A ChREBP szabályozása a Chrebpa által egy előremenő hurok létezésére utal, amely potenciálisan súlyosbítja a glükózra adott választ hiperglikémiás körülmények között. Ugyanakkor tisztázni kell a ChREBP-Izoform szabályozási mechanizmusát(mechanizmusait), és ami még fontosabb, sajátos funkcióját.
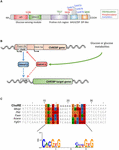
1. ábra. (A) a szénhidrát-válasz elem kötőfehérje szerkezete (ChREBPa). A ChREBPa 864 aminosavból áll, és számos szabályozó domént tartalmaz. Az N-terminálisban a fehérje egy glükózérzékelő modult tartalmaz, amely az alacsony glükóz gátló doménből (LID) és a glükóz aktivált konzervált elemből (GRACE) áll. A fehérje tartalmaz egy poliprolinban gazdag, egy bHLH / LZ és egy leucin-cipzárszerű (Zip-szerű) domént is, amely a C-terminálison helyezkedik el. A transzláció utáni módosításokat a megfelelő szermaradékok, a foszforiláció (piros), az acetilezés (kék) és a nemrégiben azonosított O-Glcnacilációk (zöld) jelzik. B) a ChREBP gén szerkezete, valamint a két ChREBP izoforma generálása, a kettő közül a kettő. A ChREBP-t egy alternatív első exon promoter 1b-ből írják át. ezt az átiratot a 4.exonból fordítják le, amely egy rövidebb, 687 aminosavból álló fehérjét hoz létre, amelyben hiányzik a két NES, az NLS és a LID domén. Azt javasolták, hogy a ChREBP-t a Chrebpa közvetlenül szabályozza, mivel az exon promoter 1b-ben egy házimunka-szekvenciát azonosítottak. jelenleg nem ismert, hogy mind a ChREBP-t, mind a xhamsteret izoformák kötődnek-e a Házimunkához. Ábra adaptálva Herman et al. (2012). (C) több összehangolása házimunka konszenzus szekvenciák bemutatja több ChREBP cél gén promoterek. A nukleotidok alapú igazítást az ábra tetején mutatjuk be a poungvarin et al. (2015). Az adott igazításhoz társított konszenzussorozatnak megfelelő logó szintén képviselteti magát.
a ChREBP aktiválása glükóz metabolitok által
éhgyomri körülmények között a protein-kináz a (PKA) glükagonfüggő aktiválása (Kawaguchi et al., 2002) foszforilálja a ChREBP-t a ser196 és Thr666 maradékokon, ami a ChREBP kötődéséhez vezet a 14-3-3 fehérjéhez és annak visszatartásához a citoszolban (Kawaguchi et al., 2001, 2002; Davies et al., 2008). AMP aktivált protein-kináz (AMPK), egy központi sejtenergia-érzékelő, szintén foszforilálja a ChREBP-t a ser568 maradékon, ami viszont csökkenti a ChREBP kötődését a célgének promótereihez (Kawaguchi et al., 2002; Sato et al., 2016). Kimutatták, hogy az éhezés során keletkező metabolitok, mint például az AMP és a zsírsav oxidációjából előállított ketontestek, alloszterikus gátló szerepet játszanak a ChREBP és a 14-3-3 fehérje affinitás megváltoztatásával, a komplex stabilizáció fokozásával és a citoszol retenció elősegítésével (Sakiyama et al., 2008; Nakagawa et al., 2013; Sato et al., 2016). A szénhidrátokra adott válaszként a ChREBP transzkripciós, transzlációs és poszttranszlációs szinten szabályozott. Az étkezés utáni megnövekedett glükózkoncentráció elősegíti a közbenső metabolitok, például a xilulóz-5-foszfát (X5P) szintézisét, amelyet eredetileg a fehérje foszfatáz 2A (PP2A) aktivátoraként javasoltak (Kawaguchi et al., 2001; Kabashima et al., 2003). Korábban leírták, hogy a PP2A defoszforilálja a ChREBP – t a Ser196 maradékon, lehetővé téve annak transzlokációját a magba, ahol tovább defoszforilálják X5P-és PP2A-függő módon (Thr666-on és Ser568-on). Ezt a modellt azonban az évek során megkérdőjelezték, és más metabolitokat, például glükóz-6-foszfátot (G6P) javasoltak a ChREBP transzlokáció/aktivitás potenciális aktivátorainak (Dentin et al., 2012). McFerrin et al. (2012) feltételezett motívumot azonosított a G6P kötéshez (253-SDTLFT-258) A GRACE doménen, amelyet szintén konzerváltak MondoA, a ChREBP/MondoB ortolog (lásd Richards et al., 2017 felülvizsgálatra). E hipotézis szerint a G6P elősegítheti az alloszterikus konformáció változását, amely nyílt konformációt indukál a ChREBP számára, megkönnyítve a Ko-faktorokkal való kölcsönhatást, majd az azt követő transzlokációt a magba (McFerrin et al., 2012).
a sejtmagban a ChREBP módosítható O-Glcnacilezéssel, amely a glükóz metabolizmusától függő poszttranszlációs módosítás, és amely fontos szerepet játszik a ChREBP transzkripciós aktivitásában (Guinez et al., 2010). Az O-Glcnaciláció a szerin és a treonin maradékokon az O-GlcNAc transzferáz (OGT) aktivitása révén történik, amely enzim N-acetil-glükózamin (GlcNAc) maradékokat ad a célfehérjékhez, ezáltal módosítva azok aktivitását, stabilitását és/vagy szubcelluláris elhelyezkedését. Yang et al. (2017) A közelmúltban számos ChREBP maradékot tárt fel, amelyeket o-Glcnacilezéssel módosítottak. Ezeknek a maradékanyagoknak a bHLH/ZIP, valamint a dimerizációs és citoplazmatikus lokalizációs domén (DCD) doméneken történő mutációi lehetővé tették a Thr517 és a Ser839 azonosítását, mint a ChREBP glükózfüggő aktiválásának lényeges helyét (1a.ábra). A ChREBP acetilezéssel is módosítható a P300 hiszton-acetil-transzferáz aktivitásán keresztül (Bricambert et al., 2010). A glükóz-aktivált p300 acetilezi a ChREBP-t a Lys672-en, és növeli annak transzkripciós aktivitását azáltal, hogy fokozza a toborzást a Házimunkaszekvenciába, amelynek optimális konszenzuskötési szekvenciája a CAYGYCnnnnnCRCRTG (1C ábra). Poungvarin et al. (2015) elemezte a ChREBP kötőhelyeket ChIP-seq-val az egerek májában és fehér zsírszövetében, amelyeket magas szénhidráttartalmú, zsírmentes étrenddel tápláltak. Beszámoltak arról, hogy a ChREBP kötődése gazdagodik az inzulin jelátvitelben, az adherens csomópontokban és a rákban, ami arra utal, hogy a ChREBP újszerű szerepet játszik a tumorigenesisben és a rák progressziójában. Továbbá egy nemrégiben készült tanulmány beszámolt a ChREBP fontosságáról a hepatocelluláris karcinómában (Hcc) (Ribback et al., 2017). A szerzők azt találták, hogy a ChREBP genetikai deléciója (ChREBPKO egerekben) csökkentette a hepatocarcinogenezist, amelyet a protein kináz B/Akt túlzott expressziója vezetett egerekben. Továbbá a ChREBP siRNS-mediált gátlása egér és / vagy humán HCC sejtekben csökkent proliferációt és apoptózist eredményezett.
ChREBP társfaktorok és partnerek
az elmúlt években számos társfaktort és/vagy partnert azonosítottak a ChREBP-ben (lásd Richards et al., 2017 felülvizsgálatra). Max mint protein x (Mlx), a bHLH/LZ transzkripciós faktor volt az első, amelyet a Mondo család közös kötő partnereként azonosítottak (Stoeckman et al., 2004). A ChREBP MLX-szel történő dimerizációja szükséges mind a glükózra adott nukleáris transzlokációhoz, mind a Házimunkaelemekhez való kötődéshez. A nukleáris receptorokat, mint például a hepatocyta 4-es faktor (hnf4a) és a farnesoid x receptor (FXR) szintén ChREBP partnerként írták le. A HNF4a fizikailag kölcsönhatásba lép a ChREBP-vel azáltal, hogy kötődik a közvetlen repeat-1 (DR-1) régióhoz a ChREBP célgének promoterén (Adamson et al., 2006; Meng et al., 2016). Ezenkívül kimutatták, hogy a p300/CBP transzkripciós koaktivátor fehérjék stabilizálják a ChREBP/HNF4a komplexet (Burke et al., 2009). A p300 / CBP transzkripciós koaktivátor fehérjék központi szerepet játszanak a transzkripciós apparátussal történő több jelfüggő esemény koordinálásában és integrálásában. A p300/CBP másik kulcsfontosságú tulajdonsága a hiszton-acetil-transzferáz (HAT) aktivitás jelenléte, amely a P300/CBP-t azzal a képességgel ruházza fel, hogy nukleoszomális hisztonok modulálásával befolyásolja a kromatin aktivitását. Humán hepatocitákban az FXR kötődik a ChREBP-HNF4a komplexhez kiváltja a ChREBP felszabadulását a CBP/p300-ból, ami a hiszton-dezacetiláz SMRT toborzásához vezet az Lpk promóteren, ezáltal a ChREBP transzkripciós aktivitásának társrepresszoraként működik (Caron et al., 2013). Ezenkívül a CBP / p300 HAT aktivitása módosítja a ChREBP-t A Lys 672-en, ami transzkripciós aktiválódásához vezet a glükózra adott válaszként (Bricambert et al., 2010).
Bricambert et al. (2018) nemrégiben azonosította a hiszton demetiláz növény homeodomain finger 2 (Phf2), amely a hiszton lizin demetiláz (KDM7) család, mint a ChREBP új társfaktora. A Phf2 és a ChREBP közötti kölcsönhatás fokozza a ChREBP transzkripciós aktivációját azáltal, hogy törli a célgének promoterén lévő h3k9 metilnyomokat. Érdekes módon a Phf2 és a ChREBP specifikus együttes toborzása a nukleáris faktor erythroid 2 like 2 (Nrf2) promóteréhez hozzájárul a phf2 védőhatásához a megnövekedett reaktív oxigénfajokkal (ROS) és a NAFLD progresszióval szemben a hiperglikémia összefüggésében (Bricambert et al., 2018).
a ChREBP szerepe a szénhidrát anyagcserében és a Hepatokin termelésben
a ChREBP a Májzsírsavszintézis és a VLDL szekréció szabályozójaként
az alkoholmentes zsírmájbetegség a metabolikus szindróma egyik jellemzője, és az embereken végzett vizsgálatok azt mutatják, hogy a De novo lipogenezis a NAFLD-ben szenvedő betegek összes májlipidjének körülbelül 25% – át teszi ki (Donnelly et al., 2005). Inzulinrezisztens állapotokban a hiperglikémia és a hiperinsulinémia részben a ChREBP és SREBP-1C aktiválása révén fokozza a lipogenezist. A ChREBP gátlása elhízott és inzulinrezisztens ob / ob egerek májában, RNSi vagy genetikai abláció révén a máj steatosisának megfordulásához vezet (Dentin et al., 2006; Iizuka et al., 2006). A VLDL máj általi megváltozott szekréciója szintén hozzájárul a NAFLD patogeneziséhez. A mikroszomális triglicerid transzfer fehérje (mttp) az apolipoprotein B-tartalmú lipoproteinek összeállításáért és kiválasztásáért felelős fehérje. Az MTTP hiánya egerekben és emberekben hipolipidémiát és zsírmájat okoz. Ennek a fehérjének a szabályozását néhány erősen konzervált cisz-elemmel társították promoterében, beleértve a kritikus pozitív és negatív szabályozó doméneket (Cuchel et al., 2013; Hussain et al., 2011). A közelmúltban a ChREBP-t az MTTP potenciális szabályozójaként mutatták ki, mivel a májban a funkcionális ChREBP hiánya elnyomja az Mttp expresszióját és a VLDL összeszerelését és szekrécióját (Niwa et al., 2018). Mivel azonban az Mttp promóterén nem lehetett egyértelműen azonosítani a házimunkát, további elemzésre lesz szükség annak a mechanizmusnak az azonosításához, amellyel a ChREBP szabályozza az Mttp-t.
a fruktóz metabolizmusának szabályozása a májban és a bélben
a ChREBP és a fruktóz metabolizmus közötti kapcsolatot először a ChREBP knockout egerek (ChREBPKO egerek) fenotípusos elemzésével igazolták. A ChREBPKO egerek a magas fruktóztartalmú étrend (HFrD) etetését követő néhány napon belül elpusztultak (Iizuka et al., 2004). Ezt a fruktóz-intoleranciát a fruktóz metabolizmusához szükséges két enzim, a fruktokináz és a trióz-kináz expressziójának csökkenésének tulajdonították (Iizuka et al., 2004). Kim et al. (2016) később beszámolt a ChREBP fontosságáról a fruktóz glükózzá történő hatékony átalakításában a májban és az egész test fruktóz clearance-ében, de fruktóz lenyelése esetén a ChREBP hozzájárulhat a hiperglikémiához azáltal, hogy közvetlenül transz-aktiválja a g6pc expressziót, amely a glükoneogenezis kulcsfontosságú génje. Ez a hatás ördögi körhöz vezethet, amelyben a fruktózfogyasztás súlyosbítja a glükóztermelést ChREBP aktivitás (Kim et al., 2016). A következő év, Zhang tanulmánya et al. (2017) arról számolt be, hogy a Hfrd-vel táplált ChREBPKO egerekben súlyos májkárosodás alakul ki az endoplazmatikus retikulum stressz és a CCAAT-enhancer-binding protein homológ protein (CHOP) által közvetített hepatocita apoptózis túlzott aktiválása miatt. Ezekben az egerekben a májsejtek apoptózisa nagy valószínűséggel a megnövekedett koleszterin bioszintézishez kapcsolódott, mivel ennek az útnak a HMG-CoA reduktáz (HMGCR) vagy SREBP2 gátlás útján történő gátlása megmentette a ChREBPKO egereket a HFrD által kiváltott májkárosodástól. A ChREBP hiánya a közelmúltban a szacharóz és a fruktóz metabolizmusának diszregulációjával is társult, ami cukor intoleranciához és malabszorpcióhoz vezetett egerekben (Kato et al., 2018). Ezek a hatások a szacharózt glükózban és fruktózban emésztő intesztinális szacharóz-izomaltáz (SI), az 5 (Glut5) és 2 (Glut2) glükóz transzporterek, valamint a fruktolízist szabályozó ketohexokináz (Khk) enzim csökkent expressziójával jártak (2.ábra). Ezen enzimek szabályozatlansága az emésztetlen szacharóz és fruktóz felhalmozódásához vezethet, ami potenciálisan káros hatással lehet a bél mikrobiota összetételére. A ChREBPKO és a hfrd-vel táplált májspecifikus ChREBP knockout (ChREBPLiverKO) egerek összehasonlítása korábban azt mutatta, hogy a máj ChREBP-hiánya önmagában nem vezet fruktóz intoleranciához, de a vékonybélben a ChREBP-hiány valószínűleg felelős az ezeknél az egereknél megfigyelt fruktóz tolerancia károsodásáért (Kim et al., 2017). Összességében ezek a tanulmányok hangsúlyozzák a ChREBP fontosságát a fruktóz metabolizmus szabályozásában, és hangsúlyozzák annak szükségességét, hogy jobban megértsék szerepét és szabályozását a vékonybélben.
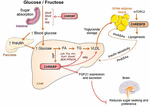
2. ábra. A ChREBP szabályozza a többszörös jelátviteli / metabolikus útvonalakat a glükózra és a fruktózra reagálva. A ChREBP számos szövetben expresszálódik, beleértve a beleket, a májat és a fehér zsírszövetet. Ezekben a sejttípusokban, válaszul a glükóz és / vagy fruktóz ChREBP aktiválódik, és indukál specifikus genic program, mint az ábrán látható. A bélben leírták az SI, Glut5, Glut2 és Ketohexokináz (Khk) expressziójának ChREBP általi stimulálását (közvetlenül vagy közvetve), hogy javítsák a szacharóz toleranciát és a fruktóz felszívódását. A májban a ChREBP a glikolitikus, lipogén és mikroszomális triglicerid transzfer fehérje (Mttp) génexpresszió kulcsfontosságú modulátora, ezáltal szabályozza mind a zsírsav felhalmozódását, mind a VLDL májból történő exportját. A ChREBP szabályozza a hepatokinek, például a fibroblaszt növekedési faktor 21 (FGF21) termelését is. Ez a máj-agy tengely kiterjeszti a máj ChREBP funkcióját a májszabályozótól a szisztémás Modulátor nemcsak a szubsztrát kezelését befolyásolja a májban, hanem a tápanyag-preferenciát is. A ChREBP aktiválása a fehér zsírszövetben a metabolikus homeosztázis javulásához kapcsolódik védő keringő jelek előállításával. Az emlősök lipidjeinek egy új osztályáról, amelyet a zsírsav és a hidroxi-zsírsav (palmitinsav-hidroxil-sztearinsav) közötti elágazó észter-kapcsolat jellemez, beszámoltak arról, hogy kedvező hatást fejt ki a glükóz homeosztázisra a sejtek működésének közvetlen és inkretin-mediált modulációja, a fokozott zsírszövet glükózfelvétel és a gyulladás csökkentése révén. Érdekes, hogy az mTORC2-t nemrégiben a ChREBP új szabályozójaként azonosították a zsírsejtekben található izoforma.
a BDK szabályozása:PPM1K tengely a májban
az elágazó láncú aminosav (BCAA) katabolizmus első elkötelezett lépését az elágazó láncú ketoacid dehidrogenáz (BCKDH) komplex szabályozza, amelyet két enzim, az elágazó láncú alfa-keto sav dehidrogenáz kináz (BDK) és a fehérje foszfatáz, Mg2+/Mn22+ függő 1K (PPM1K) szabályoz. White et al. (2018) a közelmúltban társította a ChREBP-t a BDK felszabályozásával és a PPM1K lefelé történő szabályozásával a májban, és mindkét gén promoterében konzervált házimunkát azonosított. Pozitív korrelációt figyeltek meg a BDK és más tipikus ChREBP célgének (Fasn, Pklr, ChREBP) expressziója között magas glükóz-vagy fruktóz étrenddel táplált patkányok májában. Fiziológiai szinten a BDK:PPM1K arány növekedése az ATP-citrát liáz (ACLY) foszforilációjához és aktiválásához vezetett, ezáltal stimulálva a De novo lipogenezist. Ezek az eredmények azt mutatják, hogy a BDK és a PPM1K új lipogenezist aktiváló gének lehetnek, amelyeket a ChREBP szabályozott. Tekintettel a lipid -, glükóz-és aminosav-metabolizmus szabályozásában betöltött szerepükre, a BDK és a PPM1K a közeljövőben potenciális terápiás célpontnak tekinthető a májban (White et al., 2018).
ChREBP szükséges az FGF21 glükóz által közvetített szabályozásához
a ChREBP-t nemrégiben összefüggésbe hozták hepatokinek, például fibroblaszt növekedési faktor 21 (FGF21) termelésével és szekréciójával (Iizuka et al., 2009; Dushay et al., 2015, Iroz et al., 2017). Az FGF21 egy metabolikus hormon, amelyet a máj szintetizál, többszörös jótékony hatással a perifériás szövetekben (Kharitonenkov et al., 2005; Badman et al., 2007; Markan et al., 2014). Egészen a közelmúltig az FGF21-et éhgyomri hormonnak tekintették, amely fokozza a zsírsav oxidációját, a ketogenezist és a lipolízist a peroxiszóma proliferátor aktivált receptor (PPARa) transzkripciós kontrollja alatt (Inagaki et al., 2007). Az Fgf21 promoter munkáját korábban azonosították mind egerekben (-74-52 bp), mind emberekben (-380-366 bp) (Iizuka et al., 2009), de a funkcionális tanulmányok a közelmúltig hiányoztak. Beszámoltak arról, hogy a glükóz és a fruktóz fogyasztása az FGF21 szintjének gyors emelkedéséhez vezetett egészséges önkéntesekben és metabolikus szindrómás betegekben (Dushay et al., 2015). További vizsgálatok is beszámoltak egy mechanisztikus kapcsolatról a ChREBP-eredetű FGF21 és a makrotápanyag-preferencia között a máj-agy tengelyen keresztül (Talukdar et al., 2016; von Holstein-Rathlou et al., 2016). Ez a máj-agy tengely kiterjeszti a ChREBP funkciót a máj metabolikus szabályozójától a szisztémás modulátor, amely nemcsak a máj szubsztrát kezelését, hanem a globális táplálkozási viselkedést is befolyásolja (Abdul-Wahed et al., 2017).
a ChREBP szerepe az energia homeosztázist szabályozó szervek közötti hálózatban
a máj ChREBP szerepe az inzulinérzékenységi egyensúly szabályozásában
laboratóriumunk korábban arról számolt be, hogy a ChREBP a máj zsírsav-összetételének és az inzulinérzékenység kulcsfontosságú modulátoraként működik alkoholmentes és alkoholos májbetegségek összefüggésében (lásd Abdul-Wahed et al., 2017 felülvizsgálatra). A ChREBP-t túlexpresszáló egereknél nagyobb máj steatosis alakult ki, mint a kontrolloknál, de érdekes módon mentes maradt az anyagcsere szövődményeitől és nem alakult ki inzulinrezisztencia. A lipidomikai elemzés kimutatta, hogy a ChREBP által közvetített steatosis a telített zsírsavak csökkenésével és az egyszeresen telítetlen zsírsavak növekedésével jár, ez utóbbiakról kimutatták, hogy a ChREBP által közvetített jótékony hatással vannak az inzulinérzékenységre (Benhamed et al., 2012). Ezek az eredmények bizonyítják a ChREBP szerepét a lipid particionálásban, és arra utalnak, hogy bizonyos lipidfajok, ha a megfelelő helyen és időben vannak jelen, olyan jeleket válthatnak ki, amelyek modulálják a metabolikus stresszhez való alkalmazkodást (Benhamed et al., 2012; Bricambert et al., 2018). Érdekes módon, Jois et al. (2017) A máj ChREBP védő szerepét is javasolta az egész test glükóz homeosztázisa és az inzulinérzékenység tekintetében. A ChREBPLiverKO egerek rosszabb glükóz toleranciát mutatnak, miközben védettek a máj steatosisától. A máj ChREBP deléciója génexpressziós változásokat is eredményezett a fehér és barna zsírszövetekben, ami a szövetek közötti kommunikációra utal. A ChREBP hozzájárulása az egész test energiaegyensúlyához ezért támaszkodhat a lipidfajok szabályozására és / vagy a hepatokin termelésre, amely hozzájárul az energia homeosztázis szövetközi koordinációjához (Jois et al., 2017).
a zsírszövet ChREBP összekapcsolja a lipogenezist az inzulinérzékenységgel
a zsírszövetben az inzulinrezisztencia kritikus jellemzője. Tanulmányok arról számoltak be, hogy a ChREBP aktiválása a fehér zsírszövetben javíthatja a metabolikus homeosztázist védő keringő jelek előállításával (Yore et al., 2014; Tang et al., 2016). Az emlős lipidek egy csoportja, melyet a zsírsav és a hidroxi-zsírsav közötti elágazó észter-kapcsolat jellemez, a palmitinsav-hidroxil-sztearinsav (pahsa), kedvező hatást fejt ki a glükóz homeosztázisra a sejtek működésének közvetlen és inkretin által közvetített modulációja, a glükózfelvétel és a gyulladás csökkentése révén (Yore et al., 2014). Hasonlóképpen, a zsírspecifikus ChREBP knockout (ChREBPadiposeKO), amelyek alacsony lipogenezis arányt mutatnak a zsírszövetben, inzulinrezisztensek, csökkent inzulinhatással a májban, az izomban és a fehér zsírszövetben mind chow, mind magas zsírtartalmú étrend mellett körülmények között. A ChREBPadiposeKO egerekben alacsonyabb a pahsas szérumszintje, míg a PAHSA-kiegészítés, különösen a 9-PAHSA izomer, megmenti a ChREBPadiposeKO globális inzulinrezisztenciáját és zsírszöveti gyulladását, megerősítve, hogy a zsír-ChREBP elvesztése elegendő az inzulinrezisztencia kiváltásához (Vijayakumar et al., 2017). Egy nemrégiben készült tanulmány azonosította a rapamicin 2.komplex (mTORC2) mechanisztikus célpontját, mint a ChREBP új szabályozóját (különösen a .. izoform) zsírsejtekben. Az mTOR (Rictor) rapamicin-érzéketlen kísérőjének specifikus ablációja Érett adipocitákban csökkentette az inzulin-stimulált glükózfelvételt a zsírszövetben, ami a ChREBP lefelé történő szabályozásához vezetett., 2016). A ChREBP által közvetített fontos zsírszövet–máj áthallással egyetértésben ezek a hatások a máj inzulinrezisztenciájával és a fokozott glükoneogenezissel társulnak. Összességében ezek a tanulmányok alátámasztják a zsírszövet ChREBP fontos szerepét az inzulinérzékeny jelek kiváltásában (Tang et al., 2016).
új kölcsönhatás a hormonérzékeny lipáz és a ChREBP között a zsírszövetben
a ChREBP-t nemrégiben a zsírszövetben a hormonérzékeny lipáz (HSL) lipolitikus enzim partnereként azonosították (Morigny et al., 2019). Kimutatták, hogy a HSL leütése az emberi zsírsejtekben és az egér zsírszövetében fokozza az inzulinérzékenységet és indukálja a nagyon hosszú láncú zsírsav enzim (Elovl6) megnyúlását. Az Elov16 egy mikroszomális enzim, amely ChREBP-függő módon szabályozza a C12-16 telített és egyszeresen telítetlen zsírsavak megnyúlását (Morigny et al., 2019). Mechanisztikus szinten a HSL és a ChREBP közötti fizikai kölcsönhatás rontotta a ChREBPa nukleáris transzlokációját, és ezt követően a ChREBP és a Célgének, különösen az Elovl6 indukálását (Morigny et al., 2019). Ez a tanulmány a ChREBP új szabályozását tárja fel a zsírszövetben. A HSL és a ChREBP közötti kölcsönhatás gátlása potenciális terápiás stratégiákhoz vezethet a zsírsejtek inzulinérzékenységének javítására.
következtetés és jövőbeli irányok
a ChREBP ma már jól bevált szénhidrátérzékelő. Bár a legtöbb tanulmányt a glikolitikus és lipogén utak szabályozásában való részvételére szentelték, a legfrissebb adatok a ChREBP új hozzájárulását is feltárják a hepatocitákban és a zsírsejtekben, ahol ez fontos szerepet játszhat a hepatokinek és/vagy lipokinek előállításában, amelyek kiváltják a szervek közötti áthallást. Mint említettük, az újonnan azonosított társfaktorok (epigenetikus módosítók) és/vagy partnerek (zsírszövet HSL) ezekben a szövetekben szintén potenciális terápiás stratégiákat jelenthetnek a NAFLD és/vagy a szisztémás inzulinérzékenység javítására. A legújabb tanulmányok is alátámasztották a ChREBP fontosságát a fruktóz metabolizmus szabályozásában, és hangsúlyozták annak szükségességét, hogy jobban megértsék a vékonybélben betöltött szerepét és szabályozását. Végül, a következő években különösen fontos lesz a ChREBPa és a ChREBP blokkok specifikus és/vagy egymást átfedő céljainak azonosítása a kulcsfontosságú sejttípusokban, valamint az inzulinérzékenységre gyakorolt specifikus hatásuk meghatározása.
szerzői hozzájárulások
a felsorolt szerzők jelentős, közvetlen és szellemi hozzájárulást tettek a műhöz, és jóváhagyták a közzétételt.
finanszírozás
a Postic laboratóriumát (U1016-Institut Cochin) a ChroME hálózat (Marie Curie SK Oncodowska Action H2020-MSCA-ITN-2015-675610), az Orvosi Kutatási Alapítvány (FRM) (DEQ20150331744) és az ANR-15-CE14-0026-hepatokind.
összeférhetetlenségi nyilatkozat
a szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségnek tekinthetők.