Holger J Sche Xhamnemann, Julian PT Higgins, Gunn e Vist, Paul Glasziou, Elie a Akl, Nicole Skoetz, Gordon H Guyatt; a Cochrane GRADEing Methods Group (korábban Applicability and Recommendations Methods Group) és a Cochrane Statistical Methods Group (korábban Applicability and Recommendations Methods Group) nevében
- főbb pontok:
- 14.1 ‘A megállapítások összefoglalása’ táblázatok
- 14.1.1 Bevezetés a megállapítások összefoglalásához
- 14.1.2 a megállapítások összefoglalása táblázatok eredményeinek kiválasztása
- 14.1.3 általános sablon a megállapítások összefoglalása táblázatokhoz
- 14.1.4 a megállapítások összefoglalása táblázatok készítése
- 14.1.5 statisztikai megfontolások a megállapítások összefoglalása táblázatokban
- 14.1.5.1 dichotóm eredmények
- 14.1.5.2 az eseményig eltelt idő eredményei
- 14.1.6 a megállapítások összefoglalása táblázat részletes tartalma
- 14.1.6.1 a táblázat címe és fejléce
- 14.1.6.2 eredmények
- 14.1.6.3 az összehasonlító beavatkozással járó kockázat legjobb becslése
- 14.1.6.4 beavatkozással járó kockázat
- 14.1.6.5 kockázati különbség
- 14.1.6.6 relatív hatás (95% CI)
- 14.1.6.7 résztvevők száma (tanulmányok)
- 14.1.6.8 A bizonyítékok bizonyossága (fokozat)
- 14.1.6.9 Comments
- 14.1.6.10 magyarázatok
- 14.2 A bizonyítékok bizonyosságának vagy minőségének értékelése
- 14.2.1 a fokozati megközelítés
főbb pontok:
- a beavatkozások adott összehasonlítására szolgáló megállapítások összefoglalása táblázat kulcsfontosságú információkat tartalmaz a vizsgált beavatkozások relatív és abszolút hatásainak nagyságáról, a rendelkezésre álló bizonyítékok mennyiségéről és a rendelkezésre álló bizonyítékok bizonyosságáról (vagy minőségéről).
- a megállapítások összefoglalása táblázatok minden fontos eredményhez egy sort tartalmaznak (legfeljebb hét). A ‘megállapítások összefoglalása’ táblázatok elfogadott formátumai és az interaktív ‘megállapítások összefoglalása’ táblázatok a GRADEPRO GDT szoftverével állíthatók elő.
- Cochrane a bizonyítékok bizonyosságának (vagy minőségének) értékelésére a GRADE megközelítést (az ajánlások értékelése, fejlesztése és értékelése) alkalmazta.
- A fokozatú megközelítés a bizonyosság négy szintjét határozza meg egy adott eredményre vonatkozó bizonyítékok esetében: magas, közepes, alacsony és nagyon alacsony.
- a bizonyosság FOKOZATÉRTÉKELÉSÉT öt terület figyelembevételével határozzák meg: az elfogultság, az inkonzisztencia, a közvetlenség, a pontatlanság és a publikációs elfogultság kockázata. A nem randomizált vizsgálatokból és ritkán randomizált vizsgálatokból származó bizonyítékok esetében az értékeléseket három további terület figyelembevételével lehet frissíteni.
idézze ezt a fejezetet: Sche Enterprises HJ, Higgins JPT, Vist GE, Glasziou P, Akl EA, Skoetz N, Guyatt GH. 14. fejezet: a megállapítások összefoglalása táblázatok kitöltése és a bizonyítékok bizonyosságának osztályozása. Ban ben: Higgins JPT, Thomas J, Chandler J, Cumpston M, Li T, oldal MJ, Welch VA (szerkesztők). Cochrane Kézikönyv A beavatkozások szisztematikus áttekintéséhez 6.2 verzió (Frissítve 2021.február). Cochrane, 2021. Elérhető a www.edzés.cochrane.org/handbook.
14.1 ‘A megállapítások összefoglalása’ táblázatok
14.1.1 Bevezetés a megállapítások összefoglalásához
‘a megállapítások összefoglalása’ táblázatok átlátható, strukturált és egyszerű táblázatos formában mutatják be a felülvizsgálat főbb megállapításait. Különösen a bizonyítékok bizonyosságára vagy minőségére (azaz a hatásbecslés vagy asszociáció tartományában fennálló megbízhatóságra vagy bizonyosságra), a vizsgált beavatkozások hatásának nagyságára, valamint a főbb eredményekre vonatkozóan rendelkezésre álló adatok összegére vonatkozó kulcsfontosságú információkat nyújtanak. A Cochrane-értékeléseknek tartalmazniuk kell a megállapítások összefoglaló táblázatait a tervezés és a közzététel során, és tartalmazniuk kell legalább egy kulcsfontosságú megállapítások összefoglaló táblázatát, amely a legfontosabb összehasonlításokat tartalmazza. Egyes felülvizsgálatok egynél több ‘megállapítások összefoglalása’ táblázatot is tartalmazhatnak, például ha a felülvizsgálat egynél több fő összehasonlítással foglalkozik, vagy lényegesen különböző populációkat tartalmaz, amelyek külön táblázatokat igényelnek (például azért, mert a hatások különböznek, vagy fontos az eredmények külön megjelenítése). A Cochrane Database of Systematic Reviews (CDSR) adatbázisában a felülvizsgálat fő megállapításainak összefoglalása táblázata az elején, a háttér szakasz előtt jelenik meg. Az eredmények és a vitafórumok között további’ megállapítások összefoglalása ‘ táblázatok jelennek meg.
14.1.2 a megállapítások összefoglalása táblázatok eredményeinek kiválasztása
a megállapítások összefoglalása táblázat tervezése a szisztematikus felülvizsgálat korai szakaszában kezdődik, az eredmények kiválasztásával, amelyeket a következőkben kell feltüntetni: i.a felülvizsgálat; és ii. a megállapítások összefoglalása táblázat. Ez egy fontos lépés, és az egyik, hogy a felülvizsgálat szerzők kell foglalkozni óvatosan.
az optimálisan hasznos információk előállításának biztosítása érdekében a Cochrane-értékelések egy felülvizsgálati kérdés kidolgozásával és a betegek és más döntéshozók számára fontos főbb eredmények felsorolásával kezdődnek (lásd a 2.és a 3. fejezetet). A bizonyítékok bizonyosságának értékelésére szolgáló osztályozási megközelítés (lásd a 14.2.szakaszt) meghatározza és működteti a minősítési folyamatot, amely segít elkülöníteni az eredményeket a döntéshozatal szempontjából kritikus, fontos vagy nem fontos eredményekre. A felülvizsgálati jegyzőkönyvvel kapcsolatos konzultáció és visszajelzés-többek között a fogyasztóktól és más döntéshozóktól-elősegítheti ezt a folyamatot.
a kritikus eredmények valószínűleg egyértelműen fontos végpontokat tartalmaznak; tipikus példák a mortalitás és a súlyos morbiditás (például stroke és myocardialis infarctus). Ezek azonban gyakori kisebb és ritka súlyos mellékhatásokat, tüneteket, életminőséget, a kezeléssel kapcsolatos terheket és erőforrás-problémákat (költségeket) is jelenthetnek. A terhek az egészségügyi munkaterhelésnek a beteg működésére és jólétére gyakorolt hatását jelentik, és magukban foglalják a betegek vagy a gondozók (pl. család) nem szeretik a beavatkozást, mint például a gyakoribb vizsgálatok elvégzése, vagy az életmód korlátozásai, amelyeket bizonyos beavatkozások igényelnek (Spencer-Bonilla et al 2017).
gyakran, amikor olyan kérdéseket fogalmaznak meg, amelyek magukban foglalják a betegek számára a döntéshozatal szempontjából fontos összes eredményt, az áttekintő szerzők szembesülnek olyan tanulmányokról szóló jelentésekkel, amelyek nem tartalmazzák ezeket az eredményeket. Ez különösen igaz a kedvezőtlen eredményekre. Például a randomizált vizsgálatok bizonyítékokkal szolgálhatnak a tervezett hatásokról és a gyakori, viszonylag kisebb mellékhatásokról, de nem jelentenek ritka káros eredményeket, például öngyilkossági kísérleteket. A 19. fejezet a káros hatások kezelésére vonatkozó stratégiákat tárgyalja. Az összes fontos eredményre vonatkozó adatok megszerzéséhez szükség lehet a nem randomizált vizsgálatok eredményeinek vizsgálatára (lásd a 24.fejezetet). Cochrane másokkal együttműködve iránymutatást dolgozott ki az áttekintő szerzők számára, hogy támogassák döntésüket arról, hogy mikor kell keresni, és nem randomizált vizsgálatokat is magukban foglaljanak (Sche Multinnemann et al 2013).
ha a felülvizsgálat csak randomizált vizsgálatokat tartalmaz, ezek a vizsgálatok nem feltétlenül foglalkoznak az összes fontos eredménnyel, ezért előfordulhat, hogy ezeket az eredményeket nem lehet a felülvizsgálat korlátain belül kezelni. Az áttekintő szerzőknek tudomásul kell venniük ezeket a korlátozásokat, és átláthatóvá kell tenniük azokat az olvasók számára. A felülvizsgálat szerzőit arra ösztönzik, hogy vegyenek fel nem randomizált vizsgálatokat a ritka vagy hosszú távú káros hatások vizsgálatára, amelyeket randomizált vizsgálatokban nem lehet megfelelően tanulmányozni. Ez felveti annak lehetőségét, hogy a kár kimenetele olyan tanulmányokból származhat, amelyekben a résztvevők különböznek az előnyök elemzésében használt tanulmányokétól. Az áttekintő szerzőknek ezt követően mérlegelniük kell, hogy ezek a különbségek valószínűleg milyen hatással lesznek a megállapításokra, és ez befolyásolja a bizonyítékok bizonyosságát a populációval kapcsolatos közvetlenséggel kapcsolatos aggodalmak miatt (lásd a 14.2.2.szakaszt).
a nem randomizált vizsgálatok nemcsak akkor nyújthatnak fontos információkat, ha a randomizált vizsgálatok nem jelentenek eredményt, vagy a randomizált vizsgálatok közvetlenségben szenvednek, hanem akkor is, ha a randomizált vizsgálatokból származó bizonyítékokat nagyon alacsonynak minősítik, a nem randomizált vizsgálatok pedig nagyobb bizonyosságot mutatnak. E kérdések további megvitatása a 24. fejezetben is megjelenik.
14.1.3 általános sablon a megállapítások összefoglalása táblázatokhoz
a megállapítások összefoglalása táblázatok több alternatív standard változatát dolgozták ki annak érdekében, hogy biztosítsák a következetességet és a könnyű használhatóságot a felülvizsgálatok során, a döntéshozók számára szükséges legfontosabb információk beillesztését és az optimális megjelenítést (lásd a példákat a 14.1.ábrákon.a és 14.1.b). Ezeket a formátumokat olyan kutatások támasztják alá, amelyek az általuk közvetíteni kívánt információk jobb megértésére összpontosítanak (Carrasco-Labra et al 2016, Langendam et al 2016, Santesso et al 2016). Ezek a GRADE hivatalos SZOFTVERCSOMAGJÁN keresztül érhetők el, amelyet a GRADE megközelítés támogatására fejlesztettek ki: GRADEpro GDT (www.gradepro.org).
a Standard Cochrane ‘megállapítások összefoglalása’ táblázatok a következő elemeket tartalmazzák az elfogadott formátumok egyikével. További útmutatás ezekről a 14.1.6. szakaszban található.
- a rendelkezésre álló bizonyítékok (amelyek kissé eltérhetnek vagy szűkebbek lehetnek a felülvizsgálati kérdésben meghatározottaktól) a sokaság és a környezet rövid leírása.
- az összehasonlítás rövid leírása a megállapítások összefoglalása táblázatban, beleértve mind a kísérleti, mind az összehasonlító beavatkozásokat.
- a legkritikusabb és/vagy legfontosabb egészségügyi eredmények felsorolása, mind kívánatos, mind nemkívánatos, legfeljebb hét kimenetelre korlátozva.
- az egyes eredmények tipikus terheinek mértéke (pl. szemléltető kockázat vagy szemléltető átlag az összehasonlító beavatkozásnál).
- mindegyikre mért abszolút és relatív hatásnagyság (ha mindkettő megfelelő).
- az egyes eredmények elemzéséhez hozzájáruló résztvevők és tanulmányok száma.
- az egyes eredményekre vonatkozó bizonyítékok teljes bizonyosságának értékelése (amely eredményenként változhat).
- szóköz a megjegyzésekhez.
- magyarázatok (korábbi nevén lábjegyzetek).
ideális esetben a megállapítások összefoglalása táblázatokat részletesebb táblázatok (más néven bizonyítékprofilok) támasztják alá, amelyekhez a felülvizsgálat kapcsolódhat, és amelyek részletesebb magyarázatot nyújtanak. A bizonyítékprofilok ugyanazokat a fontos egészségügyi eredményeket tartalmazzák, és nagyobb részletességgel szolgálnak, mint a megállapítások összefoglalása táblázatok mind a bizonyosság osztályozásába, mind a vizsgálatok eredményeibe beépülő egyedi megfontolásokról (Guyatt et al 2011a). Biztosítják, hogy strukturált megközelítést alkalmazzanak a bizonyítékok bizonyosságának értékelésére. Bár ezeket ritkán teszik közzé a Cochrane Reviews – ban, a bizonyítékprofilokat gyakran használják, például, az iránymutatás-fejlesztők a bizonyítékok bizonyosságának mérlegelésében az iránymutatási ajánlások alátámasztására. Az áttekintő szerzők könnyebben kidolgozhatják a megállapítások összefoglalása táblázatot, ha először a gradepro GDT-ben kitöltik a bizonyítékok bizonyosságának minősítését a bizonyítékprofilban. Ezután automatikusan átalakíthatják ezt a gradepro GDT’ megállapítások összefoglalása ‘ formátumának egyikére, beleértve egy interaktív ‘megállapítások összefoglalását’ közzétételre.
a dichotóm eredmények hatásának mértékeként a megállapítások összefoglalása táblázatnak a hatás relatív mértékét (pl. kockázati arány, esélyhányados, veszély) és az abszolút kockázat mértékét kell megadnia. Más típusú adatok esetében önmagában egy abszolút mérték (például a folyamatos adatok átlagának különbsége) elegendő lehet. Fontos, hogy a hatás nagyságát értelmesen mutassuk be, ami szükségessé teheti a metaanalízis eredményének némi átalakítását (Lásd még a 15.fejezet 15.4 és 15.5 szakaszát). A több fő összehasonlítást tartalmazó értékeléseknek minden összehasonlításhoz külön táblázatot kell tartalmazniuk A megállapítások Összefoglalásáról.
14.1.ábra.az a egy példa a megállapítások összefoglalása táblázatra. 15.1. ábra.a b alternatív formátumot biztosít, amely tovább könnyítheti a felhasználók számára a felülvizsgálat megállapításainak megértését és értelmezését. A különböző formátumokat értékelő bizonyítékok azt sugallják, hogy a megállapítások összefoglalása táblázatnak tartalmaznia kell a kockázati különbséget az abszolút hatás mércéjeként, és a szerzőknek lehetőleg olyan formátumot kell használniuk, amely tartalmazza a kockázati különbséget .
a megállapítások összefoglalása táblázat tartalmának részletes leírása a 14.1.6.szakaszban található.
14.1.ábra.példa a ‘megállapítások összefoglalása’ táblázatra
a megállapítások összefoglalása (interaktív változatért kattintson ide)
|
kompressziós harisnya, összehasonlítva a nem kompressziós harisnyával a hosszú járatokat igénybe vevő emberek számára |
||||||
|
betegek vagy populáció: bárki, aki hosszú repülést folytat (6 óránál hosszabb ideig tart) Beállítások: nemzetközi légi utazás beavatkozás: kompressziós harisnyaa összehasonlítás: harisnya nélkül |
||||||
|
eredmények |
szemléltető összehasonlító kockázatok* (95% CI) |
relatív hatás (95% CI) |
résztvevők száma (tanulmányok) |
a bizonyítékok bizonyossága (fokozat) |
||
|
feltételezett kockázat |
megfelelő kockázat |
|||||
|
harisnya nélkül |
harisnyával |
|||||
|
tüneti mélyvénás trombózis (DVT) |
lásd megjegyzés |
lásd a megjegyzést |
nem becsülhető |
(9 tanulmányok) |
lásd a megjegyzést |
0 a résztvevők tüneti DVT-t fejlesztettek ki ezekben a vizsgálatokban |
|
tünetmentes DVT |
alacsony kockázatú lakosságb |
RR 0.10 (0.04 hogy 0.26) |
(9 tanulmányok) |
⊕⊕⊕⊕ magas |
||
|
10 per 1000 |
1 per 1000 (0 hogy 3) |
|||||
|
magas kockázatú lakosságb |
||||||
|
20 per 1000 |
2 per 1000 (1 hogy 8) |
|||||
|
felületes vénás trombózis |
13 per 1000 |
6 per 1000 (2 hogy 15) |
RR 0.45 (0.18-tól 1.13) |
(8 tanulmányok) |
⊕⊕⊕◯ Moderatec |
|
|
Oedema repülés utáni értékek 0-tól, ödéma nélkül, 10-ig terjedő skálán mérve, maximális oedema |
az átlagos oedema pontszám a kontrollcsoportok között 6-tól 9 |
az átlagos oedema pontszám az intervenciós csoportokban átlagosan 4, 7 alacsonyabb volt(95% CI-4, 9-4.5) |
(6 tanulmányok) |
⊕⊕◯◯ Lowd |
||
|
tüdőembólia |
lásd a megjegyzést |
lásd a megjegyzést |
nem becsülhető |
(9 tanulmányok) |
lásd a megjegyzést |
0 a résztvevők tüdőembóliát fejlesztettek ki ezekben a tanulmányokban |
|
halál |
lásd a megjegyzést |
lásd a megjegyzést |
nem becslés |
(9 tanulmányok) |
lásd a megjegyzést |
0 a résztvevők ezekben a vizsgálatokban haltak meg |
|
káros hatások |
lásd a megjegyzést |
lásd a megjegyzést |
nem becsülhető |
(4 tanulmányok) |
lásd a megjegyzést |
a harisnya tolerálhatóságát nagyon jónak írták le, mellékhatások nélkül 4 tanulmányban |
|
*a feltételezett kockázat alapja a következő lábjegyzetek. A megfelelő kockázat (és annak 95% – os konfidencia-intervalluma) az intervenciós csoport feltételezett kockázatán és a beavatkozás relatív hatásán (és 95% – os konfidencia INTERVALLUMÁN) alapul. CI: konfidencia intervallum; RR: kockázati arány; fokozat: fokozat Munkacsoport bizonyítékok osztályai (lásd a magyarázatokat). |
||||||
a Az ebben a felülvizsgálatban szereplő kilenc tanulmány összes harisnyája térd alatti kompressziós harisnya volt. Négy vizsgálatban a kompressziós szilárdság 20-30 Hgmm volt a bokánál. A másik négy vizsgálatban 10-20 Hgmm volt. A harisnya különböző méretű. Ha a harisnya túl szoros a térd körül, megakadályozhatja az esszenciális vénás visszatérést, ami a vér térd körüli medencéjét okozza. A kompressziós harisnyát megfelelően kell felszerelni. A túl szoros harisnya hosszú repülés közben bevághatja a bőrt, és fekélyesedést és fokozott DVT-kockázatot okozhat. Néhány harisnya kissé vastagabb lehet, mint a normál lábborítás, és szűk lábviselés esetén potenciálisan korlátozó lehet. Ez egy jó ötlet, hogy viseljen harisnyát a ház körül utazás előtt, hogy biztosítsa a jó, kényelmes illeszkedést. A résztvevők a legtöbb vizsgálatban két-három órával a repülés előtt helyezték el harisnyájukat. A harisnyák elérhetősége és költsége változhat.
b két vizsgálatban magas kockázatú résztvevőket vettek fel, akiket a DVT korábbi epizódjai, véralvadási rendellenességek, súlyos elhízás, csont-vagy ízületi problémák miatt korlátozott mozgásképesség, neoplasztikus betegség az előző két évben, nagy visszér vagy az egyik vizsgálatban 190 cm-nél magasabb és 90 kg-nál nehezebb résztvevők. A magas kockázatú résztvevőket kizáró hét vizsgálat incidenciája az volt 1.45% és a magas kockázatú (legalább egy kockázati tényezővel rendelkező) résztvevőket toborzó két vizsgálat incidenciája 2,43% volt. A különböző kockázati rétegek kifejezésére 10, illetve 30 / 1000-et használtunk.
c a konfidencia intervallum nem keresztezi a különbséget, és nem zárja ki a kis növekedést.
d az oedema mérését nem validálták (az eredmény közvetlensége), vagy elvakították a beavatkozástól (elfogultság kockázata).
e ha nagyon kevés vagy egyáltalán nincs esemény, és a résztvevők száma nagy, a bizonyítékok bizonyosságára vonatkozó megítélés (különösen a pontatlanságra vonatkozó ítéletek) az abszolút hatáson alapulhat. Itt a bizonyossági besorolás magasnak tekinthető, ha az eredményt megfelelően értékelték, és az esemény valójában nem történt meg 2821 vizsgált résztvevőnél.
f a többi vizsgálat egyikében sem számoltak be káros hatásokról, eltekintve a térd régió varikozusaiban előforduló felületes vénás trombózis négy esetétől, amelyeket egy vizsgálatban a harisnya felső széle összenyomott.
14.1.ábra.b példa a megállapítások összefoglalásának alternatív táblázatára
|
a megállapítások összefoglalása (interaktív változatért kattintson ide): |
||||||
|
probiotikumok a No probiotikumokhoz képest, mint a gyermekek antibiotikumainak kiegészítése |
||||||
|
beteg vagy populáció: gyermekek antibiotikumot kaptak Beállítások: fekvőbetegek és járóbetegek beavatkozás: probiotikumok összehasonlítás: nincs probiotikum |
||||||
|
eredmények résztvevők száma (tanulmányok) |
relatív hatások |
várható abszolút hatások* (95% CI) |
a bizonyítékok bizonyossága |
|||
|
probiotikumok nélkül |
probiotikumokkal |
különbség |
||||
|
hasmenés előfordulása: probiotikus dózis 5 milliárd CFU/nap nyomon követés: 10 naptól 3 hónapig gyermekek < 5 év |
gyermekek < 5 év |
⊕⊕⊕⊝ mérsékeltb az elfogultság kockázata miatt |
valószínűleg csökkenti a hasmenés előfordulását. |
|||
|
1474 (7 tanulmányok) |
RR 0,41 (0,29 hogy 0.55) |
22.3%a |
8.9% (6.5 hogy 12.2) |
13.4% kevesebb gyermeka (10,1-15.8 kevesebb) |
||
|
gyermekek > 5 év |
gyermekek > 5 év |
⊕⊕⊝⊝ lowb, c az elfogultság és a pontatlanság kockázata miatt |
csökkentheti a hasmenés előfordulását. |
|||
|
624 (4 tanulmányok) |
RR 0,81 (0,53 to 1.21) |
11.2%a |
9% (5.9 hogy 13.6) |
2.2% kevesebb gyermeka (5,3-2.4 több) |
||
|
nemkívánatos eseményeksd követés: 10-44 nap 1575 (11 vizsgálat) |
1.8%a |
2.3% (0.8 hogy 3.8) |
0.5% több nemkívánatos esemény (1 kevesebb – 2 több) |
⊕⊕⊝⊝ lowf, g az elfogultság és következetlenség kockázata miatt |
a nemkívánatos eseményekben alig vagy egyáltalán nem lehet különbség. |
|
|
a hasmenés időtartama követés: 10 naptól 3 hónapig 897 (5 vizsgálat) |
a hasmenés átlagos időtartama probiotikumok nélkül 4 nap volt. |
0.6 kevesebb nap (1,18 – 0,02 kevesebb nap) |
⊕⊕⊝⊝ lowh, i pontatlanság és következetlenség miatt |
csökkentheti a hasmenés időtartamát. |
||
|
széklet naponta nyomon követés: 10 naptól 3 hónapig 425 (4 vizsgálat) |
a probiotikumok nélküli napi átlagos széklet napi 2,5 széklet volt. |
0.3 kevesebb széklet naponta ( 0,6-0 kevesebb) |
⊕⊕⊝⊝ lowj, k pontatlanság és következetlenség miatt |
lehet, hogy kevés vagy nincs különbség a székletben naponta. |
||
|
*a kontrollcsoporton belüli kockázat alapja (pl. a kontrollcsoporton belüli medián kockázat a vizsgálatok során) lábjegyzetekben található. Az intervenciós csoport kockázata (és annak 95% – os konfidencia-intervalluma) az összehasonlító csoport feltételezett kockázatán és a beavatkozás relatív hatásán (és 95% – os konfidencia INTERVALLUMÁN) alapul. CI: konfidencia intervallum; RR: kockázati arány. |
||||||
|
magyarázat a kontrollcsoport kockázati becslései a kontrollcsoportok összesített becsléseiből származnak. Relatív hatás a rendelkezésre álló esetelemzés alapján b az elfogultság magas kockázata a nyomon követés nagy vesztesége miatt. c a kevés eseményből és konfidencia intervallumból eredő pontatlanság jelentős hasznot vagy kárt jelent. D mellékhatások: kiütés, hányinger, puffadás, hányás, fokozott váladék, mellkasi fájdalom, székrekedés, ízérzészavar és alacsony étvágy. a kockázatokat összevont kockázati különbségekből számították ki. f az elfogultság magas kockázata. Csak 11 nak, – nek 16 a nemkívánatos eseményekről szóló vizsgálatok szelektív jelentési torzításra utalnak. G súlyos következetlenség. Számos probiotikus szert és dózist értékeltek viszonylag kis számú kísérletben, korlátozva a képességünket arra, hogy következtetéseket vonjunk le a sok probiotikum hatóanyag és adag biztonságosságáról. H súlyos, megmagyarázhatatlan inkonzisztencia (nagy heterogenitás I2 = 79%, P érték , pontbecslések és konfidencia intervallumok jelentősen eltérnek). I súlyos pontatlanság. A 0,02 nappal kevesebb hasmenés felső határa nem tekinthető a beteg számára fontosnak. J súlyos, megmagyarázhatatlan inkonzisztencia (nagy heterogenitás I2 = 78%, P érték , pontbecslések és konfidencia intervallumok jelentősen eltérnek). K súlyos pontatlanság. A 95% – os konfidencia intervallum nem tartalmaz hatást,és a napi 0,60 széklet alsó határa megkérdőjelezhető a beteg szempontjából. |
||||||
14.1.4 a megállapítások összefoglalása táblázatok készítése
a GRADE Munkacsoport szoftvere, GRADEPRO GDT (www.gradepro.org), beleértve a GRADE interaktív kézikönyvét, amely segítséget nyújt az áttekintő szerzőknek a megállapítások összefoglalása táblázatok elkészítésében. A GRADEpro felhasználhatja az összehasonlító csoport kockázatára és a hatásbecslésre vonatkozó adatokat (amelyeket a felülvizsgálat szerzői adtak meg vagy a RevMan-ban létrehozott fájlokból importáltak) a kísérleti beavatkozásokhoz kapcsolódó relatív hatások és abszolút kockázatok előállításához. Ezenkívül végigvezeti a felhasználót a minőségértékelés folyamatán, és létrehoz egy táblázatot, amely önálló táblázatként használható a felülvizsgálatban (beleértve a közvetlen importálást olyan szoftverekbe, mint a RevMan vagy a RevMan Web integrációval), vagy egy interaktív ‘megállapítások összefoglalása’ táblázatot (lásd a gradepro súgóforrásait).
14.1.5 statisztikai megfontolások a megállapítások összefoglalása táblázatokban
14.1.5.1 dichotóm eredmények
a megállapítások összefoglalása táblázatoknak tartalmazniuk kell mind a dichotóm eredmények abszolút, mind relatív hatásmérőit. A kockázati arányok, esélyhányadosok és kockázati különbségek különböző módon hasonlíthatók össze két csoportot a dichotóm eredményadatokkal (lásd a 6.fejezet 6.4.1. szakaszát). Ezenkívül két különböző kockázati arány létezik attól függően, hogy melyik esemény (például igen vagy nem) áll az elemzés középpontjában (lásd a 6.fejezet 6.4.1.5. szakaszát). Nem nulla beavatkozási hatás jelenlétében az összehasonlító csoportban végzett vizsgálatok közötti bármilyen eltérés kockázatot jelent (pl. az érdeklődés beavatkozása nélkül bekövetkező esemény kockázatának változása, például különböző populációkban) lehetetlenné teszi, hogy ezen intézkedések közül egynél több valóban azonos legyen minden tanulmányban.
az epidemiológiában régóta feltételezik, hogy a relatív hatásmérők következetesebbek, mint az abszolút hatásmérők egyik forgatókönyvről a másikra. Empirikus bizonyítékok támasztják alá ezt a feltételezést (Engels et al 2000, Deeks and Altman 2001, Furukawa et al 2002). Ezért a metaanalíziseknek általában kockázati arányt vagy esélyhányadost kell használniuk a hatás mértékeként (lásd a 10.fejezet 10.4.3. szakaszát). Ennek megfelelően a relatív hatás egyetlen becslése valószínűleg megfelelőbb összefoglaló, mint az abszolút hatás egyetlen becslése. Ha egy relatív hatás valóban konzisztens a vizsgálatok során, akkor a különböző összehasonlító csoport kockázatainak különböző következményei lesznek az abszolút előny szempontjából. Például, ha a kockázati arány következetesen 0.75, akkor a kísérleti beavatkozás csökkentené az összehasonlító csoport 80-60% – os kockázatát az intervenciós csoportban (abszolút kockázatcsökkentés 20 százalékponttal), de csökkentené az összehasonlító csoport 20-15% – os kockázatát is az intervenciós csoportban (abszolút kockázatcsökkentés 5 százalékponttal).
a megállapítások összefoglalása táblázatok a következetes relatív hatás feltételezése köré épülnek. Ezért fontos figyelembe venni, hogy ez a hatás milyen hatással van az összehasonlító csoport különböző kockázataira (ezek több forrásból is levezethetők vagy megbecsülhetők, lásd a 14.1 pontot.6.3), amely megkövetelheti a prognosztikai bizonyítékok bizonyosságának értékelését (Spencer et al 2012, Iorio et al 2015). Bármely összehasonlító csoport kockázata esetén meg lehet becsülni a megfelelő intervenciós csoport kockázatát (azaz az abszolút kockázatot a beavatkozással) a meta-analitikus kockázati arány vagy esélyhányados. Vegye figyelembe, hogy a megfelelő kockázat oszlopban megadott számok a szomszédos oszlopban szereplő kockázatokra vonatkoznak.
a meta-analitikus kockázati arány (RR) és a feltételezett összehasonlító kockázat (ACR) esetében a megfelelő beavatkozási kockázatot a következőképpen kapjuk meg:
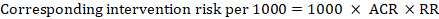 .
.
példaként a 14.1.ábrán.a, a tünetmentes mélyvénás trombózis (DVT) meta-analitikus kockázati aránya RR = 0,10 (95% CI 0,04-0,26). Feltételezve, hogy az összehasonlító kockázat ACR = 10 per 1000 = 0,01, megkapjuk:
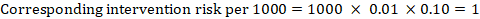 .
.
a meta-analitikus esélyhányados (OR) és a feltételezett összehasonlító kockázat (ACR) esetében a megfelelő beavatkozási kockázatot a következőképpen kapjuk meg:
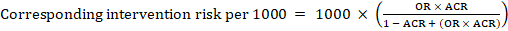 .
.
a megfelelő beavatkozási kockázat felső és alsó konfidencia határértékeit az RR helyettesítésével, illetve azok felső és alsó konfidencia határértékeivel (pl. a 0 helyettesítésével) kapjuk meg.10 0,04-gyel, majd 0,26-tal a példában). Az ilyen konfidencia-intervallumok nem tartalmaznak bizonytalanságot a feltételezett összehasonlító kockázatokban.
a kockázati arányok kezelésekor kritikus fontosságú, hogy az eseménynek ugyanazt a meghatározását használják, mint a metaanalízisnél. Például, ha a metaanalízis a ‘halálra’ (szemben a túléléssel) összpontosított, mint eseményre, akkor a megállapítások összefoglalása táblázatban szereplő megfelelő kockázatoknak a ‘halálra’ is utalniuk kell.
olyan (ritka) körülmények között, amikor egyértelmű indoklás áll fenn a meta-analízis következetes kockázati különbségének feltételezésére, elvben lehetséges ezt bemutatni a releváns ‘feltételezett kockázatokra’ és azok megfelelő kockázataira, és bemutatni a megfelelő (eltérő) relatív hatásokat minden feltételezett kockázatra vonatkozóan.
a kockázati különbség az ACR és a megfelelő beavatkozási kockázat közötti különbséget fejezi ki (vagy a kísérleti és az összehasonlító beavatkozás közötti különbséget).
a meta-analitikus kockázati arány (RR) és a feltételezett összehasonlító kockázat (ACR) esetében a megfelelő kockázati különbséget úgy kapjuk meg, hogy (megjegyezzük, hogy a kockázatok százalékponttal vagy százalékponttal is kifejezhetők):
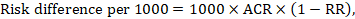
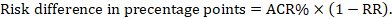
például a 14.1. ábrán.b A Meta-analitikus kockázati arány 0,41 (95% – os CI 0,29-0,55) hasmenés esetén 5 évesnél fiatalabb gyermekeknél. Feltételezve, hogy az összehasonlító csoport kockázata 22,3%, megkapjuk:
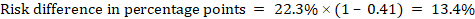 .
.
a meta-analitikus esélyhányados (OR) és a feltételezett összehasonlító kockázat (ACR) esetében az abszolút kockázati különbséget (százalékpont) kapjuk):
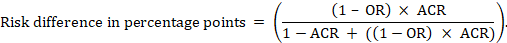
az abszolút kockázati különbségre vonatkozó felső és alsó konfidencia határértékeket úgy kapjuk meg, hogy a fenti számítást újrafuttatjuk, miközben az RR-t helyettesítjük, vagy pedig a felső és az alsó konfidencia határértékeket (például a 0,41-et 0,28-ra, majd a példában 0,55-re cseréljük). Az ilyen konfidencia-intervallumok nem tartalmaznak bizonytalanságot a feltételezett összehasonlító kockázatokban.
14.1.5.2 az eseményig eltelt idő eredményei
az eseményig eltelt idő eredményei azt mérik, hogy egy adott esemény (pl. halál) bekövetkezik-e és mikor (van Dalen et al 2007). A kísérleti beavatkozás hatását az összehasonlító csoporthoz viszonyítva az eseményig eltelt időre általában relatív hazárd (HR) alkalmazásával mérik (lásd a 6.fejezet 6.8.1. szakaszát).
a relatív hazárd relatív hatásbecslést fejez ki. Különböző módokon használható abszolút kockázatok és más értelmezhető mennyiségek megszerzésére egy adott sokaságra vonatkozóan. Itt leírjuk, hogyan lehet újra kifejezni a relatív hazárdokat: (i) az eseménymentes túlélés abszolút kockázata egy adott időszakon belül; (ii) egy esemény abszolút kockázata egy adott időszakon belül; és (iii) az eseményig eltelt medián idő. Minden módszer a következetes relatív hatások feltételezésén alapul (azaz hogy a relatív arány nem változik az idő múlásával).
i.az eseménymentes túlélés abszolút kockázatát egy adott időtartamon belül az eseménymentes túlélést(pl. a teljes túlélést) gyakran jelentik az egyes vizsgálatok. Az eseményig eltelt idő abszolút hatásainak elérése érdekében eseménymentes túlélésként mérve az összefoglaló HR alkalmazható a betegek feltételezett arányával együtt, akik eseménymentesek az összehasonlító csoportban (Tierney et al 2007). A betegek ezen aránya specifikus lesz a megfigyelési időszakra. Ezt az időtartamot azonban nem feltétlenül szükséges meghatározni. Például az eseménymentes betegek 50%-ának aránya vonatkozhat azokra a betegekre, akiknél magas eseményarány figyelhető meg 1 év alatt, vagy olyan betegekre, akiknél alacsony eseményarány figyelhető meg 2 év alatt.

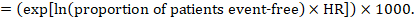
tegyük fel például, hogy a meta-analitikus relatív hazárd 0,42 (95% CI 0,25-0,72). Feltételezve az eseménymentes túlélés összehasonlító csoportjának kockázatát (pl. a teljes túlélésre életben lévő emberek) 2 éves ACR = 900 / 1000 = 0,9:

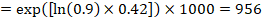
annak érdekében, hogy ez a 956/1000 ember életben maradjon a kísérleti beavatkozással 2 év alatt. A kockázat levezetését megjegyzésben vagy lábjegyzetben kell kifejteni.
(ii) egy esemény abszolút kockázata egy adott időtartamon belül ennek az abszolút hatásnak a megszerzéséhez ismét az összefoglaló HR használható (Tierney et al 2007):

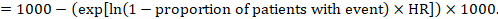
a példában tegyük fel, hogy feltételezzük az események összehasonlító csoportjának kockázatát (például halálozás, halottak) 2 éves ACR = 100 / 1000 = 0,1. Megkapjuk:

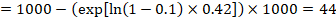
annak érdekében, hogy ez az 44 1000 ember meghaljon a kísérleti beavatkozással az 2 években.
iii. az eseményig eltelt medián idő abszolút számok helyett a beavatkozási és összehasonlító csoportokban az eseményig eltelt idő hónapokban vagy években kifejezett medián túlélési időként fejezhető ki. A medián túlélési idő megszerzéséhez az összevont HR alkalmazható egy feltételezett medián túlélési időre az összehasonlító csoportban (Tierney et al 2007):
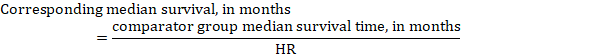
a példában, feltételezve, hogy az összehasonlító csoport medián túlélési ideje 80 hónap, megkapjuk:
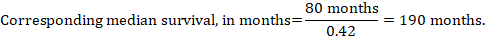
a time-to-event elemzések eredményeinek újbóli kifejezésére szolgáló mindhárom lehetőség esetében a megfelelő beavatkozási kockázat felső és alsó konfidenciahatárát úgy kapjuk meg, hogy a HR-t a felső és az alsó konfidenciahatárokkal helyettesítjük (például a 0,42-et 0,25-tel helyettesítjük, majd a példában 0,72-vel helyettesítjük). Ismét, mint a dichotóm kimenetelek esetében, az ilyen konfidencia intervallumok nem tartalmaznak bizonytalanságot a feltételezett összehasonlító csoport kockázataiban. Ez különösen fontos a hosszú távú túlélés szempontjából, alacsony vagy közepes halálozási arány mellett, és ennek megfelelően magas a cenzúrázott betegek száma (azaz alacsony a veszélyeztetett betegek száma és magas a cenzúrázási Arány).
14.1.6 a megállapítások összefoglalása táblázat részletes tartalma
14.1.6.1 a táblázat címe és fejléce
az egyes megállapítások összefoglalása táblázatok címének meg kell határoznia az egészségügyi ellátás kérdését, a népesség szempontjából megfogalmazva, és egyértelművé téve, hogy a beavatkozások milyen összehasonlításra kerülnek. A 14.1. Ábrán.a, A lakosság olyan emberek, akik hosszú repülőgépeket repülnek, a beavatkozás kompressziós harisnya, az ellenőrzés pedig nem kompressziós harisnya.
a megállapítások összefoglalása táblázat első soraiban a következő ‘fejléc’ információkat kell megadni:
betegek vagy populáció ez tovább tisztázza az érdeklődésre számot tartó populációt (és esetleg az alcsoportokat), és ideális esetben a beavatkozás legfontosabb káros kimenetelének kockázatát. Például, a hosszú távú járaton tartózkodó emberek különböző kockázatoknak lehetnek kitéve a DVT szempontjából; a szelektív szerotonin újrafelvétel-gátlókat (SSRI-ket) használók eltérő kockázattal járhatnak a mellékhatások miatt; míg a pitvarfibrillációban szenvedők alacsony (< 1%), közepes (1-4%) vagy magas (> 4%) éves stroke kockázatúak lehetnek.
ennek a beállításnak tartalmaznia kell az egészségügyi kérdés beállításainak minden olyan sajátos jellemzőjét, amely korlátozhatja a megállapítások összefoglalásának más beállításokra való alkalmazhatóságát (pl. alapellátás Európában és Észak-Amerikában).
beavatkozás a kísérleti beavatkozás.
összehasonlítás az összehasonlító beavatkozás (specifikus beavatkozás nélkül).
14.1.6.2 eredmények
a megállapítások összefoglalása táblázat sorainak tartalmazniuk kell a döntéshozatal szempontjából elengedhetetlen összes kívánatos és nemkívánatos egészségügyi eredményt (fontossági sorrendben felsorolva), legfeljebb hét eredményig. Ha több eredmény van a felülvizsgálatban, a felülvizsgálat szerzőinek ki kell hagyniuk a kevésbé fontos eredményeket a táblázatból, és a protokoll kidolgozása során meg kell határozni, hogy mely eredmények kritikusak vagy fontosak a felülvizsgálat szempontjából (lásd a 3.fejezetet). A felülvizsgálat készítőinek meg kell adniuk az eredmények (például 90 nap vagy 12 hónap) és a műszer-pontszámok típusának (például 0-tól 100-ig terjedő) mérésére szolgáló időkereteket.
vegye figyelembe, hogy a felülvizsgálat szerzőinek fel kell tüntetniük az előre meghatározott kritikus és fontos eredményeket a táblázatban, függetlenül attól, hogy rendelkezésre állnak-e ADATOK. Ugyanakkor figyelmet kell fordítaniuk arra a lehetőségre, hogy az eredmény (pl. súlyos káros hatás) jelentősége csak a jegyzőkönyv megírása vagy az elemzés elvégzése után válhat ismertté, és meg kell tenniük a megfelelő intézkedéseket annak érdekében, hogy ezeket felvegyék a megállapítások összefoglalása táblázatba.
a megállapítások összefoglalása táblázat a különböző összehasonlító kockázatok és hatásméretek tekintetében külön-külön tartalmazza a populáció alcsoportjaira gyakorolt hatásokat. Például a 14.1. ábrán.b az 5 évesnél fiatalabb és idősebb gyermekek esetében külön-külön kerülnek bemutatásra a hatások. Az áttekintő szerzők dönthetnek úgy is, hogy külön megállapítások összefoglalása táblázatokat készítenek a különböző populációk számára.
a felülvizsgálat szerzőinek figyelembe kell venniük a súlyos nemkívánatos eseményeket, de lehetséges, hogy a kisebb nemkívánatos eseményeket egyetlen eredményként kombinálják, és ezt magyarázó lábjegyzetben írják le (vegye figyelembe, hogy nem helyénvaló eseményeket összeadni, kivéve, ha függetlenek, vagyis az a résztvevő, aki egy nemkívánatos eseményt tapasztalt, változatlan eséllyel tapasztalja meg a másik nemkívánatos eseményt).
a több időpontban mért eredmények egy adott problémát jelentenek. Általánosságban, hogy a táblázat egyszerű legyen, az áttekintő szerzőknek csak a döntéshozatal szempontjából kritikus eredmények esetében kell több időpontot bemutatniuk, ahol az eredmény vagy a meghozott döntés valószínűleg idővel változik. A fennmaradó részt lehetőség szerint egy közös időpontban kell bemutatni.
az áttekintő szerzők folyamatos eredményméréseket mutathatnak be a megállapítások összefoglalása táblázatban, és törekedniük kell arra, hogy ezeket a célközönség számára értelmezhetővé tegyék. Ez megköveteli, hogy az egységek világosak és könnyen értelmezhetők legyenek, például a fájdalom napjai vagy a fejfájás gyakorisága, és meg kell adni az alkalmazott mérőeszközök nevét és skáláját (pl. egy 0-tól 100-ig terjedő vizuális analóg skála). Számos mérőeszköz azonban nem könnyen értelmezhető Nem szakorvos által klinikusok vagy betegek, például pontok A Beck depresszió leltár vagy életminőség pontszám. Ezek esetében egy értelmezhető prezentáció magában foglalhatja a folytonos dichotóm eredményre történő átalakítását, például > 50% – os javulást (lásd a 15.fejezet 15. szakaszát.5).
14.1.6.3 az összehasonlító beavatkozással járó kockázat legjobb becslése
a felülvizsgálat szerzőinek legfeljebb három tipikus kockázatot kell megadniuk az összehasonlító beavatkozásban részesülő résztvevők számára. A dichotóm kimenetelek esetében azt javasoljuk, hogy ezeket az eseményt 100 vagy 1000 főre eső (természetes gyakoriság) személyek számának formájában mutassák be, az eredmény gyakoriságától függően. Folyamatos eredmények esetén ezt a mért eredmény átlagos vagy medián értékeként határoznák meg.
a becsült vagy feltételezett összehasonlító beavatkozási kockázatok a különböző betegcsoportok tipikus kockázatainak értékelésén alapulhatnak, amelyek magából a felülvizsgálatból származnak, az egyes reprezentatív vizsgálatok a felülvizsgálatban, vagy a prognózisos vizsgálatok szisztematikus áttekintéséből származó kockázatok vagy más bizonyítékforrások, amelyek viszont megkövetelhetik a prognosztikai bizonyítékok bizonyosságának értékelését (Spencer et al 2012, Iorio et al 2015). Ideális esetben a kockázatok tükröznék azokat a csoportokat, amelyeket a klinikusok bemutató jellemzőik alapján könnyen azonosíthatnak.
magyarázó lábjegyzetben meg kell határozni az egyes összehasonlító csoportokra vonatkozó kockázatok forrását vagy indoklását, beleértve adott esetben azt az időszakot is, amelynek megfelelnek. A 14.1. Ábrán.a, A klinikusok könnyen megkülönböztethetik a mélyvénás trombózis kockázati tényezőivel rendelkező egyéneket a nélküliektől. Ha ismert, hogy a kiindulási kockázat csekély, akkor az áttekintő szerzők használhatják a összehasonlító csoport medián kockázatát a vizsgálatok során. Ha a tipikus kockázatok nem ismertek, lehetőség van a kockázat kiválasztására a mellékelt vizsgálatok közül, biztosítva a második legmagasabbat a magas, a második legalacsonyabbat pedig az alacsony kockázatú populáció esetében.
14.1.6.4 beavatkozással járó kockázat
a dichotóm eredmények esetében az áttekintő szerzőknek meg kell adniuk a megfelelő abszolút kockázatot minden összehasonlító csoport kockázatához, konfidencia intervallummal együtt. Ez az abszolút kockázat a (kísérleti) beavatkozással általában a relatív hatás oszlopban bemutatott metaanalízis eredményéből származik (lásd a 14.1.6.6. szakaszt). A képleteket a 14.1. szakasz tartalmazza.5. A felülvizsgálat szerzőinek az abszolút hatást ugyanolyan formátumban kell bemutatniuk, mint az összehasonlító beavatkozással járó kockázatokat (lásd a 14.1.6.3.szakaszt), például az eseményt 1000 főre jutó személyek számaként.
folyamatos eredmények esetén az átlagok különbségét vagy az átlagok standardizált különbségét konfidenciaintervallumával kell bemutatni. Ezeket általában közvetlenül a metaanalízis. Magyarázó szöveget kell használni a jelentés tisztázására, mint a 14.1.a és 14.1.b.
14.1.6.5 kockázati különbség
dichotóm kimenetelek esetén a kockázati különbség a megállapítások összefoglalása táblázat formátumának egyikével adható meg kiegészítő lehetőségként (lásd a 14.1.ábrát.b). Ez a kockázati különbség a kísérleti és a komparátor beavatkozás közötti különbséget fejezi ki, és általában a relatív hatás oszlopban bemutatott metaanalízis eredményéből származik (lásd a 14.1.6.6.pontot). A képleteket a 14.1.5.szakasz tartalmazza. A felülvizsgálat készítőinek a kockázati különbséget ugyanolyan formátumban kell bemutatniuk, mint az összehasonlító beavatkozással feltételezett és a megfelelő kockázatokat (lásd a 14.1.6.3.szakaszt); például az eseményt 1000 főre jutó személyek számaként, vagy százalékpontként, ha a feltételezett és a megfelelő kockázatokat százalékban fejezik ki.
folyamatos eredmények esetén, ha a megállapítások összefoglalása táblázat tartalmazza ezt a lehetőséget, az átlagos különbséget itt lehet bemutatni, a megfelelő kockázat oszlopot pedig üresen kell hagyni (lásd a 14.1.ábrát.b).
14.1.6.6 relatív hatás (95% CI)
a relatív hatás jellemzően kockázati arány vagy esélyhányados (vagy esetenként kockázati arány) a kísérő 95%-os konfidencia intervallummal, amelyet ugyanazon hatásmérés alapján végzett metaanalízisből nyernek. A kockázati arányok és esélyhányadosok hasonlóak, ha az összehasonlító beavatkozási kockázatok alacsonyak és a hatások kicsiek, de jelentősen eltérhetnek, ha az összehasonlító csoport kockázatai növekednek. A metaanalízis magában foglalhatja a rögzített vagy véletlenszerű hatások feltételezését, attól függően, hogy a felülvizsgálat szerzői mit tartanak megfelelőnek, és arra utal, hogy a relatív hatás vagy a beavatkozás hatásának becslése, vagy a beavatkozás átlagos hatásának becslése a tanulmányok között.
14.1.6.7 résztvevők száma (tanulmányok)
ennek az oszlopnak tartalmaznia kell az egyes eredményekre vonatkozóan a mellékelt vizsgálatokban értékelt résztvevők számát, valamint az ezekhez a résztvevőkhöz hozzájáruló tanulmányok megfelelő számát.
14.1.6.8 A bizonyítékok bizonyossága (fokozat)
az áttekintő szerzőknek kommentálniuk kell a bizonyítékok bizonyosságát (más néven a bizonyítékok minősége vagy a hatásbecslésekbe vetett bizalom). A felülvizsgálat szerzőinek az osztályozási Munkacsoport (Atkins et al 2004, Guyatt et al 2008, Guyatt et al 2011a) által kidolgozott konkrét bizonyíték-osztályozási rendszert kell alkalmazniuk, amelyet a 14.2.szakasz részletesen ismertet. Az osztályozási megközelítés a bizonyosságot a bizonyítékok halmazában az eredmény szerint ‘magas’, ‘mérsékelt’, ‘alacsony’ vagy ‘nagyon alacsony’ kategóriába sorolja. Ez az ítélet eredménye, de az ítélkezési folyamat átlátható struktúrában működik. Például a bizonyosság magas lenne, ha az összefoglaló több randomizált vizsgálatból állna, alacsony az elfogultság kockázata, de a bizonyosság besorolása alacsonyabb lesz, ha aggályok merülnek fel az elfogultság, következetlenség, közvetlenség, pontatlanság vagy publikációs elfogultság kockázatával kapcsolatban. A nem nagy bizonyossággal hozott ítéleteket magyarázó lábjegyzetek vagy a megállapítások összefoglalása táblázat Megjegyzések oszlopa segítségével kell átláthatóvá tenni (lásd a 14.1.6.10.szakaszt).
14.1.6.9 Comments
a ‘Comments’ mező célja, hogy segítse a sorban azonosított információk vagy adatok értelmezését. Például ez lehet az eredménymérés érvényessége vagy a hatás nagyságához kapcsolódó változók jelenléte. Az eredményekkel kapcsolatos fontos figyelmeztetéseket itt kell megjelölni. Nem minden sor igényel megjegyzéseket, és a legjobb, ha üresen hagyja, ha semmi nem indokolja a megjegyzést.
14.1.6.10 magyarázatok
a megállapítások összefoglalása táblázatban az ítéleteket alátámasztó részletes magyarázatokat lábjegyzetként kell feltüntetni, például az Általános osztályzat értékelését. A magyarázatoknak le kell írniuk a tartalom fontos szempontjainak indoklását. Táblázat 14.1.a hasznos magyarázatokhoz útmutatást sorol fel. A magyarázatoknak tömörnek, informatívnak, relevánsnak, könnyen érthetőnek és pontosnak kell lenniük. Ha a magyarázatokat nem lehet megfelelően leírni a lábjegyzetekben, a felülvizsgálat szerzőinek további részleteket kell megadniuk a kérdésekről a felülvizsgálat eredmény-és Vitafórumaiban.
14.1.táblázat.útmutató a megállapítások összefoglalása (SoF) táblázatokban található hasznos magyarázatokhoz. Átvéve Santesso et al (2016)
általános útmutatás
- ha lehetséges, írja be az olvasóknak szóló információkat közvetlenül a táblázatba (például a nyomon követés időtartamára vagy az alkalmazott skálára vonatkozó információkat).
- általában ne hivatkozzon a magyarázatok részben, kivéve, ha konkrét okok vannak, például az alapkockázatok forrásaira vonatkozó információk szolgáltatására (lásd a 3.pontot).
- adja meg az abszolút hatások kiszámításához használt alapkockázatokra vonatkozó információforrást.
- a táblázat befejezése után tekintse át az összes magyarázatot annak megállapításához, hogy egyesekre többször is hivatkozni lehet-e, ha átfogalmazzák vagy kombinálják őket.
- indokolja meg a bizonyítékok frissítését és visszaminősítését (lásd alább a tartományspecifikus útmutatást), és használja a GRADEpro GDT szoftvert a GRADE guidance betartásához.
- egy adott eredményre vonatkozó bizonyítékok alapján megállapítható, hogy súlyos vagy nagyon súlyos problémák vannak az érintett területen (vagy kritikusan súlyos az elfogultság kockázata miatt, ha ROBINS-I-t használnak). Ezért hasznos lehet megadni a leminősítéshez szükséges szintek számát (pl. a torzítás kockázata miatt egy szinttel leminősítve), de kerülni kell a táblázatban szereplő adatok megismétlését (valamint a képletes vagy algoritmikus jelentés benyomását). A bizonyítékprofilokban ez az információ már a táblázat celláiban található.
- bár a bizonyosság bizonyosságára vonatkozó magyarázatokra elsősorban akkor van szükség, amikor azok megváltoztatják a bizonyosságot, fontolja meg magyarázat hozzáadását, ha a bizonyosság bizonyosságát nem változtatták meg, de amikor ezt a döntést mások megkérdőjelezhetik. Ez segít megérteni a nézeteltérés okait.
- biztosítani kell, hogy a táblázatot ne használják a felülvizsgálat módszereinek leírására (pl. ne írják le a statisztikai elemzés okait).
- adjon meg olyan eredményeket, amelyek statisztikailag nem kombinálhatók metaanalízissel (pl. narratív eredmények) közvetlenül a SoF táblázatba az eredmények oszlopokban. Előfordulhat, hogy az eredmények közléséhez nincs szükség magyarázatra. Ha a célközönség számára előnyösnek tekintik, a Megjegyzések oszlopban kiegészítő becsléseket kell adni a beavatkozási hatásokról (pl. a haszon és kár kezeléséhez szükséges szám, a kockázati különbség százalékban kifejezve, a folyamatos eredmény minimális fontos különbségegységekben kifejezve).
- használja az osztályozási folyamat magyarázataiban szereplő információkat a felülvizsgálat más kulcsfontosságú részeinek tájékoztatására, beleértve az összefoglaló verziókat és a vitát.
Domain-specifikus útmutatás hasznos magyarázatok írásához
torzítás kockázata
- írja le azon tanulmányok számát vagy az általuk a metaanalízis során szolgáltatott információk mennyiségét, amelyek esetében nagy az elfogultság kockázata, és amelyek kritériuma.
- használjon olyan kifejezéseket, mint a többség, a kisebbség, az összes, néhány vagy semmi; vagy a vizsgálatok száma X/X vizsgálatként.
- randomizált vizsgálatok esetén említse meg a konkrét kritériumokat, beleértve az allokációs szekvencia elrejtését, a szelektív eredményjelentést stb. Nem randomizált vizsgálatok esetén írja le a kritériumot az alkalmazott eszközben (például a ROBINS-I eszköz használatával).
- jelölje meg, hogy a torzítás kockázatának hatását érzékenységi elemzéssel vizsgálták-e. Adott esetben említse meg az elfogultság magas kockázatával járó tanulmányok hozzájárulását a becslésekhez.
- a vizsgálati tervre vonatkozó információk szerepelhetnek a magyarázatokban, különösen a SoF – ban, ha különböző vizsgálati terveket tartalmaznak.
inkonzisztencia
- jelölje meg az inkonzisztencia megítéléséhez használt mértéket, például a statisztikai tesztet vagy mértéket (I2, Chi2, Tau), vagy a konfidencia intervallumok átfedését vagy a pontbecslések hasonlóságát.
- ha az inkonzisztencia az I2-n alapul, írja le azt jelentősnek, jelentősnek, mérsékeltnek vagy nem fontosnak.
- adott esetben említse meg, hogy a heterogenitást a PICO (betegek, beavatkozás, összehasonlítás, eredmény) alcsoport-elemzéseiben feltárták-e, és vannak-e más lehetséges okok a heterogenitásra.
- az eredményre vonatkozó egyetlen vizsgálat esetében azt kell mondani, hogy nincs, nem pedig nem alkalmazható.
pontatlanság
- jelölje meg, hogy a minta mérete vagy az események száma nem felel meg a számított optimális információméretnek, vagy az ökölszabálynak (pl. 400 esemény). Kerülje a tanulmányok számának hivatkozását a pontatlanság okaként.
- jelölje meg, hogy a konfidenciaintervallumok magukban foglalják-e a csekély hatás lehetőségét vagy sem, valamint a jelentős hasznot vagy kárt. Ha ismert, adja meg a fontos előny küszöbének numerikus értékét.
- kerülje az eredmény statisztikailag vagy nem statisztikailag szignifikáns jelentését.
frissítés
- említse meg a frissítés okát: nagy hatás miatt; dózis-válasz gradiens; vagy valószínű maradék ellentétes zavaró növeli a bizonyítékok bizonyosságát.
- nagy hatások esetén jelentse, ha a relatív hatás >2 vagy > 5. A dózis-válasz gradiensek esetében adja meg a beavatkozás szintjét és az eredményre gyakorolt hatást. A ‘hihető maradék ellentétes zavaró’ tartomány esetében írja le a zavaró tényező becslésre gyakorolt hatását.
14.2 A bizonyítékok bizonyosságának vagy minőségének értékelése
14.2.1 a fokozati megközelítés
az ajánlási, értékelési, fejlesztési és értékelési Munkacsoport (GRADE Working Group) kifejlesztett egy rendszert a bizonyítékok bizonyosságának osztályozására (Sche! Nnemann et al 2003, Atkins et al 2004, Sche! Nnemann et al 2006, Guyatt et al 2008, Guyatt et al 2011a). Több mint 100 szervezet, köztük az Egészségügyi Világszervezet (WHO), az American College of Physicians, az American Society of Hematology (ASH), a Canadian Agency for Drugs and Technology in Health (CADTH) és a National Institutes of Health and Clinical Excellence (NICE) az Egyesült Királyságban elfogadta az osztályozási rendszert (www.gradeworkinggroup.org).
a Cochrane hivatalosan is elfogadta ezt a megközelítést, és minden Cochrane-felülvizsgálatnak fokozatot kell használnia a fontos eredmények bizonyosságának értékelésére (lásd a MECIR 14.2. keretes írását.a).
MECIR doboz 14.2.a beavatkozási felülvizsgálatok lefolytatásával kapcsolatos releváns elvárások
|
C74: a bizonyítékok bizonyosságának értékelése (kötelező) |
|
|
használja az öt fokozatú megfontolásokat (az elfogultság kockázata, a hatás következetessége, pontatlanság, közvetlenség és publikációs torzítás) az egyes eredményekre vonatkozó bizonyítékok bizonyosságának felmérésére, és a felülvizsgálat szövegében a bizonyítékok bizonyosságára vonatkozó következtetések levonására. |
a fokozat a legszélesebb körben alkalmazott megközelítés a beavatkozások hatásaiba vetett bizalom összegzésére a tanulmányok eredményei szerint. Célszerű az online GRADEpro eszközt használni, és azt a szoftver súgórendszerében leírtak szerint használni. Ennek segítenie kell annak biztosítását, hogy a szerzői csoportok ugyanazokhoz az információkhoz férjenek hozzá, hogy tájékoztassák ítéleteiket. Ideális esetben két, egymástól függetlenül dolgozó embernek értékelnie kell a bizonyítékok bizonyosságát, és konszenzusra kell jutnia a leminősítési döntésekről. Az öt kategóriára vonatkozó megfontolásokat figyelembe kell venni, függetlenül attól, hogy a felülvizsgálat tartalmaz-e a megállapítások összefoglalását tartalmazó táblázatot. Hasznos erre az információra támaszkodni a vitában, a szerzők következtetéseiben, és a bizonyítékok bizonyosságát absztrakt és egyszerű nyelvű összefoglalóban közvetíteni. |
|
C75: a bizonyítékok bizonyosságának igazolására vonatkozó értékelések (kötelező) |
|
|
indokolják és dokumentálják a bizonyítékok összességének bizonyosságára vonatkozó valamennyi értékelést (pl. leminősítés vagy felminősítés besorolási fokozattal). |
a strukturált megközelítés elfogadása átláthatóságot biztosít a bizonyítékok értelmezésének megfogalmazásában, az eredmény pedig informatívabb a felhasználó számára. |
szisztematikus áttekintésekhez, A fokozatú megközelítés a bizonyítékok bizonyosságát úgy határozza meg, hogy mennyire lehet biztos abban, hogy a hatás vagy asszociáció becslése közel áll a konkrét érdeklődés mennyiségéhez. A bizonyítékok bizonyosságának értékelése magában foglalja az elfogultság (a tanulmány tervezésének és végrehajtásának korlátai vagy a módszertani minőség), az inkonzisztencia (vagy heterogenitás), a bizonyítékok közvetlensége, a hatásbecslések pontatlansága és a közzétételi torzítás kockázata (lásd a 14.2.2.szakaszt), valamint azon területek mérlegelését, amelyek növelhetik a hatásbecslésbe vetett bizalmunkat (a 14.2.3. szakaszban leírtak szerint). Az osztályozási rendszer magában foglalja az egyes eredményekre vonatkozó bizonyítékok bizonyosságának értékelését. A bizonyítékok bizonyosságát meghatározó területekkel kapcsolatos ítéleteket az eredmények vagy a vita szakaszban, valamint a megállapítások összefoglalása táblázat részeként kell leírni.
A fokozatú megközelítés a bizonyosság négy szintjét határozza meg (14.2.a). A beavatkozások esetében, beleértve a beavatkozásként értékelt diagnosztikai és egyéb vizsgálatokat is (S. D. A. és társai 2008b., S. A. D. A. és társai 2008a., Balshem S. A. 2011., S. A. A. S. A. S. A. és más vizsgálatok esetében) a bizonyítékok bizonyosságának minősítésének kiindulópontja két típusba sorolható:
- randomizált vizsgálatok; és
- nem randomizált intervenciós vizsgálatok (nrsi), beleértve a megfigyelési vizsgálatokat (beleértve, de nem kizárólagosan a kohorsz vizsgálatokat, esettanulmányokat, keresztmetszeti vizsgálatokat, esettanulmányokat és esettanulmányokat, bár ezek a minták általában nem szerepelnek a Cochrane-áttekintésekben).
számos olyan eset van, amikor az áttekintő szerzők az NRSI-től származó információkra támaszkodnak, különösen a lehetséges károk értékeléséhez (lásd a 24.fejezetet). Ezenkívül az áttekintő szerzők releváns adatokat szerezhetnek mind a randomizált vizsgálatokból, mind az NRSI-ből, mindegyik típusú bizonyíték kiegészíti a másikat (Sch Enterprises et al 2013).
évfolyamon a randomizált vizsgálatokból származó bizonyítékok nagy bizonyossággal kezdődnek, míg az NRSI-ből származó bizonyítékok alacsony bizonyossággal kezdődnek. Az nrsi alacsonyabb besorolása a véletlenszerűség hiánya által kiváltott potenciális torzítás eredménye (azaz zavaró és szelekciós torzítás).
azonban, ha az elfogultság új kockázatát használják a beavatkozások nem randomizált vizsgálataiban (ROBINS-I) eszköz (Sterne et al 2016), egy értékelési eszköz, amely lefedi a torzítás kockázatát a véletlenszerűség hiánya miatt, minden tanulmány a bizonyítékok nagy bizonyosságaként kezdődhet (Sche Oncnemann et al 2018). Az összes tanulmányterv (beleértve az NRSI-t is) nagy bizonyossággal történő megkezdésének megközelítése nem ütközik az nrsi alacsony bizonyosságú bizonyítékként történő minősítésének kezdeti fokozatú megközelítésével. Ez azért van, mert az NRSI-ből származó bizonyítékokat általában két szinttel kell csökkenteni a véletlenszerűség hiányával járó torzítás kockázata miatt, nevezetesen zavaró és szelekciós torzítás. Az NRSI magasról alacsonyra történő leminősítésének elkerülése átlátható és részletes indokolást igényel arra vonatkozóan, hogy mi enyhíti a zavaró és szelekciós torzítással kapcsolatos aggodalmakat (Sch Enterprises et al 2018). Jelenleg nagyon kevés példa létezik arra, hogy a két szinttel nem alacsonyabb besorolás megfelelő.
a legmagasabb bizonyossági besorolás akkor minősül bizonyítéknak, ha a 14.2.ábrán felsorolt besorolási tényezők egyike sem aggályos.a. az áttekintő szerzők gyakran mérsékelt, alacsony vagy akár nagyon alacsony bizonyossági bizonyítékokra csökkentik a bizonyítékokat, a 14.2. ábrán szereplő öt tényező jelenlététől függően.a. a bizonyossági besorolás általában minden tényező esetében egy szinttel, minden tényező esetében legfeljebb három szinttel csökken. Ha nagyon súlyos problémák merülnek fel bármelyik területen (pl. az elfogultság kockázatának értékelésekor az összes vizsgálatot nem fedték le, nem vakították el, és a betegek több mint 50%-át elvesztették a nyomon követésre), a bizonyítékok két szinttel csökkenhetnek egyedül ennek a tényezőnek köszönhetően. Nem lehet a nagyon alacsony bizonyosságnál alacsonyabb értéket értékelni.
az áttekintő szerzők általában a megbízható, nem randomizált vizsgálatokból származó bizonyítékokat alacsony bizonyosságnak minősítik, még akkor is, ha ROBINS-I-t használnak. Ha azonban az ilyen vizsgálatok nagy hatásokat eredményeznek, és nincs nyilvánvaló torzítás, amely megmagyarázná ezeket a hatásokat, az áttekintő szerzők a bizonyítékokat mérsékeltnek vagy – ha a hatás elég nagy – akár nagy bizonyosságnak is értékelhetik (14.2.a). A nagyon alacsony bizonyossági szint megfelelő, de nem kizárólagosan a kritikus problémákkal és a nem szisztematikus klinikai megfigyelésekkel (pl. esettanulmányok vagy esettanulmányok) végzett vizsgálatokhoz.