Bevezetés
az egészségügyi ellátással összefüggő fertőzések (HAIs), mint például a multirezisztens Pseudomonas aeruginosa törzsek által okozott bacteremia, megnövekedett morbiditást és mortalitást eredményeznek, meghosszabbítva a kórházi kezelést, és magasabbak a költségek az érzékeny törzsek által okozott fertőzésekhez képest.1-3 Az ilyen rezisztens mikroorganizmusok által okozott fertőzések gyakran összefüggenek az életkorral, a rákkal, a szívbetegséggel, a cukorbetegséggel, az antibiotikumok intenzív használatával és az invazív eljárásokkal, mint például a hemodialízis, a mechanikus szellőztető katéter, a tracheostomia és mások.4
a multirezisztens P növekvő előfordulása. az aeruginosa, mint a nozokomiális fertőzés oka, globális probléma, ennek a mikroorganizmusnak az a képessége, hogy az antimikrobiális kemoterápia során szinte minden más antimikrobiális szerrel szemben rezisztenciát alakítson ki, akár a kromoszómális gének mutációinak kiválasztásával, akár horizontális génátadással.5,6 Brazíliában ez a probléma még jelentősebb, mivel nagyon nagy az antibiotikum-használat sűrűsége, különösen a laktámok, karbapenemek és fluorokinolonok esetében.7,8 az ellenállás P. néhány Brazil kórházban az aeruginosa-karbapenemek aránya akár 60%-ot is elérhet9,10, és főként metallo-ons-laktamázok (MBL) termelésével fordul elő.
az MBL enzimek tíz alosztálya ismert: IMP (Imipenemáz), VIM (Verona Imipenemáz), SPM-1 (s Xhamo Paulo MBL), GIM (német Imipenemáz), SIM-1 (Seul Imipenemáz),11 AIM-1 (Ausztrál Imipenemáz),12 KHM (Kyorin Egyetemi Kórház),13 NDM-1 (Újdelhi MBL),14 DIM-1 (holland imipenemase),15 és TMB (Tripoli MBL).16 Brazíliában a legelterjedtebb alosztályok az IMP-1 és az SPM-1.11
számos más virulencia gén, valamint a biofilm képződése hozzájárulhat a súlyos fertőzések patogenitásához,különösen az invazív eljárásokkal összefüggésben.17 a szakirodalomban leírt főbb virulencia tényezők közül kiemeljük azokat, amelyek a mikroorganizmusok gazdasejtekhez való tapadásával kapcsolatosak a flagella, a fimbriae és az alginate18 révén, valamint azokat, amelyek megkönnyítik az epiteliális integritás megzavarását és zavarják az immunrendszert, mint például az elasztáz, a foszfolipáz C és a proteáz lúgos, további exotoxin A, pyocianin és pyoverdine.19 a biofilm-termelés különösen összefügg azzal, hogy az antibiotikumok nehezen jutnak be a sejtekbe, mivel poliszacharidokból, fehérjékből és DNS-ből álló polimer mátrixot választanak ki.20,21
a vizsgálat célja az volt, hogy azonosítsa a karbapenem-rezisztens P. aeruginosa által okozott bakterémiával kapcsolatos kockázati tényezőket, valamint az MBL termelését. Ezenkívül megvizsgáltuk a virulencia gének gyakoriságát és a biofilm képződésének képességét.
anyagok és módszerekbetegek és kórház
a P. az aeruginosa törzseket az Uberlandia Egyetemi Kórházba (Brazília), az Uberl Szövetségi Egyetemre (HC-UFU) felvett betegekből nyerték ki, és a HC-UFU mikrobiológiai laboratóriumából szerezték be a 2009 májusától 2012 decemberéig tartó időszakban, Figyelembe véve csak a fertőzés első epizódját.
tanulmányterv
egy esetet (a karbapenemekkel szemben rezisztens P. aeruginosa miatt bakterémiában szenvedő betegek) végeztünk kontroll (a P. aeruginosa által okozott bakterémiában szenvedő betegek, akik érzékenyek a karbapenemekre) vizsgálat a P-vel fertőzött betegek kockázati tényezőinek azonosítására. aeruginosa ellenáll a karbapenemeknek. Ezenkívül értékeltük másodlagos eredmények, beleértve a kórházi ápolás időszakait, felvétel az intenzív osztályra (ICU), valamint invazív eljárások alkalmazása. A vizsgálatba bevont betegek demográfiai, klinikai és epidemiológiai jellemzői a klinikai feljegyzésekből származnak.
definíciók
az egészségügyi ellátással összefüggő fertőzések (HAIs) minden olyan fertőzés, amelyet a beteg kórházba történő felvétele után szereztek be. A HAIs a kórházi kezelés során vagy a mentesítés után nyilvánulhat meg, mivel a kórházi ápoláshoz vagy a kórházi kezelés során végzett eljárásokhoz kapcsolódnak.22 bakterémia, a Centers for Disease Control and Prevention szerint, 23 meghatározható életképes baktériumok jelenléteként a vérben, amelyet pozitív vérkultúra eredmény dokumentál. A bakterémiát elsődlegesnek minősítették, amikor nem volt összefüggésben a fertőzés másik fókuszával, vagy amikor intravénás katéterrel volt összefüggésben, és másodlagos, amikor klinikailag összefüggött egy másik anatómiai hely fertőzésével.9 A Multirezisztencia definíciója: szerzett nem-érzékenység legalább egy szerrel szemben három vagy több antimikrobiális kategóriában.24 az antimikrobiális terápiát nem tartották megfelelőnek, amikor egy izolált mikroorganizmus in vitro rezisztenciát mutatott a beteg kezelésére használt antimikrobiális szerekkel szemben és / vagy a mikrobiális fertőzések diagnózisát követő 24 órán át nem kezelték.25
Klinikai Mikrobiológiai és molekuláris vizsgálatok
a tenyészeteket a HC-UFU mikrobiológiai laboratóriuma által használt protokoll szerint gyűjtöttük össze, és a BACT/Alert GmbH automatizált rendszer segítségével dolgoztuk fel őket (Biomingonconkrieux, Durham, USA). Az azonosítási és antimikrobiális érzékenységi vizsgálatokat a VITEK II rendszer alkalmazásával automatizálással végezték, és a közepes érzékenységet mutató törzseket rezisztensnek tekintették. A minőség-ellenőrzési protokollokat a Clinical and Laboratory Standard Institute szabványainak megfelelően alkalmazták.26-28 a karbapenem-rezisztens P. az aeruginosa izolátumokat fenotípusosan szűrtük MBL-termelésre kettős lemezes szinergiatesztekkel, amint azt korábban leírtuk.29,30 ezenkívül az MBL gének P. aeruginosa törzsekben való jelenlétének értékelésére multiplex PCR-t végeztünk, a korábban leírtak szerint.31 a ciklus feltételei a következők voltak: 94 db C 5 perc, majd 30 db denaturációs ciklus 94 db C 30-as, 53 db C 45-ös, és 72 db C 30-as, majd 72 db C 10-es, mind MasterCycler personal (Eppendorf). Az alkalikus proteáz (aprA), az elasztáz A (lasA), az elasztáz (lasB),a 32 hemolitikus foszfolipáz C (plcH), a nem hemolitikus foszfolipáz C (plcN), az exotoxin a (toxA) és az alginát (algD)33 kódoló virulencia gének kimutatását uniplex PCR-rel határoztuk meg, a következő protokollt alkalmazva: 94 db C 3 perc, 30 ciklus 94 db C 30 perc, 55 db C 1 perc és 72 dB 1 perc, és 30-as és 72-es évek C 5 perc alatt.
kezdeti adhéziós vizsgálat34
a kezdeti adhézió értékeléséhez 200 db cella-szuszpenziót adtunk a 96 lyukú polisztirol lemezekhez, amely 1 db 107 sejt/mL-t tartalmaz TSB-ben. A kezdeti tapadást 2 órán keresztül hagytuk bekövetkezni 37-nél 620 fordulat / perc forgással. A 96 lyukú polisztirol lemezeken tapadt baktériumokat kétszer mossuk 0,9%-os NaCl-oldattal, és a kutak 90-es évek kaparásával betakarítjuk. a kapott sejtszuszpenziót TSA-ra vontuk be kolóniaképző egység (CFU) számláláshoz. Az összes kísérletet három példányban, három független kísérletben végeztük. Az ATCC15692 (PAO1) törzset pozitív kontrollként, a baktériumok nélküli TSB-t pedig negatív kontrollként használták.
Biofilmképződési vizsgálat35
200 db TSB-ben előállított, 1 db 107 sejt/mL-t tartalmazó sejtszuszpenziót adtunk a 96 lyukú polisztirol lemezekhez. A Biofilm képződését 24 órán át hagytuk bekövetkezni 37-en 620 fordulat / perc forgással. A 96 lyukú polisztirol lemezeken termesztett baktériumokat kétszer mossuk 0,9% – os NaCl-oldattal, majd fordított helyzetben száradni hagyjuk. A teljes biomasszát metanol (Merck) rögzítéssel, kristálylila (Merck) festéssel és savas ecetsav (Merck) elúcióval mértük a korábban leírtak szerint. Az eluált festéket minden kútból eltávolították, és egy új, 96 lyukú mikrotiter lemezbe helyezték, és abszorbanciáját egy ELISA lemezolvasón (BioTek Instruments Inc., Vermont, USA) 570 nm-en. A kísérleteket nyolc ismétléssel végeztük minden törzsre három független kísérletben. A baktériumok nélküli TSB-t negatív kontrollként használták. Az optikai sűrűség küszöbértékét (ODc) három szórásként (SD) határoztuk meg a negatív kontroll optikai sűrűségének (OD) átlaga felett: ODc=negatív kontroll átlagos OD+3x negatív kontroll SD. Az eredmények könnyebb értelmezése érdekében a törzseket az optikai sűrűség szerint a következő kategóriákra osztottuk: (ODi): ODi .. ODC vagy ODc
ODi2x ODc=nem biofilm termelő/gyenge biofilm termelő; 2x ODcODi4x ODc=mérsékelt biofilm termelő; 4x ODcODi=erős biofilm termelő.Biofilm sejtkoncentráció36
a biofilm sejtkoncentrációt CFU számlálással határoztuk meg. A biofilm képződése után a biofilmeket kétszer mossuk 0,9% – os NaCl-oldattal, majd a kutak 90-es évekig történő lekaparása után betakarítjuk. a kapott sejtszuszpenziót TSA lemezekre vontuk. Minden kísérletet három példányban, három független alkalommal végeztünk.
statisztikai elemzés
a statisztikai elemzést GraphPad Prism V.5 (GraphPad Software, San Diego, CA) segítségével végeztük. A kvantitatív vizsgálatokat a Kruskal–Wallis alkalmazásával hasonlítottuk össze, Dunn többszörös összehasonlító tesztjét alkalmazva. Minden vizsgálatot 95% – os konfidenciaszinttel végeztünk, és a statisztikai szignifikancia meghatározása p
0,05 volt.Etikai jóváhagyás
az Uberlandia Szövetségi Egyetem kutatási Etikai Bizottsága értékelte és jóváhagyta tanulmányi tervünket.
eredmények
1. május 2009-től 31. December 2012-ig az Egyetemi Kórház mikrobiológiai laboratóriumában kórházi megfigyelést végeztek a P. aeruginosa bakterémia előfordulásáról. Ebben az időszakban 157 nem ismétlődő P. aeruginosa bakterémiában szenvedő beteget vontak be a vizsgálatba. A bakterémia kialakulásával kapcsolatos tényezőkre, a klinikai és demográfiai jellemzőkre, valamint a betegek osztályonkénti megoszlására vonatkozó részletes információkat az 1.és 2. táblázat mutatja. Az elsődleges bakterémia 75,8% – ban, az ismeretlen fókuszú betegek pedig 62% – ban fordultak elő.Az esetek 4% – ában. A másodlagos bakterémia a betegek 24,2% – át tette ki, ahol a fertőzés fő fókusza a légzőrendszer volt (17,2%). Ezenkívül a betegek 43,9%-ánál volt bakterémia karbapenem-rezisztens P. aeruginosa-val, és ezeknek a betegeknek a többségét felvették az intenzív osztályra. A legtöbb beteg férfi volt (66,8%), az átlagos kórházi tartózkodás 63,2 60,17 nap, az átlagos életkor 52,01 20,24 év volt.
a Pseudomonas aeruginosa-val fertőzött betegek megoszlása az Uberl Szövetségi Egyetem Klinikai Kórházának különböző egységeiben, 2009 májusától 2012 decemberéig.
| klinikák | összesen | karbapenem-rezisztens Pseudomonas aeruginosa |
|---|---|---|
| N=157 (%) | N=69 (%) | |
| sebészet | 35 (22.3) | 16 (23.2) |
| orvosi klinika | 24 (15.3) | 10 (14.5) |
| onkológia | 14 (8.9) | 2 (2.9) |
| sürgősségi szoba | 9 (5.7) | 5 (7.3) |
| ICUa | 50 (31.9) | 31 (44.9) |
| újszülött ICU | 2 (1.3) | 0 |
| gyermek ICU | 2 (1.3) | 1 (1.5) |
| transzplantáció | 2 (1.3) | 0 |
| Egyéb | 3 (1.9) | 0 |
intenzív osztály.
Burneds, mellkasi fájdalom egység.
a karbapenem-rezisztenciával kapcsolatos kockázati tényezők Pseudomonas aeruginosa által okozott bakterémiában szenvedő betegeknél.
| kockázati tényezők | összesen | karbapenem rezisztens | Multisensitivea | egyváltozós | többváltozós | ||
|---|---|---|---|---|---|---|---|
| N=157 (%) | N=69 (%) | N=65 (%) | ORb (CIc 95%) | pd | vagy (CI 95%) | p | |
| életkor-átlag (év) | 52.01±24.49 | 59.01±20.24 | 43.18±27.56 | – | 0.0009* | – | – |
| férfi / nő | 105/52 (66.88/33.12) | 45 (65.22)/24 (34.78) | 43 (66.15)/22 (33.85) | 0.9593 (0.4698–1.959) | 0.9092 | – | – |
| a kórházi kezelés ideje, átlag (nap) | 63.2±80.17 | 60.01±48.97 | 68.86±110.4 | – | 0.3477 | – | – |
| intenzív osztály | 74 (47.13) | 38 (55.07) | 22 (33.85) | 2.396 (1.190–4.822) | 0.0135 | – | – |
| sebészet | 69 (43.95) | 37 (53.62) | 20 (30.77) | 2.602 (1.281–5.282) | 0.0075* | – | – |
| invazív eljárások (72h) | 139 (88.53) | 64 (92.75) | 54 (83.08) | 2.607 (0.8527–7.973) | 0.0843 | – | – |
| Mechanical ventilation | 89 (56.69) | 48 (69.56) | 28 (43.08) | 3.020 (1.485–6.144) | 0.002* | 3.0674 (1.22–7.73) | 0.0175 |
| Tracheostomy | 70 (44.58) | 43 (62.32) | 17 (26.15) | 4.670 (2.234–9.759) | * | – | – |
| Urinary catheter | 101 (64.33) | 52 (75.36) | 34 (52.31) | 2.789 (1.340–5.804) | 0.0054* | – | – |
| vénás központi katéter | 125 (79.62) | 59 (85.51) | 48 (73.85) | 2.090 (0.8761–4.984) | 0.0926 | – | – |
| sebészeti lefolyó | 24 (15.29) | 14 (20.29) | 7 (10.77) | 2.109 (0.7918–5.618) | 0.1297 | – | – |
| szondák enterális / gyomor táplálkozás | 109 (69.43) | 54 (78.26) | 40 (61.54) | 2.250 (1.053–4.810) | 0.0345* | 3.8347 (1.43–10.26) | 0.0074 |
| hemodialízis | 39 (24.84) | 27 (39.13) | 8 (12.31) | 4.580 (1.892–11.09) | 0.0004* | ||
| parenterális táplálás | 25 (1.92) | 14 (20.29) | 8 (12.31) | 1.814 (0.7052–4.664) | 0.2125 | – | – |
| komorbiditási feltételek | 122 (77.70) | 53 (76.81) | 49 (75.38) | 1.082 (0.4886–2.394) | 0.8465 | – | – |
| szívelégtelenség | 35 (22.29) | 21 (30.43) | 12 (18.46) | 1.932 (0.8597–4.343) | 0.1079 | – | – |
| rák | 32 (20.38) | 8 (11.59) | 17 (26.15) | 0.3703 (0.1473–0.9308) | 0.0306 | – | – |
| Diabetes mellitus | 21 (13.37) | 9 (13.04) | 7 (10.75) | 1.243 (0.4341–3.558) | 0.6849 | – | – |
| krónikus veseelégtelenség | 40 (25.48) | 21 (30.43) | 16 (24.61) | 1.340 (0.6249–2.873) | 0.4514 | – | – |
| humán immundeficiencia vírus | 10 (6.37) | 5 (7.25) | 3 (4.61) | 1.615 (0.3699–7.048) | 0.7191 | – | – |
| ASISescore≥4 | 81 (51.59) | 35 (50.72) | 33 (50.77) | 0.9982 (0.5068–1.966) | 0.9959 | – | – |
| elsődleges bakterémia | 119 (75.79) | 45 (65.22) | 57 (87.69) | 0.2632 (0.1080–0.6413) | 0.0023* | – | – |
| központi vonal katéter kapcsolódó | 21 (13.37) | 11 (15.94) | 7 (10.75) | 1.571 (0.5693–4.338) | 0.3802 | – | – |
| ismeretlen | 98 (62.42) | 34 (49.27) | 50 (76.9) | 0.2914 (0.1383–0.6143) | 0.0009 | 0.2363 (0.08–0.73) | 0.0127 |
| másodlagos bakterémia | 38 (24.20) | 24 (34.78) | 8 (12.31) | 3.800 (1.559–9.260) | 0.0023* | – | – |
| légutak | 27 (17.19) | 17 (24.64) | 5 (7.69) | 3.923 (1.353–11.37) | 0.0081* | – | – |
| húgyúti rendszer | 6 (3.82) | 4 (5.79) | 1 (1.54) | 3.938 (0.4282–36.22) | 0.3666 | – | – |
| nem megfelelő terápia | 49 (31.21) | 32 (46.37) | 8 (12.31) | 6.162 (2.560–14.83) | * | 8.5534 (3.28–22.32) | |
| az antibiotikumok korábbi használata | 123 (78.34) | 59 (85.51) | 43 (66.15) | 3.019 (1.297–7.025) | 0.0086* | – | – |
| halálozás | 92 (58.59) | 48 (69.56) | 32 (49.23) | 2.357 (1.163–4.779) | 0.0165* | 2.3660 (1.15–4.85) | 0.0186 |
Multiszenzitív törzseket úgy tekintették, mint azokat, amelyek érzékenységet mutattak az összes vizsgált antimikrobiális szerre.
esélyhányados.
konfidencia intervallum.
p érték.
a betegség súlyosságának átlagos pontszáma.
statisztikailag szignifikáns (p 0,05).
gyakori volt az antibiotikumok (78,3%), az invazív eljárások (88,5%), a társbetegségek (77,7%) és a korábbi műtétek (43,9%) alkalmazása. Megállapítást nyert, hogy a betegek 31,2% – a nem megfelelő kezelést kapott, a halálozási arány 58,6% volt. Számos belső és külső tényező a P törzsek bakterémia kialakulásához. a karbapenemekkel szemben rezisztens aeruginosa-t egyváltozós analízissel detektálták. Azonban csak a mechanikus szellőzés, az enterális/nasogastricus csövek, az ismeretlen fókuszú primer bacteriaemia és a nem megfelelő terápia voltak a karbapenem-rezisztens P. aeruginosa bacteriaemia kialakulásával függetlenül összefüggő kockázati tényezők.
MBL termelést elemeztünk 56 karbapenem-rezisztens P. aeruginosa izolátum esetében. Kilenc (25,0%) izolátum fenotípusosan pozitív volt, és összesen 16,1% (n= 9/56) konzisztens volt az AMPLICONS MBL génekkel, ami 10,71% blaSPM-1 és 5 volt.3% blaVIM gének általában a törzsek multidrug rezisztencia profilt mutattak. A többi vizsgált virulencia gén esetében (aprA, plcH, plcN, lasA, lasB, toxA és algD) az összes törzs magas gyakoriságot mutatott (88%).
a 88 karbapenem-fogékony P. aeruginosa törzs közül 21 (23,9%) rezisztens volt más ons-laktámokkal szemben. A karbapenemekkel szemben rezisztens 69 törzs esetében a rezisztencia profil magas volt: 50/69 (72,5%), 48/69 (69,6%) fluorokinolonok és 50/69 (72,5%) aminoglikozidok (3.táblázat).
Antimicrobial resistance profiles in samples of Pseudomonas aeruginosa isolated from blood.
| Antimicrobial | Carbapenems | p (OR) | |
|---|---|---|---|
| Resistant group N=69 (%) |
Susceptible group N=88 (%) |
||
| Ceftazidime | 51 (73.9) | 10 (11.4) | |
| Cefepime | 45 (65.2) | 17 (19.3) | |
| Piperacillin/tazobactam | 37 (53.6) | 12 (13.6) | |
| Fluorquinolones (ciprofloxacin and levofloxacin) | 48 (69.6) | 17 (19.3) | |
| Aminoglicosides (amikacin and gentamicin) | 50 (72.5) | 12 (13.6) | |
az MBL kutatás mellett öt törzset választottak ki (kettő SPM-1-et, egy VIM-et, kettő pedig fenotípusosan pozitív MBL-t tartalmaz) a biofilm képződés értékelésére a teljes biomassza kvantitatív vizsgálataival kristálylila festéssel. Figyelembe véve az MBL gének jelenlétét, az összes törzset erősen biofilm-termelőként azonosították, átlagosan 0,90 0,61 db biomasszával. Az egyes törzsek kezdeti tapadásának különbségeit nem figyelték meg. A blaVIM gént tartalmazó törzs esetében azonban alacsonyabb volt az OD (ábra. 1).
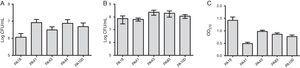
a) a polisztirol felületre tapadt sejtek száma 2 óra után, log CFU/mL-ben kifejezve 5 vérből izolált Pseudomonas aeruginosa mintára. B) az életképes sejtek száma a biofilmben (log CFU/mL). (C) biomassza biofilm kifejezve optikai sűrűsége kristály ibolya (OD570nm).
Vita
a multirezisztens mikroorganizmusok által okozott kórházi bakterémiát, akár Gram-pozitív, akár Gram-negatív, gyakran jelentős egészségügyi problémaként írják le, amely növeli a kórházi költségeket, és megnehezíti a megfelelő antimikrobiális terápia megállapítását, ami rosszabb prognózist eredményez.37 a karbapenemekkel szemben rezisztens P. aeruginosa által okozott kórházi bakterémia magas aránya jelzi ennek a szervezetnek a fontosságát, mint a fertőzés jelentős okát kórházunkban. A karbapenemekkel szemben rezisztens P. aeruginosa által okozott kórházi bakterémia magas aránya jelzi ennek a szervezetnek a fontosságát, mint a fertőzés jelentős okát kórházunkban. Különböző vizsgálatok eredményei arra utalnak, hogy a belső kockázati tényezők, mint például a mechanikus szellőzés, a nasogastricus cső használata és az antibiotikumok előzetes alkalmazása növelik a karbapenemekkel szemben rezisztens P. aeruginosa által okozott bakterémia kialakulásának kockázatát, valamint a morbiditás és mortalitás kockázatát.38
ebben a vizsgálatban a kockázati tényezők több mint 50% – át a mikroorganizmus fertőzésével társították egyváltozós elemzés szerint. Többváltozós analízissel azonban csak a gépi lélegeztetést, az enterális/gyomortápláló csöveket, az ismeretlen eredetű primer bakterémiát és a nem megfelelő kezelést tekintették független kockázati tényezőknek.
a központi vénás katéter a szerzett bakterémia egyik legjelentősebb kockázati tényezője a kórházban, mivel e fertőzések több mint 90% – ával társult.39 bár ez nem volt jelentős kockázati tényező ebben a vizsgálatban, a karbapenem-rezisztens P. aeruginosa bakterémiában szenvedő betegek 85,5% – ánál volt ez az invazív eljárás.
gyakran az antibiotikumokkal szemben rezisztens P. aeruginosa által okozott bakterémia magasabb halálozási arányt mutat, különösen a nem megfelelő antibiotikum-terápia beadása miatt.40 ebben a tanulmányban 157 betegből álló kohortot vizsgáltunk P. aeruginosa törzsek által okozott bakterémiában, közülük 69-et karbapenem-rezisztens P. aeruginosa izolátumokkal fertőztek meg. A teljes mortalitás magasabb volt a karbapenem-rezisztens csoportban; a rezisztens törzsek jelenléte azonban szignifikánsan összefüggött a nem megfelelő antimikrobiális terápiával, bizonyítva, hogy ennek a csoportnak általában rosszabb a prognózisa. Eredményeinkhez hasonlóan a korábbi vizsgálatok azt mutatták, hogy a nem megfelelő terápiában részesülő betegekből izolált P. aeruginosa prognózisa rosszabb volt, 46,1% – kal 41 és 53,8% – kal.42
amellett, hogy súlyos fertőzésekkel jár, a P. aeruginosa karbapenemekkel szembeni rezisztenciája gyakran MBL termelését eredményezi.43 eredményeink azt mutatták, hogy a karbapenem-rezisztens P. az aeruginosa az egész kórházban elterjedt volt olyan génekkel, amelyek ezeket az enzimeket kódolják a törzsek 16,1%-ában, a blaSPM-1 genotípus 10,7% – ában és a blaVIM genotípus 5,4% – ában. Mivel a multirezisztens törzsek gyakorisága magas volt, ezek az eredmények arra utalnak, hogy más rezisztencia mechanizmusok is léteznek ezekben a törzsekben, mint például az efflux szivattyúk és a membrán áthatolhatatlansága.44
az MBL mint rezisztencia mechanizmus prevalenciája megnőtt, különösen Latin-Amerikában.45 Brazíliában az MBL-t termelő P prevalenciája. az aeruginosa régiók és kórházak között változik, az arány 7,5% és 44% között mozog.11
az SPM-1 enzimet Brazíliában tekintik a leggyakoribbnak, amelyet IMP-1,11,46 követ azonban a Vim enzimet tartalmazó P. aeruginosa izolátumok gyakorisága is megnőtt.45,47 vizsgálatunkban az SPM-1 enzimet az MBL fenotípusosan termelő mintáinak 16,7% – ában detektáltuk, majd VIM enzimet, amelyet az esetek 8,3% – ában detektáltunk. Ezek az eredmények az MBL-t kódoló gének jelentős terjedését jelzik régiónkban.
figyelembe véve az MBL és a biofilm termelés jelenlétét, a törzsek 100% – át erős termelőknek minősítették. Egy másik Brazíliai tanulmány megállapította, hogy az erős biofilmet előállító P. aeruginosa 40%-a MBL-gyártó is volt.35 úgy véljük, hogy ezek az eredmények akkor fontosak, ha ezek a jellemzők (biofilm termelés és MBL) átfedik egymást, és az e baktériumok által okozott fertőzések nehezen kezelhetők. Ez részben azért indokolt, mert a baktériumok szaporodása a biofilmben körülbelül 64-szer ellenállóbb az antimikrobiális szerekkel szemben.48
P. az aeruginosa számos extracelluláris virulencia faktorral rendelkezik, amelyek szintén hozzájárulnak ezeknek a fertőzéseknek a patogenitásához és súlyosságához, mint például az aprA, plcH, plcN, lasA, lasB, toxA és algD gének által kódolt.32,33 adataink azt mutatták, hogy a multirezisztens profil jelenléte a legtöbb törzsben (88%) pozitív volt az aprA, a plcH, a plcN, a lasA, a lasB, a toxA és az algD virulencia génekre, kivéve egy olyan törzset, amely nem mutatta a toxA és a plcH géneket, ami tovább hozzájárulhat a súlyos fertőzésekkel kapcsolatos rosszabb prognózishoz.
eredményeink megerősítik a P. aeruginosa karbapenem-rezisztens bakterémia kialakulásának kockázati tényezőivel kapcsolatos korábbi megállapításokat, valamint az MBL-t termelő spm-1 típusú törzsek terjesztését. Ez a tanulmány azonban hozzájárul az MBL-t termelő törzsek, különösen a VIM típus terjedésének további bizonyítékaihoz az erősen virulens törzsekben és az erősen biofilm-termelőkben.
összeférhetetlenség
a szerzők nem nyilatkoznak összeférhetetlenségről.