Bevezetés
a Helicobacter pylori (H. pylori) egy Gram-negatív mikroaerofil baktérium, amelynek természetes élőhelye a gyomor. Bár jellemzően bacilláris formája van, egyik végén több flagellával, kedvezőtlen környezeti körülmények között coccoid megjelenést kölcsönöz.1, 2
H. a pylori az aktív krónikus gastritis, a peptikus fekély, a gyomor nyálkahártyájával összefüggő lymphoid tissue (MALT) lymphoma és a gyomorrák egyik fő etiológiai tényezője. Bár a becslések szerint a baktérium a világ népességének felének gyomornyálkahártyájában van jelen, ezek a betegségek csak a gyarmatosított egyének körülbelül 15-20% – ában alakulnak ki.2,3
a leggyakoribb kezelési rendek 85% körüli felszámolási arányt eredményeztek számos földrajzi területen, 4-6, de a hatékonyságot veszélyeztette, különösen az utóbbi években, az antibiotikum-rezisztens törzsek gyors megjelenése és a kezelés rossz betartása.5,7
fontos figyelembe venni, hogy az aktív krónikus gastritis és peptikus fekély, valamint a gyomor maláta lymphoma néhány alacsony fokú formájának gyógyítása (valamint a szövődmények megelőzése) a H. pylori felszámolásának sikerétől függ. Ezenkívül a mikroorganizmus minden biológiai formájának sikeres felszámolása és fenntartása megakadályozná a fertőzés újbóli kiújulását, és ezáltal a betegség visszaesését.
a felülvizsgálat célja, hogy általános áttekintést nyújtson a H. pylori coccoid formájáról, kiemelve annak mikrobiológiai profilját, antibiotikum-érzékenységét és virulenciáját. A gyomorbetegségben való részvételét is elemezni fogják, és azt is megvizsgálják, hogy milyen mértékben kapcsolódik a fertőzés visszatéréséhez és a betegség visszaeséséhez.
a H túlélése és sejtadaptációja. pyloriGeneral considerations
minden élő szervezet olyan mechanizmusokkal van felszerelve, amelyek lehetővé teszik számukra a túlélést kedvezőtlen környezetben. Egyesek számára válaszuk (a metabolikus adaptációk mellett) a sejtmorfológia változásait is magában foglalja.8,9 számos mikroorganizmus képes életképes, de nem tenyészthető (vbnc) állapotba differenciálódni a túlélésre és növekedésre kedvezőtlen környezeti feltételek hatására. Ezt a stratégiát széles körben használják olyan mikroorganizmusok, mint a Salmonella, a Campylobacter és az Escherichia.10,11
VBNC állapotban a baktériumok általában csökkentik méretüket és megváltoztatják alakjukat, hogy kis gömb alakú testekké váljanak. Csökkentik légzési sebességüket és tápanyag-transzportjukat, megváltoztatják a génexpressziót és a molekuláris szintézist. Ebben az állapotban nem lehet kimutatni hagyományos tenyésztési technikákkal. A környezeti feltételek változásai azonban ezeket a mikroorganizmusokat “újjáéleszthetik” (és újra aktív állapotba kerülhetnek), vagy degenerálódhatnak.10-13
Hasonlóképpen, H. a pylori, amikor káros környezeti feltételeket tapasztal (természetes élőhelyén vagy azon kívül), megváltoztatja klasszikus bacilláris formáját és VBNC állapotba kerül, amely morfológiai és metabolikus változásokhoz, valamint a növekedési viselkedés módosulásához vezet.14,15
a H. pylori életképes, de nem kulturálható állapota
bár egyes szerzők kezdetben megpróbálták bizonyítani, hogy a bacillárisból a coccoid formába való átalakulás passzív folyamat volt, amely sejthalált eredményezett,és ezért a coccoid formák az elhalt baktériumok degenerált maradványai voltak,16, 17 a H három formája. a pylori jelenleg létezőnek tekinthető, nevezetesen (a legkevésbé virulens sorrendben), az életképes, tenyészthető bacilláris forma, a vbnc coccoid forma és a nem életképes degeneratív forma.18-20
morfológiailag a bacillárisból a coccoid formába történő átalakulás közbenső V – és U-formákon keresztül történik13,14 (ábra. 1 és 2), amelyben a sejtszerkezetek,mint a citoplazma és a sejtmembrán sértetlenek maradnak,15, 21, míg a flagella általában a coccoid sejtszerkezet köré tekeredik, ezáltal szinte láthatatlanná válik. A coccoid forma egyéb ultrastrukturális módosításai két altípust eredményeznek. Az A típusnak szabálytalan élei vannak, durva felülettel, és halott sejtnek tekintik, míg a B típusnak simább felülete van, kisebb és élő sejtnek tekinthető.21,22
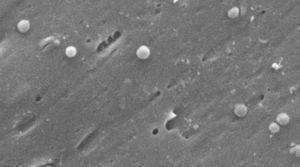
képek a Helicobacter pylori coccoid formájáról. Pásztázó elektronmikroszkóp kép Dr. Nuno F. Azevedo jóvoltából. LEPABE-az Oportói Egyetem Mérnöki Karának Vegyészmérnöki Tanszéke (Portugália).
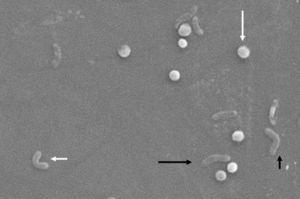
a Helicobacter pylori morfológiai változásai. Spirális forma (hosszú fekete nyíl), V-forma (rövid fekete nyíl), U-forma (rövid fehér nyíl) és coccoid forma (hosszú fehér nyíl). Pásztázó elektronmikroszkóp kép Dr. Nuno F. Azevedo jóvoltából. LEPABE-az Oportói Egyetem Mérnöki Karának Vegyészmérnöki Tanszéke (Portugália).
pásztázó elektronmikroszkópban (sem) a H. pylori-val fertőzött gyomorrákos betegek felszíni nyálkahártya-gélrétegének elemzése, Ota et al.23 megfigyelték mind a bacilláris, mind a coccoid formák együttélését. Más szerzők megerősítették a coccoid forma jelenlétét mind az emberi gyomorban,mind a duodenumban, 24-26, bár úgy tűnik, hogy a coccoid formák százalékos aránya magasabb a duodenumban, mint a gyomorban, addig a pontig, ahol csak a coccoid forma figyelhető meg néhány duodenális biopsziában.26,27 ez a tény arra utal, hogy H. a pylori kénytelen alkalmazkodni a duodenum biológiai körülményeihez, vagy hogy ezek a körülmények ideálisak ahhoz, hogy H. pylori ott menedéket találjon a VBNC állapotban.
In vitro és in vivo kísérletek kimutatták, hogy kedvezőtlen körülmények között,mint az aerobiosis,28,29 lúgos pH,29,30 magas hőmérséklet,31 hosszú inkubációs periódus,29,32 hosszan tartó inkubáció vízben33 vagy protonpumpa-gátlókkal történő kezelés32 vagy antibiotikumokkal, 34 a coccoid fenotípus képes fenntartani a metabolikus aktivitás bizonyos szintjét,mivel a bacilláris formában jelen lévő gének széles skáláját fejezi ki,35 fenntartja az ureáz aktivitásának kimutatható szintjét, 36 folytatja a fehérjék szintetizálását, bár a kisebb mennyiségben (kevesebb, mint 1% – A mennyiségű fehérje által szintetizált bacilláris formában) 37 és kis mennyiségű DNS-t termel,amelyet még 3 hónapos fiziológiás sóoldatban való tárolás után is fenntartanak 4 6CC.29, 38 mindezek az adatok hangsúlyozzák azt a tényt, hogy a H. pylori biológiai változásai a káros ingerekre adott válaszként tükrözik annak erőteljes képességét, hogy hasznos élettartama alatt megőrizze a fajt.
Biofilm képződés
mint más baktériumok esetében, a H. pylori azon képessége, hogy fertőző entitásként fennmaradjon, és ellenálljon az antimikrobiális szerek arzenáljának, amelynek felszámolása a genetikai variabilitásnak köszönhető, amely lehetővé teszi a bakteriális rezisztencia kialakulását. Túlélési stratégiája tovább javul, amikor a baktériumsejtek úgynevezett biofilmeket képeznek.20 a biofilmek egyfajta mikrobiális “közösség”, amelyben a baktériumok saját készítésű mátrix segítségével szilárdan tapadnak a biotikus vagy abiotikus felületekhez. Ez a mátrix, amely extracelluláris polimer anyagokból áll, 39,40 Olyan környezetet teremt, amely nagyon toleráns az antimikrobiális szerekkel szemben, és erősen ellenáll a fagocitózisnak. Ezért a gazdaszervezet különböző védelmi mechanizmusait megkerülik, ami megnehezíti a felszámolást. A biofilmeket valóban összetett, dinamikus rendszereknek tekintik, amelyek megkönnyítik a baktériumok közötti horizontális génátadást. Így a baktériumpopulációkat új módosított genomokkal látják el, amelyek jelentősen hozzájárulnak a baktériumok rezisztenciájához, törzsváltozatosságához és alkalmazkodóképességéhez.41-43
egy 21 biopsziával végzett vizsgálatban olyan betegektől, akiknél a baktériumot korábban felszámolták, a H. pylori-t tenyésztéssel izolálták 7 biopsziában, míg a génexpressziós technikák életképes H. pylori sejteket mutattak ki a legtöbb biopsziában. A SEM eközben klaszterezett coccoid baktériumokat mutatott egy mikrobiális biofilmben, ami arra utal, hogy a coccoid formák elősegíthetik a baktériumok perzisztenciáját és az antibiotikum-rezisztenciát.44
fogékonyság a coccoid formájú antibiotikumokra
számos tanulmány kimutatta, hogy a H. pylori a bacillárisról a coccoid formára változhat az expozíció során (in vitro) különböző antimikrobiális szerekre. Az amoxicillin, a klaritromicin, a metronidazol és az eritromicin különböző koncentrációja (hogy csak néhányat említsünk a rendelkezésre álló antibiotikumok közül) indukálhatja ezt a morfológiai átalakulást.34,35,45 a legnagyobb indukciós hatást az amoxicillin (27,34,46) esetében figyelték meg,amelyekről ismert, hogy nagyon hatásosak in vitro a H. pylori ellen; a tenyészetek morfológiai megfigyelései azonban azt mutatják, hogy a bacilláris formák száma csökken a coccoid formák javára.34,46 Faghri et al., 47 baktericid hatást ért el a coccoid formákra, több mint 60% – ban a metronidazollal a minimális gátló koncentráció kétszeresénél (MIC), és 80-90% – ban a klaritromicinnel a MIC-nél; azonban az amoxicillin Mic-vel és mic-vel végzett kezelés 2 nem gátolta az életképes coccoid formákat. Hasonlóképpen, Berry et al.34 megfigyelték, hogy míg az amoxicillin a mic-nél 60-nél megszüntette a H. pylori bacilláris formáit, coccoid formák kialakulását is kiváltotta. Perkins et al.48 a H. pylori-val természetesen fertőzött macskák vizsgálata során megfigyelték, hogy 6 héttel az eradikációs kezelés után a gyomornedvek csak egy macskában pozitívak voltak a H. pylori szempontjából, mégis a polimeráz láncreakció (PCR) analízis a H. pylori genetikai anyagát azonosította a vizsgálatban részt vevő összes macskában. Annak ellenére, hogy H. a pylori-t egyetlen macskában mutatták ki, a szövettani elváltozások krónikus gastritisre utaltak, és lymphoid tüszők jelenléte jellemezte őket.
figyelembe véve ezeket a mikrobiológiai és alapkutatási adatokat, egy korábbi, H. pylori—val fertőzött betegeken végzett vizsgálatban—ahol az izolált törzsek érzékenységét korábban meghatározták az amoxicillinre-a kettős terápia (protonpumpa-gátlók és amoxicillin) az amoxicillin-érzékeny törzsek gyógyulási arányát csak 66% – ban érte el. Ez az eredmény bizonyítja az antibiotikum sikeres alkalmazásával kapcsolatos fontos további független baktériumrezisztencia-tényezők jelenlétét.49 Ez különösen igaz akkor, ha figyelembe vesszük, hogy lehetetlennek tűnik, hogy a kokcoid formák érzékenyek legyenek a ons-laktám antibiotikumokra, mivel a kokcoid formák penicillinkötő fehérje profiljai különböznek a bacilláris formáktól.50 ezért valószínű, hogy az eradikációs kezelést követően nem minden H. pylori organizmus szűnik meg teljesen; inkább néhányuk valószínűleg coccoid formává alakul át, és így rezisztenssé válik az antibakteriális gyógyszerekkel szemben. Ez megmagyarázná a kezelés sikertelenségét és a regenerálódást.13,34,45
érdemes kiemelni, hogy néhány nagyon friss tanulmány kimutatta, hogy a szabad zsírsavak, mint például a linolénsav és a liposzómás linolénsav, baktericid hatással vannak mindkét H. pylori formára, függetlenül az antibiotikumokkal szembeni rezisztenciájuktól.51,52 ezek a molekulák tehát potenciálisan hatékony antimikrobiális hatást fejthetnek ki a H. pylori fertőzés kezelésében, különösen annak coccoid formájában.
a coccoid forma virulenciája és patogenitása
a H bacilláris formájának virulenciafaktorai. a pylori-t és azokat a mechanizmusokat, amelyekkel ez a baktérium részt vesz a gyomor-bélrendszeri betegségek kialakulásában, széles körben tanulmányozták.1,3,4 a coccoid forma virulenciájáról és patogenitásáról azonban keveset tudunk. Az alábbiakban áttekintjük a témával kapcsolatos legfontosabb megállapításokat.
a bacilláris formához hasonlóan a coccoid forma is kifejezi a fő virulencia géneket, mint például a karbamid, az ureB, a hpaA, a vacA és a cagA, a cagE és a BabA.35,53,54 ez a kifejezés, amely hosszú időn keresztül fordul elő, valószínűleg fontos szerepet játszik a krónikus súlyos gyomorbetegségekben.
H betartása. pylori a gastroduodenális epitheliumhoz ismert, hogy fontos lépés a nyálkahártya aktív krónikus gyulladásának indukálásában réteg. A sem vizsgálatok azt találták, hogy a H. pylori coccoid formája jelen lehet a gyomor hámsejtjeinek plazmamembrán felületén, és a bacilláris formához hasonlóan képes behatolni ezeket a sejteket.15,55 sejtinvázió esetén a coccoid formák kétrétegű membránhólyagokba vannak zárva, és a gyomor hámsejtjei duzzadtak és litikusak, a nyálkahártya réteg erózióját mutatják.56 mivel a coccoid forma kevésbé érzékeny az antibiotikumokra, feltételezhető, hogy ezek a látens plazmamembrán formák hatékony antibiotikum-koncentráció hiányában más szomszédos hámsejteket is átterjedhetnek és megfertőzhetnek.57
a H. pylori fertőzésről ismert, hogy helyi immunválaszt vált ki, amely nem képes felszámolni a baktériumokat, ezáltal lehetővé téve a gyomorbetegség krónikussá válását. Az immunválaszt antitest detektálással lehet meghatározni a H. pylori bacilláris formájával kifejlesztett szerológiai módszerekkel.58 valójában ezeknek a specifikus antitesteknek a jelenléte felhasználható a fertőzés epidemiológiai indikátoraként és a kezelés sikerességének igazolására. Nincsenek azonban olyan szerológiai módszerek, amelyek kimutatnák a coccoid formákat. Annak megállapítása érdekében, hogy a coccoid formák hatással voltak-e a kolonizált egyének immunválaszára, Figueroa et al.59 kidolgozott egy specifikus enzimhez kapcsolt immunszorbens assay (Elisa) technikát a coccoid és bacilláris formákra adott immunválasz értékelésére és összehasonlítására tüneti és tünetmentes fertőzött egyének szérumainak paneljével szemben. A H coccoid formái. kimutatták, hogy a pylori humorális immunválaszt indukál, hasonló ahhoz, amelyet a bacilláris formák indukálnak fertőzött egyénekben. Egy másik, epigasztrikus fájdalomban szenvedő gyermekeknél végzett vizsgálatban a coccoid forma lehetséges szerepét a H. pylori fertőzésben ELISA technikával és bacilláris és coccoid sejtformákból előállított antigénekkel vizsgálták. Megállapítást nyert, hogy a sejtek 13,3% – a, illetve 55,8% – a szeropozitív volt a bacilláris formájú antigénekre, illetve a coccoid formára, míg az asztmás gyermekek szeropozitivitási értékei csak 7,0%, illetve 26,5% voltak. A coccoid – és bacilláris antigének szeropozitivitásának ez a nagyjából négyszeres különbsége tüneti és tünetmentes betegeknél a H. pylori coccoid formájának lehetséges fertőző szerepére utalhat.60
Cellini et al.61 a H. pylori intragasztrikusan beoltott koncentrált szuszpenziói coccoid formában BALB / C egér modellben. A H. pylori-t 2 héttel később izolálták, a kórszövettani változások 1 hónappal később következtek be, és az összes kolonizált egér szisztémás antitestválaszt mutatott a H. pylori-ra. A balb/C egerekkel végzett más kísérletekben a coccoid formákkal beoltott állatok jelentős patológiás változásokat fejlesztettek ki a gyomorban, beleértve az eróziós elváltozásokat és a gyomornyálkahártya gyulladásos sejtszivárgását.36 ő et al.,53 a virulencia és a fertőzőképesség összehasonlítása érdekében intragasztrikusan beoltott BALB/c egereket H. pylori-val, az egyik csoportot bacilláris formával, a második csoportot coccoid formával. A 2 csoportból származó minták SEM vizsgálata során megfigyelték mind a bacilláris, mind a coccoid formák tapadását a gyomorfal hámsejtjeihez, valamint a flagella jelenlétét a coccoid formákban. A szövettani vizsgálat különböző fokú elváltozásokat mutatott a gyomor nyálkahártyájában, az enyhe gyulladásos sejt infiltrációtól az erózióig és a fekélyekig. A nyálkahártya elváltozása enyhébb volt a coccoid formában fertőzött egerekben, míg a steril vizet kapó kontrollcsoportban nem sikerült pozitív eredményt elérni.53 Rabelo-gon (Rabelo-Gon) és mtsai.62 kimutatta, hogy a coccoid formái H. a pylori akut gyulladásos választ váltott ki az egerek gyomrában a fertőzés legkorábbi szakaszaitól kezdve. A fenti eredmények rávilágítanak arra, hogy a coccoid formák képesek kolonizálni és megfertőzni a gyomor nyálkahártyáját in vivo.
számos tanulmány kimutatta a coccoid forma jelenlétét a vízben.33,63 az egyik ilyen vizsgálat—csoportunk szerint—2 elválasztott Wistar egércsoportot hasonlított össze, az egyikben hosszabb ideig kútvizet és csapvizet, a másikban steril desztillált vizet adtak be, megállapítva, hogy a vizsgálati csoport egereiben krónikus gyulladásos folyamat alakult ki limfocita plakkok képződésével és a H. pylori-nak megfelelő bacillusok jelenlétével.64
mint korábban említettük, logikus lenne feltételezni, hogy kedvezőtlen körülmények között H. a pylori “nyugalmi” állapotba kerül, klasszikus bacilláris formáját coccoid formává változtatja anélkül, hogy degeneratív változásokat okozna a genomjában, és megtartja azt a képességét, hogy visszatérjen a bacilláris formába, ha a környezeti vagy természetes élőhelyi feltételek javulnak.
a coccoid forma részvétele a rekrudenciában
a H. pylori megismétlődése a sikeres felszámolást követően ritka a fejlett országokban a fejlődő országokhoz képest, éves kiújulási aránya 2,67%, illetve 13%.65,66
a H. pylori fertőzés megismétlődésének két típusa van: rekrudeszcencia, amikor a kiújulásért felelős baktériumtörzs genetikailag azonos az eradikáció előtt izolált baktériumtörzzsel; és újrafertőződés, ha a kiújulást egy másik törzs okozza.67 a rekrudeszcencia megkülönböztetése az újrafertőzéstől PCR vagy genetikai polimorfizmus elemzést igényel a baktériumtörzsek azonosításához.67,68 mivel ezeket a módszereket nem rutinszerűen alkalmazzák, gyakran lehetetlen különbséget tenni a rekrudeszcencia és az újrafertőződés között a rutin klinikai gyakorlatban.
H. a pylori kiújulása klinikailag releváns, mivel a peptikus fekély visszaesése a fertőzött betegek jelentős részében megfigyelhető, míg a mikroorganizmusok újbóli megjelenése magyarázhatja a MALT lymphoma visszatérését a kezelés után.69 olyan tényező, mint a csapvíz ivása, a fog-és ínybetegségek, a visszatérő mandulagyulladás, a kórházi ápolás, a fogászati és orvosi berendezések és a családtagokkal való érintkezés, úgy gondolják, hogy befolyásolják a H. pylori kiújulását.70-72 a fertőzés kiújulásával kapcsolatos egyéb tényezők a fiatalabb életkor, a fiatal betegek cukorbetegsége, az alacsony éves jövedelem és a gyomorsav hosszú távú gátlása az eradikációt követően.73-76
a kiújulás legvalószínűbb oka a felszámolást követő első évben, míg az újbóli fertőzés hosszabb időszak után fordulhat elő.68,77 a fejlett országokban a kiújulás sok esete a valóságban a kiújulás miatt következik be. Az újbóli fertőzés gyakoribb a fejlődő országokban, mivel az emberek nyilvánvalóan folyamatosan ki vannak téve a H. pylori-nak.65,78
poliakrilamid gélfehérje elektroforézis technikák alkalmazásával, Costas et al.Az 79 megállapította, hogy az eradikációs kezelés után 4 héttel visszatérő betegek valójában nem fertőződtek meg egy másik H. pylori törzzsel; inkább az eredeti fertőzést okozó törzset a kezelés nem szüntette meg teljesen, ami a fertőzés újbóli kiújulásához vezetett. Ezért fontos figyelembe venni a terápiás kezelés hatékonyságát: H. a pylori kiújulása gyakori az alacsony hatékonyságú terápiákkal kezelt betegeknél, de ritka, ha nagy hatékonyságú terápiákat alkalmaznak. Ezt egy tanulmány igazolta a H. pylori megismétlődésének előfordulásáról Spanyolországban Gisbert et al., 80 who megállapította, hogy a H. pylori kiújulása 6 hónappal az eradikáció után 8,2% volt az alacsony hatékonyságú terápiákkal kezelt betegeknél, de csak 1,7% a nagy hatékonyságú terápiákkal kezelt betegeknél.
egy Koreában 2007-től 2010-ig végzett tanulmányban H. a pylori kiújulási arányokat 6 hónapos sikeres első és második vonalbeli eradikációs terápia után elemezték, éves nyomon követéssel—a vizsgálati időszak végéig-légzéstesztek, gyomorbiopszia és gyors ureáztesztek alapján.81 megállapítást nyert, hogy az éves kiújulási arány a 2 éves követésen belül 9,3%, illetve 2,0% volt az első vonalbeli kezelés után, illetve 4,5%, illetve 2,9% a második vonalbeli kezelés után. A szerzők arra a következtetésre jutottak, hogy az éves H. az eradikációs kezelésben részesülő betegek pylori kiújulási aránya éles csökkenést mutatott a 2 éves követési időszak után. Ezt a kezelést követően elegendő időnek tekintették az eradikáció megerősítéséhez, valamint elegendő időnek ahhoz, hogy különbséget lehessen tenni a H. pylori törzsek kiújulása és kiújulása között.81
végső megfontolások és következtetések
tekintettel H képességére. pylori a VBNC állapotba való belépéshez, ha kedvezőtlen körülményeknek van kitéve élőhelyén belül vagy kívül, ésszerű feltételezni, hogy a H. pylori bacilláris formájának felszámolására alkalmazott antibiotikus kezelési rendek indukálhatják a vbnc coccoid formáit, amelyek hosszú ideig képesek túlélni a gastroduodenális környezetben. Innentől kezdve közvetlen és közvetett patogén potenciállal rendelkezhetnek, amely a fertőzés újbóli kiújulásához vezet, és ennek eredményeként a kezelés kudarcai, a fertőzés visszaesése és a gastroduodenális betegség megismétlődése. A sikeres felszámoláshoz tehát nemcsak a bacilláris formák, hanem a coccoid formák felszámolására is szükség lehet, vagy annak biztosítására, hogy a coccoid formák ne indukálódjanak.
szem előtt tartva, hogy mivel a klinikai gyakorlatban jelenleg alkalmazott rutin módszerek a H. pylori felszámolása nem képes kimutatni a coccoid formákat, a gazdaszervezeteket helytelenül diagnosztizálhatják fertőzésmentesnek; továbbá ezek a módszerek nem biztos, hogy képesek teljes bizonyítékot szolgáltatni a H. pylori felszámolására használt gyógyszerek klinikai potenciáljáról. Ezért annak érdekében, hogy a felszámolás sikeresnek tekinthető legyen, éves nyomon követés ajánlott-nem invazív technikák alkalmazásával, vagy ha rendelkezésre állnak, molekuláris módszerek—annak megállapítására, hogy a baktériumok teljesen eliminálódtak-e, különösen a magas prevalenciájú területeken és a kiújulás kockázatának kitett betegeknél.
végül további vizsgálatokra van szükség a H. pylori coccoid VBNC formájáról, patogén potenciáljáról, a fertőzésben és a recrudescenciában való részvételéről, valamint a biofilmek kialakulásában betöltött szerepéről a gyomorban és a gazdaszervezeten belül. Az ilyen vizsgálatok lehetővé tennék mind a hatékonyabb diagnosztikai protokollok kifejlesztését, amelyek elkerülik a H. pylori kolonizációjának alábecsülését, mind az új terápiás stratégiákat, amelyek célja a coccoid formák megszüntetése és a biofilmek “hatástalanítása”.
összeférhetetlenség
a szerzők kijelentik, hogy nincs összeférhetetlenségük.