- Inleiding
- materialen en methoden
- oogst van oöcyten en cRNA-Microinjectie
- isolatie van Membraanfracties en Immunoblotting
- immunohistochemie
- Vriesfractuur elektronenmicroscopie
- gepaarde Oöcyte Assay en kwantificering van contactgebieden
- hydrostatische druk impuls Assay
- Capraatincubatie
- statistische analyse
- resultaten
- expressie van Claudin-5 en integratie in X. laevis oöcyt-plasmamembraan
- pleisters van Tight-junction strengen zijn zichtbaar in Claudin-5 expressie oöcyten
- gepaarde Eiceltest voor analyse van Claudin-Transinteractie
- hydrostatische Drukimpuls test toont Claudin-specifieke kruising van Eicelparen
- incubatie met Capraat
- discussie
- Claudins dragen bij tot sterkere Adhesieeigenschappen
- conclusie
- Gegevensbeschikbaarheidsverklaring
- ethische verklaring
- Auteursbijdragen
- financiering
- belangenconflict
- Dankbetuigingen
- aanvullend materiaal
Inleiding
de tight junction proteïne familie is cruciaal voor celfysiologie omdat gebrek of beschadiging geassocieerd is met ziekten en disfunctie van vele organen en weefsels, zoals bijvoorbeeld in het binnenoor (Wilcox et al., 2001; Florian et al., 2003), nier (Konrad et al., 2006; Günzel et al., 2009), gastrointestinal tract (Resnick et al., 2005; Amasheh et al., 2009), epidermis (Furuse et al., 2002; Tebbe et al., 2002), en hersenen capillairen (Nitta et al., 2003; Wolburg et al., 2003). Claudins vertegenwoordigen een transmembraaneiwitfamilie die ten minste 27 leden omvat (Mineta et al., 2011). Naast hun vier transmembrane helix domeinen, bevatten ze twee extracellulaire lussen (ECL1 en ECL2), een korte N-terminus en een C-terminus (Suzuki et al., 2014). Specifieke claudin-expressiepatronen bepalen en weerspiegelen de selectieve permeabiliteit van epithelia, en het vermogen van claudin-eiwitten om te interageren in cis (binnen hetzelfde membraan) en in trans (tussen de membranen van de naburige cel) maakt de vorming van barrièrevorming en porievorming van strakke junctiestrengen mogelijk (van Itallie en Anderson, 2006).
Claudin – 5 wordt sterk uitgedrukt in capillaire endothelia en domineert de tight junction (TJ) van de bloed-hersenbarrière (BBB) omdat de expressie >100 keer hoger is dan alle andere claudin (Ohtsuki et al., 2007). Bovendien wordt het uitgedrukt in een verscheidenheid van epitheliale weefsels met inbegrip van Long (Soini, 2011), exocriene weefsels (Comper et al., 2009), intestinal (Garcia-Hernandez et al., 2017), en urinewegen (Koda et al., 2011). Claudin-5 veroorzaakt echter een sterkere barrière in de hersenhapillairen dan in andere weefsels (Reinhold en Rittner, 2017) en zijn functie is verstoord bij neurodegeneratieve en neuro-inflammatoire aandoeningen (Greene et al., 2019). Daarom is claudin-5 cruciaal voor het behoud van de BBB. Maar de BBB is niet alleen Beschermend, het beperkt ook de therapeutische opties aangezien drugs worden belemmerd om deze barrière te doordringen.
Nitta et al. (2003) gemeld, dat de BBB is meer permeabel voor moleculen van 800 Da in grootte in claudin-5 deficiënte muizen in vergelijking met wild type muizen (Nitta et al., 2003). Dit was in overeenstemming met transfectie experimenten aantonen van een afdichting effect van claudin-5 in Caco-2 cel monolagen (Amasheh et al., 2005).
een andere belangrijke barrièrevormende claudin is claudin-3, waarvan is gemeld dat het de barrière selectief afdicht tegen de passage van ionen van ladings-en niet-opgeladen opgeloste stoffen (Milatz et al., 2010). Het wordt ook uitgedrukt in de endotheliale strakke kruising van de hersenen capillairen en het functionele verlies wordt waargenomen in fasen van microvessel ontsteking, glioblastoom en choroïde plexus van patiënten met multiple sclerose (Engelhardt et al., 2001; Wolburg et al., 2003).
barrière-eigenschappen kunnen dynamisch worden gewijzigd, zoals bijv. incubatie met natriumcapraat bleek de transepitheliale elektrische weerstand in de menselijke darmcellijn HT-29/B6 snel en reversibel te verminderen (Krug et al., 2013). Natriumcapraat opent kortstondig claudin – 5 met barriã res op tight junctions van epitheliale en endotheliale cellen (Del Vecchio et al., 2012).
dit geeft aan dat claudin-5 Een veelbelovend doel is voor verbetering van de toediening van geneesmiddelen in de BBB.
in deze studie werd getracht het heterologe expressiesysteem van Xenopus laevis oöcytes (Vitzthum et al., 2019) voor de analyse van claudin-5 en claudin-3 interactie en pertubatie. Wegens het gebrek aan endogene cel-cel-contacten, maakt dit eencellige uitdrukkingssysteem de analyse van specifieke claudins zonder interferentie van andere strakke verbindingsproteã nen mogelijk.
materialen en methoden
oogst van oöcyten en cRNA-Microinjectie
oöcyten werden verzameld bij volwassen vrouwelijke Afrikaanse klauwkikkers door chirurgische laparotomie. Voor anasthesie, 0.2% MS222 (ethyl 3-aminobenzoate methanesulfonate, Sigma-Aldrich, Taufkirchen, Duitsland) werd gebruikt als badoplossing voor 5-10 min bij 20°C. Zodra chirurgische anasthesie werd bereikt, werden de huid en de buikspierinsnijdingen gemaakt en werd de ovariale massa geëxterioriseerd en het ovariale weefsel verwijderd. De isolatie van oöcyten werd uitgevoerd door enzymatische spijsvertering bij kamertemperatuur gedurende 90 minuten in 1,5 mg / ml collagenase Fisher BioReagents BP2649-1 (Fisher Scientific, Schwerte, Duitsland) opgelost in oöcyt Ringer solution (ORi) zoals beschreven door Vitzthum et al. (2019). Folliculaire cellen werden verwijderd door incubatie in Ca2 + – vrije ORi met (in mM): NaCl (90), KCl (1), EGTA (triethyleenglycoldiaminetetra-azijnzuur) (1), 5 HEPES (5); pH 7,4 gedurende 10 minuten op een mechanisch schudapparaat met 50 tpm. Oöcyten van de stadia V en VI (>1000 µm) werden geïnjecteerd (Nanoliter 2010, World Precision Instruments, Sarasota, FL, Verenigde Staten) met 1 ng cRNA die codeert voor humaan claudin-5, claudin-3 of RNase-vrij water als controles. Het injectievolume was 50,6 nl per eicel. Na injectie werden oöcyten geïncubeerd bij 16°C in 3 dagen voor eiwitexpressie.
isolatie van Membraanfracties en Immunoblotting
tien geïnjecteerde oöcyten werden gepoold voor analyse van westelijke vlekken en geresuspendeerd in 500 µl homogenisatiebuffer met (in mM) MgCl2 (5), NaH2PO4 (5), EDTA (ethyleendiaminetetra-azijnzuur) (1), sucrose (80) en Tris (Tris(hydroxymethyl)aminomethaan) (20); pH 7,4. Eicelextracten werden tweemaal gecentrifugeerd bij 200 toeren per minuut gedurende 10 minuten bij 4°C om celresten te verwijderen. Het supernatant werd gecentrifugeerd bij 13.000 toeren per minuut gedurende 30 minuten bij 4°C om het celmembraan te pellet zoals beschreven door Leduc-Nadeau et al. (2007). Pellets werden geresuspendeerd in een homogenisatiebuffer van 80 µl. Eiwitkwantificatie werd colorimetrisch gedaan met behulp van Pierce 600 nm Protein Assay Kit (Thermo Fisher Scientific, Hennigsdorf, Duitsland) volgens de instructies van de fabrikant in een 96-wells plaat. De plaatlezer (PerkinElmer EnSpire Multimode Plaatlezer, Waltham, MA, Verenigde Staten) werd aangepast tot 562 nm en de Bovine Serum albumine standaard (Thermo Fisher Scientific, Hennigsdorf, Duitsland) variërend van 125 tot 2000 µg/ml werd gebruikt voor de evaluatie. Voorafgaand aan immunoblotting werden monsters gemengd met 4× Laemmli buffer (Bio-Rad Laboratories, München, Duitsland), geladen op een 10% SDS polyacrylamide gel en elektroforesed. Voor eiwitoverdracht werden PVDF-membranen gebruikt en gedurende 120 minuten geblokkeerd in 5% vetvrije droge melk in Tris-gebufferde zoutoplossing. Proteã nen werden ontdekt door immunoblotting gebruikend primaire antilichamen tegen claudin-3 of claudin-5 (invitrogen #35-2500, #34-1700, #34-1600, Life Technologies, Carlsbad, CA, Verenigde Staten).
Peroxidase-conjugated goat anti-rabbit and anti-mouse antilichamen (#7074, # 7076 Cell Signaling Technology, Danvers, MA, Verenigde Staten) werden gebruikt om zich te binden aan de primaire antilichamen en werden daarom minimaal 45 minuten bij kamertemperatuur geïncubeerd. Voor detectie werd Clarity Western ECL Blotting substraat (#1705061, Bio-Rad Laboratories GmbH, München, Duitsland) gebruikt en werden signalen gevisualiseerd door een ChemiDoc MP-systeem (Bio-Rad Laboratories).
immunohistochemie
geïnjecteerde oöcyten werden gefixeerd in 4% PFA (16% paraformaldehyde, E15700, Science Service, München, Duitsland) gedurende 4 uur bij kamertemperatuur, gevolgd door dehydratatiegradiënt van 70% ethanol naar xylol (Carl Roth, Karlsruhe, Duitsland) binnen 48 uur. monsters werden ingebed in paraffine en met behulp van een Leica rm 2245 microtoom (Leica Microsystems Heidelberg, Duitsland). Kort voor de immunohistochemische behandeling werd paraffine via xylol tot ethanolgradiënt verwijderd. Niet-specifieke bindingsplaatsen werden geblokkeerd met 5% geitenserum in fosfaatgebufferde zoutoplossing en geïncubeerd met dezelfde primaire antilichamen als voor immunoblotting. Monsters werden geïncubeerd met de secundaire antilichamen Alexa Fluor-488 goat anti-rabbit en Alexa Fluor-594 goat anti-mouse (Life Technologies, Carlsbad, CA, Verenigde Staten) en onderzocht met confocale laser-scanning immunofluorescentiemicroscopie (LSM 710, Zeiss, Oberkochen, Duitsland).
Vriesfractuur elektronenmicroscopie
Vriesfractuur elektronenmicroscopie werd uitgevoerd zoals onlangs gemeld (Greene et al., 2019). Voor fixatie werden geïnjecteerde oöcyten ‘ s nachts geïncubeerd in glutaaraldehyde (2,5% in 0,1 m cacodylaatbuffer) bij 4°C. Na wassen met cacodylaatbuffer werden oöcyten bereid voor vriesfracturering. Monsters werden cryoprotected in 30% glycerol en ingevroren in vloeibare stikstof. Na het breken, en schaduwen met platina en koolstof (Baf400d; Balzers, Liechtenstein), werd het resterende organische materiaal verwijderd door een natriumhypochlorietwassing. Oöcyten werden geanalyseerd met een transmissie-elektronenmicroscoop (EM-10, Zeiss, Oberkochen, Duitsland) en gefotografeerd met een digitale camera (Tröndle GmbH). Morfometrische analyse van de strakke verbindingsstrengen werd uitgevoerd bij een vergroting van 20.000×.
gepaarde Oöcyte Assay en kwantificering van contactgebieden
Mannitol werd uitgevoerd om de geïnjecteerde oöcyten te verkleinen en een mechanische verwijdering van het vitellinemembraan met een tang mogelijk te maken zonder het plasmamembraan te beschadigen. 5-10 oöcyten werden geplaatst in een petrischaal (35 mm diameter, Thermo Fisher, Henningsdorf, Duitsland, #153066) gevuld met ORi. Mannitol werd toegevoegd en opgelost totdat een hypertonische krimp van de cellen werd bereikt (ongeveer 400 mOsmol/l gedurende 10 min). Na handmatige devitellinisatie werden oocyten onmiddellijk overgebracht naar een 24-Wells plaat (1. 86 cm2 oppervlakte, TPP Techno Plastic Products, Trasadingen, Zwitserland, # 92024) met 2 ml ORi. In elk putje werden twee cellen voorzichtig geclusterd door ze samen te duwen met een pasteurpipet (1 ml, Thermo Fisher, Henningsdorf, Duitsland, #PP88SB) en een bolvormige sonde.
Eicelparen van claudin-5-expressie (cldn5 − cldn5), claudin-3-expressie (cldn3 − cldn3), claudin-3 en claudin-5 − Co − expressie (cldn3,5-cldn3,5) en controle-oöcyten (control-control) werden tot 48 uur bij elkaar gehouden in ORi bij 16°C. 24, en 48 h. beelden van de naïeve eicelparen in 24 putkweekschalen werden op deze tijdstippen genomen met behulp van een Leica dmi6000 B microscoop (Leica Microsystems, Wetzlar, Duitsland). De Diameter van het contactoppervlak werd gemeten met behulp van de micron schaal (LAS-AF 3.2.0). Contactgebieden worden als cirkelvormig beschouwd en dus werd het contactgebied berekend met behulp van de cirkelvergelijking a=π r r2.
hydrostatische druk impuls Assay
Vitelline membranen werden mechanisch verwijderd zoals eerder beschreven en oöcyten geclusterd analaag aan de gepaarde oöcyte assay. Daarnaast werden gemengde eicelparen (control–cldn5 en control–cldn3) getest in de hydrostatische drukimpuls (hpi) assay. Na 24 uur stabilisatie werd een gedefinieerde hydrostatische impuls gecreëerd met behulp van een elektronische pipet met één kanaal (EE-300R, Eppendorf Research Pro, software version 2.06.00, Hamburg, Duitsland).
oöcyten werden bewaard in 24 putplaten met 2 ml ORi en de centrale positie werd gecontroleerd voordat het pipetteervolume 250 µl ORi werd toegepast. De doseersnelheid werd uniform ingesteld op maximumsnelheid, wat overeenkomt met een doseersnelheid van 0,9 s. Verder werden de hoek (45°) en de afstand van het aanbrengen (1.3 1,3 cm) uniform toegepast. De omgevingsdruk, de viscositeit van de ORi en de diameter van de opening van de pipettip werden onder constante omstandigheden gehandhaafd. De heldere gebiedsmicroscopie werd aangewend voor kwantificering van contactgebieden 30 min nadat de hydrostatische druk werd toegepast en in contactgebieden vóór toepassing werd vergeleken. De experimentele opstelling is beschreven in Figuur 1.
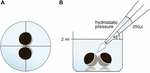
figuur 1. Experimentele opstelling van hydrostatische drukimpuls assay (a) schematisch bovenaanzicht van de put: de centrale positionering van het eicelpaar werd gecontroleerd voordat de hydrostatische druk werd toegepast. B) schematische zijaanzicht van de put: 250 µl ORi werd toegevoegd met behulp van een elektronische pipet met één kanaal. De doseersnelheid was uniform ingesteld op maximale snelheid. De hoek (45°) en de afstand van toepassing werden uniform toegepast. De omgevingsdruk, de viscositeit van de ORi en de diameter van de opening van de pipettip werden onder constante omstandigheden gehandhaafd.
Capraatincubatie
voor capraatincubatie werd natriumcapraat (#C4151, Sigma Aldrich, Taufkirchen, Duitsland) in eindconcentraties van 50, 100 en 500 µM, of ORi als referentiegroep, 24 uur na koppeling aan de oöcyten toegevoegd. Oöcyten werden bewaard in 24 putplaten met 2 ml ORi en capraatoplossing werd opgelost in een gedefinieerd additie-volume van 250 µl ORi per put. Breedte van het contactoppervlak werd gekwantificeerd op 30, 60 en 120 minuten na toevoeging.
statistische analyse
statistische analyse werd uitgevoerd met JMP Pro 14.0.0 (NC, Verenigde Staten). Gegevens worden gepresenteerd als medianen en weergegeven als procentuele verandering op basis van de geclusterde combinatie op de eerste examenpunten. De figuren 4 en 5 worden weergegeven als Vakdiagrammen, waarop het eerste kwartiel (25 procent), de mediaan (50 procent) en het tweede kwartiel (75 procent) zijn afgebeeld. De snorharen worden getrokken tot het 10e percentiel en tot het 90e percentiel. De normale verdeling werd gecontroleerd met behulp van Shapiro–Wilk-test.
Kruskal-Wallis-test werd gebruikt voor meervoudige vergelijking, gevolgd door een Dunn-Bonferroni-correctie. p-waarden worden gegeven als continue getallen.
resultaten
expressie van Claudin-5 en integratie in X. laevis oöcyt-plasmamembraan
om de succesvolle expressie en integratie van het tight junction-eiwit claudin-5 in het oöcyt-plasmamembraan te testen, werden 3 dagen na injectie van claudin-5 cRNA membraanfracties geanalyseerd door immunoblotting. Alle monsters van drie individuele dieren (d1–d3) toonden claudin-5 specifieke signalen bij 23 kDa, terwijl RNAse-vrije water-geïnjecteerde oöcyten geen specifiek signaal voor claudin-5 expressie vertoonden (figuur 2A).
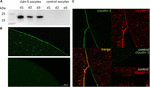
Figuur 2. Detectie van heteroloog tot expressie gebrachte claudins in Xenopus laevis oöcyten. (A) Immunoblot analyse van tight junction eiwit claudin-5 in X. laevis oöcyten van drie dieren (d1–d3). De lysaten van het celmembraan werden onderworpen aan SDS-PAGE gevolgd door immunoblot op PVDF membranen. De membranen werden geïncubeerd met primaire antilichamen en secundaire peroxidase-geconjugeerde antilichamen (n = 3). (B) Immunofluorescente kleuring onthulde specifieke claudin-5 signalen (groen) in oöcyt membranen van alle cRNA-geïnjecteerde oöcyten, terwijl in water-geïnjecteerde controles, geen claudin-specifieke signalen werden gedetecteerd in confocale microscopie. Representatieve beelden van eicellen afkomstig van drie dieren. Schaal bars: 50 µm. (C) Immunofluorescent kleuring van claudin-5 en claudin-3 expressie oöcyten onthulde specifieke claudin-3 signalen (groen) en claudin-5 signalen (rood) in oöcyt membranen van cRNA-geïnjecteerde oöcyten, terwijl in water-geïnjecteerde controles, claudin-specifieke signalen werden gedetecteerd. Colokalisatie van tot expressie gebrachte claudin-eiwitten binnen het oöcyte-plasmamembraan wordt onthuld door dubbele immunofluorescente kleuring (geel). Schaalbalk: 10 µm.
voor de visualisatie van de tot expressie gebrachte eiwitten in het plasmamembraan werden immunohistochemische stainings uitgevoerd en geanalyseerd met behulp van confocale laserscanning microscopie (figuur 2B). Specifieke signalen werden gedetecteerd en gelijkmatig verdeeld over het plasmamembraan van claudin-5 expressie oöcyten. In overeenstemming met immunobloten werden geen specifieke signalen gedetecteerd in de plasmamembranen van de oöcyt.Na injectie van cRNA werd claudin-5 met succes tot expressie gebracht en geïntegreerd in het plasmamembraan van X. laevis oöcyten.
Co-expressie van claudin-3 en claudin-5 in eicelparen onthulde specifieke signalen voor claudin-5 (rood) en claudin-3 (groen) in beide cellen (figuur 2C). Oöcyte plasma membranen toonden een fusie van de naburige cellen die door directe cldn3,5–cldn3,5 interactie (geel).
pleisters van Tight-junction strengen zijn zichtbaar in Claudin-5 expressie oöcyten
Oöcyte plasma membranen werden geanalyseerd en visualisatie van tight-junction strengen was succesvol (Figuur 3). De elektronenmicroscopie van de vriesfractuur toonde vlekken van de morfologie van de streng in de plasmamembranen van claudin-5 geïnjecteerde oöcyten, en de organisatie van de streng van claudin-5 expressie oöcyten was zeer georganiseerd en van hoekvorm (figuur 3A). De strakke verbindingsbundels werden hoofdzakelijk ontdekt in het protoplasmic (P-) gezicht van het membraan. Claudin-3 geïnjecteerde oöcyten toonden afgeronde sterk georganiseerde strakke junctiestrengen zoals eerder gemeld (Vitzthum et al., 2019; figuur 3B). Bevriezen fractuur elektronenmicroscopie van claudin – 3 en claudin-5 Co-expresserende oöcyten onthulde fibrillen die beide eigenschappen van claudin-3 en claudin-5 dragen. Fibrilstrengarchitectuur van coexpressie-oöcyten verscheen zowel rond als complex als claudin-3-expressie-oöcyten, maar ook discontinue en hoekiger zoals getoond voor claudin-5-expressie-cellen (figuur 3C). Controle oöcyten hadden een typisch glad oppervlak (figuur 3D).
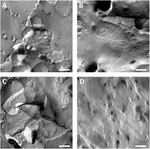
Figuur 3. Bevriezen fractuur elektronenmicroscopie. (A) De elektronenmicroscopie van de Vriesfractuur onthult tight junction protein cldn-5 als een netwerk van hoekige discontinue fibrillen in rijen in Xenopus laevis oocytes. B) Vriesfractuur elektronenmicroscopie onthult tight junction protein cldn-3 als een meshwork van afgeronde fibrillen in X. laevis oocytes. (C) bevriezen fractuur elektronenmicroscopie van claudin-3 en claudin-5 coexpress oöcyten onthullen fibrillen die beide eigenschappen van claudin-3 en claudin-5 dragen. D) DE met Water geïnjecteerde controle-oöcyten hebben een glad oppervlak. Representatieve beelden van eicellen afkomstig van drie dieren. Schaalbalk: 250 nm.
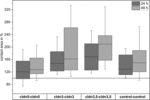
Figuur 4. Mediane contactgebieden van geclusterde eicelcombinaties cldn5–cldn5, cldn3–cldn3, cldn3,5–cldn3,5 en control–control 24 en 48 uur na clustering in % van de eerste contactgebieden kort na clustering (n = 8-38).

Figuur 5. Contactgebieden van claudin-5, claudin-3, en coexpressing van claudin – 3 en claudin-5 oöcyten in hydrostatische drukimpuls (hpi) challenge na stabilisatie periode en 30 min na HPI (n = 16-70, *p < 0,05, **p < 0.01, Kruskal-Wallis gevolgd door een Dunn-Bonferroni correctie).
gepaarde Eiceltest voor analyse van Claudin-Transinteractie
alle geclusterde combinaties vertoonden een tijdsafhankelijke toename van het contactoppervlak gedurende de gemeten periode (Figuur 4 en Tabel 1).
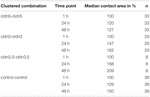
Tabel 1. Eicel contact gebieden binnen 48 uur na clustering.
het contactoppervlak van de met water geïnjecteerde controle-oöcyten nam na 24 uur toe tot 129% en na 48 uur tot 150%. Geclusterde paren oöcyten die claudin-3 tot expressie brengen, vertoonden ook een toename van contactgebieden tot 147% (24 uur) en 162% (48 uur). Geclusterde paren van oöcyten die claudin-3 en claudin-5 Co-expressie geven, vertoonden contactgebieden van 168% (24 uur) en 209% (48 uur). Geclusterde paren oöcyten die alleen claudin-5 tot expressie brengen, vertoonden contactgebieden van 120% (24 uur) en 127% (48 uur). Daarom waren contactgebieden in alle geteste combinaties vergelijkbaar.
hydrostatische Drukimpuls test toont Claudin-specifieke kruising van Eicelparen
In een aparte benadering werden de eicellen die claudin-3 of claudin-5 tot expressie brachten of beide claudin ‘ s Co-expresseerden geclusterd na mechanische devitellinisatie. Oocyten werden uitgedaagd door gebruik te maken van een HPI en contactgebieden werden 30 minuten na de provocatie gemeten en berekend en vergeleken met initiële gebieden na de stabilisatieperiode van 24 uur (Figuur 5 en Tabel 2). Na hydrostatische drukuitdaging daalde het contactgebied van met water geïnjecteerde controle-oöcyten tot 89%. Geclusterde paren van oöcyten die claudin-5, claudin-3 of claudin-3 en claudin-5 tot expressie brengen, behielden Grotere contactgebieden (97%, p = 0,0235; 96%, p = 0,003; 98%, p = 0,0253). De contactgebieden van gemengde met water geïnjecteerde controle-oöcyten en claudin-expresserende oöcyten (control–cldn5 en control–cldn3) verschilden niet significant van de controle-oöcyten (93%, p = 0,2900; 83%, p = 0,4455).
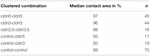
Tabel 2. Hydrostatische druk impuls assay.
incubatie met Capraat
in een proef-incubatie-experiment werden oocyten geïnjecteerd en gekoppeld in combinaties die claudin-5 (cldn5–cldn5) tot expressie brengen of geïnjecteerd met RNAse–vrij water als controlegroep (control-control). Paren werden geïncubeerd met uiteindelijke natriumcapraatconcentraties van 50, 100 of 500 µM. De incubatie van eicelparen met ORi diende als referentiegroep. De oöcyten werden geclusterd en na 24 uur stabilisatie begon de incubatie en werden de contactbreedtes 30, 60 en 120 minuten na toevoeging gemeten (aanvullend figuur S1).
de toevoeging van ORi resulteerde in een initiële afname van contactgebieden in zowel claudin-expresserende als met water geïnjecteerde eicelparen, die 60 of 120 minuten na toevoeging wordt gedispergeerd. Dit wordt geschetst door de parabolische vorm van de verbindingslijn tussen de mediane contactgebieden in de tijd (rode krommen in aanvullende figuur S1). Incubatie met 100 en 500 µM natriumcapraat verhoogde het contactoppervlak echter licht (100 µM) of sterk (500 µM) 30 minuten na capraattoevoeging van 5,1 × 105 tot 5,2 × 105 µm2 en 4,3 × 105 tot 4,9 × 105 µm2.
discussie
in deze studie gebruikten we het klassieke model voor transporters en humane ziektemodellering (Tammaro et al., 2009; Nenni et al., 2019), de X. laevis oocytes, voor een diepgaande analyse van claudin-5 interactie en functionele bijdrage aan de junctieafdichting. Hiertoe werd een nieuwe benadering vastgesteld, die een HPI introduceerde voor het uitdagen van interactie binnen het contactgebied van geclusterde Xenopus-oöcyten.
Claudins dragen bij tot sterkere Adhesieeigenschappen
in overeenstemming met eerdere resultaten van Vitzthum et al. (2019), single claudins uitgedrukt in oöcytes leidde niet tot een toename van interactie contact Gebieden in vergelijking met controle oöcytes. Nochtans, bewezen immunoblot en immunohistochemische visualisatie de succesvolle uitdrukking en integratie in X. laevis oocyte plasmamembraan. Voorts stond het gebruik van confocal de microscopie van het lasersaftasten een nauwkeurige localisatie van uitgedrukte claudins in het plasmamembraan toe aangezien het pinhole uit-van-nadruk fluorescentie blokkeerde. Een kwantificering van immunohistochemische signalen werd niet nagestreefd, aangezien de affiniteit van antilichamen voor het binden van hun doelwitten verschilt.
Vedula et al. (2009) gebruikte een techniek van de micropipette aspiratie om aspecten van claudin-claudin interactie te onderzoeken gebruikend l-fibroblasten transfected met GFP-geëtiketteerd occludin, cldn-1, en cldn-2. De scheidingskracht die nodig was om twee cellen van elkaar los te maken was groter in cldn-1 en cldn-2 getransfecteerde cellen (respectievelijk∼2,8 en 2.3 nN). Hoewel deze benadering ook veelbelovend lijkt voor de claudin-claudin – interactieanalyse van expressie van oöcyten, hebben voorlopige tests aangetoond dat een loslating van geclusterde oöcyten niet mogelijk is zonder verstoring van de oöcytplasmembranen.
daarom werd, als een nieuwe benadering, de kracht van de verbindingen gemeten door een HPI. Hoewel de HPI geen kwantificering van de scheidingskracht in absolute waarden (b. v. in newton ‘ s) geeft, staat het een snelle en kosteneffectieve analyse van de claudin interactie toe zonder verstoring van andere tight junction proteã nen (b. v., occludin, tricelluline, JAM-A). Claudins dragen bij aan de kruising van eicelparen omdat ze een groter contactgebied vertonen in vergelijking met met water geïnjecteerde eicellen na HPI. Dit wijst op een sterke homofiele trans-interactie tussen de claudin-expresserende cellen.
Strand fibrilarchitectuur is specifiek voor single claudins (Colegio et al., 2002). In de elektronenmicroscopie van de vriesfractuur, werd claudin-3 gemeld om een meer afgerond draadnetwerk in lusvormen in Xenopus oocytes samen te stellen (Vitzthum et al., 2019; Figuur 3B) terwijl in onze studie, claudin-5 vormde een mazen meer hoekig en geordend in rijen. De beelden onthulden, dat de tight junction eiwit claudin-5 vormt een netwerk van fibrillen in discontinue, hoekvormige rijen in X. laevis oocytes. Dit is in overeenstemming met claudin – 5 strengen bekend als ketens van deeltjes geassocieerd met de P-fase (Piontek et al., 2011). In onze experimenten leek de geometrische vorm van de fibrillen geen effect te hebben op de oöcyten adhesie-eigenschappen. In overeenstemming daarmee werd gemeld dat paracellulaire resistentie niet gerelateerd was aan het fibrilgetal en de fibrilvormende eigenschappen (Colegio et al., 2002). Verder, claudin-3 en claudin-5 worden getoond om een gelijkaardige capaciteit voor homofiele trans-interactie in hek293 cellen te hebben (Piontek et al., 2011).
dit model van X. laevis-oöcyten, dat enkelvoudige tight junction-eiwitten tot expressie brengt, maakt een observatie mogelijk van het effect van stoffen zoals natriumcapraat op de vorming van contactgebieden tussen geclusterde oöcyten. Het kan daarom een nuttig instrument zijn voor een tijd-en kostenefficiënte screening op stoffen die van invloed zijn op de dichte junctiebarrière.
Natriumcapraatconcentraties van 100 en 500 µM kunnen een beschermend effect hebben op de oöcyten met claudin-5-expressie, wat resulteert in toenemende contactgebieden na 30 minuten incubatie.
Krug et al. (2013) aangetoond, dat incubatie met natriumcapraat leidde tot een snelle en omkeerbare afname van transepitheliale resistentie in menselijke intestinale cellijn HT-29/B6. Bovendien, confocal laser-scanning microscopie toonde een duidelijke vermindering van claudin-5 in ht-29/B6 cellen behandeld met de middellange keten vetzuur lauraat (Dittmann et al., 2014). De eerste extracellulaire lus van claudins (ECL1) is belangrijk voor de barrièreeigenschappen van de tight junction, terwijl de tweede extracellulaire lus (ECL2) betrokken is bij de vorming van strengen van trans-interactie (Piontek et al., 2008; Rossa et al., 2014; Greene et al., 2019). Claudin-5 bindmiddelen gericht op ECL1 of ECL2 van claudin-5 kunnen intracellulaire opname van het tight junction eiwit induceren, waardoor de claudin-5 trans-interacties in de tight junction seal tussen aangrenzende cellen worden gedwarsboomd en de paracellulaire ruimte wordt losgemaakt (Hashimoto et al., 2017).
we veronderstelden dus dat incubatie met natriumcapraat zou leiden tot een afname van het contactoppervlak van geclusterde claudin-5-expressie X. laevis oöcyten. Onverwacht leidden stijgende concentraties van natriumcapraat (100 en 500 µM) tot toenemende contactgebieden van geclusterde oöcyten die claudin-5 tot expressie brachten, wat wijst op een beschermend effect van natriumcapraat op de dichte verbindingsafdichting. Verder wordt natriumcapraat beschreven om contractie van de actomyosine perijunctionele ring te induceren, waardoor de paracellulaire ruimte wordt verbreed (Lindmark et al., 1998; Maher et al., 2009). Dit effect is gebaseerd op de fosforylatie van de regulerende lichte keten van myosine via een fosfolipase C-activering die leidt tot een splitsing van fosfatidylinositol 4,5-bisfosfaat (PIP2) in inositoltrifosfaat (IP3) en diacylglycerol (Tomita et al., 1995). De strakke verbinding complex verbonden door de steigerproteã ne ZO-1 Aan de actin cytoskeleton wordt dan herverdeeld van de strakke verbinding aan het cytoplasma (Lindmark et al., 1998; Turner, 2000). De cytoarchitectuur van X. laevis oöcyte is cruciaal voor cytoplasmische regionalisatie tijdens oogenese (Wylie et al., 1985). Hoewel, voorafgaand aan de bevruchting, TJP-1 genexpressie, het gen dat codeert voor ZO-1 slechts wordt uitgedrukt 1,9 TPM in eicelstadia V–VI (Session et al., 2016). Een verminderde interactie van de claudins met het cytoskeletal scaffold kan daarom het onverwachte resultaat van de caprate incubatie verklaren. Is de reikwijdte van toekomstige studies om de mechanistische basis van de bevinding te verifiëren.
echter, een varianteffect van natriumcapraat op de paracellulaire permeabiliteit werd eerder in de literatuur beschreven. In Peyer ‘ s Patchweefsel uit de darm van volwassen varkens werd een vergelijkbaar versterkend effect waargenomen. Claudin-5 was significant verhoogd na incubatie met 5 mM caprate. In deze studie leidde capraat tot een significant hogere transepitheliale elektrische weerstand (teer) in het follikelgeassocieerde epitheel (Radloff et al., 2019).
conclusie
conclusie: heterologe expressie van het tight junction eiwit claudin – 5 in X. laevis oocytes staat nieuwe inzichten toe in de bijdrage van enige claudins aan cel-celinteractie en adhesioneneigenschappen van aangrenzende cellen. Zo maakt het gebruik van het X. laevis tight junction model voor claudin-5 analyse van BBB componenten in een eencellig model mogelijk.
Gegevensbeschikbaarheidsverklaring
de voor deze studie gegenereerde datasets zijn op verzoek beschikbaar voor de overeenkomstige auteur.
ethische verklaring
de dierbehandelingen waren in overeenstemming met de richtlijnen van de Duitse wetgeving, met goedkeuring van de dierenwelzijnsfunctionaris van de Freie Universität Berlin en onder het bestuur van de Berlin Veterinary Health Inspectorate (Landesamt für Gesundheit und Soziales Berlin, permit G0025/16).
Auteursbijdragen
alle auteurs hebben het manuscript gelezen en goedgekeurd. NB en SA ontwierpen, planden en begeleidden de experimenten en schreven het manuscript. NB, LS, VC, RK en PF-B voerden de experimenten en gegevensanalyse uit.
financiering
deze studie werd gefinancierd door de Deutsche Forschungsgemeinschaft, Grant No. Am141 / 11-1 en de H. Wilhelm Schaumann Stiftung.
belangenconflict
de auteurs verklaren dat het onderzoek werd uitgevoerd zonder enige commerciële of financiële relatie die als een potentieel belangenconflict kon worden opgevat.
Dankbetuigingen
Wij danken Martin Grunau, Gisela Manz, Katharina Söllig en Susanne Trappe voor de uitstekende technische bijstand. We erkennen de steun van de Open Access publicatie initiatief van Freie Universität Berlin.
aanvullend materiaal
het aanvullende materiaal voor dit artikel is online te vinden op: https://www.frontiersin.org/articles/10.3389/fphys.2020.00857/full#supplementary-material
figuur S1 / contactgebieden van claudin-5 die eicelparen in µm2 uitdrukt tijdens incubatie met natriumcapraat in verschillende concentraties (respectievelijk n = 6-8) en met water geïnjecteerde eicellen als controlegroep (respectievelijk n = 5-7).
Amasheh, S., Dullat, S., Fromm, M., Schulzke, J. D., Buhr, H. J., and Kroesen, A. J. (2009). Ontstoken pouch mucosa bezit veranderde tight junctions die op herhaling van inflammatoire darmziekte wijzen. Int. J. Colorect. Dis. 24, 1149–1156. doi: 10.1007/s00384-009-0737-8
PubMed Abstract / CrossRef Full Text / Google Scholar
Amasheh, S., Schmidt, T., Mahn, M., Florian, P., Mankertz, J., Tavalali, S., et al. (2005). Bijdrage van claudin-5 aan barrière-eigenschappen in tight junctions van epitheliale cellen. Celweefsel Res. 321, 89-96. doi: 10.1007 / s00441-005-1101-0
PubMed Abstract / CrossRef Full Text / Google Scholar
Colegio, O. R., van Itallie, C., Rahner, C., and Anderson, J. M. (2002). De rol van claudin extracellulaire domeinen in tight junction fibrilarchitectuur en paracellulaire ladingsselectiviteit. Mol Biol Cel. 13:286.
Google Scholar
Comper, F., Antonello, D., Beghelli, S., Gobbo, S., Montagna, L., Pederzoli, P., et al. (2009). Expressiepatroon van claudins 5 en 7 onderscheidt vast-pseudopapillair van pancreatoblastoom, acinaire cel en endocriene tumoren van de alvleesklier. Is. J. Surger Pathol. 33, 768–774. doi: 10.1097 / pas.0b013e3181957bc4
PubMed Abstract / CrossRef Full Text / Google Scholar
Del Vecchio, G., Tscheik, C., Tenz, K., Helms, H. C., Winkler, L., Blasig, R., et al. (2012). Natriumcapraat opent tijdelijk claudin-5-bevattende barriã res bij tight junctions van epitheliale en endotheliale cellen. Mol. Farmaceutisch. 9, 2523–2533. doi: 10.1021 / mp3001414
PubMed Abstract / CrossRef Full Text / Google Scholar
Dittmann, I., Amasheh, M., Krug, S. M., Markov, A. G., Fromm, M., and Amasheh, S. (2014). Lauraat doordringt de paracellulaire route voor kleine moleculen in de intestinale epitheliale cel model HT-29 / B6 via het openen van de tight junctions door reversibele verplaatsing van claudin-5. Farmaceutisch. Res.Dordr. 31, 2539–2548. doi: 10.1007 / s11095-014-1350-2
PubMed Abstract / CrossRef Full Text / Google Scholar
Engelhardt, B., Wolburg-Buchholz, K., En Wolburg, H. (2001). Betrokkenheid van de choroïde plexus bij ontsteking van het centrale zenuwstelsel. Microsc. Res. Techniq. 52, 112–129. doi: 10.1002/1097-0029(20010101)52:1<112::aid-jemt13>3.0.co;2-5
CrossRef Full Text / Google Scholar
Florian, P., Amasheh, S., Lessidrensky, M., Todt, I., Bloedow, A., Ernst, A., et al. (2003). Claudins in de tight junctions van stria vascularis marginale cellen. Biochem. Biophys. Res.Co. 304, 5–10. doi: 10.1016 / s0006-291x(03)00498-4
CrossRef Full Text / Google Scholar
Furuse, M., Hata, M., Furuse, K., Yoshida, Y., Haratake, A., Sugitani, Y., et al. (2002). Claudin-gebaseerde tight junctions zijn cruciaal voor de zoogdier epidermale barrière: een les van claudin-1-deficiënte muizen. J. Cell Biol. 156, 1099–1111. doi: 10.1083 / jcb.200110122
PubMed Abstract / CrossRef Full Text / Google Scholar
Garcia-Hernandez, V., Quiros, M., en Nusrat, A. (2017). Intestinale epitheliale claudins: expressie en Regulatie in homeostase en ontsteking. Anne. N. Y. Acad. Sci. 1397, 66–79. doi: 10.1111 / nyas.13360
PubMed Abstract / CrossRef Full Text / Google Scholar
Greene, C., Hanley, N., and Campbell, M. (2019). Claudin-5: poortwachter van neurologische functie. Vloeistoffen Barr. CNS 16: 4321.
Google Scholar
Günzel, D., Amasheh, S., Pfaffenbach, S., Richter, J. F., Kausalya, P. J., Hunziker, W., et al. (2009). Claudin-16 beïnvloedt transcellulaire CL-secretie in mdck-cellen. J. Physiol. Lond. 587, 3777–3793. doi: 10.1113 / jphysiol.2009.173401
PubMed Abstract / CrossRef Full Text / Google Scholar
Hashimoto, Y., Shirakura, K., Okada, Y., Takeda, H., Endo, K., Tamura, M., et al. (2017). Claudin-5-bindmiddelen verbeteren permeatie van opgeloste stoffen over de bloed-hersenbarrière in een zoogdiermodel. J. Pharmacol. Exp. Ther. 363, 275–283. doi: 10.1124 / jpet.117.243014
PubMed Abstract / CrossRef Full Text / Google Scholar
Koda, R., Zhao, L. N., Yaoita, E., Yoshida, Y., Tsukita, S., Tamura, A., et al. (2011). Nieuwe expressie van claudin-5 in glomerulaire podocyten. Celweefsel Res. 343, 637-648. doi: 10.1007/s00441-010-1117-y
PubMed Abstract / CrossRef Full Text / Google Scholar
Konrad, M., Schaller, A., Seelow, D., Pandey, A. V., Waldegger, S., Lesslauer, A., et al. (2006). Mutaties in het tight-junction gen claudin 19 (CLDN19) worden geassocieerd met renale magnesium verspilling, nierfalen en ernstige oculaire betrokkenheid. Is. J. Hum. Genet. 79, 949–957. doi: 10.1086/508617
PubMed Abstract / CrossRef Full Text / Google Scholar
Krug, S. M., Amasheh, M., Dittmann, I., Christoffel, I., Fromm, M., and Amasheh, S. (2013). Natriumcapraat als versterker van macromolecule permeatie over tricellulaire strakke verbindingen van intestinale cellen. Biomaterialen 34, 275-282. doi: 10.1016 / j.biomaterialen.2012.09.051
PubMed Abstract / CrossRef Full Text / Google Scholar
Leduc-Nadeau, A., Lahjouji, K., Bissonnette, P., Lapointe, J. Y., and Bichet, D. G. (2007). Uitwerking van een nieuwe techniek voor de zuivering van plasmamembranen uit Xenopus laevis oocytes. Is. J. Physiol. Cel. 292, C1132-C1136.
Google Scholar
Lindmark, T., Kimura, Y., and Artursson, P. (1998). Absorptieverhoging door intracellulaire regulatie van tight junction permeabiliteit door middellange ketenvetzuren in Caco-2 cellen. J. Pharmacol. Exp. Ther. 284, 362–369.
Google Scholar
Maher, S., Leonard, T. W., Jacobsen, J., and Brayden, D. J. (2009). Veiligheid en werkzaamheid van natriumcapraat bij het bevorderen van orale geneesmiddelabsorptie: van in vitro naar de kliniek. ADV. Drug Leveren. Rev. 61, 1427-1449. doi: 10.1016/j.addr.2009.09.006
PubMed Abstract / CrossRef Full Text / Google Scholar
Milatz, S., Krug, S. M., Rosenthal, R., Gunzel, D., Muller, D., Schulzke, J. D., et al. (2010). Claudin-3 fungeert als een afdichtingscomponent van de tight junction voor ionen van ladings-en niet-opgeladen opgeloste stoffen. Biochim. Biophys. Acta 1798, 2048-2057. doi: 10.1016 / j. bbamem.2010.07.014
PubMed Abstract / CrossRef Full Text / Google Scholar
Mineta, K., Yamamoto, Y., Yamazaki, Y., Tanaka, H., Tada, Y., Saito, K., et al. (2011). Voorspelde uitbreiding van de claudin multigene familie. FEBS Lett. 585, 606–612. doi: 10.1016 / j.febslet.2011.01.028
PubMed Abstract / CrossRef Full Text / Google Scholar
Nenni, M. J., Fisher, M. E., James-Zorn, C., Pells, T. J., Ponferrada, V., Chu, S., et al. (2019). Xenbase: het vergemakkelijken van het gebruik van Xenopus om menselijke ziekte te modelleren. Voorkant. Fysiol. 10:154. doi: 10.3389 / fphys.2019.00154
PubMed Abstract / CrossRef Full Text / Google Scholar
Nitta, T., Hata, M., Gotoh, S., Seo, Y., Sasaki, H., Hashimoto, N., et al. (2003). Grootte-selectief losmaken van de bloed-hersenbarrière bij claudin-5-deficiënte muizen. J. Cell Biol. 161, 653–660. doi: 10.1083 / jcb.200302070
PubMed Abstract / CrossRef Full Text / Google Scholar
Ohtsuki, S., Sato, S., Yamaguchi, H., Kamoi, M., Asashima, T., and Terasaki, T. (2007). Exogene expressie van claudin-5 induceert barrière-eigenschappen in gekweekte rat hersenen capillaire endothelial cellen. J. Cell Physiol. 210, 81–86. doi: 10.1002 / jcp.20823
PubMed Abstract / CrossRef Full Text / Google Scholar
Piontek, J., Fritzsche, S., Cording, J., Richter, S., Hartwig, J., Walter, M., et al. (2011). Verhelderend de principes van de moleculaire organisatie van heteropolymeer strakke verbindingsbundels. Cell Mol. Life Sci. 68, 3903–3918. doi: 10.1007 / s00018-011-0680-Z
PubMed Abstract / CrossRef Full Text / Google Scholar
Piontek, J., Winkler, L., Wolburg, H., Muller, S. L., Zuleger, N., Piehl, C., et al. (2008). Vorming van tight junction: determinanten van homofiele interactie tussen klassieke claudins. FASEB J. 22, 146-158. doi: 10.1096 / fj.07-8319com
PubMed Abstract / CrossRef Full Text / Google Scholar
Radloff, J., Cornelius, V., Markov, A. G., and Amasheh, S. (2019). Capraat moduleert de intestinale barrièrefunctie in het follikelgeassocieerde epitheel van porcine Peyer. Int. J. Mol. Sci. 20:1418. doi: 10.3390 / ijms20061418
PubMed Abstract / CrossRef Full Text / Google Scholar
Reinhold, A. K., and Rittner, H. L. (2017). Barrièrefunctie in het perifere en centrale zenuwstelsel-een beoordeling. Pflug. Boog. Euro. J. Phys. 469, 123–134. doi: 10.1007/s00424-016-1920-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Resnick, M. B., Gavilanez, M., Newton, E., Konkin, T., Bhattacharya, B., Britt, D. E., et al. (2005). Claudin expression in gastric adenocarcinomas: a tissue microarray study with prognostic correlation. Hum. Pathol. 36, 886–892. doi: 10.1016/j.humpath.2005.05.019
PubMed Abstract | CrossRef Full Text | Google Scholar
Rossa, J., Ploeger, C., Vorreiter, F., Saleh, T., Protze, J., Gunzel, D., et al. (2014). Claudin-3 en Claudin-5 eiwit vouwen en assemblage in de strakke verbinding worden gecontroleerd door niet-geconserveerde residuen in de transmembrane 3 (TM3) en extracellulaire lus 2 (ECL2) segmenten. J. Biol. Scheikunde. 289, 7641–7653. doi: 10.1074 / jbc.m113. 531012
PubMed Abstract / CrossRef Full Text / Google Scholar
Session, A. M., Uno, Y., Kwon, T., Hapman, J. A. C., Toyoda, A., Takahashi, S., et al. (2016). Genoomevolutie in de allotetraploïde kikker Xenopus laevis. Nature 538, 336-343.
Google Scholar
Soini, Y. (2011). Claudins bij longziekten. Resp. Res. 12: 70.
Google Scholar
Suzuki, H., Nishizawa, T., Tani, K., Yamazaki, Y., Tamura, A., Ishitani, R., et al. (2014). Kristalstructuur van een claudin geeft inzicht in de architectuur van tight junctions. Wetenschap 344, 304-307. doi: 10.1126 / wetenschap.1248571
PubMed Abstract / CrossRef Full Text / Google Scholar
Tammaro, P., Shimomura, K., and Proks, P. (2009). “Xenopus Oocytes as a heterologe expression system for studying ion channels with the patch-clamp technique,” in Potassium Channels: Methods and Protocols, ed. J. D. Lippiat (Totowa, NJ: Humana Press), 127-139.
Google Scholar
Tebbe, B., Mankertz, J., Schwarz, C., Amasheh, S., Fromm, M., Assaf, C., et al. (2002). Strakke junctieproteã nen: een nieuwe klasse van integrale membraanproteã nen – uitdrukking in menselijke epidermis en in HaCaT keratinocytes. Arch Dermatol. Res. 294, 14-18. doi: 10.1007 / s00403-001-0290-y
PubMed Abstract / CrossRef Full Text / Google Scholar
Tomita, M., Hayashi, M., and Awazu, S. (1995). Absorptieversterkend mechanisme van natriumcapraat en decanoylcarnitine in Caco-2 cellen. J. Pharmacol. Exp. Ther. 272, 739–743.
Google Scholar
Turner, J. R. (2000). ‘Putting the squeeze’ op de tight junction: inzicht in cytoskeletal Regulatie. Sperma. Cel Dev. Biol. 11, 301–308. doi: 10.1006 / scdb.2000.0180
PubMed Abstract / CrossRef Full Text / Google Scholar
van Itallie, C. M., and Anderson, J. M. (2006). Claudins en epitheliaal paracellulair transport. Annu. Rev. Physiol. 68, 403–429. doi: 10.1146 / annurev.fysiol.68.040104.131404
PubMed Abstract / CrossRef Full Text / Google Scholar
Vedula, S. R. K., Lim, T. S., Kausalya, P. J., Lane, E. B., Rajagopal, G., Hunziker, W., et al. (2009). Kwantificerende krachten bemiddeld door integrale strakke junctieproteã nen in cel-cel adhesie. Exper. Mech. 49, 3–9. doi: 10.1007/s11340-007-9113-1
CrossRef Full Text | Google Scholar
Vitzthum, C., Stein, L., Brunner, N., Knittel, R., Fallier-Becker, P., and Amasheh, S. (2019). Xenopus oocytes as a heterologous expression system for analysis of tight junction proteins. FASEB J. 33, 5312–5319. doi: 10.1096/fj.201801451rr
PubMed Abstract | CrossRef Full Text | Google Scholar
Wilcox, E. R., Burton, Q. L., Naz, S., Riazuddin, S., Smith, T. N., Ploplis, B., et al. (2001). Mutaties in het gen dat codeert voor tight junction claudin-14 veroorzaken autosomaal recessieve doofheid DFNB29. Cel 104, 165-172. doi: 10.1016 / s0092-8674(01)00200-8
CrossRef Full Text / Google Scholar
Wolburg, H., Wolburg-Buchholz, K., Kraus, J., Rascher-Eggstein, G., Liebner, S., Hamm, S., et al. (2003). Lokalisatie van claudin-3 in tight junctions van de bloed-hersenbarrière wordt selectief verloren tijdens experimentele auto-immune encefalomyelitis en humaan multiform glioblastoom. Acta Neuropathol. 105, 586–592. doi: 10.1007 / s00401-003-0688-Z
PubMed Abstract / CrossRef Full Text / Google Scholar
Wylie, C. C., Brown, D., Godsave, S. F., Quarmby, J., and Heasman, J. (1985). Het cytoskelet van Xenopus oöcytes en zijn rol in ontwikkeling. J. Embryol. Exp. Morph. 89, 1–15.
Google Scholar