- Introduction
- Multipulfuncties van Chymase
- Chymase in mestcellen
- meerdere enzymatische functies van Chymase
- enzymatische functie van Chymase bij NASH
- betrokkenheid van Chymase in NASH – diermodellen
- Effect van Chymase Remmer in NASH Dierlijke Modellen
- Effect van Chymase Remmer in NASH Dierlijke Modellen
- mechanisme van leverontsteking verzwakt door Chymaseremmer
- mechanisme van hepatische steatose, verzwakt door Chymaseremmer
- mechanisme van leverfibrose verzwakt door Chymaseremmer
- conclusie
- Auteursbijdragen
- belangenverstrengeling verklaring
Introduction
Non-alcoholic fatty liver disease (NAFLD) is erkend als de meest voorkomende vorm van leverziekte (Angulo, 2002; Clark et al., 2002). Niet-alcoholische steatohepatitis (NASH) bootst alcoholische hepatitis na ondanks de afwezigheid van een geschiedenis van Drinken (Ludwig et al., 1980). NAFLD en NASH worden geassocieerd met metabool syndroom als gevolg van obesitas, insulineresistentie, hyperlipidemie en hypertensie. NAFLD wordt beschouwd als de meest voorkomende leverziekte en presenteert zich meestal als eenvoudige hepatische steatose (Tiniakos et al., 2010). In tegenstelling, NASH wordt gekenmerkt door ernstige steatose, lobulaire ontsteking, en fibrose van de lever (Powell et al., 1990; Bertot and Adams, 2016). Hoewel het mechanisme dat verantwoordelijk is voor de ontwikkeling van NASH onduidelijk blijft, wordt ervan uitgegaan dat NASH wordt veroorzaakt door een ‘multiple-hit’ – proces, met hepatische steatose als de ‘eerste hit’ en daaropvolgende hits zoals ontsteking, oxidatieve stress en endotoxinen (Torg and Moschen, 2010). NASH is nauw verwant aan metabool syndroom, en verschillende klinische studies hebben de therapeutische behandeling van NASH onderzocht door zich te concentreren op de symptomen van diabetes, hyperlipidemie en hypertensie (Georgescu et al., 2009; Park et al., 2010; Mahady et al., 2011). Er zijn echter geen algemeen aanvaarde therapeutische middelen vastgesteld.
Chymase kan betrokken zijn bij de pathogenese van leverfibrose. Chymase activiteit was significant verhoogd in de levers van patiënten met fibrose of cirrose en er was een significante correlatie tussen chymase niveau en mate van fibrose (Komeda et al., 2008). Hoewel verhoogde chymase activiteit niet is gemeld bij patiënten met NASH, is het wel waargenomen in diermodellen van NASH (Tashiro et al., 2010; Masubuchi et al., 2013; Miyaoka et al., 2017). Daarentegen resulteerde de remming van chymase door gebruik te maken van inhibitoren met een laag molecuul in een significante vermindering van ontsteking, steatose en fibrose in NASH-modellen van ratten en hamsters (Tashiro et al., 2010; Masubuchi et al., 2013; Miyaoka et al., 2017). Deze bevindingen wijzen erop dat chymase betrokken kan zijn bij ontsteking, steatose en fibrose tijdens de ontwikkeling en progressie van NASH (figuur 1).
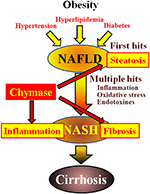
FIGUUR 1. NAFLD en NASH zijn verbonden met het metabool syndroom door obesitas, insulineresistentie, hyperlipidemie en hypertensie. Van NASH wordt aangenomen dat het zich ontwikkelt via een ‘multiple-hit’ – proces, met hepatische steatose als de “eerste hit” en daaropvolgende hits zoals ontsteking, oxidatieve stress en endotoxinen, en wordt gekenmerkt door ernstige steatose, ontsteking en fibrose. Chymase kan betrokken zijn bij de progressie van steatose, ontsteking en fibrose in de lever.
Multipulfuncties van Chymase
Chymase in mestcellen
Chymase (EC 3.4.21.39) worden uitgedrukt in het secretiekorrels van mestcellen. Chymase wordt geproduceerd als inactief prochymase binnen secretoire korrels, en vereist dipeptidylpeptidase I (DPPI) voor activering. DPPI is een thiol proteïnase en de optimale pH is 6,0. De optimale pH-waarde komt overeen met de voorgestelde functie van DPPI om prochymase te activeren, aangezien de pH in secretoire granulaten wordt geregeld bij pH 5,5 (De Young et al. 1987) (Figuur 2). Chymase heeft echter geen enzymatische activiteit in mestcellen bij deze pH, omdat de optimale pH voor chymase tussen 7 en 9 ligt (Takai et al., 1996, 1997). Na activering van mestcelkorrels door stimuli zoals ontsteking en letsel, wordt chymase vrijgegeven en vertoont enzymatische functie bij de optimale pH 7,4 (Figuur 2).
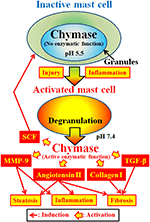
FIGUUR 2. Chymase wordt opgeslagen in de secretoire korrels van inactieve mestcellen. De pH in granulaat wordt gehandhaafd op pH 5,5, een aandoening waarbij chymase geen enzymatische activiteit heeft. Chymase vertoont zijn enzymatische functies, zoals vorming van angiotensine II, MMP-9, TGF-β, collageen I en SCF, na afgifte uit mestcelkorrels, na activering door ontsteking en letsel.
meerdere enzymatische functies van Chymase
Chymase is een serineprotease en splijt de C-terminale zijde van eiwitten na aromatische aminozuren zoals Phe, Tyr en Trp in het algemeen. Chymase kan de phe8–His9 band van niet-bioactive peptide angiotensine I splijten en zijn bioactive peptide angiotensine II in zoogdierweefsels met inbegrip van mens vormen (Urata et al., 1990; Takai et al., 1996, 1997). Bovendien splijt chymase enzymatisch de precursoren van matrixmetalloproteïnase (MMP)-9, waarbij de groeifactor (TGF)-β en collageen I worden omgezet in hun actieve vormen (Kofford et al., 1997; Takai et al., 2003; Furubayashi et al., 2008). Bovendien kan de enzymatische functie van chymase stamcelfactor (SCF) produceren door enzymatische splitsing van de inactieve membraangebonden vorm van SCF, die de vorming van rijpe mestcellen uit onrijpe mestcellen induceert via de stimulatie van c-kit receptor (Longley et al., 1997). Zo heeft chymase meerdere enzymatische functies, waaronder activering van angiotensine II, MMP-9, TGF-β, collageen I en SCF (Figuur 2).
enzymatische functie van Chymase bij NASH
angiotensine II kan hepatische steatose en ontsteking bevorderen door reactieve zuurstofsoorten (ROS) te verhogen na stimulatie van angiotensine II-receptoren in diermodellen NASH (Hirose et al., 2007; Nabeshima et al., 2009). Angiotensine II induceerde ook hepatische fibrose via inductie van α-smooth muscle actine (SMA) in hepatische stellaatcellen (HSCs) (Yoshiji et al., 2001). MMP-9 is gemeld om de infiltratie van neutrofielen en macrofagen via degradatie van intercellulaire matrixen zoals vitronectine en fibronectine te induceren, resulterend in toename van ontsteking (Medina et al., 2006). Bij NASH-patiënten werd een significante toename van MMP-9 genexpressie waargenomen in de lever vergeleken met normale controles (Ljumovic et al., 2004). Hepatische overexpressie van TGF-β bij transgene muizen veroorzaakte ernstige hepatische fibrose via augmentatie van procollagen I genexpressie (Casini et al., 1993). Het is bekend dat zowel de vorming van TGF-β als de accumulatie van collageen I leverfibrose veroorzaken. Activering van SCF induceert een toename van het aantal mestcellen en de enzymatische functie ervan kan resulteren in een toename van de chymase-activiteit in fibrotische weefsels (Maruichi et al., 2004). Deze enzymatische functies van chymase kunnen betrokken zijn bij steatose, ontsteking en fibrose, die allemaal worden waargenomen in de levers van NASH-patiënten en diermodellen (Figuur 2).
betrokkenheid van Chymase in NASH – diermodellen
het methionine-en cholinedeficiënte (MCD) dieet is op grote schaal gebruikt om een typisch NASH-model te induceren. Bij hamsters die het MCD-dieet kregen, werden significante verhogingen van totaal bilirubine, triglyceride en hyaluronzuur in plasma waargenomen (Tashiro et al., 2010). Bovendien werden ophoping van ontstekingscellen en toename van lipideafzetting en fibrotisch gebied in de lever waargenomen. In dit MCD dieet-geïnduceerde NASH-model, hepatische chymase activiteit en gerelateerde factoren, zoals angiotensine II, MMP-9 en collageen I, waren significant verhoogd (Tashiro et al., 2010; Masubuchi et al., 2013). Onlangs werd een nieuw NASH-model ontwikkeld waarin beroerte-gevoelig spontaan hypertensieve 5/Dmcr (SHRSP5 / Dmcr) ratten werden gevoed een hoog-vet en-cholesterol (HFC) dieet (Kitamori et al., 2012). Dit model toonde symptomen van metabool syndroom waarvan wordt aangenomen dat ze klinisch lijken op die van NASH-patiënten (Kitamori et al., 2012). In het door HFC-dieet geïnduceerde NASH-model werden hypertensie en hyperlipidemie waargenomen, en ernstige steatose, fibrose en inflammatoire celaccumulatie werden gedetecteerd in de lever (Miyaoka et al., 2017). Verder werd een significante toename van chymase-activiteit waargenomen samen met MMP-9, TGF-β en collageen I in de lever (Miyaoka et al., 2017). Er lijkt dus een nauwe relatie te bestaan tussen chymase en NASH pathogenese in diermodellen van NASH.
Effect van Chymase Remmer in NASH Dierlijke Modellen
Effect van Chymase Remmer in NASH Dierlijke Modellen
Een lage molecuul chymase remmer aanzienlijk verzwakt chymase activiteit en verminderde angiotensine II, MMP-9 en collageen ik niveaus in de lever bij een MCD dieet-fed NASH hamster model, wanneer de administratie van de inhibitor werd gelanceerd op hetzelfde moment als de MCD dieet (Tashiro et al., 2010; Masubuchi et al., 2013). De chymase-remmer voorkwam significant hepatische steatose, fibrose en inflammatoire celaccumulatie in dit NASH-model (Tashiro et al., 2010; Masubuchi et al., 2013). Oxidatieve stress wordt verondersteld een rol te spelen in de’ multiple-hit ‘ theorie van NASH ontwikkeling, en de toename van de oxidatieve stress marker malondialdehyde werd significant verzwakt in de lever door de chymase remmer (Masubuchi et al., 2013). In een hamster MCD dieet-geïnduceerd NASH model, de chymase remmer toonde een verbeterend effect wanneer toegediend in gevestigde NASH (Masubuchi et al., 2013). De graden van zowel steatose als fibrose in de lever waren verminderd in vergelijking met vóór toediening van de chymaseremmer (Masubuchi et al., 2013).
in de lever van een hypertensief HFC-dieet-geïnduceerd NASH-model bij ratten verminderde een chymase-remmer met een laag molecuul zowel de chymasespiegels als MMP-9, TGF-β en collageen I, die allemaal chymase-geassocieerde factoren zijn (Miyaoka et al., 2017). De chymase remmer verzwakte significant hepatische steatose en fibrose, en verminderde myeloperoxidase als een marker van ontsteking, in het bijzonder van neutrofiel infiltratie (Miyaoka et al., 2017). In dit HFC-dieet-geïnduceerde model, overleving van de placebo-behandelde groep was 0% op 14 weken na de start van het HFC-dieet, en het gevolg van ernstig leverfalen (Miyaoka et al., 2017). Echter, de met chymaseremmer behandelde groep, waarin de ratten onmiddellijk na de start van het HFC-dieet met de chymaseremmer werden behandeld, vertoonde 100% overleving na 14 weken. Bovendien werd een overlevingspercentage van 50% gemeld voor ratten die werden behandeld met de chymaseremmer vanaf 8 weken na het begin van het HFC-dieet, waarna NASH werd vastgesteld (Miyaoka et al., 2017).Daarom kunnen chymaseremmers nuttige middelen zijn voor de preventie en verbetering van NASH in diermodellen. Anderzijds bevordert angiotensine II indirect ook leverontsteking, steatose en fibrose via verhogingen van MMP-9 en TGF-β genexpressie. Zowel MMP-9 als TGF-β zijn nauw betrokken bij de pathogenese van NASH, maar deze factoren worden niet noodzakelijk alleen veroorzaakt door angiotensine II (Takai et al., 2010). Andere factoren dan de stimulatie van angiotensine II dragen bij tot de toename van de MMP-9-en TGF-β-genexpressie (Takai et al., 2010). In dergelijke gevallen is angiotensine II-receptorblokker (ARB) niet in staat om de MMP-9-en TGF-β-werking te verzwakken; een chymaseremmer kan echter verzachtende effecten hebben via remming van de MMP-9-en TGF-β-activering, wat wijst op een potentieel behandelingsverloop voor de preventie van NASH-progressie.
mechanisme van leverontsteking verzwakt door Chymaseremmer
Chymaseremmer was in staat om ontsteking te verminderen in hamster MCD dieet – en rat HFC dieet-geïnduceerde NASH modellen (Tashiro et al., 2010; Masubuchi et al., 2013; Miyaoka et al., 2017). Behandeling met chymase-inhibitoren verminderde significant de chymase-activiteit in de lever en verminderde angiotensine II – en MMP-9-spiegels (Tashiro et al., 2010; Masubuchi et al., 2013; Miyaoka et al., 2017). In HSC, veroorzaakt angiotensine II Ros generatie zoals waterstofperoxide en superoxide door de activering van nicotinamide adenine dinucleotide phosphate (NADPH) oxidase (de Minicis en Brenner, 2007). Chymaseremmer resulteerde in verlagingen van de genexpressie van de NADPH-oxidase-component Rac-1 en de oxidatieve stressmarker malondialdehyde, naast een verlaging van angiotensine II-spiegels in een hamster MCD-geïnduceerd NASH-model (Masubuchi et al., 2013). Door angiotensine II geïnduceerde augmentatie van ROS bevorderde MMP-9 genexpressie in neutrofielen en macrofagen (Yaghooti et al., 2011; Kurihara et al., 2012). Daarom remt de chymaseremmer direct de activering van proMMP-9 tot MMP-9 en vermindert hij indirect de MMP-9 genexpressie via het verlaagde angiotensine II-gehalte. MMP-9 splijt extracellulaire matrixbestanddelen, zoals vitronectine en fibronectine, leidt tot de desintegratie van leverintegriteit en induceert de infiltratie van macrofagen en neutrofielen (Medina et al., 2006). In een door HFC-dieet geïnduceerd NASH-model werd een significante toename van myeloperoxidase-expressie in macrofagen en neutrofielen waargenomen in de lever, en werd verminderd door chymaseremmer (Miyaoka et al., 2017). Daarom kan het ontstekingsmechanisme, verzwakt door chymaseremmer, afhankelijk zijn van de verlaging van angiotensine II-en MMP-9-spiegels in de lever.
mechanisme van hepatische steatose, verzwakt door Chymaseremmer
angiotensine II kan hepatische steatose beïnvloeden via de productie van ROS. In muriene HSC, verminderde een inhibitor van NADPH oxidase beduidend Ros productie en een ARB vertraagde de ontwikkeling van hepatische steatosis via verzwakking van Ros productie (Hirose et al., 2007; Guimarães et al., 2010). In een MCD DIEETGEÏNDUCEERD NASH muismodel werd een significante verzwakking van steatose waargenomen bij angiotensine II receptor-deficiënte muizen (Nabeshima et al., 2009). Zowel in vivo als in vitro experimenten toonden aan dat angiotensine II sterol regulatory element-binding protein (SREBP)-1c en Fat acid synthase (FAS) genexpressie upreguleerde, beide belangrijke factoren in de regulatie van lipogenese, na ROS-augmentatie (Kim et al., 2001; Hongo et al., 2009). In tegenstelling, verzwakte ARB hepatische steatosis samen met downregulating de genuitdrukking van SREBP-1c en FAS via Ros verzwakking in een muis NASH model (Kato et al., 2012). In een hamster MCD DIEETGEÏNDUCEERD NASH-model werd een significante verzwakking van SREBP-1c en FAS genexpressie waargenomen na behandeling met een chymaseremmer met een laag molecuul (Masubuchi et al., 2013). Daarom kan het verbeterende mechanisme van hepatische steatose door chymaseremmer afhankelijk zijn van de vermindering van de Ros-productie via een verminderde angiotensine II-generatie in de lever.
mechanisme van leverfibrose verzwakt door Chymaseremmer
Chymase kan nauw geassocieerd zijn met de progressie van weefselfibrose, omdat het bijdraagt aan de vorming van TGF-β uit de niet-bioactieve precursor TGF-β, en van TGF-β is bekend dat het de groei van fibroblasten sterk induceert (Takai et al., 2003; Oyamada et al., 2011). Het is bekend dat TGF-β een centrale rol speelt in de progressie van fibrose bij NASH-patiënten via geactiveerde HSC (Williams et al., 2000). Remming van de TGF-β-functie via genexpressie en signalering resulteerde in verbeterde leverfibrose in experimentele modellen (George et al., 1999; Arias et al., 2003). In een door HFC-dieet geïnduceerd NASH-model bij ratten resulteerde de verzwakking van de chymase-activiteit door chymase-inhibitor in verlagingen van het TGF-β-niveau en het fibrotische gebied in de lever (Miyaoka et al., 2017). Aldus kan de vermindering van TGF-β door chymaseremmer bijdragen aan de preventie van leverfibrose.Angiotensine II kan ook betrokken zijn bij de inductie van leverfibrose. Angiotensine II induceert samentrekking en proliferatie van HSC, en induceert ook de genexpressie van TGF-β in fibroblasten in vitro (Kagami et al., 1994; Bataller et al., 2000). Zowel TGF-β-spiegels als de mate van collageenaccumulatie en fibrotische laesies werden waargenomen door galwegligatie bij wild-type muizen, maar deze werden verzwakt bij angiotensine II receptor deficiënte muizen (Yang et al., 2005). In een NASH-model bij de rat verzwakte ARB ook de leverfibrose via de reductie van TGF-β-genexpressie (Hirose et al., 2007). Er kan ook een verband zijn tussen angiotensine II en leverfibrose anders dan door angiotensine II geïnduceerde TGF-β genexpressie. Bij patiënten met chronische hepatitis C verminderde ARB de collageengenexpressie via RAC-1 genexpressie (Colmenero et al., 2009). HSC wordt erkend als de belangrijkste producerende cellen van collageen in de lever, en de toename in de uitdrukking van α-gladde spieractine (SMA) in HSC veroorzaakt sterk extracellulaire matrixdepositie, met inbegrip van collageen I (De Minicis en Brenner, 2007). Angiotensine II kan α-SMA genexpressie induceren bij rat HSC. Angiotensine II-blokkade daarentegen resulteert in de verzwakking van leverfibrose samen met vermindering van α-SMA (Yoshiji et al., 2001). Hoewel niet onderzocht bij patiënten met NASH, werden zowel chymase als angiotensine II-vormende activiteiten significant verhoogd in fibrotische regio ‘ s van levers van patiënten met cirrose, en significante correlaties tussen chymase, angiotensine II-vormende activiteit en leverfibrose waargenomen (Komeda et al., 2008). In een hamstertetrachloride-geïnduceerd levercirrose-model werden significante verhogingen van chymase en angiotensine II-vormende activiteit waargenomen, die samen met levercirrose significant verzwakt waren na behandeling met een chymaseremmer met een laag molecuul (Komeda et al., 2010).
de mestcelstabilisator tranilast kan de activering van mestcellen remmen, waardoor de afgifte van chymase wordt geblokkeerd en daardoor de ontwikkeling van leverfibrose wordt voorkomen in een NASH-model met diabetes bij ratten en een door HFC-dieet geïnduceerd NASH-model (Uno et al., 2008). Chymase bevordert de proliferatie van mestcellen via SCF-activering door zijn enzymatische functie (Longley et al., 1997). In diermodellen van NASH verminderde chymase-remmer de toename van het aantal mestcellen in de lever, wat resulteerde in een verminderde chymase-activiteit na directe remming door chymase-remmer en een indirecte reductie van chymase-expressie in mestcellen (Masubuchi et al., 2013; Miyaoka et al., 2017).
daarom kan chymaseremmer bijdragen aan de preventie van leverfibrose door remming van de TGF-β-activering door remming van chymase en/of verzwakking van het TGF-β-niveau door reductie van angiotensine II en mastcelproliferatie.
conclusie
metabolisch syndroom, bestaande uit obesitas, insulineresistentie, hyperlipidemie en hypertensie, is nauw gerelateerd aan de ontwikkeling van NASH, en er zijn studies uitgevoerd met anti-diabetische, anti-hyperlipidemische en anti-hypertensieve middelen voor de behandeling van NASH. Het concept achter deze middelen is om de symptomen van metabool syndroom af te zwakken (Georgescu et al., 2009; Park et al., 2010; Mahady et al., 2011). Eerdere rapporten hebben aangetoond dat chymase inhibitor vermindert ontsteking en fibrose zonder invloed op bloedglucose en lipide niveaus en bloeddruk in diermodellen van diabetes, hyperlipidemie, en hypertensie, respectievelijk (Inoue et al., 2009; Takai et al., 2014; Zhang et al., 2016). Daarom is het concept achter chymase remming om leverontsteking en fibrose van NASH direct af te zwakken. We stellen voor dat chymase inhibitor gericht op metabool syndroom is een potentieel krachtige strategie voor de verzwakking van NASH progressie.
Auteursbijdragen
ST en DJ: schreef het manuscript. Beide auteurs hebben het definitieve manuscript gelezen en goedgekeurd.
belangenverstrengeling verklaring
de auteurs verklaren dat het onderzoek werd uitgevoerd zonder enige commerciële of financiële relatie die als een potentieel belangenconflict kon worden opgevat.