- Inleiding
- materialen en methoden
- onderzoeksopzet
- inclusiecriteria
- diagnose
- Operatiegroep
- radiotherapie Groep
- Classificatie van Tumoren
- chirurgisch programma
- statistische analyse
- resultaten
- Operatiegroep
- deelnemers
- de aard van de tumoren
- chirurgische resultaten
- radiotherapie Groep
- symptomatische resultaten
- radiologische resultaten
- verdere behandeling
- discussie
- conclusie
- verklaring betreffende de beschikbaarheid van gegevens
- ethische verklaring
- bijdragen van auteurs
- financiering
- belangenconflict
Inleiding
Cerebellopontine angle meningeomen zijn verantwoordelijk voor 6-15% van de tumoren in de regio cerebellopontine angle (1). Ze worden gekenmerkt door de diepe tumor locatie, smalle chirurgische veld, en de nabijheid van de hersenstam, meerdere paren van (V–XI) craniale zenuwen (2). Momenteel is chirurgische behandeling de eerste keuze voor grote cerebellopontine hoek meningeomen, terwijl kleine cerebellopontine hoek meningeomen altijd worden behandeld met stereotactische radiotherapie, farmacotherapie en experimentele therapie (3). In de afgelopen jaren, hebben vele studies gevonden dat stereotactische radiotherapie de beperkingen van lage tumorcontrole tarief, post-behandeling hersenoedeem, en weefseladhesie had, die de verdere behandelingen belemmerde (4). Daarom wenden steeds meer kleine cerebellopontine hoekmeningeoom patiënten zich tot chirurgische behandeling.
materialen en methoden
onderzoeksopzet
een retrospectieve analyse van patiënten met kleine cerebellopontine hoekmeningeoom werd uitgevoerd. Deze patiënten werden tussen januari 2010 en December 2019 geopereerd in de neurochirurgieafdeling van het eerste aangesloten Ziekenhuis van Soochow University. Deze patiënten werden geclassificeerd als de operatiegroep. We bespraken ook de literatuur over stereotactische radiotherapie van kleine cerebellopontine hoek meningeomen van de afgelopen 10 jaar. De klinische gegevens van patiënten in de literatuur werden verzameld en geanalyseerd, en deze patiënten werden geclassificeerd als de radiotherapie groep. We analyseerden de verschillen tussen de twee groepen, met inbegrip van de aard van tumoren, symptomen pre – en post-behandelingen, neurologische tekorten, en prognose. Tot slot hebben we de chirurgische resultaten van kleine cerebellopontine hoekmeningeomen onderzocht en de chirurgische ervaring samengevat.
inclusiecriteria
diagnose
om meningeomen te onderscheiden van andere cerebellopontinehoektumoren, zoals akoestische neuroomen en gliomen, werden alle patiënten gediagnosticeerd door zowel radiologisch als histopathologisch onderzoek, inclusief MRI -, CT -, PET-en sstr2-liganden. Zowel het dural staartteken op MRI als geen uitzetting van de interne gehoorgang op CT zijn de belangrijkste differentiële punten tussen cerebellopontine hoek meningiomen en akoestische neuroomen. Om cerebellopontine hoekmeningeomen te onderscheiden van gliomen en metastasen, werden patiënten conventioneel Getest met MR-spectroscopie (5). In termen van histologische aspecten, immunohistochemische analyse werd ook conventioneel getest, zoals he kleuring, vimentin kleuring, EMA kleuring, Ki-67 en CD56.
Operatiegroep
(1) de patiënten met klein cerebellopontine hoekmeningeoom werden geopereerd tussen januari 2010 en December 2019, (2) tumorvolume ≤ 8 cm3, (3) geen gerelateerde behandeling vóór de operatie, (4) geen andere aandoeningen van het zenuwstelsel, en (5) hielden contact tijdens de follow-up.
radiotherapie Groep
(1) de patiënten met klein cerebellopontine hoekmeningeoom werden verzameld uit de literatuur over stereotactische radiotherapie, die gepubliceerd werd tussen januari 2010 en December 2019, (2) de geïncludeerde patiënten hadden volledige gegevens voor en na de behandeling, (3) geen andere aandoeningen van het zenuwstelsel, en (4) hielden contact tijdens de follow – up.
de Follow-up bestond uit routinematig bezoek aan de patiënten en het uitvoeren van MRI-of CT-tests elke 3-6 maanden gedurende de eerste 3 jaar na de behandeling, en vervolgens bezoeken en testen elk jaar.
Classificatie van Tumoren
Gebaseerd op de centrale site van dural bijlage cerebellopontine hoek meningeomen werden ingedeeld in drie typen (6): de anterieure tumoren waren degenen die afkomstig is van het tentorium de helft van cerebellum of de petrous bot dura anterieure de inwendige gehoorgang; midden tumoren waren degenen die afkomstig is van de dura mater in de inwendige gehoorgang; posterior tumoren waren degenen die afkomstig is van het sigmoïd en dwars sinussen of de petrous bot dura posterieure de inwendige gehoorgang (Figuur 1).
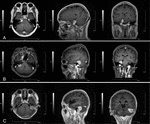
figuur 1. Drie soorten kleine cerebellopontine hoek meningeomen. A) Anterieur. B) Midden. C) Posterieur.
op basis van tumorpathologie werden cerebellopontine hoekmeningeomen ingedeeld in drie klassen: WHO-graad I (laag recidief en lage invasieve groei), WHO-graad II (hoog recidief en hoge invasieve groei) en WHO-graad III (sterk recidief en systemisch metastaseren).
op basis van de graad van tumorresectie werden patiënten met cerebellopontine hoekmeningeomen onderverdeeld in vijf graden: Simpson graad I: totale resectie van het meningeoom, de duraalhechting en de schedel; Simpson graad II: totale resectie van het meningeoom en elektrocoagulatie of laserbehandeling met duraalhechting; Simpson graad III: totale resectie van meningeomen en geen behandeling met de duraalhechting en de schedel; Simpson graad IV: gedeeltelijke resectie van meningeomen; Simpson graad V: decompressie en tumorbiopsie.Tumorprogressie en-regressie werden gedefinieerd als volumeveranderingen van meer dan 15% bij radiologisch onderzoek.
chirurgisch programma
alle patiënten gebruikten de suboccipitale retrosigmoïdbenadering. Een suboccipitale retrosigmoid rechte incisie van ongeveer 8-10 cm werd gemaakt op de aangetaste kant. De lange diameter van het ovale botvenster was 5 cm en de korte diameter 3,5 cm. Het botvenster tot aan de transversale sinus, lateraal tot aan de mastoïde wortel, legde de hoek tussen de sigmoïde en transversale sinus bloot. Snijd de dura, strekte het cerebellum uit, opende de cisterna magna, en liet de cerebrospinale vloeistof vrij. Ten slotte werd de hersenvlieshoek volledig verwijderd om de Petrus-ader, de nervus trigeminus en de nervus abducens te beschermen. Tijdens de operatie werd elektrofysiologische monitoring gebruikt om de gezichts-en akoestische zenuwen te controleren.
statistische analyse
alle statistische analyses werden uitgevoerd met SPSS versie 22.0. De parametrische continue variabelen werden gerapporteerd als gemiddelde ± standaardafwijking. De niet-parametrische variabelen werden gerapporteerd als de mediaan met het bereik. Klinische resultaten en klachten en symptomen werden gerapporteerd als gegevens uit drie categorieën (verbetering of vergroting, geen verandering, verslechtering of afname). De onafhankelijke monsters t-test werd uitgevoerd voor twee categorieën gegevens, en ANOVA werd uitgevoerd voor drie categorieën gegevens. De chi-kwadraattest werd uitgevoerd om nominaal gedistribueerde categorische variabelen te vergelijken. Logistische regressieanalyse werd uitgevoerd voor multivariate analyses. P-waarden lager dan 0,05 werden statistisch significant geacht.
resultaten
Operatiegroep
deelnemers
in totaal werden 162 patiënten met klein cerebellopontine hoekmeningeoom opgenomen, waaronder 53 mannen en 109 vrouwen, met een gemiddelde leeftijd van 54,85 jaar (21-89 jaar). De preoperatieve symptomen waren hoofdpijn en duizeligheid (96), gehoorverlies en tinnitus (48), gezichtsgevoel en verlamming (29), instabiliteit van het lopen en ataxie (28), heesheid, slechte hoestreflex (16). Er waren 77 patiënten met twee of meer symptomen en 64 patiënten zonder symptomen vóór de diagnose.
de aard van de tumoren
het volume van de tumoren varieerde van 1.042 tot 8.161 cm3, met een gemiddelde van 4.710 cm3; 72 patiënten hadden anterieure tumoren, 41 patiënten hadden middentumoren en 49 patiënten hadden posterieure tumoren; 148 patiënten hadden WHO-graad I tumoren en 14 patiënten hadden who-graad II tumoren.
chirurgische resultaten
er waren 152 gevallen van Simpson graad I en 10 gevallen van Simpson graad II, 41 gevallen van postoperatieve symptoomverlichting, 110 gevallen van geen significante verandering, 11 gevallen van verergering of nieuwe symptomen.
radiotherapie Groep
in totaal werden 1644 patiënten met klein cerebellopontine hoekmeningeoom opgenomen, waaronder 335 mannen en 1309 vrouwen (Tabel 1).
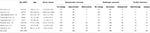
Tabel 1. Kenmerken van patiënten in literatuur.
van de radiotherapie-groep vertoonden 971 patiënten (59,1%) geen significante verandering in symptomen na behandeling, 546 patiënten (33,2%) vertoonden een verbetering van de symptomen en 127 patiënten (7,7%) vertoonden een verergering van de symptomen of ontwikkelden nieuwe neurologische symptomen.
er waren 151 patiënten (9.2%) in de radiotherapie groep met tumor recidief tijdens de follow-up.
er waren 54 patiënten (3,3%) die tweede stereotactische radiotherapie kregen en 62 patiënten (3,8%) ondergingen een operatie tijdens de follow-up.
symptomatische resultaten
van de operatiegroep hadden 102 patiënten (63,0%) geen significante verandering in symptomen na de operatie, 49 patiënten (30,2%) vertoonden een verbetering van de symptomen en 11 patiënten (6,8%) vertoonden een verergering van de symptomen of ontwikkelden nieuwe neurologische symptomen. Er was geen significant verschil in de mate van verslechtering van de symptomen tussen de operatiegroep en de radiotherapie groep, met uitzondering van Andrew et al.onderzoek (Tabel 2). De mate van symptoomafbraak van Andrew et al. significant hoger was dan die van de operatiegroep.
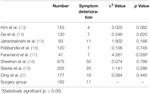
Tabel 2. De mate van symptoomafbraak.
radiologische resultaten
er waren 10 patiënten (6,2%) in de operatiegroep met een tumorherval tijdens de follow-up. We vonden geen significant verschil in tumoruitbreiding tussen de operatiegroep en de radiotherapie groep, met uitzondering van Robert et al. (Tabel 3). De tumoruitbreiding van Robert et al. significant hoger was dan die van de operatiegroep.
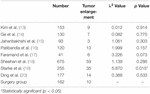
Tabel 3. Tumoruitbreiding.
verdere behandeling
in de operatiegroep was er één patiënt (0,6%) die een tweede resectie onderging, en 12 patiënten (7,4%) kregen stereotactische radiotherapie tijdens de follow-up. We vonden geen significant verschil in het verdere behandelingspercentage tussen de operatiegroep en de radiotherapie groep, met uitzondering van Kyung et al. en Andrew et al. (Tabel 4). De verdere behandelingssnelheid van Kyung et al. significant lager was dan die van de operatiegroep, terwijl het verdere behandelingspercentage van Andrew et al. significant hoger was dan die van de operatiegroep.
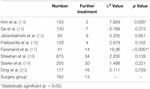
Tabel 4. Verdere behandeling.
in de operatiegroep waren WHO-graad II en Simpson-graad II risicofactoren voor verdere behandeling (Tabel 5).

Tabel 5. Risicofactoren voor verdere behandelingen.
discussie
de keuze voor chirurgie of stereotactische radiotherapie hangt af van de algemene situatie van de patiënten en de aard van de tumoren (7). De meeste cerebellopontine hoek meningeomen behoren tot goedaardige tumoren. Het chirurgische effect van cerebellopontine hoek meningeomen is altijd tevreden, en de tarieven van zowel post-operatieve symptoom verslechtering en tumoruitbreiding zijn lager dan andere zenuwstelsel tumoren. Echter, de compressie van de hersenstam en cerebellum is een frequent optreden van cerebellopontine hoek meningeomen, vooral bij patiënten met grote cerebellopontine hoek meningeomen, de hoge intracraniale druk kan leiden tot herniatie en acute hydrocephalus. Of volledige of gedeeltelijke resectie kan het risico op complicaties aanzienlijk verminderen. Vandaar, chirurgie is de beste keuze voor patiënten met grote cerebellopontine hoek meningeomen. Voor kleine cerebellopontine hoekmeningeomen wordt stereotactische radiotherapie, waaronder Gamma Knife, cyber knife en andere types lineaire versneller (8), algemeen erkend als de eerste keuze. Met de ontwikkeling van medische behandeling en de popularisatie van MRI, wordt de vroege diagnose van cerebellopontine hoekmeningeoom in het kleinvolume of asymptomatische stadium mogelijk. Vroege diagnose en behandeling sterk verbeteren van de prognose van cerebellopontine hoek meningeoom, evenals het brengen van een verwarring van de keuze tussen chirurgie en stereotactische radiotherapie voor kleine cerebellopontine hoek meningeoom. In overweging van het oedeem en de adhesie van hersenweefsel na stereotactische radiotherapie, die de verdere chirurgie belemmerde, hebben meer en meer studies vroege chirurgische behandelingen ondersteund.
in termen van verlichting van preoperatieve symptomen was de mate van verslechtering van de symptomen in de operatiegroep vergelijkbaar met of zelfs lager dan de mate in de radiotherapie groep. Vergeleken met stereotactische radiotherapie, kan chirurgische behandeling soms leiden tot betere resultaten in het verlichten van pre-operatieve symptomen. Oedeem van perifeer hersenweefsel is een veel voorkomende bijwerking van stereotactische radiotherapie. Zwelling van hersenweefsel zal de spanning en compressie van zenuwen verergeren, dat is de reden waarom de symptomen verergeren na stereotactische radiotherapie. Om zenuwletsel te verminderen en symptoomverslechtering te verlichten, moeten operators hersenweefsel, zenuwen en bloedvaten tijdens de operatie zorgvuldig beschermen. Vergeleken met reguliere meningeomen in de cerebellopontinehoek, vereist een chirurgische ingreep aan kleine meningeomen in de cerebellopontinehoek meer bescherming voor zenuwen en bloedvaten, en neuro-elektrofysiologische monitoring tijdens het hele operatieproces wordt essentieel geacht, wat bijdraagt aan de lagere mate van symptoomafbraak in de operatiegroep. De meest voorkomende klinische manifestatie van kleine cerebellopontine hoekmeningeomen is functionele defecten van de gezichts-en gehoorzenuwen. Vandaar, het beschermen van de gezichts-en gehoorzenuwen is een belangrijk punt van chirurgie. Verschillende soorten cerebellopontine hoek meningeomen zal duwen de gezichtszenuwen en gehoorzenuwen naar verschillende posities (9). Dus, de eerste stap van kleine cerebellopontine hoek meningeomen chirurgie is het lokaliseren van de gezichts-en gehoorzenuwen. Anterieure tumoren over het algemeen duwen de gezichts-en gehoorzenuwen aan de laterale of laterale inferieure kant. Posterieure tumoren duwen over het algemeen de gezichts-en gehoorzenuwen naar de mediale of mediale inferieure kant. Middelste tumoren over het algemeen duwen de gezichts-en gehoorzenuwen verticaal (Figuur 2). Door de compressie van de tumor zijn de gezichts-en gehoorzenuwen vaak langwerpig en dun en verkleurd.
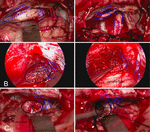
Figuur 2. (A) anterieure tumoren duwen de gezichts-en gehoorzenuw naar de laterale kant. (B) middelste tumoren duwen zenuw naar het ventrale aspect. (C) posterieure tumoren duwen zenuw naar de mediale inferieure kant.
tijdens de operatie moet de operator aandringen op een scherpe scheiding bij het scheiden van de tumor van de gezichts-en gehoorzenuwen. De tractie van de gezichts-en gehoorzenuwen en cerebellum moet worden geminimaliseerd. De voedende vaten rond de gezichts-en gehoorzenuwen moeten zoveel mogelijk worden bewaard. Hoewel de gezichts-en gehoorzenuwen anatomisch worden bewaard na de operatie, bestaat het verlies van zenuwfunctie nog steeds bij veel patiënten, die het gevolg kunnen zijn van de invasieve groei van tumoren, intraoperatieve tractie en warmtegeleidingsschade veroorzaakt door elektrocoagulatie (10). De efficiënte intraoperatieve neuro-elektrofysiologische controle kan het neuronverwonding verminderen door de tijdige plaats van de gezichts-en auditieve zenuwen toe te laten, waardoor het tarief van het behoud van de zenuwfunctie wordt verhoogd.
in termen van remmende tumorprogressie is het tumorhervalpercentage in de operatiegroep vergelijkbaar met of zelfs lager dan het tumoruitbreidingspercentage in de radiotherapie groep. Vergeleken met stereotactische radiotherapie, kan chirurgische behandeling leiden tot de betere resultaten in remming tumorprogressie. Stereotactische radiotherapie, voornamelijk verwijzend naar Gamma Knife en cyber knife, onderdrukt tumorprogressie door het doden van tumorcellen. Het doel van stereotactische radiotherapie bevindt zich over het algemeen in het centrum van tumoren en de dosis neemt af met de afstand van het centrum van tumoren. Hoewel de technologie van de perifere dosisverhoging in de afgelopen jaren naar voren is gekomen, bestaat het probleem van onvolledige inactivering van de tumorgrens nog steeds, wat ook tot de verhoging van het tarief van de tumoruitbreiding in de radiotherapie groep leidt (11). Voor de chirurgische behandeling van kleine cerebellopontine hoek meningeomen, totale resectie van de tumor, dural gehechtheid, en schedel zijn de sleutel tot het voorkomen van tumor recidief. In het chirurgische principe, moet de operator de dural gehechtheid en de schedel na de tumor resectie resecteren om Simpson graad I te bereiken. Wanneer de dural gehechtheid en schedel onvolledig werden verwijderd, is elektrocoagulatie essentieel om de mogelijkheid van tumorherval te verminderen en Simpson graad II te bereiken. met de ontwikkeling van radiofrequente laser scalpels en andere microinstrumenten, wordt de chirurgische behandeling van dural gehechtheid en schedelresectie steeds meer gestandaardiseerd. Het totale tumorresectiepercentage van kleine cerebellopontine hoekmeningeomen neemt toe en het tumorhervalpercentage neemt jaar na jaar af.
veel radiotherapie studies hebben gemeld dat het opnieuw optreden van kleine cerebellopontine hoekmeningeomen verband houdt met de pathologie van de tumoren. Meningeomen van WHO – graad II zullen vaker terugkeren dan meningeomen van WHO – graad I, wat gerelateerd is aan het kenmerk van hoge invasieve groei. Stereotactische radiotherapie kan echter niet het tumorweefsel verkrijgen om de pathologie van de tumor direct te onderzoeken. Daarom wordt de graad van cerebellopontine hoekmeningeomen behandeld met radiotherapie meestal afgeleid uit beeldvormend onderzoek, dat onzeker is. In tegenstelling tot stereotactische radiotherapie kan chirurgie direct tumorweefsel verkrijgen voor pathologisch onderzoek en verdere behandeling begeleiden door de exacte pathologische onderzoeksresultaten. In dit onderzoek waren WHO-graad II en Simpson-graad II de risicofactoren voor tumorherval na een operatie. Daarom moeten patiënten met WHO grade II of Simpson grade II die chirurgie ondergaan verdere behandelingen in het vroege stadium in plaats van te wachten op de herhaling van tumoren ontvangen. Dit is ook de reden waarom het recidiefpercentage in de operatiegroep iets lager was dan het tumoruitbreidingspercentage in de radiotherapie groep.
in termen van verdere behandelingen was het aantal verdere behandelingen in de operatiegroep gelijk aan of zelfs lager dan die gerapporteerd in de radiotherapie groep. In vergelijking met stereotactische radiotherapie hebben patiënten met chirurgische behandeling daarom een lagere kans op verdere behandelingen. In Kyung et al.in het onderzoek waren de proefpersonen asymptomatische patiënten met kleine cerebellopontine hoekmeningeomen. Een gebrek aan symptomen of relatief milde symptomen kan de subjectieve wens van patiënten voor behandeling aanzienlijk verminderen, wat de reden kan zijn waarom het verdere behandelingspercentage bij Kyung et al. was lager dan die gerapporteerd in de operatiegroep. In de radiotherapie-groep was er geen significant verschil tussen het aantal patiënten dat Voor verdere radiotherapie koos en het aantal patiënten dat opereerde. In de operatiegroep was er 1 patiënt (0,6%) die een tweede resectie onderging en 12 patiënten (7,4%) kregen stereotactische radiotherapie tijdens de follow-up. De reden voor verdere radiotherapie voor patiënten in de operatiegroep was de hoge invasiviteit van de tumor en de onvolledige behandeling van de duralhechting en schedel (12). Net als bij andere meningeomen, stereotactische radiotherapie van kleine cerebellopontine hoek meningeomen is meer kans om een extra behandeling voor het remmen van tumorprogressie na de operatie.
de chirurgische complicaties omvatten voornamelijk dysfunctie van de gezichts-en gehoorzenuwen, de nervus trigeminus en de posterieure craniale zenuwen alsook hydrocephalus. Gezichtsverlamming, gevoelloosheid en gehoorverlies kunnen de kwaliteit van leven van patiënten na de operatie ernstig beïnvloeden. De symptomen van beschadiging van de posterieure craniale zenuwen, zoals heesheid, dysartrie en verzwakte hoestreflex, beïnvloeden de prognose van patiënten na de operatie aanzienlijk. Vanwege de kleine omvang van de tumor, complicaties, zoals hydrocephalus en intracerebrale bloeding, zijn zeldzaam bij patiënten met kleine cerebellopontine hoek meningeomen.
conclusie
vergeleken met stereotactische radiotherapie kan chirurgische behandeling van kleine cerebellopontine hoekmeningeomen soms leiden tot betere resultaten in het verlichten van preoperatieve symptomen en het remmen van tumorprogressie. In termen van verdere behandelingen, vergeleken met de onzekerheid van stereotactische radiotherapie, chirurgische behandeling kan exacte pathologische onderzoek resultaten te verkrijgen om de verdere behandeling te begeleiden. Net als bij grote tumoren zou chirurgische behandeling de eerste keuze moeten zijn voor kleine cerebellopontine hoekmeningeomen, terwijl stereotactische radiotherapie, farmacotherapie en experimentele therapie geschikter zijn als aanvulling op chirurgische behandeling.
verklaring betreffende de beschikbaarheid van gegevens
de ruwe gegevens die de conclusies van dit artikel ondersteunen, zullen zonder onnodig voorbehoud door de auteurs ter beschikking worden gesteld.
ethische verklaring
de studies met menselijke deelnemers werden beoordeeld en goedgekeurd door de Institutional Review Board en de Ethische Commissie van het eerste aangesloten Ziekenhuis van Soochow University. De patiënten / deelnemers hebben hun schriftelijke geïnformeerde toestemming gegeven om deel te nemen aan deze studie.
bijdragen van auteurs
JW en GC ontwierpen de studie. JB, PP, HY, WG, YL, ZY en ZW voerden de experimenten uit en analyseerden de gegevens. JB schreef het manuscript. Alle auteurs hebben het manuscript gelezen en goedgekeurd. JB, PJ en HY hebben in gelijke mate bijgedragen aan dit werk. Alle auteurs hebben bijgedragen aan het artikel en de ingediende versie goedgekeurd.
financiering
dit werk werd ondersteund door de Jiangsu Provincial Medical Key Talent grant (ZDRCA2016040) en grant (SYS2019045) van de regering van Suzhou.
belangenconflict
de auteurs verklaren dat het onderzoek werd uitgevoerd zonder enige commerciële of financiële relatie die als een potentieel belangenconflict kon worden opgevat.
1. Kankane VK, Warade AC, Misra BK. Niet-vestibulaire schwannoma tumoren in de cerebellopontine hoek: een ervaring met één chirurg. Aziatische Neurochirurg. (2019) 14:154–61. doi: 10.4103 / ajns.ajns_335_17
CrossRef Full Text / Google Scholar
2. Faramand A, Kano H, Niranjan A, Park K-J, Flickinger JC, Lunsford LD. Tumorcontrole en craniale zenuwuitkomsten na adjuvante radiochirurgie voor laaggradige schedel-base meningeomen. Wereld Neurochirurgie. (2019) 127:e221–9. doi: 10.1016 / j.wneu.2019.03.052
PubMed Abstract / CrossRef Full Text / Google Scholar
3. Spena G, Sorrentino T, Altieri R, Zinis LR, Stefini R, Panciani PP, et al. Vroege carrière chirurgische praktijk voor cerebellopontine hoek tumoren in het tijdperk van radiochirurgie. J Neurol Surg B Schedelbasis. (2018) 79:269–81. doi: 10.1055 / s-0037-1606826
PubMed Abstract / CrossRef Full Text / Google Scholar
4. Magill ST, Lee DS, Yen AJ, Lucas CG, Raleigh DR, Aghi MK, et al. Chirurgische resultaten na heropening voor terugkerende schedelbasis meningeomen. J Neurochirurg. (2018) 130:876–83. doi: 10.3171 / 2017.11.jns172278
PubMed Abstract / CrossRef Full Text / Google Scholar
5. Nowosielski M, Galldiks N, Iglseder S, Kickingereder P, Deimling A, Bendszus M, et al. Diagnostische uitdagingen bij meningeoom. J Neuro Oncol. (2017) 19:1588–98.
Google Scholar
6. Magill ST, Rick JW, Chen WC, Haase DA, Ralelgh DR, Aghl MK, et al. Petrous gezicht meningeomen: classificatie, klinische syndromen, en chirurgische uitkomsten. Wereld Neurochirurgie. (2018) 114:e1266–74. doi: 10.1016 / j.wneu.2018.03.194
PubMed Abstract / CrossRef Full Text / Google Scholar
7. Tomasello F, Angileri FF, Conti A, Scibilia A, Cardali S, Torre DL, et al. Petrosale meningeomen: factoren die van invloed zijn op de uitkomst en de rol van intraoperatieve multimodale hulp bij Microchirurgie. Neurochirurgie. (2019) 84:1313–24. doi: 10.1093 / neuros / nyy188
CrossRef Full Text / Google Scholar
8. Goldbrunner R, Minniti G, Preusser M, Jenkinson MD, Sallabanda K, Houdart E, et al. Eano richtlijnen voor de diagnose en behandeling van meningeomen. Lancet Oncol. (2016) 17: e383-91. doi: 10.1016 / S1470-2045(16)30321-7
CrossRef Full Text / Google Scholar
9. Ehresman JS, Garzon-Muvdi T, Rogers D, Lim M, Gallia GL, Weingart J, et al. Risico op het ontwikkelen van postoperatieve tekorten op basis van tumorlocatie na chirurgische resectie van een intracraniaal meningeoom. J Neurol Surg B Schedelbasis. (2019) 80:59–66. doi: 10.1055 / s-0038-1667066
PubMed Abstract / CrossRef Full Text / Google Scholar
10. D ‘ Amico RS, Banu MA, Petridis P, Bercow AS, Malone H, Praver M, et al. Werkzaamheid en resultaten van gezichtszenuwsparende behandelingsbenadering van cerebellopontine hoekmeningeomen. J Neurochirurg. (2017) 127:1231–41. doi: 10.3171 / 2016.10.JNS161982
CrossRef Full Text / Google Scholar
11. Iwai Y, Yamanaka K, Shimohonji W, Ishibashi K. geënsceneerde gamma knife radiochirurgie voor grote schedel base meningeomen. Cureus. (2019) 11: e6001. doi: 10.7759 / cureus.6001
PubMed Abstract / CrossRef Full Text / Google Scholar
12. Magill ST, Dalle Ore CL, Diaz MA, Jalili DD, Raleigh DR, Aghi MK, et al. Chirurgische resultaten na heropening voor recidiverende niet-schedel base meningeomen. J Neurochirurg. (2018) 1:1–9. doi: 10.3171 / 2018. 6JNS18118
CrossRef Full Text / Google Scholar
13. Kim KH, Kang SJ, Choi JW, Kong DS, Seol HJ, Nam DH, et al. Klinische en radiologische resultaten van proactieve Gamma Knife chirurgie voor asymptomatische meningeomen vergeleken met het natuurlijke verloop zonder interventie. J Neurochirurg. (2018) 1:1–10. doi: 10.3171 / 2017. 12JNS171943
CrossRef Full Text / Google Scholar
14. Ge Y, Liu D, Zhang Z, Li Y, Li Y, Wang G, et al. Gamma Knife radiochirurgie voor intracraniële goedaardige meningeomen: follow-up resultaat bij 130 patiënten. Neurochirurgische Focus. (2019) 46: E7. doi: 10.3171 / 2019.3.FOCUS1956
CrossRef Full Text / Google Scholar
15. Jahanbakhshi A, Azar M, Kazemi F, Jalessi M, Chanideh I, Amini E. Gamma Knife stereotactic radiochirurgy for cerebellopontine angle meningeoma. Clin Neurol Neurochirurg. (2019) 187:105557. doi: 10.1016 / j. clineuro.2019.105557
PubMed Abstract / CrossRef Full Text / Google Scholar
16. Patibandla MR, Lee CC, Tata A, Addagada GC, Sheehan JP. Stereotactische radiochirurgie voor Who graad I posterior fossa meningeomen: lange termijn resultaten met volumetrische evaluatie. J Neurochirurg. (2018) 129:1249–59. doi: 10.3171 / 2017. 6JNS17993
CrossRef Full Text / Google Scholar
17. Faramand a, Kano H, Niranjan A, Johnson SA, Hassib M, Park KJ, et al. Craniale zenuwuitkomsten na primaire stereotactische radiochirurgie voor symptomatische schedelbasis meningeomen. J Neurooncol. (2018) 139:341–8. doi: 10.1007 / s11060-018-2866-9
PubMed Abstract / CrossRef Full Text / Google Scholar
18. Sheehan JP, Starke RM, Kano H, Barnett GH, Mathieu D, Chiang V, et al. Gamma knife radiochirurgie voor posterior fossa meningeomen: een multicenter studie. J Neurochirurg. (2015) 122:1479–89. doi: 10.3171 / 2014. 10JNS14139
CrossRef Full Text / Google Scholar
19. Starke RM, Williams BJ, Hiles C, Nguyen JH, Elsharkawy MY, Sheehan JP. Gamma Knife operatie voor schedelbasismeningeomen. J Neurochirurg. (2012) 116:588–97.
Google Scholar
20. Ding D, Starke RM, Kano H, Nakaji P, Barnett GH, Mathieu D, et al. Gamma knife radiochirurgie voor cerebellopontine hoekmeningeomen: een multicenter studie. Neurochirurgie. (2014) 75: 398-408; quiz 408. doi: 10.1227 / NEU.0000000000000480
PubMed Abstract / CrossRef Full Text / Google Scholar