ondanks de dramatische afname van humaan immunodeficiëntievirus type 1 (HIV-1) – gerelateerde morbiditeit en mortaliteit na de ontdekking van de proteaseremmers en de komst van een combinatie van hoogactieve antiretrovirale (ARV) therapie in het midden van de jaren negentig, faalden veel patiënten nog steeds bij de therapie vanwege resistentie en/of intolerabiliteit (1). Het was duidelijk dat er meer ARV ‘ s nodig waren die op verschillende stappen in de viruslevenscyclus inwerken, actief zijn tegen resistente virussen en beter worden verdragen. De demonstratie van de sleutelrol van de chemokine receptoren CCR5 en CXCR4 in HIV-1 entry leidde tot interesse in dit proces als een nieuwe ARV target (2, 3). CCR5 is de co-receptor voor de meeste HIV-1 stammen, en deze virussen worden CCR5 tropic (R5) genoemd. Virusstammen die CXCR4 gebruiken worden CXCR4-troop (X4) genoemd, terwijl stammen die beide receptoren kunnen gebruiken dual-troop zijn (4). Virus van een patiënt kan vaak mengsels van R5, X4 en dual-trope stammen bevatten, gezamenlijk CXCR4-gebruikend genoemd.
de sleutelrol van CCR5 bij HIV-1 entry, in combinatie met de demonstratie dat individuen die homozygoot waren voor een 32-basenpaar deletie in het CCR5-gen (CCR5Δ32), en vervolgens geen functionele CCR5 tot expressie brengen, zeer beschermd waren tegen infectie met R5 HIV-1, richtte de aandacht op CCR5 als een aantrekkelijk doelwit (5). Hoewel sommige studies subtiele effecten van de ccr5δ32-mutatie op de immuunfunctie hebben aangetoond, zoals verminderde ontstekingsscores bij met hepatitis C geïnfecteerde personen en herstel van hepatitis B bij heterozygoten; terwijl homozygoten gevoeliger zijn voor tekenencefalitis en ernstige West-Nijlvirusziekte, lijden deze personen weinig duidelijke nadelige effecten op hun gezondheid (5, 6). Dit, samen met het feit dat de leden van de G eiwit-gekoppelde receptor superfamilie vaak tractable aan ontwikkeling van machtige, selectieve, en mondeling biologisch beschikbare drugs (7) zijn, leidde tot de initiatie van CCR5 ligand ontdekkingsprogramma ‘ s door veelvoudige groepen, met inbegrip van een team van Pfizer globaal onderzoek en ontwikkeling die bij de Sandwichlaboratoria in het Verenigd Koninkrijk wordt gebaseerd.
Maraviroc (UK-427.857, MVC) werd ontdekt door middel van high-throughput screening van de Pfizer compound library met behulp van een chemokine radioligand-binding assay. De meest veelbelovende verbinding uit het screeningsproces werd geoptimaliseerd voor potentie tegen de receptor, antivirale activiteit, farmacokinetische kenmerken, en selectiviteit tegen menselijke cellulaire targets door een grote medicinale chemische inspanning waarin bijna 1000 moleculen werden gekarakteriseerd (7). MVC bindt in de transmembrane pocket van CCR5 en is een slow-offset functionele antagonist die internalisatie voorkomt (7, 8). Het heeft een krachtige antivirale werking tegen een breed scala aan HIV-1-isolaten (7). Samen met het uitstekende preklinische veiligheidsprofiel en de aanvaardbare farmacokinetiek werd het in December 2000 genomineerd als klinische kandidaat (7).
het was altijd duidelijk dat de klinische ontwikkeling van CCR5-antagonisten een uitdaging zou zijn, aangezien dit de eerste op de gastheer gerichte ARV-geneesmiddelen zouden zijn en we ons daarom op onbekend terrein waagden. Om te voorkomen dat belangrijke kwesties, een klinische ontwikkeling team werd opgericht zeer snel na de start van het discovery programma en ik werd gerekruteerd om het early development team te leiden, bij Pfizer in februari 1999. We identificeerden verschillende belangrijke uitdagingen om aan te pakken in het ontwerp van het klinische programma, naast het aantonen van veiligheid en werkzaamheid. De eerste was dat er geen commercieel beschikbare, klinisch gevalideerde test bestond om patiënten te identificeren die geïnfecteerd waren met R5 HIV-1. Dit was van cruciaal belang, aangezien MVC alleen actief is tegen R5 HIV – 1 stammen (7). Ten tweede bleven, ondanks het ogenschijnlijk gezonde fenotype van personen met CCR5Δ32 (5, 6), zorgen over de veiligheid van langdurige blootstelling aan CCR5-antagonisten, aangezien het blokkeren van CCR5 kan verschillen van de aangeboren afwezigheid van de CCR5-receptor, waar het immuunsysteem is gerijpt in de afwezigheid van CCR5 en compenserende mechanismen kunnen zijn ontwikkeld. Tot slot neemt bij HIV-1 geïnfecteerde personen de incidentie van CXCR4-gebruikende HIV-1-stammen toe met ziekteprogressie en afname van het aantal CD4-cellen (9), Hoewel er geen causaal verband is aangetoond tussen CXCR4-gebruikende virussen en CD4-celdepletie. Dit heeft geleid tot bezorgdheid dat de selectieve druk van een CCR5-antagonist de viruspopulatie kan drijven om CXCR4 te gebruiken en in CD4-celdaling kan resulteren.
Fase 1 onderzoeken met enkelvoudige en meervoudige doses bij gezonde vrijwilligers, uitgevoerd in 2001 en de eerste helft van 2002, toonden aan dat MVC veilig was en goed werd verdragen in meervoudige doses tot 300 mg tweemaal daags, een farmacokinetisch profiel had dat compatibel was met eenmaal daags (QD) of tweemaal daags orale toediening, gecombineerd kon worden met andere ARV ‘ s, en dat doses van ≥100 mg tweemaal daags leidden tot een blootstelling boven het geometrisch gemiddelde antivirale IC90 in vitro (7, 10). Om bewijs van farmacologie aan te tonen, werd de verzadiging van de CCR5-receptor gemeten met behulp van een op maat gemaakte ex vivo MIP-1β internalisatietest. Dosisafhankelijke verzadiging werd aangetoond, met doses van ≥25 mg eenmaal daags resulterend in bijna maximale verzadigingsniveaus, wat de interessante mogelijkheid verhoogt dat MVC werkzaam kan zijn bij doses vanaf 25 mg eenmaal daags. De receptorverzadiging bleef gedurende enkele dagen na het stopzetten van de toediening hoog, als gevolg van een langzame verschuiving van de receptor in vivo (11).
we waren zowel enthousiast als aangemoedigd door de fase 1-gegevens en gingen snel over naar een Fase 2a proof of concept-programma. HIV-1 geïnfecteerde patiënten werden alleen gescreend op de aanwezigheid van het R5-virus, met behulp van een nieuwe fenotypische tropismetest (Trofile®, Monogram Biosciences, South San Francisco, CA, USA), en kregen MVC als monotherapie gedurende 10 dagen (12). In deze studie werd de verzadiging van de CCR5-receptor gemeten om de mogelijkheid te evalueren om dit te gebruiken als biomarker voor werkzaamheid en bij therapeutische monitoring. De langverwachte gegevens voldeden aan onze verwachtingen en toonden aan dat doses van ≥100 mg tweemaal daags leidden tot gemiddelde maximale HIV-1 RNA-reducties van >1.5log10 (figuur 1A), waarbij alle patiënten, met uitzondering van één patiënt met X4-virus die ten onrechte is opgenomen, een HIV-1 RNA-reductie van ten minste 1log10 (12) bereikten. Dit gaf ons vertrouwen dat de assay correct geïdentificeerde patiënten waarschijnlijk reageren op MVC. HIV-1 RNA-nadir trad op 1-5 dagen na de laatste dosis MVC, wat overeenkomt met verlengde receptorverzadiging zoals aangetoond in de fase 1-studies (12). Voor alle doses behalve 25 mg QD receptor werd gedurende de gehele doseringsperiode een verzadiging van >80% waargenomen. Er was echter geen correlatie tussen vermindering van de virale belasting en mate van verzadiging van de receptor. De meest waarschijnlijke verklaring hiervoor is dat zeer hoge niveaus van receptorverzadiging vereist zijn voor antivirale werkzaamheid en dat de inherente variabiliteit van de assay geen differentiatie in die mate toelaat (11, 12).
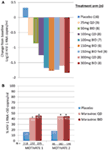
figuur 1. Maraviroc proof of concept en fase 3 werkzaamheidsresultaten. (A) gemiddelde maximale verandering ten opzichte van baseline in HIV-1 RNA bij patiënten die MVC monotherapie kregen. Op basis van Fase 1-gegevens en modellering en simulatie werden doses geselecteerd die varieerden van 25 mg eenmaal daags tot 300 mg tweemaal daags (inclusief 150 mg tweemaal daags gevoed en gevast). HIV-1 RNA, veiligheid en MVC farmacokinetiek werden geëvalueerd (12). (B) motiveer 1 en 2 – proportie patiënten die HIV-1 RNA <50 kopieën/mL bereikten in week 48. HIV-1-geïnfecteerde patiënten met R5 HIV-1 en triple class ervaring en/of resistentie werden gerandomiseerd om MVC QD of BID, of placebo te krijgen in combinatie met een geoptimaliseerde antiretrovirale achtergrondbehandeling (obt). P < 0.001 (13, 14).
de fase 2a-gegevens zorgden voor opwinding in het hele bedrijf en we wilden graag zo snel mogelijk vooruitgang boeken met het klinische ontwikkelingsprogramma, omdat er een grote medische behoefte was aan nieuwe ARV ‘ s voor de behandeling van patiënten met geen of beperkte behandelingsopties. Het uitgebreide fase 1 programma (inclusief meerdere geneesmiddeleninteractiestudies) en het brede dosisbereik geëvalueerd in de fase 2a proof of concept studies, samen met modellering en simulatie, gaven ons een zeer goed inzicht in de waarschijnlijke effectieve dosis van MVC in combinatie met andere ARV ‘ s. We waren daarom in staat om direct over te gaan naar Fase 3 werkzaamheidsstudies die MVC evalueerden bij 300 mg (of equivalent, afhankelijk van gelijktijdig toegediende geneesmiddelen) QD en BID, zonder de noodzaak om stand-alone Fase 2b-dosis variërende studies te doen, waardoor de ontwikkelingstijd aanzienlijk werd verkort. Eind 2004 begonnen we met vier grote studies; MOTIVATE 1 en 2 bij eerder behandelde patiënten met R5 HIV-1 (13, 14), MERIT (een fase 3-onderzoek met een Fase 2b roll-in) bij niet eerder behandelde patiënten met R5 HIV-1 (15), en studie A4001029, een Fase 2b-veiligheidsonderzoek bij eerder behandelde patiënten met niet-CCR5-troopvirus (CXCR4-gebruikend of niet-fenotypeerbaar virus) (16).
dit was een enorme onderneming, met 4794 patiënten gescreend op meer dan 200 locaties in de VS, Canada, europa, australië, Zuid-Afrika, Mexico en Argentinië. Twee andere CCR5-antagonisten met een klein molecuul (aplaviroc en vicriviroc) werden op dit moment ook geëvalueerd in Fase 2b-onderzoeken (17, 18). Naast de gebruikelijke uitdagingen van het beheren van grote klinische studies, kregen we twee curveballs, de eerste daarvan was het staken van aplaviroc vanwege idiosyncratische hepatotoxiciteit. Er werd gespeculeerd dat dit een klasse-effect zou kunnen zijn van CCR5-antagonisten, aangezien CCR5-knockoutmuizen gevoeliger zijn voor concanavalin-a gemedieerde hepatoxiciteit (17). Bovendien ontwikkelde een patiënt in de MERIT-studie ernstige hepatotoxiciteit. De gegevens impliceerden dat het waarschijnlijk gerelateerd was aan isoniazide of cotrimoxazol, maar een bijdragende rol voor MVC kon niet worden uitgesloten (15). Bij een grondige herziening van alle gegevens op aanwijzingen voor hepatotoxiciteit voor MVC en een hoge mate van waakzaamheid voor signalen, werden geen aanwijzingen gevonden voor een systematische toename van leverenzymen of andere markers voor hepatotoxiciteit. Kort daarna werd bezorgdheid geuit over een mogelijk verhoogd risico op bepaalde maligniteiten, na het optreden van lymfoom bij vier patiënten die vicriviroc kregen in onderzoek ACTG5211 (18). Aanvankelijk was er bezorgdheid dat dit een klasse-effect zou kunnen zijn op basis van het immunomodulerende potentieel van CCR5-antagonisten, maar beoordeling van gegevens uit andere vicriviroc-onderzoeken en de lopende MVC-onderzoeken onderbouwen deze theorie niet (18).
gegevens van MOTIVATE 1 en 2 en A4001029 waren beschikbaar voorafgaand aan die van verdienste, aangezien de onderzoeksduur doorgaans korter is voor studies bij eerder behandelde patiënten. Het was met grote opwinding dat we wachtten op de week 24 tussentijdse analyses voor de MOTIVATE studies in oktober 2006 en we waren opgetogen om te zien dat significant meer patiënten die MVC kregen een HIV-1 RNA van <50 kopieën/mL (de belangrijkste marker voor werkzaamheid) hadden in vergelijking met degenen die placebo OBT kregen. Dit werd bevestigd door de gegevens van week 48, waaruit de duurzaamheid van de respons blijkt (figuur 1B) (13, 14). Daarentegen bleken patiënten met niet-CCR5-troop HIV-1 die MVC kregen in A4001029 geen significant virologisch voordeel te behalen in vergelijking met placebo (16). De analyse van veiligheidsgegevens gaf geen aanleiding tot ernstige bezorgdheid. In het bijzonder was er geen bewijs voor een nadelig effect op de immuunfunctie, met geen toename van episodes van infectie of maligniteiten bij met MVC behandelde patiënten. Beoordeling van virustropisme bij falen toonde aan dat >50% van de patiënten bij wie MVC therapie faalde, CXCR4-gebruikend virus had bij falen, maar er was geen bewijs voor een schadelijk effect op het aantal CD4-cellen (14). Virologische beoordeling toonde aan dat het CXCR4-gebruikende virus dat onder MVC-selectieve druk naar voren kwam, afkomstig was van een reeds bestaande minderheidspopulatie en zich niet de novo voordeed (19). Al met al toonden deze resultaten duidelijk het voordeel aan van MVC bij de behandeling van eerder behandelde patiënten met R5 HIV-1. Een grote inspanning van het team resulteerde in de indiening van dossiers voor registratie in zowel de VS als Europa slechts twee maanden nadat de tussentijdse gegevens beschikbaar waren. MVC (300 mg BID) kreeg goedkeuring voor gebruik (in combinatie met andere ARV ‘ s) in de VS in augustus 2007, slechts 6.5 jaar nadat het werd genomineerd als kandidaat voor klinische ontwikkeling. Een maand later werd het ook goedgekeurd voor gebruik bij deze bevolking in de EU.
de analyse in week 48 van de MERIT-studie was teleurstellend, omdat MVC plus zidovudine/lamivudine (HIV-1 RNA <50 kopieën/mL, 65,3%) niet voldeed aan de vooraf vastgestelde criteria voor non-inferioriteit (ondergrens van het eenzijdige 97,5 betrouwbaarheidsinterval lager dan -10%) ten opzichte van efavirenz plus zidovudine/lamivudine (HIV-1 RNA <50 kopieën/mL, 69,3%) (15). Patiënten voor deze studie werden echter gescreend op R5 virus met behulp van de oorspronkelijke trofile assay. Deze test is ondertussen verbeterd om gevoeliger te zijn voor de detectie van minderheidspopulaties van CXCR4-gebruikend virus. Alle screeningsmonsters voor patiënten in verdienste werden vervolgens opnieuw getest met behulp van de verbeterde assay en een post-hoc analyse werd uitgevoerd met alleen patiënten die alleen met de gevoeligere assay R5-virus hadden. In deze analyse waren de responspercentages voor MVC en efavirenz respectievelijk 68,3% en 68,5%, met een ondergrens van het 97,5% betrouwbaarheidsinterval boven -10% (15). Op basis van deze gegevens werd MVC ook goedgekeurd voor gebruik bij niet eerder behandelde patiënten in November 2009 door de United States Food and Drug Administration.
MVC is niet alleen een waardevolle aanvulling gebleken op het steeds groeiende ARV-geneesmiddel armamentarium, maar gegevens uit deze studies hebben ons begrip van HIV-tropisme en de relatie tussen tropisme en ziekteprogressie verbeterd. Voor mij persoonlijk betekende dit een periode van grote opwinding en tevredenheid, zowel als arts als wetenschapper.
Auteursbijdragen
ER heeft dit manuscript opgesteld op basis van haar persoonlijke ervaring als lid van het MVC-ontwikkelingsteam. Alle gegevens zijn elders volledig gepubliceerd. Alle studies zijn uitgevoerd in overeenstemming met de beginselen van de Verklaring van Helsinki en met alle richtlijnen van de Internationale Conferentie over harmonisatie van goede klinische praktijken en lokale wettelijke en regelgevende vereisten. Alle studies werden goedgekeurd door onafhankelijke ethische commissies en alle patiënten gaven schriftelijke geïnformeerde toestemming.
verklaring inzake belangenconflicten
Elna van der Ryst was een medewerker van Pfizer Global Research and development op het moment dat MVC werd ontwikkeld. Momenteel verleent zij adviesdiensten aan Pfizer.
Dankbetuigingen
Ik wil mijn collega ‘ s van Pfizer bedanken die hebben bijgedragen aan het MVC discovery and development program, evenals onderzoekers en patiënten die hebben deelgenomen aan de klinische studies.
1. Richman DD, Morton SC, Wrin T, Hellmann N, Berry s, Schapiro MF, et al. De prevalentie van antiretrovirale geneesmiddelenresistentie in de Verenigde Staten. AIDS (2004) 18: 1393-401. doi: 10.1097 / 01.aids.0000131310.52526.C7
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text / Google Scholar
2. Dragic T, Litwin V, Allaway GP, Martin SR, Huang Y, Nagashima KA, et al. HIV-1 ingang in CD4 + cellen wordt gemedieerd door de chemokinereceptor CC-CKR-5. Nature (1996) 381: 667-73. doi: 10.1038 / 381667a0
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text / Google Scholar
3. Feng Y, Broder CC, Kennedy PE, Berger EA. HIV – 1 entry cofactor: functionele cDNA klonen van een zeven-transmembrane, g eiwit-gekoppelde receptor. Wetenschap (1996) 272:872-7. doi: 10.1126 / wetenschap.272.5263.872
CrossRef Full Text / Google Scholar
4. Berger EA, Doms RW, Fenyö EM, Korber BT, Littman DR, Moore JP, et al. Een nieuwe classificatie voor HIV-1. Nature (1998) 391: 240. doi:10.1038/34571
CrossRef Full Text / Google Scholar
5. Samson M, Libert F, Doranz BJ, Rucker J, Liesnard C, Farber C, et al. Resistentie tegen HIV-1-infectie bij Kaukasische personen met mutante allelen van het CCR5 chemokinereceptorgen. Nature (1996) 382: 722-5. doi: 10.1038 / 382722a0
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text / Google Scholar
6. Gilliam BL, Riedel DJ, Redfield RR. Klinisch gebruik van CCR5-remmers bij HIV en daarbuiten. J Transl Med (2011) 9 (Suppl 1): S9. doi: 10.1186 / 1479-5876-9-S1-S9
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text / Google Scholar
7. Dorr P, Westby M, Dobbs S, Griffin P, Irvine B, Macartney M, et al. Maraviroc (UK-427.857), een krachtige, oraal biologisch beschikbare en selectieve kleine molecuulremmer van chemokinereceptor CCR5 met een breedspectrum anti-humaan immunodeficiëntievirus type 1 activiteit. Antimicrob Agents Chemother (2005) 49:4721-32. doi: 10.1128 / AAC.49.11.4721-4732.2005
CrossRef Full Text / Google Scholar
8. Kondru R, Zhang J, Ji C, Mirzadegan T, Rotstein D, Sankuratri S, et al. Moleculaire interacties van CCR5 met belangrijke klassen anti-HIV-1 CCR5-antagonisten van kleine moleculen. Mol Pharmacol (2008) 73:789-800. doi: 10.1124 / mol.107.042101
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text / Google Scholar
9. Berger EA, Murphy PM, Farber JM. Chemokinereceptoren als HIV-1 co-receptoren: rollen in virale binnenkomst, tropisme en ziekte. Annu Rev Immunol (1999) 17: 657-700. doi: 10.1146 / annurev.immunol.17.1.657
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text / Google Scholar
10. Abel s, van der Ryst E, Rosario MC, James I, Ridgway C, Medhurst C, et al. Beoordeling van de farmacokinetiek, veiligheid en tolerantie van maraviroc, een nieuwe CCR5-antagonist, bij gezonde vrijwilligers. Br J Clin Pharmacol(2008) 65 (S1):5-18. doi: 10.1111 / j. 1365-2125. 2008. 03130.X
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text / Google Scholar
11. Rosario MC, Jacqmin P, Dorr P, James I, Jenkins T, Abel S, et al. Farmacokinetische-farmacodynamische analyse van de bezetting van de CCR5-receptor door maraviroc bij gezonde proefpersonen en HIV-positieve patiënten. Br J Clin Pharmacol(2008) 65 (S1):86-94. doi: 10.1111 / j. 1365-2125. 2008. 03140.X
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text / Google Scholar
12. Fätkenheuer G, Pozniak AL, Johnson MA, Plettenberg A, Staszewski S, Hoepelman AIM, et al. Werkzaamheid van kortdurende monotherapie met maraviroc, een nieuwe CCR5-antagonist bij HIV-1-geïnfecteerde patiënten. Nat Med (2005) 11: 1170-2. doi: 10.1038 / nm1319
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text / Google Scholar
13. Gulick RM, Lalezari J, Goodrich J, Clundeck N, Dejesus E, Horban A, et al. Maraviroc voor eerder behandelde patiënten met R5 HIV-1-infectie. N Engl J Med (2008) 359:1429-41. doi: 10.1056 / NEJMoa0803152
CrossRef Full Text / Google Scholar
14. Fätkenheuer G, Nelson M, Lazzarin A, Konourina I, Hoepelman IM, Lampiris H, et al. Subgroepanalyses van maraviroc bij eerder behandelde R5 HIV – 1-infectie. N Engl J Med (2008) 359:1442-55. doi: 10.1056 / NEJMoa0803154
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text / Google Scholar
15. Cooper DA, Heera J, Goodrich J, Tawadrous M, Saag M, DeJesus E, et al. Maraviroc versus efavirenz, beide in combinatie met zidovudine/lamivudine, voor de behandeling van antiretroviraal-naïeve patiënten met CCR5-troop HIV-1. J Infecteren Dis (2010) 201: 803-13. doi:10.1086/650697
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text / Google Scholar
16. Saag M, Goodrich J, Fätkenheuer G, Clotet B, Clundeck N, Sullivan J, et al. Een dubbelblind, placebogecontroleerd onderzoek met maraviroc bij eerder behandelde patiënten die geïnfecteerd zijn met niet-CCR5-troop HIV-1: 24-weekse resultaten. J Infect Dis (2009) 11: 1638-47. doi:10.1086/598965
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text / Google Scholar
17. Nichols WG, Steel HM, Bonny T, Adkison K, Curtis L, Millard J, et al. Hepatotoxiciteit waargenomen in klinische onderzoeken met aplaviroc (GW873140). Antimicrob Agents Chemother (2008) 52:858-65. doi: 10.1128 / AAC.00821-07
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text / Google Scholar
18. Tsibris AM, Paredes R, Chadburn A, Su Z, Henrich TJ, Krambrink A, et al. Lymfoom diagnose en plasma Epstein-Barr virus load tijdens vicriviroc therapie: resultaten van de AIDS klinische studies groep A5211. Clin Infect Dis (2009) 48: 642-9. doi:10.1086/597007
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text / Google Scholar
19. Lewis M, Simpson P, Fransen S, Huang W, Whitcomb J, Mosley M, et al. CXCR4-gebruikend virus dat werd gedetecteerd bij patiënten die maraviroc kregen in de fase III-onderzoeken MOTIVATE 1 en 2 is afkomstig van een reeds bestaande minderheid van CXCR4-gebruikend virus. Antivir Ther (2007) 12:S65.
Google Scholar