- Introduction
- Chrebp-structuur en-regulering Via de LID / Grace-domeinen
- activering van ChREBP door Glucosemetabolieten
- Co-factoren en Partners van ChREBP
- rol van ChREBP in het koolhydraatmetabolisme en de Hepatokineproductie
- ChREBP als Regulator van de vetzuursynthese in de lever en de VLDL-secretie
- regulering van het Fructosemetabolisme door ChREBP in lever en darm
- regeling van de BDK:Ppm1k-as in lever
- ChREBP is vereist voor de Glucose-gemedieerde regulatie van FGF21
- rol van ChREBP in het Inter-Orgaannetwerk dat de energiehomeostase controleert
- rol van hepatische ChREBP in de controle van de Insulinegevoeligheidsbalans
- Adipose ChREBP koppelt lipogenese aan insulinegevoeligheid
- conclusie en toekomstige richtingen
- Auteursbijdragen
- financiering
- verklaring inzake belangenconflicten
Introduction
verhoogde consumptie van enkelvoudige suikers zoals sucrose en fructosestroop met hoog fructose in de afgelopen jaren heeft geleid tot een verhoogd risico op metabole ziekten zoals obesitas, dyslipidemie, type 2 diabetes en/of nonalcoholic fatty liver disease (NAFLD). De lever is het belangrijkste orgaan dat verantwoordelijk is voor de omzetting van overtollige koolhydraten in vet. De resulterende triglyceriden (TG) kunnen in zeer lage dichtheidslipoproteins (VLDL) worden ingepakt en of in de omloop worden afgescheiden, als lipidedruppeltjes worden opgeslagen, of door de bèta-oxidatieweg worden gemetaboliseerd. Insuline die wordt uitgescheiden als reactie op verhoogde bloedglucose, stimuleert de expressie van genen van de novo vetzuursynthese (lipogenese) via de transcriptiefactor sterol regulatory element binding protein-1c (SREBP-1C) (Foretz et al., 1999). SREBP-1c werkt in synergie met een andere transcriptiefactor genaamd koolhydraatrespons-elementbindend eiwit (ChREBP), dat de reactie op voedingskoolhydraten bemiddelt. De chrebp-eiwitstructuur bevat een laag glucoseremmend domein (LID) en een glucose-respons activatie geconserveerd element (GRACE) in zijn n-eindpunt (Li et al., 2006). De activering van het GRACE-domein door glucosemetabolieten bevordert de transcriptionele activiteit van ChREBP en de binding aan een hoogst geconserveerde sequentie genaamd het koolhydraatresponselement (karwei). ChoRE is aanwezig op de promotors van chrebp-doelgenen, die coderen voor belangrijke enzymen van de novo lipogenese, waaronder l-pyruvaatkinase (L-pk), een snelheidsbeperkend enzym in glycolyse, vetzuursynthase (Fas), acetyl-CoA carboxylase (Acc) en stearoyl-CoA desaturase (Scd1) (Kawaguchi et al., 2001). Een recente studie meldde de onderlinge afhankelijkheid tussen ChREBP (geactiveerd door glucose) en SREBP-1c (geactiveerd door insuline) voor de volledige inductie van glycolytische en lipogene genexpressie in de lever (Linden et al., 2018). Viraal herstel van de kernactieve vorm van SREBP-1c in de lever van chrebp-deficiënte muizen (ChREBPKO) genormaliseerde lipogene genexpressie, terwijl het geen effect had op het redden van glycolytische genexpressie. Het spiegelexperiment, waarin de uitdrukking ChREBP in de lever van SREBP-1C knockoutmuizen werd veroorzaakt, redde glycolytic genuitdrukking maar verrassend niet lipogenic genuitdrukking, ondanks de bekende rol van ChREBP in de controle van vetzuursynthesegenen. Niettemin, suggereert deze studie het belang van de dubbele werking van ChREBP en SREBP-1c in de controlegenen betrokken bij de regulatie van vetzuursynthese (Linden et al., 2018).
ChREBP is sterk verrijkt in de lever en is onderzocht als een meesterregulator van het lipidenmetabolisme (Iizuka et al., 2004; Osorio et al., 2016). ChREBP wordt ook significant uitgedrukt in pancreaseilandjes, dunne darm, skeletspieren en in mindere mate in de nieren en de hersenen (zie Richards et al., 2017 ter beoordeling). Interessant is dat een andere isovorm van ChREBP, ChREBPß, afkomstig van een alternatieve eerste exon promotor, werd voor het eerst geïdentificeerd in vetweefsel (Herman et al., 2012) en later beschreven in andere celtypen (zie Abdul-Wahed et al., 2017 ter beoordeling). Zoals we zullen bespreken, ChREBPß wordt beschreven als een constitutief actieve isovorm. Het is te hopen dat het toekomstige werk de respectieve rollen van ChREBP en ChREBPß in de regulering van glucose en lipidenmetabolisme zal behandelen evenals hun specifieke en/of overlappende doelstellingen zal identificeren.
Chrebp-structuur en-regulering Via de LID / Grace-domeinen
ChREBP behoort tot de Mondo-familie van bhlh/Zip-transcriptiefactoren. Het n-terminusdomein (1-251 residuen) bevat twee kernexportsignaal (NES) en een kernlokalisatiesignaal (NLS) dat subcellulaire lokalisatie regelt door interactie met chromosoomgebied onderhoud 1 (CRM1) ook als exportin 1 en/of 14-3-3 proteã nen wordt bedoeld (Sakiyama et al., 2008). De C-terminus regio bevat een polyproline domein, een bhlh / LZ domein( 660-737 residuen) en een leucine rits-achtige domein (Zip-achtige, 807-847 residuen) die worden geassocieerd met co-factoren en DNA-binding (Yamashita et al., 2001; Fukasawa et al., 2010; Ge et al., 2012). Lokalisatie en transcriptionele activering van ChREBP worden bepaald door de beschikbaarheid van nutriënten. Glucose-gemedieerde regulering van ChREBP vindt meestal plaats op het niveau van de glucose-sensing module (GSM) of mondo geconserveerd gebied (MCR), die bestaat uit het deksel en de GRACE domeinen, zoals vermeld in de inleiding (figuur 1A; Li et al., 2006; Singh en Irwin, 2016). In 2012, Herman et al. (2012) beschreef een andere ChREBP isovorm, ChREBPß, die wordt getranscribeerd van een alternatieve eerste exon promotor 1b naar exon 2 (Figuur 1B). Dit transcript is vertaald uit exon 4, het genereren van een korter eiwit van 687 aminozuren (de volledige lengte ChREBP isovorm, hernoemd α, bevat 864 aminozuren, genaamd ChREBP in het manuscript) waarin de twee NES, NLS en het deksel domein ontbreken. ChREBPß is zeer actief in wit vetweefsel op een GLUT-4-afhankelijke manier en wordt voorgesteld om direct te worden gereguleerd door ChREBPa omdat een karwei sequentie werd geïdentificeerd in de exon promotor 1β (Herman et al., 2012; figuur 1B). De regulering van ChREBPß door ChREBPa suggereert het bestaan van een feed-forward lus die mogelijk de respons op glucose onder hyperglycemie verergert. Het reguleringsmechanisme(en) van de chrebpß-isovorm, en vooral de specifieke functie ervan, moet echter worden verduidelijkt.
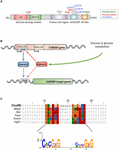
figuur 1. A) structuur van het bindingseiwit α (ChREBPa) van het koolhydraatresponselement. ChREBPa is samengesteld uit 864 aminozuren en bevat verscheidene regelgevende domeinen. Bij het n-eindpunt bevat de proteã Ne een glucose-sensing module die uit het lage glucose remmende domein (deksel) en het glucose geactiveerde behouden element (genade) wordt samengesteld. Het eiwit bevat ook een polyproline-rijk, een bhlh / LZ en een leucine-ritssluiting-achtig (Zip-achtig) domein gelegen bij de C-terminus. Post-translationele modificaties worden aangegeven in hun respectieve residuen, fosforylering (rood), acetylering (blauw) en de recent geïdentificeerde O-Glcnacylaties (groen). B) genstructuur van het chrebp-gen en generatie van de twee chrebp-isovormen α En β. ChREBPß wordt getranscribeerd van een alternatieve eerste exon promotor 1b. dit transcript wordt vertaald van exon 4 het genereren van een kortere proteã ne van 687 aminozuren waarin de twee NES, de NLS en het DEKSELDOMEIN ontbreken. De chrebpß isovorm wordt voorgesteld om direct te worden gereguleerd door ChREBPa omdat een karwei sequentie werd geïdentificeerd in de exon promotor 1b. of zowel chrebp α En β isovormen beide binden aan de karwei is momenteel niet bekend. Figuur aangepast van Herman et al. (2012). (C) Multi-alignment van ChoRE consensus sequenties presenteert in verschillende chrebp target gen promotors. De op nucleotiden-gebaseerde uitlijning wordt gepresenteerd op de bovenkant van het cijfer samen met de opdracht van de consensusvolgorde die in Poungvarin et al wordt beschreven. (2015). Het logo dat overeenkomt met de consensusreeks die bij deze specifieke uitlijning hoort, wordt ook weergegeven.
activering van ChREBP door Glucosemetabolieten
in nuchtere toestand, de glucagon-afhankelijke activering van proteïne kinase A (PKA) (Kawaguchi et al., 2002) fosforylaten chrebp op residuen Ser196 en Thr666, wat leidt tot binding van ChREBP aan het eiwit 14-3-3 en zijn retentie in het cytosol (Kawaguchi et al., 2001, 2002; Davies et al., 2008). AMP geactiveerd eiwit kinase (AMPK), een centrale cellulaire energie sensor, ook fosforylaten ChREBP op residu Ser568, die op zijn beurt vermindert binding van ChREBP aan promotors van zijn doelgenen (Kawaguchi et al., 2002; Sato et al., 2016). Er werd aangetoond dat metabolieten die worden gegenereerd tijdens het vasten, zoals AMP en ketonlichamen geproduceerd uit vetzuuroxidatie, een allosterische remmende rol spelen door chrebp en 14-3-3 eiwitaffiniteit te veranderen, de complexe stabilisatie te verbeteren en cytosolische retentie te bevorderen (Sakiyama et al., 2008; Nakagawa et al., 2013; Sato et al., 2016). Als reactie op koolhydraten wordt ChREBP gereguleerd op de transcriptionele, translationele en post-translationele niveaus. Verhoogde glucoseconcentraties na een maaltijd bevorderen de synthese van intermediaire metabolieten zoals xylulose-5-fosfaat (X5P), aanvankelijk voorgesteld als activator van eiwitfosfatase 2A (PP2A) (Kawaguchi et al., 2001; Kabashima et al., 2003). PP2A werd eerder beschreven voor dephosphorylaatchrebp bij het Ser196 residu, waardoor de translocatie naar de kern mogelijk is waar het verder gedefosforyleerd wordt op een X5P – en PP2A-afhankelijke manier (op Thr666 en Ser568). Dit model werd echter door de jaren heen uitgedaagd en andere metabolieten zoals glucose-6-fosfaat (G6P) werden voorgesteld als potentiële activatoren van chrebp translocatie/activiteit (dentine et al., 2012). McFerrin et al. (2012) identificeerde een vermoedelijk motief voor G6P-binding (253-SDTLFT-258) op het GRACE-domein, dat ook wordt bewaard in MondoA, een chrebp/MondoB ortholog (zie Richards et al., 2017 ter beoordeling). Volgens deze hypothese, kon G6P een allosteric bouwverandering bevorderen die een open bouw voor ChREBP veroorzaakt, die de interactie met co-factoren en daaropvolgende translocatie aan de kern faciliteert (McFerrin et al., 2012).
binnen de kern kan ChREBP worden gewijzigd door O-Glcnacylatie, een post-translationele modificatie die afhankelijk is van het glucosemetabolisme, en geïdentificeerd als belangrijk voor de transcriptionele activiteit van ChREBP (Guinez et al., 2010). O-Glcnacylering vindt plaats op serine-en threonineresiduen door de activiteit van o-GlcNAc transferase (OGT), een enzym dat N-acetylglucosamine (GlcNAc) – residuen toevoegt aan doeleiwitten, waardoor hun activiteit, stabiliteit en/of subcellulaire locatie worden gewijzigd. Yang et al. (2017) onlangs onthulde een aantal chrebp residuen gemodificeerd door O-Glcnacylatie. Mutaties van deze residuen in de domeinen bHLH/ZIP en dimerisatie en cytoplasmatische locatiedomein (DCD) hebben de identificatie van Thr517 en Ser839 als essentiële plaatsen voor de glucose-afhankelijke activering van ChREBP (figuur 1A) mogelijk gemaakt. ChREBP kan ook worden gewijzigd door acetylering via de Histon-acetyltransferase-activiteit van p300 (Bricambert et al., 2010). Glucose-geactiveerde p300 acetyleert ChREBP op Lys672 en verhoogt zijn transcriptionele activiteit door zijn rekrutering tot de Karwei-sequentie te verbeteren, de optimale consensusbindingsreeks is CAYGYCnnnnnCRCRTG (figuur 1C). Poungvarin et al. (2015) analyseerde de plaatsen van de chrebpband door Spaander-seq in lever en wit vetweefsel van muizen die met een hoog-koolhydraat, vet-vrij dieet opnieuw worden gevoed. Zij rapporteerden dat de binding van ChREBP in wegen betrokken bij insulinesignalering, adherente verbindingen en kanker wordt verrijkt, die een nieuwe betrokkenheid van ChREBP in tumorigenesis en kankervooruitgang suggereren. Verder rapporteerde een recente studie het belang van ChREBP in hepatocellulair carcinoom (HCC) (Ribback et al., 2017). De auteurs vonden dat de genetische schrapping van chrebp (in chrebpko muizen) levercarcinogenese verminderde gedreven door eiwitkinase B/Akt overexpressie in muizen. Bovendien resulteerde door siRNA gemedieerde remming van ChREBP in muizen en/of humane HCC-cellen in verminderde proliferatie en apoptose.
Co-factoren en Partners van ChREBP
in de afgelopen jaren werden verschillende co-factoren en/of partners van ChREBP geïdentificeerd (zie Richards et al., 2017 ter beoordeling). Max like protein x (Mlx), een bhlh / LZ transcriptiefactor, was de eerste geïdentificeerd als een gemeenschappelijke bindingspartner van de Mondo-familie (Stoeckman et al., 2004). Dimerisatie van ChREBP met Mlx is vereist voor zowel de nucleaire translocatie als reactie op glucose als binding aan karwei-elementen. Nucleaire receptoren zoals hepatocyt nuclear factor 4α (HNF4a) en farnesoid x receptor (FXR) werden ook beschreven als chrebp partners. Hnf4a interageert fysiek met ChREBP door binding aan de directe repeat-1 (DR-1) Regio op de promotor van chrebp-doelgenen (Adamson et al., 2006; Meng et al., 2016). Bovendien werd aangetoond dat de P300 / CBP transcriptionele co-activator eiwitten het chrebp/HNF4a complex stabiliseren (Burke et al., 2009). De P300 / CBP transcriptionele co-activator eiwitten spelen een centrale rol in het coördineren en integreren van meerdere signaal-afhankelijke gebeurtenissen met het transcriptie apparaat. Een andere belangrijke eigenschap van p300/CBP is de aanwezigheid van Histon acetyltransferase (HAT) activiteit, die P300/CBP de capaciteit geeft om chromatine activiteit te beïnvloeden door nucleosomale histonen te moduleren. In humane hepatocyten zorgt FXR-binding aan het chrebp-HNF4a-complex voor de afgifte van ChREBP uit CBP / p300, wat leidt tot de rekrutering van het HISTONDEACETYLASE SMRT op de LPK-promotor, waardoor het werkt als een co-repressor van de transcriptionele activiteit van ChREBP (Caron et al., 2013). Bovendien wijzigt CBP/P300 HAT-activiteit ChREBP op Lys 672, wat leidt tot transcriptionele activering in reactie op glucose (Bricambert et al., 2010).
Bricambert et al. (2018) onlangs identificeerde de histone demethylase plant homeodomain finger 2 (Phf2), die behoort tot de histone lysine demethylase (KDM7) familie, als een nieuwe co-factor van ChREBP. De interactie tussen Phf2 en ChREBP verbetert de transcriptionele activering van ChREBP door h3k9-methylmarkeringen op de promotor van zijn doelgenen te wissen. Interessant is dat specifieke co-rekrutering van Phf2 en ChREBP aan de promotor van nucleaire factor erythroid 2 like 2 (Nrf2) bijdraagt aan het beschermende effect van Phf2 tegen verhoogde reactieve zuurstof species (ROS) en NAFLD progressie in de context van hyperglycemie (Bricambert et al., 2018).
rol van ChREBP in het koolhydraatmetabolisme en de Hepatokineproductie
ChREBP als Regulator van de vetzuursynthese in de lever en de VLDL-secretie
niet-alcoholische vettige leverziekte is een kenmerk van het metabool syndroom en studies bij mensen hebben aangetoond dat de novo lipogenese bijdraagt aan ongeveer 25% van de totale leverlipiden bij patiënten met NAFLD (Donnelly et al., 2005). In insulineresistente Staten verbeteren hyperglycemie en hyperinsulinemie de lipogenese gedeeltelijk door de activering van ChREBP en SREBP-1c. Chrebp remming in de lever van obese en insuline resistente ob/ob muizen, door RNAi of genetische ablatie leidt tot omkering van hepatische steatose (dentine et al., 2006; Iizuka et al., 2006). Veranderde secretie van VLDL door de lever draagt ook bij aan de pathogenese van NAFLD. Microsomal triglyceride overdrachtproteã ne (MTTP) is de proteã ne belast met assemblage en afscheidend apolipoprotein B-bevattende lipoproteã NEN. Deficiëntie van MTTP bij muizen en mensen veroorzaakt hypolipidemie en leververvetting. Regulatie van dit eiwit is geassocieerd met een paar sterk geconserveerde cis-elementen in zijn promotor met inbegrip van kritische positieve en negatieve regelgevende domeinen (Cuchel et al., 2013; Hussain et al., 2011). Onlangs, ChREBP werd gewezen op als een potentiële regulator van MTTP sinds gebrek aan functionele ChREBP in de lever onderdrukt Mttp expressie en VLDL assemblage en secretie (Niwa et al., 2018). Echter, aangezien er geen karwei duidelijk kan worden geïdentificeerd op de MTTP promotor, verdere analyse zal nodig zijn om het mechanisme waarmee ChREBP regelt Mttp identificeren.
regulering van het Fructosemetabolisme door ChREBP in lever en darm
het verband tussen ChREBP en het fructosemetabolisme werd voor het eerst aangetoond door de fenotypische analyse van chrebp knockoutmuizen (chrebpko-muizen). ChREBPKO muizen werden gemeld om te sterven binnen enkele dagen van high-fructose dieet (hfrd) voeding (Iizuka et al., 2004). Deze belangrijke intolerantie voor fructose werd toegeschreven aan de vermindering van de expressie van fructokinase en triose kinase, twee enzymen die nodig zijn voor het fructosemetabolisme (Iizuka et al., 2004). Kim et al. (2016) later meldde het belang van ChREBP voor de efficiënte omzetting van fructose in glucose in de lever en het gehele lichaam fructose klaring maar ook, onder inname van fructose, kan ChREBP bijdragen aan hyperglycemie door direct trans-activerende g6pc expressie, een belangrijk gen van gluconeogenese. Dit effect kan leiden tot een vicieuze cirkel waarin de fructoseconsumptie de glucoseproductie verergert door de activiteit van ChREBP (Kim et al., 2016). Het volgende jaar, de studie door Zhang et al. (2017) gemeld dat chrebpko muizen gevoed met HFrD ontwikkelen ernstige leverbeschadiging als gevolg van over-activering van endoplasmatische reticulum stress en ccaat-enhancer-bindende eiwit homologe eiwit (CHOP)-gemedieerde hepatocyte apoptose. Apoptose in hepatocyten bij deze muizen was hoogstwaarschijnlijk gekoppeld aan een verhoogde biosynthese van cholesterol, aangezien remming van deze route via HMG-CoA reductase (HMGCR) of srebp2-remming chrebpko-muizen redde van hfrd-geïnduceerde leverbeschadiging. Een gebrek aan ChREBP werd onlangs ook geassocieerd met een dysregulatie van sucrose en fructosemetabolisme wat leidde tot suikerintolerantie en malabsorptie bij muizen (Kato et al., 2018). Deze effecten werden geassocieerd met een verminderde expressie van intestinale sucrose-isomaltase (SI), die sucrose verteert in glucose en fructose, de glucosetransporters 5 (Glut5) en 2 (Glut2) en het ketohexokinase (Khk) enzym, dat fructolyse reguleert (Figuur 2). Dysregulatie van deze enzymen kan leiden tot de accumulatie van onverteerde sucrose en fructose met mogelijke repercussies in de darmmicrobiota-samenstelling. De vergelijking tussen chrebpko en leverspecifieke chrebp knockout-muizen (ChREBPLiverKO) die met HFrD worden gevoed, had eerder aangetoond dat lever-chrebp-deficiëntie alleen niet leidt tot fructose-intolerantie, maar dat chrebp-deficiëntie in de dunne darm hoogstwaarschijnlijk verantwoordelijk is voor de verminderde fructosetolerantie die bij deze muizen wordt waargenomen (Kim et al., 2017). Al met al onderstrepen deze studies het belang van ChREBP in de regulatie van het fructosemetabolisme en onderstrepen zij de behoefte aan een beter begrip van de rol en regulatie van ChREBP in de dunne darm.
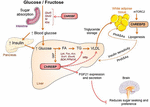
Figuur 2. ChREBP reguleert veelvouden signalerende / metabole routes in reactie op glucose en fructose. ChREBP komt tot expressie in verschillende weefsels, waaronder darm, lever en wit vetweefsel. In deze celtypes, in reactie op glucose en/of fructose wordt ChREBP geactiveerd en induceert specifiek genic programma zoals aangegeven op de figuur. In de darm werd stimulatie van de expressie van SI, Glut5, Glut2 en Ketohexokinase (Khk) door chrebp (direct of indirect) beschreven om de sucrose-tolerantie en de fructose-absorptie te verbeteren. In de lever is ChREBP een belangrijke modulator van glycolytische, lipogene en microsomale triglyceride transfer protein (Mttp) genexpressie, waardoor zowel vetzuuraccumulatie als VLDL-export uit de lever wordt gecontroleerd. ChREBP regelt ook de productie van hepatokines zoals fibroblastgroeifactor 21 (FGF21). Deze lever-naar-hersenen as breidt de lever chrebp functie uit van een leverregulator naar een systemische modulator die niet alleen de behandeling van substraten in de lever beïnvloedt, maar ook de voorkeur aan voedingsstoffen. De activering van ChREBP in wit vetweefsel is verbonden met betere metabolische homeostase door Beschermende het doorgeven signalen te produceren. Een nieuwe klasse van zoogdierlipiden gekenmerkt door een vertakte esterverbinding tussen een vetzuur en een hydroxy-vetzuur (palmitinezuur hydroxylstearinezuur) werd gemeld om gunstige effecten op glucose homeostase uit te oefenen door directe en incretine-gemedieerde modulatie van β-celfunctie, verbeterde opname van vet en verminderde ontsteking. Interessant, werd mTORC2 onlangs geà dentificeerd als nieuwe Regelgever van chrebpß isovorm in vetcellen.
regeling van de BDK:Ppm1k-as in lever
de eerste stap van het vertakte aminozuurkatabolisme (BCAA ‘ s) wordt gereguleerd door het vertakte ketozuurdehydrogenase (bckdh)-complex dat wordt gecontroleerd door twee enzymen, het vertakte Alfa-ketozuurdehydrogenasekinase (BDK) en de eiwitfosfatase, Mg2+/Mn22+ afhankelijk 1K (PPM1K). White et al. (2018) onlangs geassocieerd ChREBP met de upregulation van BDK en down-regulation van ppm1k in lever en identificeerde een behouden karwei motief in de promotor van beide genen. Een positieve correlatie tussen de expressie van BDK en andere typische chrebp-doelgenen (Fasn, Pklr, ChREBPß) werd waargenomen bij levers van ratten die werden gevoed met een hoog glucose-of fructose-dieet. Op fysiologisch niveau leidde de verhoging van de verhouding BDK:PPM1K tot de fosforylering en activering van ATP-citraatlyase (ACLY), waardoor de novo lipogenese werd gestimuleerd. Deze bevindingen onthullen dat BDK en PPM1K nieuwe lipogenesis-activerende genen kunnen zijn die door ChREBPß worden geregeld. Gezien hun rol in de regulering van het lipide -, glucose-en aminozuurmetabolisme, zouden BDK en PPM1K in de nabije toekomst als potentiële therapeutische doelwitten in de lever kunnen worden beschouwd (White et al., 2018).
ChREBP is vereist voor de Glucose-gemedieerde regulatie van FGF21
ChREBP werd onlangs geassocieerd met de productie en secretie van hepatokines zoals Fibroblastgroeifactor 21 (FGF21) (Iizuka et al., 2009; Dushay et al., 2015, Iroz et al., 2017). FGF21 is een metabolisch hormoon gesynthetiseerd door de lever met meerdere gunstige effecten in perifere weefsels (Kharitonenkov et al., 2005; Badman et al., 2007; Markan et al., 2014). Tot voor kort werd FGF21 beschouwd als een vasten hormoon dat vetzuuroxidatie, ketogenese en lipolyse versterkt onder de transcriptionele controle van peroxisome proliferator activated receptor α (PPARa) (Inagaki et al., 2007). Een karwei op de FGF21 promotor is eerder geïdentificeerd in zowel muizen (-74 tot -52 bp) en mensen (-380 tot -366 bp) (Iizuka et al., 2009) maar functionele studies ontbreken tot voor kort. Consumptie van glucose en fructose werd gemeld om te leiden tot een snelle verhoging van FGF21 niveaus bij gezonde vrijwilligers en metabool syndroom patiënten (Dushay et al., 2015). Aanvullende studies rapporteerden ook een mechanistische link tussen chrebp-afgeleide FGF21 en macronutriëntenvoorkeur via een lever-hersenas (Talukdar et al., 2016; von Holstein-Rathlou et al., 2016). Deze lever-naar-hersenen as breidt chrebp functie uit van een lever metabole regulator naar een systemische modulator, die niet alleen de behandeling van het leversubstraat beïnvloedt, maar ook het globale voedingsgedrag (Abdul-Wahed et al., 2017).
rol van ChREBP in het Inter-Orgaannetwerk dat de energiehomeostase controleert
rol van hepatische ChREBP in de controle van de Insulinegevoeligheidsbalans
ons laboratorium meldde eerder dat ChREBP werkt als een belangrijke modulator van de vetzuursamenstelling van de lever en de insulinegevoeligheid in de context van niet-alcoholische en alcoholische leverziekten (zie Abdul-Wahed et al., 2017 ter beoordeling). Muizen met overexpressie van ChREBP ontwikkelden een grotere hepatische steatose dan de controlegroep, maar interessant genoeg bleven ze vrij van metabole complicaties en ontwikkelden ze geen insulineresistentie. Lipidomic analyse heeft aangetoond dat ChREBP-gemedieerde steatose geassocieerd is met een afname van verzadigde vetzuren en een toename van enkelvoudig onverzadigde vetzuren, de laatste waarvan is aangetoond dat ze geassocieerd zijn met chrebp-gemedieerde gunstige effecten op insulinegevoeligheid (Benhamed et al., 2012). Deze resultaten tonen de rol van ChREBP in lipide verdeling aan en suggereren dat specifieke lipide species, wanneer aanwezig in de juiste plaats en tijd, signalen kunnen teweegbrengen die aanpassing aan metabolische stress moduleren (Benhamed et al., 2012; Bricambert et al., 2018). Interessant, Jois et al. (2017) stelde ook een beschermende rol voor hepatische ChREBP betreffende de homeostase van de gehele lichaamsglucose en insulinegevoeligheid voor. Chrebpliverko muizen vertonen een verslechterde glucosetolerantie, terwijl ze beschermd zijn tegen hepatische steatose. De schrapping van hepatische ChREBP resulteerde ook in veranderingen van de genuitdrukking in witte en bruine vetweefsels, die inter-weefselcommunicatie suggereren. De bijdrage van ChREBP aan de energiebalans van het hele lichaam kan daarom afhankelijk zijn van de regulatie van lipidesoorten en/of hepatokineproductie die bijdraagt aan de inter weefselcoördinatie van energiehomeostase (Jois et al., 2017).
Adipose ChREBP koppelt lipogenese aan insulinegevoeligheid
verminderde insulinesignalering in vetweefsel is een kritiek kenmerk van insulineresistentie. Studies hebben gemeld dat de activering van ChREBP in wit vetweefsel metabolische homeostase kan verbeteren door beschermende circulerende signalen te produceren (Yore et al., 2014; Tang et al., 2016). Van een klasse zoogdierlipiden die wordt gekenmerkt door een vertakte esterverbinding tussen een vetzuur en een hydroxyvetzuur, palmitinezuur hydroxylstearinezuur (PAHSA), werd gemeld dat deze een gunstig effect heeft op de glucosehomeostase door directe en incretinegemedieerde modulatie van de β-celfunctie, glucoseopname en vermindering van ontstekingen (Yore et al., 2014). Op dezelfde manier zijn vet-specifieke chrebp knockout (ChREBPadiposeKO), die lage lipogenesetarieven in vetweefsel vertonen, insulineresistent met verminderde insulinewerking in lever, spieren en wit vetweefsel onder zowel chow-als vetrijke dieet voorwaarden. Chrebpadiposeko muizen hebben lagere serumspiegels van Pahsa ‘ s, terwijl pahsa-suppletie, met name het 9-PAHSA-isomeer, chrebpadiposeko global insulineresistentie en vetweefselontsteking redt, wat bevestigt dat verlies van adipose-ChREBP voldoende is om insulineresistentie te veroorzaken (Vijayakumar et al., 2017). Een recente studie identificeerde het mechanistische doel van rapamycine complex 2 (mTORC2) als een nieuwe regulator van ChREBP (vooral de β-isovorm) in vetcellen. Specifieke ablatie van rapamycine-ongevoelige metgezel van mTOR (Rictor) in Rijpe adipocyten verminderde insuline-gestimuleerde glucoseopname in vetweefsel, wat leidde tot de down-regulatie van ChREBPß en doelgenexpressie betrokken bij lipogenese controle (Tang et al., 2016). In overeenstemming met een belangrijke Vet–Lever kruisverwijzing gemedieerd door ChREBP, worden deze effecten geassocieerd met leverinsulineresistentie en verhoogde gluconeogenese. Al met al ondersteunen deze studies een belangrijke rol voor vetchrebp in het teweegbrengen van insulinegevoelige signalen (Tang et al., 2016).Nieuwe interactie tussen hormoongevoelige Lipase en ChREBP in vetweefsel
ChREBP werd onlangs geïdentificeerd als een partner van het lipolytische enzym hormoongevoelige lipase (HSL) in vetweefsel (Morigny et al., 2019). Het neerhalen van HSL in menselijke adipocytes en het vetweefsel van de muis werd getoond om insulinegevoeligheid te verbeteren en de verlenging van zeer lange keten vetzuurenzym (Elovl6) te veroorzaken. Elov16 is een microsomaal enzym dat de verlenging van C12-16 verzadigde en enkelvoudig onverzadigde vetzuren reguleert op een chrebp-afhankelijke manier (Morigny et al., 2019). Op mechanistisch niveau verminderde fysieke interactie tussen HSL en ChREBP de nucleaire translocatie van ChREBPa en de daaropvolgende inductie van ChREBPß en doelgenen, in het bijzonder Elovl6 (Morigny et al., 2019). Deze studie onthult een nieuwe verordening voor ChREBP in vetweefsel. Het remmen van de interactie tussen HSL en ChREBP kan leiden tot potentiële therapeutische strategieën om de insulinegevoeligheid in vetcellen te verbeteren.
conclusie en toekomstige richtingen
ChREBP is nu een gevestigde koolhydraatsensor. Hoewel de meeste studies zijn gewijd aan de implicatie ervan in de controle van de glycolytische en lipogene routes, recente gegevens hebben ook ontrafeld nieuwe bijdragen van ChREBP in hepatocyten en in vetcellen waar het zou kunnen worden instrumenteel in het produceren van hepatokines en/of lipokines triggering Inter-orgaan crosstalk. Zoals besproken, kunnen nieuw geïdentificeerde co-factoren (epigenetische modifiers) en/of partners (adipose HSL) in deze weefsels ook potentiële therapeutische strategieën vertegenwoordigen voor NAFLD en/of voor het verbeteren van de systemische insulinegevoeligheid. Recente studies hebben ook het belang van ChREBP bij de regulering van het fructosemetabolisme onderbouwd en de behoefte aan een beter begrip van de rol en regulatie van ChREBP in de dunne darm onderstreept. Tot slot zal het de komende jaren van bijzonder belang zijn om specifieke en/of overlappende doelstellingen van ChREBPa en ChREBPß in sleutelceltypen vast te stellen en hun specifieke impact op de insulinegevoeligheid te bepalen.
Auteursbijdragen
alle genoemde auteurs hebben een aanzienlijke, directe en intellectuele bijdrage aan het werk geleverd en het voor publicatie goedgekeurd.
financiering
het Postic ‘ s lab (U1016-Institut Cochin) wordt ondersteund door subsidies van het Chrome Network (Marie Curie Skłodowska Action H2020-MSCA-ITN-2015-675610), de Foundation for the Medical Research (FRM) (DEQ20150331744) en het ANR-15-CE14-0026-Hepatokind.
verklaring inzake belangenconflicten
de auteurs verklaren dat het onderzoek werd uitgevoerd zonder enige commerciële of financiële relatie die als een potentieel belangenconflict kon worden opgevat.