- Mots clés
- Introduction
- Les manifestations cliniques de la pneumonie à Cytomégalovirus l’infection à cytomégalovirus (CMV) peut être divisée en infection primaire aiguë etactivation. L’infection primaire à CMV survient le plus fréquentementpendant l’allaitement et l’enfance, et est asymptomatique ou présente comme un syndrome de type mononucléose bénigne chez les adultes immunocompétents. Ensuite, le virus persiste à vie dansl’hôte, généralement au stade latent. La réactivation du CMVDE la latence est bien connue chez les patients immunodéprimés, et elle peut affecter presque tous les organes. Cependant, la pneumonie à CMV sévère est rare chez les hôtes immunocompétents. Actuellement, les mécanismes moléculaires et immunologiques précis impliqués sont encore inconnus.
- Rapport de cas
- Discussion
- Conclusion
- Contributions de l’auteur
- Remerciements
Mots clés
Pneumonie à Cytomégalovirus; Bronchiolitisoblitères organisant une pneumonie; Immunocompétents
Introduction
Les manifestations cliniques de la pneumonie à Cytomégalovirus; Bronchiolites organisant une pneumonie; Immunocompétents
Les manifestations cliniques de la pneumonie à Cytomégalovirus l’infection à cytomégalovirus (CMV) peut être divisée en infection primaire aiguë etactivation. L’infection primaire à CMV survient le plus fréquentementpendant l’allaitement et l’enfance, et est asymptomatique ou présente comme un syndrome de type mononucléose bénigne chez les adultes immunocompétents. Ensuite, le virus persiste à vie dansl’hôte, généralement au stade latent. La réactivation du CMVDE la latence est bien connue chez les patients immunodéprimés, et elle peut affecter presque tous les organes. Cependant, la pneumonie à CMV sévère est rare chez les hôtes immunocompétents. Actuellement, les mécanismes moléculaires et immunologiques précis impliqués sont encore inconnus.
La bronchiolite oblitérante organisant la pneumonie (BOOP) est une affection aclinique caractérisée par une toux, un malaise, de la fièvre et une dyspnée et une absence de réponse aux antibiotiques. Son chestradiographe décrit comme local, multiple et diffuse des changements. On peut le trouver avec une alvéolite allergique, une pneumopathie par irradiation, des réactions médicamenteuses et d’autres infections organisatrices. Des cas impliqués dans une étiologie virale compliquée de boophasont sporadiquement été rapportés. Nous présentons ici un cas de pneumonie à CMV associée à BOOP chez un patient immunocompétent par traitement au ganciclovir, qui est le premier cas de ce type jamais signalé à notre connaissance.
Rapport de cas
Un homme de 63 ans a été référé à notre hôpital en raison d’antécédents de toux et de fièvre de 10 jours. Il avait une toux paroxystique avec des expectorations jaunes. Fièvre, avec respiration sifflante principalement apparue dansl’après-midi et la nuit et la température la plus élevée était de39,3 (102,74). Ses antécédents médicaux antérieurs comprenaient l’hypertension, le diabète et la goutte. Son histoire familiale précédenteétait banal. Ses signes vitaux étaient les suivants: température corporelle: 36,5 (97,7), fréquence cardiaque: 98 battements par minute (BPM), pression artérielle: 98/61 mmHg.
Lors de l’examen physique, des crépitements inspiratoires tardifs ont été notés dans les champs pulmonaires inférieurs bilatéraux. Le nombre de globules blancs (WBC) était de 14,2 × 109/L, avec 81,9% de neutrophiles (NEUTRR), 12,8% de lymphocytes (LYR) et 0,53 × 109/Lmonocytes (MONOR) (Figure 1). Le taux sérique de protéine C réactive (CRP) était de 110,67 mg/L.
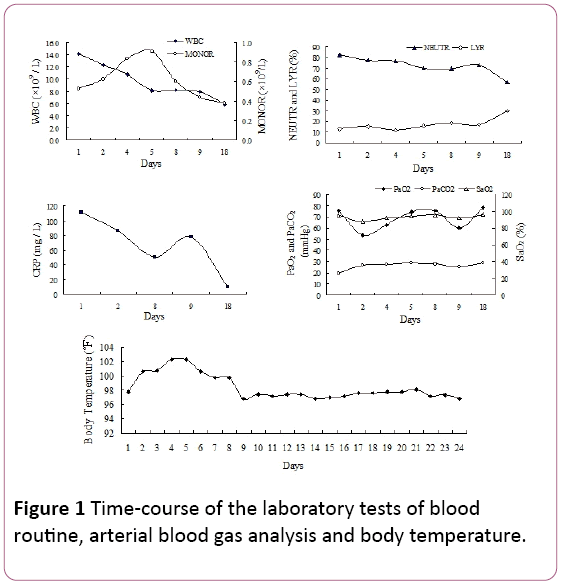
Figure 1: Temps – déroulement des tests de laboratoire de sangroutine, analyse des gaz sanguins artériels et température corporelle.
La pression partielle artérielle d’oxygène (PaO2) était de 75,5 mmHg, avec une pression partielle artérielle de CO2 (PaCO2) de 25,8 mmHg et une saturation en oxygène de 94,7% (SaO2, apport d’oxygène de 2 L/ min via la canule nasale). En raison de la fièvre et des signes d’infections respiratoires, nous avons commencé par expérience un traitement antibiotique par pipéracilline tazobactam. Cependant, la température du patient n’a pas diminué et l’essoufflement s’est développé dans les 4 jours persistants d’admission à l’hôpital.
Les mesures des gaz sanguins artériels ont révélé une défaillance de la respiration (PaO2: 53,5 mmHg, PaCO2: 35,6 mmHg, SaO2: 87,7%) avec une acidose métabolique contrebalancée (HCO3-: 21mmol / l, pH 7,39) lors de l’utilisation de 2 L / min d’oxygène par canule nasale.Les résultats de l’enquête de laboratoire étaient les suivants: anticorps de mycoplasmapneumonie: 1: 40 (positif), endotoxine bactérienne (teneur totale en lipopolysaccharide de bactéries gram négatives): 49,14 pg / mL, fibrinogène plasmatique (Fg): 7,51 g / L, temps de thromboplastine partielle activé (APTT): 45,9 secondes.
L’électrocardiogramme a montré une tachycardie sinusale avec changement de Twave. La radiographie pulmonaire a révélé deux infections pulmonaires, nonexcepter des lésions interstitielles pulmonaires (Figure 2A). Une tomodensitométrie thoracique (TDM) a révélé des lésions interstitielles pulmonaires (ombre de grille dans les deux poumons) et une hypertrophie des ganglions lymphatiques mestinaux (Figure 2D). Ensuite, 3,5 L / min d’oxygène ont été fournis avec le masque facial et le traitement antibiotique a été commuté sur la céfopérazone Sodique et le Sulbactam Sodique plus la lévofloxacine.
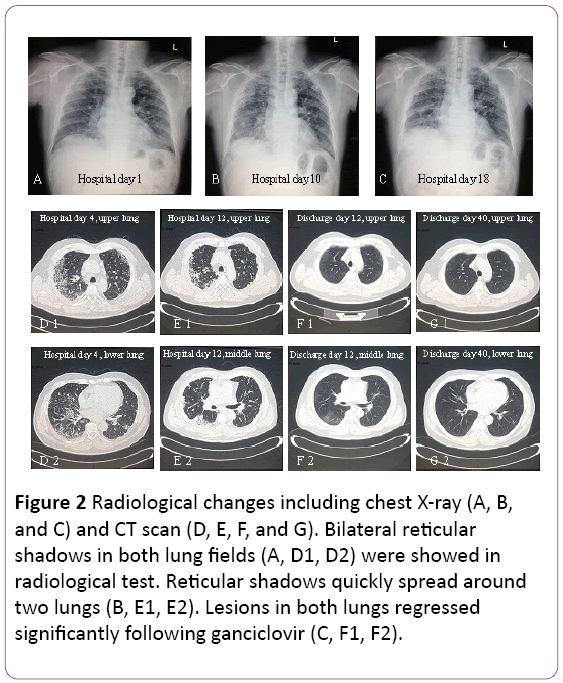
Figure 2: Changements radiologiques, y compris la radiographie pulmonaire (A, B et C) et la tomodensitométrie (D, E, F et G). Des ombres réticulaires bilatérales dans les deux champs pulmonaires (A, D1, D2) ont été montrées lors d’un test radiologique. Les ombres réticulaires se propagent rapidement autourdeux poumons (B, E1, E2). Les lésions dans les deux poumons ont régressésignificativement après le ganciclovir (C, F1, F2).
Compte tenu du diagnostic d’une pneumonie interstitielle, des tests de laboratoire pertinents et une bronchoscopie fibroptique ont été effectués au jour 5. Les résultats des tests de laboratoire étaient les suivants: PCR au CMV: négatif, IgM au CMV: négatif, IgG à l’immunoglobuline: positif, VIH: négatif, WBC: 7,96 × 109 /L, NEUTRS: 72,4%, LYR: 17%, CRP: 77,51 mg /L, fonction immunologique (cellules T, B, NK): normale, Sous-ensembles de lymphocytes T: normaux. Les marqueurs des maladies auto-immunes, y compris l’ANCA périnucléaire (p-ANCA), l’ANCA cytoplasmique (c-ANCA), l’ANA et l’anti-ADND étaient tous négatifs.
La fonction pulmonaire suggère un dysfonctionnement éventilatoire restrictif modéré. La radiographie et la tomodensitométrie ont révélé que des lésions sur le poumon supérieur étaient absorbées, mais qu’elles étaient exacerbées dans le poumon inférieur droit (Figures 2B et 2E).
Une bronchoscopie a montré une bronchite bilatérale (figure 3A).Le liquide de lavage broncho-alvéolaire (BAL) était négatif pour les formycobactéries et les taches de PAS. Le nombre de cellules différentielles a montré11% de neutrophiles, 19% de lymphocytes et 70% de macrophages.Des corps d’inclusion intranucléaires et intracytoplasmiques ont été trouvés dans le segment basal latéral de la biopsie transbronchiale du tissu pulmonaire (TBLB) de la partie inférieure droite (Figure 3B). Sur la base du diagnostic de pneumonie à cytomégalovirus avec organisation, le traitement par ganciclovir (5 mg / kg) par perfusion intraveineuse toutes les 12 heures a commencé le jour 8. Selon la combinaison ci-dessus avec les symptômes cliniques (la fièvre disparaît), le traitement antibiotique a été changé en Moxifloxacine au jour8. Après 1 semaine de traitement antivirus, toux persistante. Il a subi une biopsie pulmonaire par tomodensitométrie. Une biopsie pulmonaire a révéléboUCLE (Figure 3C). Ensuite, le patient traite avec de la stéroïdhormone orale. Néanmoins, ses symptômes se sont progressivement améliorés dans1 semaine suivante. La radiographie pulmonaire a révélé que deux lunglesions étaient meilleures qu’auparavant (figure 2C).
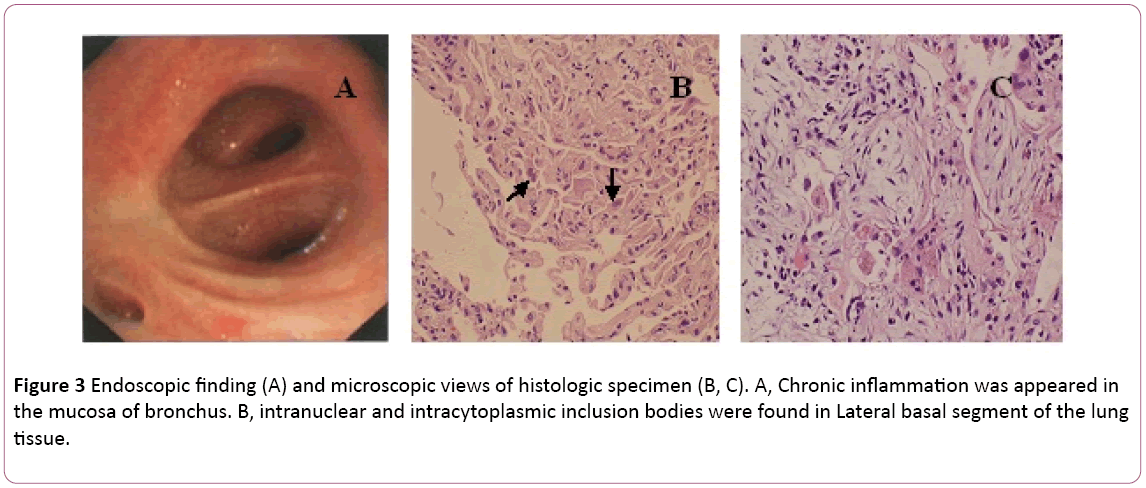
Figure 3: Découverte endoscopique (A) et vues microscopiques d’échantillons histologiques (B, C). A, une inflammation chronique est apparue dansla muqueuse des bronches. Des corps d’inclusion B, intranucléaires et intracytoplasmiques ont été trouvés dans le segment basal latéral du tissu pulmonaire.
Le traitement a été changé en ganciclovir oral, 0,6 g / j (q12h) pendant 7 jours, décharge. Dans son suivi, l’ombre de la grille dans les deux poumons a régressé de manière significative (Figure 2F et 2G). Il est toujours sous suivi à la clinique externe.
Discussion
Le CMV est un virus à ADN de la famille des Herpesviridae et son infection est fréquente. En effet, 40% à 100% des adultes sont infectés par le CMV partout dans le monde. Les infections à CMV dans la population générale sont généralement subcliniques. L’infection symptomatique au CMV s’est principalement produite chez des patients immunodéprimés présentant un dysfonctionnement immunitaire, y compris des patients atteints du SIDA, des tumeurs malignes, des receveurs de greffe et des nouveau-nés. En cas d’immunodéficience, l’infection à CMV peut provoquer une pneumonie, une rétinite, une hépatite, une encéphalite, une polyneuropathie démyélinisante, une myocardite, une pancréatite, des maladies gastro-intestinales et des maladies surrénales, etc. Au contraire, une infection grave menaçant la vie induite par le CMV, y compris la pneumonie à CMV, est grave chez les individus immunocompétents. Dans cet article, nous décrivons un cas de pneumonie à CMV, associée à BOOPin un hôte immunocompétent, et traitée efficacement avec le ganciclovir.
La pneumonie à CMV se présente souvent comme une pneumonie virale sévère, avec infiltrats interstitiels diffus à la radiographie thoracique etune insuffisance respiratoire. Le diagnostic de laboratoire peut êtredifficile, et sont faits sérologiquement ou pathologiquement.Généralement, les tests sérologiques pour détecter l’infection humaine au CMV comprennent le titre des anticorps du CMV (IgM, IgG), la protéine cmvpp65 et la PCR au CMV. Fait important, histopathologiquela détection des corps d’inclusion du CMV sur une biopsie transbronchique ou ouverte est pathognomonique, car la pneumonie à CMV chez les patients immunocompétents représente un événement rare.
Notre patient présentait des symptômes non spécifiques (toux et fièvre), qui s’étaient développés au cours de 10 jours.Les symptômes se sont détériorés après 2 jours d’hospitalisation (hypoxémie sévère), malgré un traitement antibiotique empirique. Le diagnostic de la pneumonie à CMV était basé sur le TBLB, qui a trouvé des corps d’inclusion intranucléaires et intracytoplasmiques dans des cellules géantes comme étalon-or. De plus, l’anticorps IgG sérique CMV positif était un autre indice diagnostique. L’image radiologique, y compris la radiographie pulmonaire et la tomodensitométrie, montrant des ombres réticulaires bilatérales dans les deux champs pulmonaires, a soutenu le diagnostic de pneumonie virale. Dans notre cas, la mononucléose dela routine sanguine a également été observée (figure 1). Cependant, le sérumIgM CMV était négatif dans ce cas, ce qui était conforme au rapport Eddleston. La PCR CMV était également négative. Cela peut s’expliquer par des résultats faussement négatifs induits par la nature transitoire de la virémie.
Pendant l’hospitalisation, son taux de lymphocytes a diminué de manière significative. La lymphopénie a été causée par une infection à CMV pour l’inhibition directe de la croissance des cellules progénitrices et l’échec de l’auto-renouvellement des cellules souches. On peut noter que l’analyse de la fonction immune telle que l’analyse du sous-ensemble des cellules T, des cellules B et des cellules NKcell était normale. Une normalité transitoire ou subclinique des lymphocytes T et une inversion du rapport des lymphocytes T CD4/CD8 n’ont pas été observées dans ce cas. Dans la maladie à VIH, une diminution des cellules CD4 + < 100 × 10 6 / L représentant un risque élevé de maladie à CMV. De plus, notre patient ne présentait aucune preuve d’autres immunodéficiences (VIH: négatif) et les maladies auto-immunes (anticorps auto-immunes: négatif).
BOOP a été décrit pour la première fois par Epler et al. et depuis lors, il a été largement étudié et rapporté dans le monde entier. De nombreux agents infectieux peuvent être associés à BOOP, tels que le cytomégalovirus (CMV), le virus herpessimplex (HSV). Des infections parasitaires et à pneumocystis carinii ont également été rapportées. Parce que BOEPrepresent la manière dont le poumon peut répondre à un stimulus inflammatoire, les résultats physiopathologiques clés sont liés à la voie inflammatoire. Caractéristiques histologiquesinclure le tissu de granulation dans les parois des alvéoles etles bronchioles sont importantes, associées à une infiltration dans la cavité interstitielle et trachéale par différents degrés de cellules mononucléées et de cellules mousseuses. Épithélium alvéolaire de type II, une hyperplasie cellulaire peut également être observée. Chez le patient actuel, BOOP a été diagnostiqué lors d’une biopsie pulmonaire une semaine plus tard lors de la TBLB, suggérant que le CMV peut être le pathogène le plus probable.
Bien qu’il n’y ait pas de durée standard recommandée pour le traitement par le forciclovir chez les patients atteints de pneumonie à CMV, la médication n’a pu être commencée qu’après un diagnostic définitif et est généralement administrée pendant deux à trois semaines. Dès le traitement au ganciclovir, l’état clinique de notre patient s’est amélioré, avec une résolution complète du tableau clinique et radiologique sous un suivi d’un mois.
Conclusion
Nous rapportons un cas d’infection aiguë au CMV, qui s’est présentéavec fièvre, toux, expectorations et tachypnée. Ce dernier s’est détérioré rapidement et est associé à une insuffisance respiratoire.La tomodensitométrie a révélé un petit changement de verre broyé au début, maisle changement s’est rapidement propagé autour de deux poumons. Suite à un examen pathologique (TBLB), le diagnostic de pneumonie à CMV a été confirmé. Pour les patients sans troubles de l’immunodéficience, il est très facile de faire un diagnostic erroné.Le rapport actuel suggère que lorsque la tomodensitométrie thoraciqueles lésions interstitielles, en plus de considérer la tuberculose, la pneumonie bactérienne et d’autres maladies virales, la pneumonie à CMV doit être incluse chez les patients âgés présentant une maladie de base. Fait important, ce cas a démontréque la pneumonie à cytomégalovirus peut s’associer à un patient immunocompétent. Le traitement au ganciclovir estefficace. D’autres études sont nécessaires pour analyser les relations et son mécanisme sous-jacent entre la pneumonie à CMV et le BOOP.
Contributions de l’auteur
CXC a rédigé et écrit le manuscrit. WC, LL et LYH ont pris soin du patient et ont contribué à la coordination du manuscrit. XL a réalisé les tests microbiologiques. Lyhcontribué au brouillon du manuscrit et révisé le manuscrit. Tous les auteurs ont lu le manuscrit etapprouvé sa version finale.
Remerciements
Nous sommes reconnaissants au Prof.Zhiqiang Qin pour son soutien théorique.
- Hagrecht K, Maschmann J, Vochem M, Dietz K, Speer CP, et al. (2001) Épidémiologie de la transmission du cytomégalovirus de la mère au prématuré par l’allaitement. Lancette 357:513-518.
- Carter D, Olchovsky D, Pokroy R, Ezra D (2006) Colite associée au cytomégalovirus provoquant une diarrhée chez un patient immunocompétent. World J Gastroenterol12: 6898-6899.
- Kralickova P, Mala E, Vokurkova D, Krcmova I, Pliskova L, et al. (2014) Maladie à Cytomégalovirus chez les patients présentant une Immunodéficience variable Commune: Trois Rapports de cas. Archives internationales d’Allergie et d’immunologie 163:69-74.
- Eddleston M, Peacock S, Juniper M, Warrell DA (1997) Infection à cytomégalovirus sévère chez des patients immunocompétents. Clin Infecte Dis 24:52-56.
- Cunha BA (2010) Pneumonie à cytomégalovirus: pneumonie acquise par la communauté chez des hôtes immunocompétents. Infect Dis Clin North Am 24:147-158.
- Cohen JI, Corey GR(1991) Cytomegalovirus infection in the normal host. Medicine 1985; 64:100-114.
- Geddes DM. BOOP and COP. Thorax46:545-547.
- Hansell DM (1992) What are bronchiolitis obliterans organizing pneumonia (BOOP) and cryptogenic organizing pneumonia (COP)? ClinRadiol45:369-70.
- Cunha BA, Syed U, Mickail N(2012) Renal transplant with bronchiolitis obliterans organizing pneumonia (BOOP) attributable to tacrolimus and herpes simplex virus (HSV) pneumonia. Heart & Lung 41:310-315
- Bitzan M, Ouahed JD, Carpineta L, Bernard C, Bell LE (2010) Pneumonie organisatrice cryptogénique après traitement par rituximab pour une maladie lymphoproliférative présumée post-transplantation rénale. Néphrologie pédiatrique 25: 1163-1167.
- de la Hoz RE, Stephens G, Sherlock C (2002) Approches diagnostiques et thérapeutiques des infections à CMV chez les patients adultes. J ClinVirol 25, 1-12.
- Sanadgol N, Ramroodi N, Ahmadi GA, Komijani M, Moghtaderi A, et al.(2011) Prévalence de l’infection à cytomégalovirus et son rôle dans le profil d’immunoglobuline totale chez les patients iraniens atteints de différents sous-types de sclérose en plaques. New Microbiologica 34:263-274.
- Chiotan C, Radu L, Serban R, Cornacel C, Cioboata M, et al. (2014) Rétinite à cytomégalovirus chez les patients atteints du VIH / SIDA. Journal de médecine et de vie 7:237-240.
- Liu WL, Lai CC, Ko WC, Chen YH, Tang HJ, et al. (2011) Caractéristiques cliniques et microbiologiques des infections causées par diverses espèces de Nocardia à Taiwan: une étude multicentrique de 1998 à 2010. Eur J ClinMicrobiol Infecte Dis30: 1341-1347.
- Faisceau E, RR Razonable (2012) Cytomégalovirus dans la transplantation d’organes solides: épidémiologie, prévention et traitement. Curr Infecte Dis Rep14: 633-641.
- Westman G, Berglund D, Widen J, Ingelsson M, Korsgren O, et al. (2014) Augmentation de la Réponse inflammatoire chez les patients Séropositifs à Cytomégalovirus atteints de la maladie d’Alzheimer. PloS one9:96779.
- Carney WP, Rubin RH, Hoffman RA, Hansen WP, Healey K, et al. (1981) Analyse des sous-ensembles de lymphocytes T dans la mononucléose du cytomégalovirus. J Immunol126: 2114-2116.
- Boeckh M, Leisenring W, Riddell SR, Bowden RA, Huang ML, et al. (2003) Maladie à cytomégalovirus tardive et mortalité chez les receveurs de greffes de cellules souches hématopoïétiques allogéniques: importance de la charge virale et de l’immunité des cellules T. Blood 101:407-414.
- Gunthard HF, Aberg JA, Eron JJ, Hoy JF, Telenti A, et al. (2014) Traitement antirétroviral de l’infection à VIH chez l’adulte: recommandations 2014 du Panel International Antiviral Society-USA. JAMA 312:410-425.
- Epler GR, Colby TV, McLoud TC, Carrington CB, Gaensler EA (1985) Bronchiolite oblitérante organisant une pneumonie. N Engl J Med 312:152-158.
- Kute VB, Patel MP, Patil SB, Shah PR, Vanikar AV,et al. (2013) Bronchiolitis obliterans organizing pneumonia (BOOP) after renal transplantation. IntUrolNephrol 45:1517-1521.
- White KA, Ruth-Sahd LA (2007) Bronchiolitis obliterans organizing pneumonia. Crit Care Nurse27:53-66.
- Yale SH, Adlakha A, Sebo TJ, Ryu JH(1993)Bronchiolitis obliterans organizing pneumonia caused by Plasmodium vivax malaria. Chest 104:1294-1296.
- Kleindienst R, Fend F, Prior C, Margreiter R, Vogel W(1999)Bronchiolitis obliterans organizing pneumonia associated with Pneumocystis carinii infection in a liver transplant patient receiving tacrolimus. Clin Transplant13:65-67.
- Moore SL (2003)Bronchiolitis obliterans organizing pneumonia: a late complication of stem cell transplantation. Clin J OncolNurs 7:659-662.