El material genético se almacena dentro de las células en estructuras llamadas cromosomas, que tienen una secuencia repetitiva conocida como telómero en cada extremo. Las proteínas especializadas se unen a estas secuencias para formar una «tapa» protectora que protege el cromosoma y evita que se fusione con otros cromosomas. La enzima telomerasa también ayuda a mantener los cromosomas al agregar secuencias repetitivas de ADN a los extremos de los telómeros.
Una de las moléculas capsuladoras más estudiadas es una proteína llamada Cdc13 que se une a ciertos tipos de ADN monocatenario en levadura en ciernes, y forma un complejo con otras dos proteínas (Stn1 y Ten1) que recluta telomerasa (Wellinger y Zakian, 2012). Varias líneas de evidencia sugieren que este complejo CST también recluta una enzima de replicación de ADN llamada primasa-Pola, y puede regular la actividad de esta enzima en los extremos de los cromosomas, así como en otras ubicaciones del genoma (Giraud-Panis et al., 2010; Price et al., 2010; Barbero Barcenilla y Shippen, 2019).
También se han identificado complejos similares en otros eucariotas, incluidos mamíferos, que contienen Stn1, Ten1 y otra proteína llamada CTC1 dentro de su complejo CST (Giraud-Panis et al., 2010; Price et al., 2010). Sin embargo, ha resultado difícil determinar los roles que desempeñan las diferentes proteínas en el complejo CST porque las células que carecen de una de estas proteínas luchan por sobrevivir (Figura 1A). Ahora, en eLife, Jin-Qiu Zhou y compañeros de trabajo de la Academia China de Ciencias y la Universidad ShanghaiTech, incluido Zhi-Jing Wu como primer autor, informan los resultados de experimentos que ayudan a mejorar nuestra comprensión del complejo CST (Wu et al., 2020).
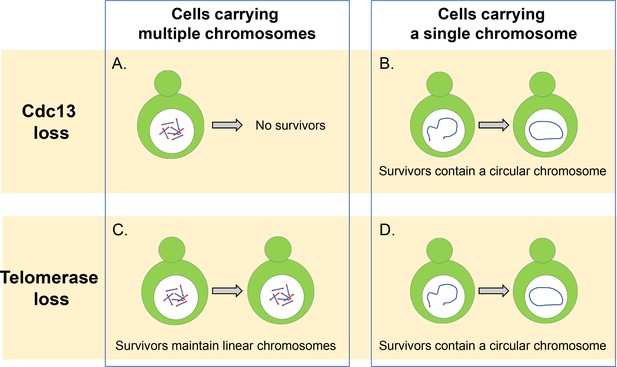
Cdc13 y telomerasa son esenciales para mantener los cromosomas lineales.
(A) Las células de levadura con cromosomas lineales múltiples requieren la proteína de cobertura Cdc13 para proteger sus telómeros y evitar que los cromosomas se fusionen. Sin esta proteína, estas células no pueden sobrevivir. (B) Las células que tienen un solo cromosoma lineal pueden sobrevivir sin Cdc13 fusionando los extremos de su cromosoma para formar un anillo circular. C) En ausencia de la enzima telomerasa, las células con cromosomas lineales múltiples pueden sobrevivir empleando vías de recombinación de ADN que pueden amplificar la secuencia de telómeros o los segmentos de ADN que se encuentran entre la cromatina y la secuencia de telómeros. D) Las células con un solo cromosoma lineal sobreviven a la pérdida de telomerasa fusionándose para formar un cromosoma circular mediante recombinación homóloga, similar a lo que sucede en las células que carecen de la proteína Cdc13.
Crédito de la imagen: Constance Nugent y Katsunori Sugimoto.
Primero, Wu et al. investigó cómo la eliminación del complejo CST afectó la viabilidad de una cepa de levadura en ciernes en la que todos sus 16 cromosomas se fusionaron para formar un solo cromosoma circular (Shao et al., 2019). Descubrieron que la eliminación de CST no impedía que las células proliferaran ni causaba más muertes celulares, incluso cuando el cromosoma circular contenía las secuencias repetitivas de telómeros. Parece, por lo tanto, que el papel principal del complejo CST es mantener cromosomas lineales y evitar que los cromosomas se fusionen con otros cromosomas, y que no es esencial para la replicación de secuencias de telómeros internos.
Además de formar un anillo circular, los 16 cromosomas de la levadura en ciernes también se pueden fusionar para formar un solo cromosoma lineal(Shao et al., 2018). Wu et al. se encontró que la eliminación del complejo CST redujo en gran medida la viabilidad de estas células, pero algunas de estas células pudieron sobrevivir fusionando los extremos de su cromosoma lineal para formar un anillo circular (Figura 1B). La eliminación individual de los genes que codifican las diferentes proteínas del complejo CST reveló que las células que carecen de Cdc13 mostraron una tasa de fusión más alta que las células que carecen de los genes para Stn1 y Ten1. Esto sugiere que Cdc13 juega un papel dominante en la inhibición de la fusión de cromosomas, y que Stn1 y Ten1 contribuyen a la protección de los telómeros independientemente de Cdc13. Sin embargo, los detalles de este mecanismo siguen sin estar claros y requieren una investigación más a fondo.
En células de tipo salvaje que contienen múltiples cromosomas, es raro encontrar cromosomas fusionados o circulares, incluso cuando la actividad de la telomerasa se ha visto comprometida: esto se debe a que las células pueden extender y mantener los telómeros mediante el uso de un mecanismo llamado recombinación dirigida por homología que repara las roturas de doble cadena en el ADN (Figura 1C). Sin embargo, Wu et al. encontró que la reducción del número de cromosomas llevó a que se detectaran más fusiones en células que carecen de la enzima telomerasa. Esto sugiere que la reducción del número de cromosomas aumenta la probabilidad de que las células puedan producir cromosomas circularizados y sobrevivir a la pérdida de telomerasa.
Se pensó que la fusión de los dos extremos del cromosoma lineal singular dependería de una vía de reparación del ADN llamada vía no homóloga de unión de extremos (NHEJ, por sus siglas en inglés) (Haber, 2016). Sin embargo, Wu et al. se demostró que, en ausencia de telomerasa, la fusión cromosómica dependía de la Rad52, que desempeña un papel crítico en la recombinación homóloga de roturas de ADN en levadura en ciernes (Figura 1D). Es posible que las células utilizadas en este estudio dependan de la vía Rad52 para la circularización cromosómica porque el único cromosoma tiene una secuencia de telómeros invertida cerca de un extremo del cromosoma. Si se eliminara dicha secuencia, las células podrían someterse a una fusión de extremo a extremo a través de la vía NHEJ, que es más común en las células humanas (Palm y de Lange, 2008). Experimentos adicionales mostraron que este hallazgo no se debió a una pérdida en la actividad de NHEJ y que esta vía es capaz de fusionar plásmidos linealizados en células de levadura en ciernes.
El trabajo de Wu et al. proporciona nuevos conocimientos sobre cómo los cromosomas se fusionan y cómo los telómeros se mantienen independientemente de la enzima telomerasa. Además, los hallazgos de este estudio podrían ir más allá de la levadura y mejorar nuestra comprensión de varios síndromes médicos humanos causados por la fusión de los extremos de los cromosomas para formar formas de anillo (Pristyazhnyuk y Menzorov, 2018).