Introducción
El tromboembolismo venoso (TEV), que incluye trombosis venosa profunda (TVP), embolia pulmonar (EP) y trombosis venosa esplácnica, es una complicación frecuente del cáncer.1 El desarrollo de TEV asociado al cáncer se asocia con una calidad de vida reducida y supone una carga económica significativa tanto para el paciente como para el sistema de atención médica.2 El TEV es la segunda causa de muerte por cáncer en pacientes ambulatorios que reciben quimioterapia y se ha demostrado que es un factor pronóstico independiente de mortalidad en la población de pacientes de cáncer.3,4 El manejo del tratamiento del TEV relacionado con el cáncer puede ser difícil porque los riesgos de TEV recidivante y sangrado relacionado con anticoagulantes son altos a pesar del manejo adecuado.5 Además, las interacciones medicamentosas y las comorbilidades relacionadas con el cáncer, como la disfunción renal y/o hepática, la disminución de la ingesta oral, las náuseas y vómitos inducidos por quimioterapia y la trombocitopenia, también aumentan la complejidad del tratamiento al limitar la elección del agente anticoagulante.
Ensayos Clínicos en los que se evalúa la heparina de bajo peso molecular para el Tratamiento del TEV Relacionado con el Cáncer
Se recomienda el uso a largo plazo de heparina de bajo peso molecular (HBPM) para el tratamiento del TEV en pacientes con cáncer activo como terapia de primera línea con base en los resultados de múltiples ensayos controlados aleatorizados, abiertos (ECA).6,7 Los dos estudios más grandes publicados hasta la fecha, los ensayos CLOT (Comparación de heparina de bajo peso molecular versus Terapia anticoagulante Oral para la Prevención de Tromboembolismo Venoso Recurrente en Pacientes con Cáncer) y CATCH (Comparación de Tratamientos Agudos en Hemostasia del Cáncer), compararon una HBPM con la terapia con antagonistas de la vitamina K en pacientes con cáncer activo y TVP proximal sintomática aguda o EP. Ver Tabla 1 para las características basales y Tabla 2 para los resultados del estudio.8,9 En ambos ensayos se utilizó un diseño de estudio abierto, el mismo cociente normalizado internacional (INR) objetivo en el grupo de control de antagonistas de la vitamina K, la misma definición de cáncer activo y la misma duración del tratamiento, y los criterios de elegibilidad de los pacientes eran comparables.
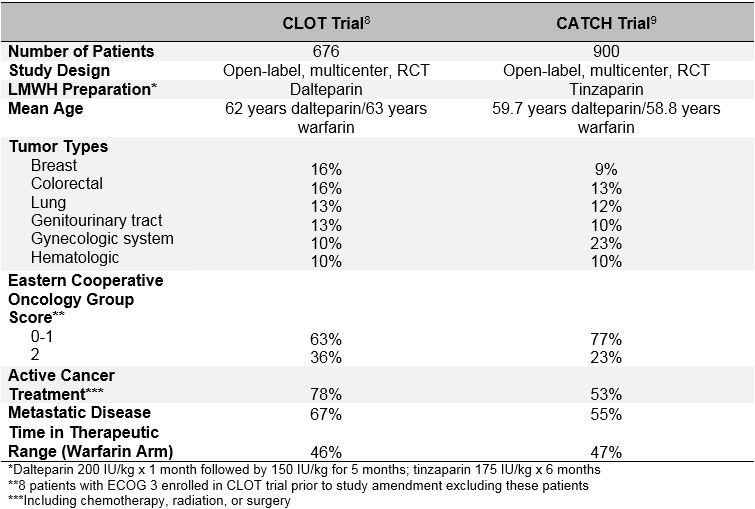
Tabla 1: Diseño del estudio y Características Basales de los ensayos CATCH y CLOT
Cuadro 2: Resultados en los ensayos de COÁGULOS y CATCH

El ensayo CLOT, publicado en 2003, aleatorizó a 676 pacientes para recibir dalteparina (200 UI/kg al día durante 1 mes seguido de 150 UI/kg al día durante 5 meses) o antagonista de la vitamina K (warfarina o acenocumarol con INR objetivo 2,5 durante un total de 6 meses con un solapamiento inicial de 5 a 7 días con dalteparina 200 UI/kg).8 Se observó TVP o EP recurrentes sintomáticas, incluida la muerte relacionada con la EP, en 27 pacientes (7,0%) aleatorizados a dalteparina y en 53 pacientes (15%) aleatorizados a antagonistas de la vitamina K (razón de riesgo 0,48; intervalo de confianza del 95%, 0,30-0,77; p = 0,002). No hay diferencia en las tasas de sangrado mayor (6 vs 4%; p = 0,27), sangrado (15 vs 19%; p = 0,09), o la muerte (39 vs 41%, p = 0.53) se observaron entre los 2 grupos.
En el ensayo CATCH, publicado más de 10 años después, en 2015, 900 pacientes fueron aleatorizados a tinzaparina (175 UI/kg al día sin reducción de dosis) o warfarina (INR objetivo 2,0-3,0 con solapamiento inicial de tinzaparina de 175 UI/kg durante 5-10 días) durante un total de 6 meses.9 La variable principal compuesta de TEV recidivantes, incluyendo TVP proximal incidental y EP, se presentó en 31 pacientes (6,9%) en el grupo de tinzaparina y en 45 pacientes (10%) en el grupo de warfarina (HR 0,65; IC 95%, 0,41-1,03; p = 0,07). La TVP sintomática se produjo en un número significativamente menor de pacientes tratados con tinzaparina (2,7 vs.5,3%; HR 0,48; IC 95%, 0,24-0,96; p = 0,04). Aunque hemorrágicas mayores tasas fueron similares en ambos brazos, una reducción significativa clínicamente relevantes, no sangrado mayor se observó con tinzaparina (10,9 vs 15.3%; HR 0,58; IC 95% 0.40-0.84; p = 0,004). La mortalidad fue similar en ambos grupos, con aproximadamente un tercio de los pacientes mueren durante el período de estudio (33.4 vs 30.6%; p = 0,54). Aunque la tinzaparina no redujo de manera significativa el criterio de valoración compuesto primario del TEV recidivante, los resultados del estudio CATCH apoyan el uso de HBPM a largo plazo como tratamiento preferido para el TEV relacionado con el cáncer debido a un menor riesgo de hemorragia mayor clínicamente relevante y una reducción significativa de la TVP recidivante.
El fracaso del ensayo CATCH para alcanzar la significación estadística para la variable principal puede deberse a la tasa de recurrencia de TEV más baja de lo esperado observada en el grupo de warfarina. Una posible explicación para esta observación podría ser una mejora en el tratamiento de la warfarina en el ensayo CATCH. Sin embargo, niveles similares de control de INR en ambos estudios argumentan en contra de esto (el tiempo en el rango terapéutico fue de 46% en CLOT vs.47% en CATCH; el tiempo por encima del rango terapéutico fue de 24% en CLOT vs. 27% en CATCH). Una explicación más probable es un sesgo en la selección de pacientes» menos enfermos » para la inscripción en el ensayo CATCH. Aunque en los estudios CATCH y CLOT se utilizaron criterios de inclusión y exclusión similares, existen diferencias clave en las características basales entre las dos poblaciones de pacientes, en particular con respecto a los factores de riesgo trombóticos y pronósticos. Una proporción más alta de pacientes en el ensayo CLOT estaban recibiendo tratamiento activo para el cáncer (72% de COÁGULOS vs. 53% CATCH), tenían antecedentes de TEV previos (11% de COÁGULOS vs. 6% CATCH), tenían pruebas de enfermedad metastásica (67% de COÁGULOS vs. 55% de CATCH), y tuvo un peor estado funcional (puntuación del Eastern Cooperative Oncology Group de 2 en 36% de CLOT vs.23% de CATCH). Además, la mortalidad durante el período de tratamiento de 6 meses también fue mayor en la población de COÁGULOS (39% de COÁGULOS frente a 32% de CATCH). Por lo tanto, la población de pacientes de CATCH probablemente tuvo un riesgo inherente menor de recurrencia de TEV en comparación con los pacientes del estudio de coágulos. Es muy probable que los investigadores no inscribieran a pacientes en CATCH si consideraban que la HBPM sería más beneficiosa que la warfarina, lo que resultó en la inscripción selectiva de pacientes que tenían menos probabilidades de presentar TEV recidivantes.
Ensayos que evalúan Anticoagulantes Orales Directos en TEV Asociados al Cáncer
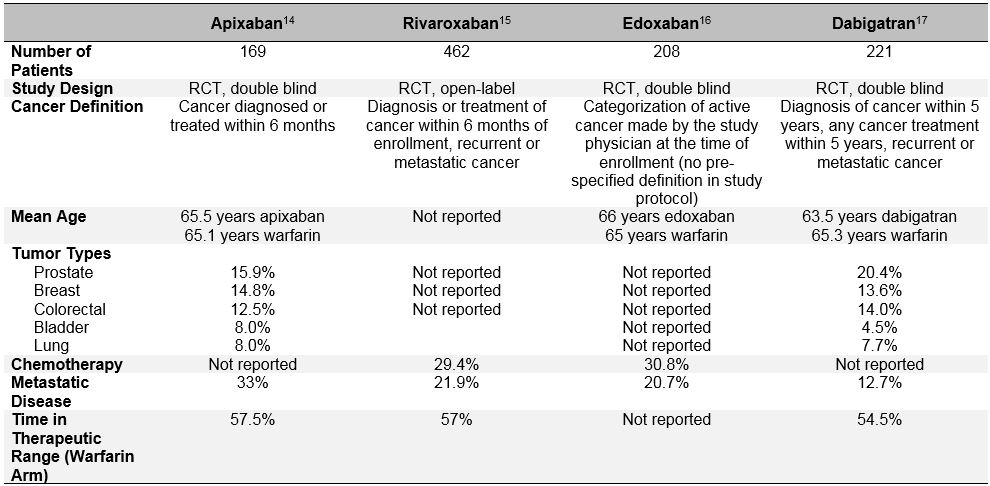
El sesgo de selección de pacientes es aún más evidente en los ensayos aleatorizados recientes que evalúan la eficacia y seguridad de los anticoagulantes orales directos (ACOD) para el tratamiento de TEV agudos.10 Estos anticoagulantes orales se han estudiado ampliamente en la última década en fibrilación auricular, tratamiento de TEV y prevención de TEV. En los ensayos clínicos de fase III de referencia para el tratamiento de TEV agudos, se demostró de manera consistente que los ACOD no son inferiores a la warfarina (riesgo relativo combinado 0,90; IC 95%, 0,77-1.06) para prevenir la recurrencia del TEV, y tienen un riesgo similar o reducido de sangrado mayor (CR agrupado 0,40; IC 95%, 0,45-0,83).11 Entre los pacientes clasificados como «cáncer» o «cáncer activo» en estos estudios, los DOAC también parecen tener un rendimiento similar al de la warfarina.12 Sin embargo, un examen más a fondo de estos datos posteriores revela un sesgo importante en la selección de pacientes y cuestiona la posibilidad de generalizar los resultados del ensayo DOAC a pacientes de la «vida real» de cáncer con TEV. Además de las definiciones heterogéneas de «cáncer activo» utilizadas en estos ensayos, que diferían de los ensayos CLOT y CATCH, los determinantes importantes de la TEV recidivante y el sangrado también fueron muy diferentes en los pacientes con DCA con cáncer de los ensayos específicos de HBPM para el cáncer (Tabla 3). Estos incluyen la presencia de enfermedad metastásica y el uso concomitante de terapia contra el cáncer. Las grandes diferencias en la mortalidad durante el período del estudio también argumentan que en los ensayos DOAC versus HBPM se incluyeron grupos muy diferentes de pacientes con «cáncer». Además, a diferencia de la HBPM, que se asocia con una reducción significativa del riesgo de TEV recurrente en comparación con los antagonistas de la vitamina K (RR 0,52; IC 95%, 0,36-0.74), los DOAC no redujeron significativamente este riesgo en un metanálisis de 1132 pacientes con cáncer incluidos en el programa de ensayos clínicos EINSTEIN, HOKUSAI-VTE (Edoxabán Versus Warfarina para el Tratamiento de Tromboembolismo Venoso Sintomático), RECOVER (Eficacia y Seguridad de Dabigatrán en Comparación con Warfarina para el Tratamiento de Tromboembolismo Venoso Sintomático Agudo durante 6 Meses) y AMPLIFICAR (Apixabán para el Tratamiento Inicial de Embolia Pulmonar y Trombosis Venosa Profunda como Terapia de Primera Línea) ECA (RR 0,66; IC del 95%, 0,39-1,11).10 Todas estas consideraciones deben tener en cuenta el uso no seleccionado de ACOD en pacientes con cáncer activo y ETV sintomáticos agudos.Tabla 3: Diseño del Estudio y Características Basales de los Subgrupos de Pacientes con Cáncer de los Ensayos DOAC de Fase III
Conclusiones
Todas las principales directrices de consenso basadas en datos probatorios recomiendan la HBPM para el tratamiento inicial y a largo plazo del TEV relacionado con el cáncer.6,7,13 Esta recomendación se basa en la observación de que la HBPM no solo es más eficaz que la warfarina para la prevención de TEV recurrentes, sino que también ofrece ventajas adicionales sobre los agentes orales, incluida la anticoagulación estable en pacientes con ingesta oral deficiente, ausencia de interacciones medicamentosas y experiencia clínica en el manejo de la anticoagulación en torno a procedimientos invasivos y trombocitopenia. Aunque actualmente no se recomiendan los ACOD para el tratamiento de TEV en pacientes con cáncer, los ECA que comparan rivaroxabán y edoxabán con HBPM están en curso y ayudarán a aclarar su papel en el TEV asociado al cáncer.6,13
- Khorana AA, Dalal M, Lin J, Connolly GC. Incidencia y factores predictivos de tromboembolismo venoso (TEV) en pacientes ambulatorios de cáncer de riesgo alto sometidos a quimioterapia en los Estados Unidos. Cancer 2013; 119: 648-55.
- Kourlaba G, Relakis J, Mylonas C, et al. La carga humanística y económica de la tromboembolia venosa en pacientes con cáncer: una revisión sistemática. Fibrinólisis de la Coagulación sanguínea 2015; 26: 13-31.
- Kuderer NM, Ortel TL, Francis CW. Impacto del tromboembolismo venoso y la anticoagulación en el cáncer y la supervivencia del cáncer. J Clin Oncol 2009; 27: 4902-11.
- Khorana AA, Francis CW, Culakova E, Kuderer NM, Lyman GH. El tromboembolismo es una de las principales causas de muerte en pacientes con cáncer que reciben quimioterapia ambulatoria. J Thromb Haemost 2007; 5: 632-4.
- Prandoni P, Lensing AW, Piccioli A, et al. Tromboembolismo venoso recurrente y complicaciones hemorrágicas durante el tratamiento anticoagulante en pacientes con cáncer y trombosis venosa. Blood 2002; 100: 3484-8.
- Lyman GH, Bohlke K, Khorana AA, et al. Profilaxis y tratamiento del tromboembolismo venoso en pacientes con cáncer: actualización de la guía de práctica clínica de la sociedad americana de oncología clínica 2014. J Clin Oncol 2015; 33: 654-6.
- Streiff MB, Holmstrom B, Ashrani A, et al. Enfermedad Tromboembólica Venosa Asociada al Cáncer, Versión 1.2015. J Natl Compr Canc Netw 2015; 13:1079-95.
- Lee AY, Levine MN, Baker RI, et al. Heparina de bajo peso molecular versus una cumarina para la prevención del tromboembolismo venoso recurrente en pacientes con cáncer. N Engl J Med 2003; 349: 146-53.
- Lee AY, Kamphuisen PW, Meyer G, et al. Tinzaparina vs Warfarina para el Tratamiento del Tromboembolismo Venoso Agudo en Pacientes con Cáncer Activo: Un Ensayo Clínico Aleatorizado. JAMA 2015; 314: 677-86.
- Carrier M, Cameron C, Delluc A, Castellucci L, Khorana AA, Lee AY. Eficacia y seguridad de la terapia anticoagulante para el tratamiento de la trombosis aguda asociada al cáncer: una revisión sistemática y metanálisis. Thromb Res 2014;134:1214-9.
- van Es N, Coppens M, Schulman S, Middeldorp S, Büller HR. Anticoagulantes orales directos comparados con antagonistas de la vitamina K para tromboembolismo venoso agudo: evidencia de ensayos de fase 3. Blood 2014;124: 1968-75.
- Vedovati MC, Germini F, Agnelli G, Becattini C. Anticoagulantes orales directos en pacientes con TEV y cáncer: una revisión sistemática y metanálisis. Chest 2015; 147: 475-83.
- Kearon C, Akl EA, Ornelas J, et al. Terapia Antitrombótica para la Enfermedad de TEV: Guía de Tórax e Informe del Panel de Expertos. Chest 2016; 149: 315-52.
- Agnelli G, Büller HR, Cohen A, et al. Apixaban oral para el tratamiento del tromboembolismo venoso en pacientes con cáncer: resultados del ensayo AMPLIFY. J Thromb Haemost 2015;13: 2187-91.
- Prins MH, Lensing AW, Brighton TA, et al. Rivaroxabán oral frente a enoxaparina con antagonista de la vitamina K para el tratamiento del tromboembolismo venoso sintomático en pacientes con cáncer (TVP EINSTEIN y EP EINSTEIN): un análisis agrupado de subgrupos de dos ensayos controlados aleatorios. Lancet Haematol 2014; 1: e37-46.
- Raskob GE, van Es N, Segers A, et al. Edoxabán para el tromboembolismo venoso en pacientes con cáncer: resultados de un análisis de subgrupos de no inferioridad del ensayo aleatorizado, doble ciego y doble simulado Hokusai-VTE. Hematol Lancet 2016; 3: e379-87.
- Schulman S, Goldhaber SZ, Kearon C, et al. Tratamiento con dabigatrán o warfarina en pacientes con tromboembolismo venoso y cáncer. Thromb Haemost 2015;114:150-7.
Temas Clínicos: Anticoagulation Management, Arrhythmias and Clinical EP, Cardio-Oncology, Pulmonary Hypertension and Venous Thromboembolism, Anticoagulation Management and Atrial Fibrillation, Anticoagulation Management and Venothromboembolism, Atrial Fibrillation/Supraventricular Arrhythmias
Keywords: Cardiotoxinas, Cardiotoxicidad, Heparina, De Bajo Peso Molecular, Warfarina, Anticoagulantes, Cociente Normalizado Internacional, Acenocumarol, Dalteparina, Antitrombinas, Tromboembolismo Venoso, Factores de Riesgo, Fibrilación Auricular, Pacientes Ambulatorios, Personal de Investigación, Calidad de Vida, Piridonas, Pirazoles, Piridinas, Tiazoles, Trombosis Venosa, Embolia Pulmonar, Trombosis, Trombocitopenia, Comorbilidad, Hemostasia, Neoplasias
< Volver a los listados