Introducción
Las infecciones asociadas a la atención de la salud (HAI), como la bacteremia causada por cepas de Pseudomonas aeruginosa resistentes a múltiples medicamentos, resultan en un aumento de la morbilidad y mortalidad, prolongando la hospitalización y costos más altos en comparación con las infecciones causadas por cepas susceptibles.1-3 Las infecciones causadas por estos microorganismos resistentes a menudo se asocian con la edad, el cáncer, las enfermedades cardíacas, la diabetes, el uso intensivo de antibióticos y procedimientos invasivos como la hemodiálisis, el catéter de ventilación mecánica, la traqueotomía y otros.4
La incidencia creciente de P multirresistente. la aeruginosa como causa de infección nosocomial es un problema global, consecuencia de la capacidad de este microorganismo para desarrollar resistencia a casi todos los demás agentes antimicrobianos durante la quimioterapia antimicrobiana, ya sea por selección de mutaciones en genes cromosómicos o por transferencia horizontal de genes.5,6 En Brasil, este problema es aún más significativo, ya que hay una densidad muy alta de uso de antibióticos, especialmente β-lactámicos, carbapenémicos y fluoroquinolonas.7,8 La resistencia en P. la aeruginosa a los carbapenems es de hasta el 60% en algunos hospitales brasileos9,10 y se produce principalmente por producción de metalo-β-lactamasas (MBL).
Se conocen diez subclases de enzimas MBL: IMP (Imipenemasa), VIM (Imipenemasa de Verona), SPM-1 (MBL de São Paulo), GIM (Imipenemasa alemana), SIM-1 (Imipenemasa Seul),11 AIM-1 (Imipenemasa australiana),12 KHM (Hospital Universitario de Kyorin),13 NDM-1 (MBL de Nueva Delhi),14 DIM-1 (Holandés Imipenemasa),15 y TMB (Trípoli MBL).16 En Brasil, las subclases más prevalentes son IMP-1 y SPM-1.11
Varios otros genes de virulencia, así como la formación de biopelículas, pueden contribuir a la patogenicidad de infecciones graves, en particular las asociadas con procedimientos invasivos.17 Entre los principales factores de virulencia descritos en la literatura, destacamos los relacionados con la adherencia de microorganismos a las células huésped a través de flagelos, fimbrias y alginate18 y los que facilitan la alteración de la integridad epitelial e interfieren con el sistema inmunitario, como la elastasa, la fosfolipasa C y la proteasa alcalina, además de la exotoxina A, la piocianina y la pioverdina.19 La producción de biopelículas está particularmente asociada a la dificultad de los antibióticos para penetrar en las células, ya que secretan una matriz polimérica compuesta de polisacáridos, proteínas y ADN.20,21
El objetivo de este estudio fue identificar los factores de riesgo asociados con bacteriemia causada por los carbapenem-resistentes de P. aeruginosa, así como la producción de MBL. Además, investigamos la frecuencia de los genes de virulencia y su capacidad para formar biopelículas.
Materiales y métodospacientes y hospitalarios
El P. las cepas de aeruginosa fueron recuperadas de pacientes ingresados en el Hospital Universitario de Uberlandia (Brasil), Universidad Federal de Uberlândia (HC-UFU), y obtenidas del Laboratorio de Microbiología del HC-UFU, durante el período de mayo de 2009 a diciembre de 2012, considerando solo el primer episodio de infección.
Diseño del estudio
Se realizó un estudio de caso (pacientes con bacteremia debida a P. aeruginosa resistente a carbapenemos) versus control (pacientes con bacteremia causada por P. aeruginosa susceptible a carbapenemos) para identificar factores de riesgo entre pacientes infectados con P. aeruginosa resistente a carbapenems. Además, evaluamos los resultados secundarios, incluidos los períodos de hospitalización, el ingreso en la unidad de cuidados intensivos (UCI) y el uso de procedimientos invasivos. Las características demográficas, clínicas y epidemiológicas de cada paciente incluido en el estudio se recuperaron de las historias clínicas.
Definiciones
Las infecciones asociadas a la atención de la salud se definen como cualquier infección adquirida después de la admisión de un paciente en el hospital. Las HAIS pueden manifestarse durante la hospitalización o después del alta, ya que están relacionadas con la hospitalización o los procedimientos realizados durante la hospitalización.22 La bacteriemia, según los Centros para el Control y la Prevención de Enfermedades,23 se puede definir como la presencia de bacterias viables en la sangre documentada por un resultado positivo de hemocultivo. La bacteriemia se clasificó como primaria cuando no estaba relacionada con otro foco de infección o cuando estaba relacionada con un catéter intravenoso, y secundaria cuando estaba clínicamente relacionada con infección en otro sitio anatómico.9 La multirresistencia se define como la no susceptibilidad adquirida a al menos un agente en tres o más categorías antimicrobianas.La terapia antimicrobiana se consideró inadecuada cuando un microorganismo aislado presentaba resistencia in vitro a los antimicrobianos utilizados para el tratamiento del paciente y / o falta de tratamiento durante 24 horas después del diagnóstico de infecciones microbianas.25
Pruebas clínicas microbiológicas y moleculares
Se recolectaron cultivos de acuerdo con el protocolo utilizado por el Laboratorio de Microbiología del HC-UFU y se procesaron utilizando el sistema automatizado BACT/Alert® (bioMérieux, Durham, EE.UU.). Las pruebas de identificación y susceptibilidad antimicrobiana se realizaron por automatización utilizando el sistema VITEK II y las cepas que mostraron susceptibilidad intermedia se consideraron resistentes. Se utilizaron protocolos de control de calidad de acuerdo con las normas del Instituto de Normas Clínicas y de Laboratorio.26-28 El P resistente al carbapenema. los aislados de aeruginosa se examinaron fenotípicamente para la producción de MBL mediante pruebas de sinergia de doble disco, como se describió anteriormente.29,30 Además, para evaluar la presencia de genes MBL en cepas de P. aeruginosa, se realizó una PCR múltiple, como se describió anteriormente.31 Las condiciones de ciclo fueron: 94 ° C durante 5 minutos, seguido de 30 ciclos de desnaturalización a 94°C durante 30 segundos, recocido a 53°C durante 45 segundos y extensión a 72°C durante 30 segundos, seguido de extensión final a 72°C a 10 minutos, todo en un MasterCycler personal (Eppendorf). La detección de genes de virulencia que codifican proteasa alcalina (aprA), elastasa A (lasA), elastasa (lasB) 32,fosfolipasa hemolítica C (plcH), fosfolipasa no hemolítica C (plcN), exotoxina A (toxA) y alginato (algD)33 se determinó mediante PCR uniplex, utilizando el siguiente protocolo: 94°C durante 3 minutos, 30 ciclos a 94°C durante 30 segundos, 55°C durante 1 minuto y 72 durante 1 minuto y 30s y 72°C durante 5 minutos.
Ensayo de adhesión inicial34
Para evaluar la adhesión inicial, se añadieron 200 µl de una suspensión celular que contenía 1×107 células/ml preparada en TSB a placas de poliestireno de 96 pocillos. Se permitió la adhesión inicial durante 2 horas a 37 ° C con rotación a 120 rpm. Las bacterias adheridas en placas de poliestireno de 96 pocillos se lavaron dos veces con una solución de NaCl al 0,9% y se recolectaron raspando los pocillos durante 90 s. La suspensión celular obtenida se plateó en TSA para el recuento de unidades formadoras de colonias (UFC). Todos los experimentos se realizaron por triplicado en tres experimentos independientes. Se utilizó la cepa ATCC15692 (PAO1) como control positivo y se utilizó TSB sin bacterias como control negativo.
Ensayo de formación de biopelículas 35
200µL de una suspensión celular que contiene 1×107 células/ml preparada en TSB se añadió a placas de poliestireno de 96 pocillos. Se permitió la formación de biopelículas durante 24 horas a 37 ° C con rotación a 120 rpm. Las bacterias cultivadas en placas de poliestireno de 96 pocillos se lavaron dos veces con una solución de NaCl al 0,9% y se dejaron secar en posición invertida. La biomasa total se midió mediante fijación de metanol (Merck), tinción de violeta cristalino (Merck) y elución acética ácida (Merck) como se describió anteriormente. El tinte eluido se retiró de cada pocillo y se colocó en una nueva placa de microtitulación de 96 pocillos, y su absorbancia se leyó en un lector de placas ELISA (BioTek Instruments Inc., Vermont, estados UNIDOS) en 570nm. Los experimentos se realizaron con ocho réplicas para cada cepa en tres experimentos independientes. Se utilizó TSB sin bacterias como control negativo. El valor de corte de densidad óptica (ODc) se estableció como tres desviaciones estándar (DE) por encima de la media de la densidad óptica (DO) del control negativo: ODc=DO promedio del control negativo+3x SD del control negativo. Para facilitar la interpretación de los resultados, las cepas se dividieron en las siguientes categorías según la densidad óptica: (ODi): ODi≤ODc u ODc
ODi2x ODc=productor de biopelículas no biológicas/productor de biopelículas débiles; 2x ODcODi4x ODc=productor de biopelículas moderadas; 4x ODcODi=productor de biopelículas fuertes.Concentración de células de biopelícula 36
La concentración de células de biopelícula se determinó mediante recuento de UFC. Después de la formación de biopelículas, las biopelículas se lavaron dos veces con una solución de NaCl al 0,9% y se cosecharon después de raspar los pocillos durante 90s. La suspensión celular obtenida se plateó en placas de TSA. Todos los experimentos se realizaron por triplicado, en tres ocasiones independientes.
Análisis estadístico
El análisis estadístico se realizó utilizando GraphPad Prism v. 5 (Software GraphPad, San Diego, CA). Los ensayos cuantitativos se compararon utilizando Kruskal-Wallis, aplicando la prueba de comparación múltiple de Dunn. Todas las pruebas se realizaron con un nivel de confianza del 95% y la significancia estadística se definió como p
0,05.Aprobación ética
El Comité de Ética en investigación de la Universidad Federal Uberlandia evaluó y aprobó el diseño de nuestro estudio.
Resultados
Del 1 de mayo de 2009 al 31 de diciembre de 2012, se realizó una vigilancia hospitalaria de la incidencia de bacteriemia por P. aeruginosa en el laboratorio de microbiología del Hospital Universitario. En este período, se incluyeron en el estudio 157 pacientes no repetitivos con bacteriemia por P. aeruginosa. La información detallada sobre los factores asociados al desarrollo de bacteriemia y las características clínicas y demográficas, así como la distribución de los pacientes por salas, se muestran en las Tablas 1 y 2. La bacteriemia primaria ocurrió en el 75,8% y la de foco desconocido en 62.4% de los casos. La bacteriemia secundaria representó el 24,2% de los pacientes, siendo el tracto respiratorio el principal foco de infección (17,2%). Además, el 43,9% de los pacientes tenían bacteremia con P. aeruginosa resistente al carbapenem, y la mayoría de estos pacientes fueron ingresados en la UCI. La mayoría de los pacientes eran del sexo masculino (66,8%), con una estancia hospitalaria media de 63,2±80,17 días y una edad media de 52,01±20,24 años.
Distribución de pacientes infectados con Pseudomonas aeruginosa en diferentes unidades del Hospital Clínico de la Universidad Federal de Uberlândia desde mayo / 2009 hasta diciembre / 2012.
| Clínicas | > Total | Carbapenem-resistentes Pseudomonas aeruginosa |
|---|---|---|
| N=157 (%) | N=69 (%) | |
| La cirugía | 35 (22.3) | 16 (23.2) |
| clínica Médica | 24 (15.3) | 10 (14.5) |
| Oncología | 14 (8.9) | 2 (2.9) |
| la sala de Emergencia | 9 (5.7) | 5 (7.3) |
| ICUa | 50 (31.9) | 31 (44.9) |
| UCI Neonatal | 2 (1.3) | 0 |
| la UCI Pediátrica | 2 (1.3) | 1 (1.5) |
| Trasplante | 2 (1.3) | 0 |
| Othersb | 3 (1.9) | 0 |
unidad de cuidados Intensivos.
Quemados, unidad de dolor torácico.
Factores de riesgo asociados a la resistencia al carbapenem en pacientes con bacteremia causada por Pseudomonas aeruginosa.
| los factores de Riesgo | > Total | resistentes a Carbapenem | Multisensitivea | Univariante | Multivariante | ||
|---|---|---|---|---|---|---|---|
| N=157 (%) | N=69 (%) | N=65 (%) | Orbe (CIc 95%) | ep | O (IC 95%) | p | |
| la Edad media (años) | 52.01±24.49 | 59.01±20.24 | 43.18±27.56 | – | 0.0009* | – | – |
| Macho/hembra | 105/52 (66.88/33.12) | 45 (65.22)/24 (34.78) | 43 (66.15)/22 (33.85) | 0.9593 (0.4698–1.959) | 0.9092 | – | – |
| el Tiempo de hospitalización, media (días) | 63.2±80.17 | 60.01±48.97 | 68.86±110.4 | – | 0.3477 | – | – |
| unidad de cuidados Intensivos | 74 (47.13) | 38 (55.07) | 22 (33.85) | 2.396 (1.190–4.822) | 0.0135 | – | – |
| la Cirugía | 69 (43.95) | 37 (53.62) | 20 (30.77) | 2.602 (1.281–5.282) | 0.0075* | – | – |
| procedimientos Invasivos (72h) | 139 (88.53) | 64 (92.75) | 54 (83.08) | 2.607 (0.8527–7.973) | 0.0843 | – | – |
| Mechanical ventilation | 89 (56.69) | 48 (69.56) | 28 (43.08) | 3.020 (1.485–6.144) | 0.002* | 3.0674 (1.22–7.73) | 0.0175 |
| Tracheostomy | 70 (44.58) | 43 (62.32) | 17 (26.15) | 4.670 (2.234–9.759) | * | – | – |
| Urinary catheter | 101 (64.33) | 52 (75.36) | 34 (52.31) | 2.789 (1.340–5.804) | 0.0054* | – | – |
| Venoso central catéter | 125 (79.62) | 59 (85.51) | 48 (73.85) | 2.090 (0.8761–4.984) | 0.0926 | – | – |
| drenaje Quirúrgico | 24 (15.29) | 14 (20.29) | 7 (10.77) | 2.109 (0.7918–5.618) | 0.1297 | – | – |
| Sondas enterales/gástrico nutrición | 109 (69.43) | 54 (78.26) | 40 (61.54) | 2.250 (1.053–4.810) | 0.0345* | 3.8347 (1.43–10.26) | 0.0074 |
| Hemodialysis | 39 (24.84) | 27 (39.13) | 8 (12.31) | 4.580 (1.892–11.09) | 0.0004* | ||
| Parenteral nutrition | 25 (1.92) | 14 (20.29) | 8 (12.31) | 1.814 (0.7052–4.664) | 0.2125 | – | – |
| Comorbilidad | 122 (77.70) | 53 (76.81) | 49 (75.38) | 1.082 (0.4886–2.394) | 0.8465 | – | – |
| la insuficiencia Cardíaca | 35 (22.29) | 21 (30.43) | 12 (18.46) | 1.932 (0.8597–4.343) | 0.1079 | – | – |
| el Cáncer | 32 (20.38) | 8 (11.59) | 17 (26.15) | 0.3703 (0.1473–0.9308) | 0.0306 | – | – |
| la Diabetes mellitus | 21 (13.37) | 9 (13.04) | 7 (10.75) | 1.243 (0.4341–3.558) | 0.6849 | – | – |
| la insuficiencia renal Crónica | 40 (25.48) | 21 (30.43) | 16 (24.61) | 1.340 (0.6249–2.873) | 0.4514 | – | – |
| virus de la inmunodeficiencia Humana | 10 (6.37) | 5 (7.25) | 3 (4.61) | 1.615 (0.3699–7.048) | 0.7191 | – | – |
| ASISescore≥4 | 81 (51.59) | 35 (50.72) | 33 (50.77) | 0.9982 (0.5068–1.966) | 0.9959 | – | – |
| Primary bacteremia | 119 (75.79) | 45 (65.22) | 57 (87.69) | 0.2632 (0.1080–0.6413) | 0.0023* | – | – |
| línea Central relacionada con el catéter | 21 (13.37) | 11 (15.94) | 7 (10.75) | 1.571 (0.5693–4.338) | 0.3802 | – | – |
| Desconocido | 98 (62.42) | 34 (49.27) | 50 (76.9) | 0.2914 (0.1383–0.6143) | 0.0009 | 0.2363 (0.08–0.73) | 0.0127 |
| Bacteriemia secundaria | 38 (24.20) | 24 (34.78) | 8 (12.31) | 3.800 (1.559–9.260) | 0.0023* | – | – |
| el tracto Respiratorio | 27 (17.19) | 17 (24.64) | 5 (7.69) | 3.923 (1.353–11.37) | 0.0081* | – | – |
| del tracto Urinario | 6 (3.82) | 4 (5.79) | 1 (1.54) | 3.938 (0.4282–36.22) | 0.3666 | – | – |
| Inadecuada de la terapia | 49 (31.21) | 32 (46.37) | 8 (12.31) | 6.162 (2.560–14.83) | * | 8.5534 (3.28–22.32) | |
| el uso Previo de antibióticos | 123 (78.34) | 59 (85.51) | 43 (66.15) | 3.019 (1.297–7.025) | 0.0086* | – | – |
| La mortalidad | 92 (58.59) | 48 (69.56) | 32 (49.23) | 2.357 (1.163–4.779) | 0.0165* | 2.3660 (1.15–4.85) | 0.0186 |
Multisensitive cepas fueron considerados como aquellos que presentan susceptibilidad a todos los antimicrobianos probados.
Odds ratio.
intervalo de Confianza.
p valor.
Promedio de severidad de la enfermedad puntuación.
Estadísticamente significativa (P≤0,05).
El uso previo de antibióticos (78,3%), procedimientos invasivos (88,5%), comorbilidades (77,7%) y cirugía previa (43,9%) fueron frecuentes. Se encontró que el 31,2% de los pacientes recibieron tratamiento inadecuado, y la tasa de mortalidad fue del 58,6%. Varios factores intrínsecos y extrínsecos para el desarrollo de bacteriemia por cepas de P. se detectaron aeruginosas resistentes a carbapenemas mediante análisis univariado. Sin embargo, solo la ventilación mecánica, las sondas enterales/nasogástricas, la bacteremia primaria con foco desconocido y el tratamiento inadecuado fueron factores de riesgo asociados de forma independiente con el desarrollo de bacteriemia P. aeruginosa resistente al carbapenem.
Se analizó la producción de MBL para 56 aislados de P. aeruginosa resistentes a carbapenem. Nueve aislados (25,0%) fueron fenotípicamente positivos y un total de 16,1% (n= 9/56) fueron consistentes con los genes MBL de los amplicones, siendo 10,71% blaSPM-1 y 5.3% de genes blaVIM En general, las cepas mostraron un perfil de resistencia a múltiples fármacos. Para otros genes de virulencia evaluados (aprA, plcH, plcN, lasA, lasB, toxA y algD), todas las cepas mostraron una alta frecuencia (88%).
De las 88 cepas de P. aeruginosa sensibles al carbapenem, 21 (23,9%) eran resistentes a otros β-lactámicos. Para 69 cepas resistentes a carbapenems, el perfil de resistencia fue alto: β-lactámico 50/69 (72,5%), fluoroquinolonas 48/69 (69,6%) y aminoglucósidos 50/69 (72,5%) (Tabla 3).
Antimicrobial resistance profiles in samples of Pseudomonas aeruginosa isolated from blood.
| Antimicrobial | Carbapenems | p (OR) | |
|---|---|---|---|
| Resistant group N=69 (%) |
Susceptible group N=88 (%) |
||
| Ceftazidime | 51 (73.9) | 10 (11.4) | |
| Cefepime | 45 (65.2) | 17 (19.3) | |
| Piperacillin/tazobactam | 37 (53.6) | 12 (13.6) | |
| Fluorquinolones (ciprofloxacin and levofloxacin) | 48 (69.6) | 17 (19.3) | |
| Aminoglicosides (amikacin and gentamicin) | 50 (72.5) | 12 (13.6) | |
Además de la investigación de MBL, se seleccionaron cinco cepas (dos que contenían SPM-1, una que contenía VIM y dos fenotípicamente positivas para MBL) para la evaluación de la formación de biopelículas utilizando ensayos cuantitativos de biomasa total mediante tinción con violeta de cristal. Considerando la presencia de genes MBL, todas las cepas fueron identificadas como fuertemente productoras de biopelículas con un promedio de 0,90±0,61 de biomasa. No se observaron diferencias en la adhesión inicial de las cepas individuales. Sin embargo, hubo una DO menor para la cepa que contenía el gen blaVIM (Fig. 1).
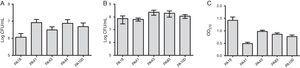
A) Número de células adheridas a una superficie de poliestireno después de 2 horas, expresado en log UFC / ml para 5 muestras de Pseudomonas aeruginosa aisladas de sangre. B) Número de células viables en la biopelícula (log UFC / ml). C) Biomasa de biopelícula expresada como densidad óptica de violeta cristal (OD570nm).
Discusión
La bacteriemia hospitalaria causada por microorganismos multirresistentes, ya sean Gram positivos o Gram negativos, a menudo se ha descrito como un problema de salud significativo que aumenta los costos hospitalarios y dificulta el establecimiento de una terapia antimicrobiana adecuada, lo que resulta en un peor pronóstico.37 La elevada proporción de bacteriemia hospitalaria causada por P. aeruginosa resistente a carbapenemos indica la importancia de este organismo como causa significativa de esta infección en nuestro hospital. La elevada proporción de bacteriemias hospitalarias causadas por P. aeruginosa resistente a carbapenemos indica la importancia de este organismo como causa significativa de esta infección en nuestro hospital. Los resultados de diferentes estudios han sugerido que factores de riesgo intrínsecos como la ventilación mecánica, el uso de una sonda nasogástrica y el uso previo de antibióticos aumentan el riesgo de desarrollo de bacteriemia causada por P. aeruginosa resistente a carbapenemos, así como el riesgo de morbilidad y mortalidad.38
En este estudio, más del 50% de los factores de riesgo se asociaron a la infección por este microorganismo de acuerdo con el análisis univariado. Sin embargo, solo la ventilación mecánica, las sondas de alimentación enteral/gástrica, la bacteriemia primaria de origen desconocido y el tratamiento inadecuado se consideraron factores de riesgo independientes mediante análisis multivariado.
Un catéter venoso central es uno de los factores de riesgo más significativos para bacteriemia adquirida en el hospital, ya que se asoció a más del 90% de esas infecciones.39 Aunque no fue un factor de riesgo significativo en este estudio, el 85,5% de los pacientes con bacteremia con P. aeruginosa resistente al carbapenem se sometieron a este procedimiento invasivo.
A menudo, la bacteremia causada por P. aeruginosa resistente a los antibióticos tiene una tasa de mortalidad más alta debido, en particular, a la administración de terapia antibiótica inadecuada.40 En este estudio, investigamos una cohorte de 157 pacientes con bacteremia causada por cepas de P. aeruginosa, de los cuales 69 fueron infectados por aislados de P. aeruginosa resistentes a carbapenem. La mortalidad total fue mayor en el grupo resistente a carbapenem; sin embargo, la presencia de cepas resistentes se asoció significativamente con una terapia antimicrobiana inadecuada, lo que demuestra que este grupo generalmente tiene un pronóstico más precario. De manera similar a nuestros hallazgos, estudios previos mostraron que P. aeruginosa aislada de pacientes que recibieron terapia inapropiada tenía un peor pronóstico, con tasas de 46,1% 41 y 53,8%.42
Además de estar asociado con infecciones graves, la resistencia a los carbapenems en P. aeruginosa a menudo resulta en la producción de MBL.43 Nuestros resultados mostraron que el P resistente al carbapenem. las aeruginosas prevalecieron en todo el hospital con genes que codifican estas enzimas en el 16,1% de las cepas, siendo el 10,7% del genotipo blaSPM-1 y el 5,4% del genotipo blaVIM. Dado que la frecuencia de las cepas multirresistentes era alta, estos resultados sugieren que coexisten otros mecanismos de resistencia en estas cepas, como las bombas de eflujo y la impermeabilidad de la membrana.44
La prevalencia de MBL como mecanismo de resistencia ha aumentado, particularmente en América Latina.45 En Brasil, la prevalencia de P productora de MBL. aeruginosa varía entre las diferentes regiones y entre los hospitales, con tasas que oscilan entre el 7,5% y el 44%.11
La enzima SPM-1 es considerada la más común en Brasil, seguida de la IMP-1,11,46 sin embargo, también ha habido un aumento en la frecuencia de aislados de P. aeruginosa que contienen la enzima VIM.45,47 En nuestro estudio, la enzima SPM-1 se detectó en el 16,7% de las muestras de MBL que producen fenotípicamente, seguida de la enzima VIM, que se detectó en el 8,3% de los casos. Estos resultados indican una diseminación significativa de genes codificadores MBL en nuestra región.
Considerando la presencia de MBL y producción de biopelículas, el 100% de las cepas fueron clasificadas como productoras fuertes. Otro estudio en Brasil encontró que el 40% de P. aeruginosa clasificado como fuerte productor de biopelículas también eran productores de MBL.35 Creemos que estos resultados son importantes una vez que estas características (producción de biopelículas y MBL) se superponen y las infecciones causadas por estas bacterias son difíciles de tratar. Esto se justifica, en parte, porque el crecimiento de bacterias en el biofilm es aproximadamente 64 veces más resistente a los antimicrobianos.48
P. aeruginosa tiene un gran número de factores de virulencia extracelular que también contribuyen a la patogenicidad y gravedad de estas infecciones, como la codificada por los genes aprA, plcH, plcN, lasA, lasB, toxA y algD.32,33 Nuestros datos mostraron que la presencia de un perfil multirresistente en la mayoría de las cepas (88%) fue positiva para los genes de virulencia aprA, plcH, plcN, lasA, lasB, toxA y algD, excepto en una cepa que no mostró los genes toxA y plcH, lo que puede contribuir aún más a un peor pronóstico asociado con infecciones graves.
Nuestros resultados confirman hallazgos previos sobre factores de riesgo para el desarrollo de bacteriemia resistente al carbapenem P. aeruginosa, así como la diseminación de cepas productoras de MBL del tipo SPM-1. Sin embargo, este estudio contribuye a una mayor evidencia de la propagación de cepas productoras de MBL, en particular del tipo VIM, en cepas altamente virulentas y productores de biopelículas fuertes.
Conflictos de intereses
Los autores declaran no tener conflictos de intereses.