La embolia pulmonar (EP) es una causa común de muerte cardiovascular, con una incidencia creciente.1-4 El insulto de un aumento agudo de la poscarga del ventrículo derecho (VD) secundario a obstrucción de trombo en las arterias pulmonares, vasoconstricción hipoxémica y liberación de vasoconstrictores de la arteria pulmonar puede llevar a disfunción y dilatación del VD y a una precarga disminuida del ventrículo izquierdo (VI), con el colapso cardiovascular resultante en los casos más graves.5 La anticoagulación es el pilar del tratamiento de todos los SLp con excelentes resultados en pacientes de bajo riesgo.6,7
Sin embargo, hay un subgrupo de pacientes con DP de riesgo intermedio alto y alto que pueden beneficiarse de una terapia más avanzada, que incluye fibrinólisis sistémica, terapia dirigida por catéter (CDT) con o sin infusión de fibrinolíticos o embolectomía pulmonar, ya que estas opciones reducen activamente la carga de trombo para disminuir la postcarga del VD. En aquellos pacientes que sobreviven a la presentación inicial, se pueden desarrollar secuelas a largo plazo que incluyen disfunción persistente del VD, hipertensión pulmonar tromboembólica crónica y disminución de la calidad de vida y la tolerancia al ejercicio.8,9
Se ha demostrado que la fibrinólisis sistémica disminuye rápidamente la carga de trombo y las presiones de las arterias pulmonares. Sin embargo, esto tiene el riesgo de una tasa de sangrado mayor que excede el 20 por ciento y la temida complicación de la hemorragia intracraneal (HIC) en el 3 por ciento.10,11 La preocupación por las complicaciones hemorrágicas ha llevado a la infrautilización de la fibrinólisis sistémica, con una alta proporción de pacientes que poseen una contraindicación absoluta o relativa.12 Dada la tasa de eventos adversos, la fibrinólisis sistémica se ha limitado generalmente a aquellos con mayor riesgo con evidencia de compromiso hemodinámico o shock cardiogénico. El CDT se ha utilizado cada vez más para ofrecer una mejora activa en la poscarga del VD más allá de la anticoagulación sola, pero con una dosis reducida o sin terapia fibrinolítica.
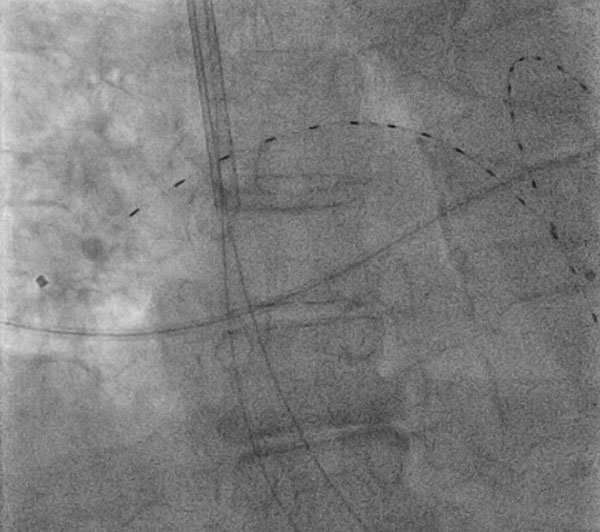 Figura 1: Fibrinólisis en Dosis Bajas dirigida por catéter, Facilitada por Ultrasonido
Figura 1: Fibrinólisis en Dosis Bajas dirigida por catéter, Facilitada por UltrasonidoUna mujer de 74 años de edad presentó embolia pulmonar proximal bilateral con taquicardia persistente y recibió fibrinólisis en dosis bajas dirigida por catéter, facilitada por ultrasonido, bajo guía fluoroscópica a través del acceso a la vena yugular interna derecha. El dispositivo en la foto es el Sistema endovascular ekosónico (EKOS, Bothell, WA) en las arterias pulmonares bilaterales.
Los TDC incluyen los que liberan agentes fibrinolíticos (p. ej., activador del plasminógeno tisular ) con o sin ayuda de ultrasonido, así como dispositivos que disminuyen la carga de coágulos mediante una variedad de métodos mecánicos sin agentes fibrinolíticos. El único dispositivo dirigido por catéter aprobado por la Administración de Alimentos y Medicamentos de los Estados Unidos para el manejo de la EP es el Sistema Endovascular Ekosónico (EKOS, Bothell, WA) (Figura 1). El 5.4 Los catéteres de infusión francesa se colocan directamente en las arterias pulmonares, generalmente a través del acceso a la vena yugular o femoral interna, y contienen un núcleo ultrasónico que libera ondas de ultrasonido, además de una serie de poros que liberan t-PA.
Los estudios in vitro han demostrado una mejor penetración y unión de la t-PA a la fibrina en presencia de ultrasonido.13 En un ensayo pequeño de 59 pacientes con TEP de riesgo intermedio aleatorizado a fibrinólisis en dosis bajas facilitadas por ultrasonido más anticoagulación vs. solo con anticoagulación, el grupo de intervención tuvo una mayor disminución de la relación de diámetro VD / VI y de las presiones sistólicas de la arteria pulmonar, y una mejoría más significativa de la función del VD a las 24 horas.14 A los 90 días de seguimiento, hubo una tendencia a una mayor reducción del tamaño del VD en el grupo de intervención (p = 0,07); sin embargo, no hubo diferencia en la presión arterial sistólica.
» El CDT se ha utilizado cada vez más para ofrecer una mejora activa en la poscarga del VD más allá de la anticoagulación sola, pero con una dosis reducida o sin terapia fibrinolítica.»
Un ensayo multicéntrico de un solo brazo más grande evaluó fibrinólisis en dosis bajas facilitadas por ultrasonido en 150 pacientes con TEP masiva o submasiva. Hubo una reducción significativa de la relación diámetro VD / VI, presión sistólica de la arteria pulmonar y carga de trombo a las 48 horas.15 Hubo un episodio de sangrado severo y 15 de sangrado moderado, sin hemorragia intracraneal. Los catéteres de infusión sin ultrasonido (por ejemplo, Cragg-McNamara, catéter de cola flexible) también ofrecen la administración de fibrinolítico en las arterias pulmonares con un costo significativamente menor en comparación con la fibrinólisis facilitada por ultrasonido. Aunque se limita a pequeños estudios retrospectivos, se ha evaluado la fibrinólisis dirigida por catéter con y sin ultrasonido y se muestran resultados similares.16,17 Estos hallazgos no se validaron en un ensayo aleatorizado controlado, aunque hay un ensayo en curso (NCT02758574).18
Un metanálisis evaluó 16 estudios de trombolisis dirigida por catéter y encontró una tasa de complicaciones mayores de 4,7 por ciento y una tasa de hemorragia intracraneal de 0,35 por ciento.19 Un análisis reciente de emparejamiento de propensión de los resultados hospitalarios utilizó la Base de Datos Nacional de Readmisiones para comparar el sistema con el sistema. fibrinólisis dirigida por catéter y mostró una menor mortalidad y hemorragia intrahospitalaria en pacientes que recibieron fibrinólisis dirigida por catéter.20 No se han realizado ensayos prospectivos aleatorizados que comparen la fibrinólisis sistémica con la dirigida por catéter.
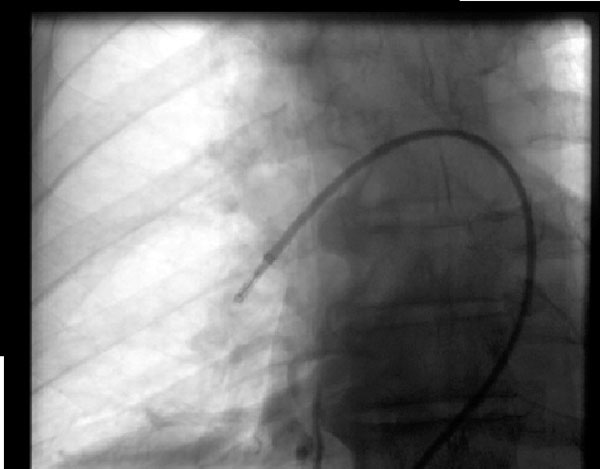 Figura 2: Trombectomía por aspiración
Figura 2: Trombectomía por aspiraciónUn varón de 68 años desarrolló una embolia pulmonar masiva un día después de la cirugía de columna vertebral y no era candidato para fibrinólisis, por lo que se sometió a trombectomía por aspiración bajo guía fluoroscópica con mejoría en su hemodinámica. El dispositivo en la foto es el sistema de embolectomía índigo (Penumbra, Alameda, CA) en la arteria pulmonar derecha.
Con frecuencia, los pacientes requieren terapia avanzada, pero tienen contraindicaciones incluso para dosis bajas de t-PA. En estos pacientes, la embolectomía pulmonar es una posible opción. Sin embargo, requiere una esternotomía y un bypass cardiopulmonar con altas dosis de heparina. La TCD mecánica ofrece una opción percutánea que no utiliza fibrinólisis. Hay varios TDC mecánicos, incluida la trombectomía mecánica por aspiración o succión (Figura 2), la maceración con un catéter de cola flexible y la trombectomía reolítica.
Hay varias limitaciones para cada sistema disponible, como la manipulación adecuada en las arterias pulmonares debido al tamaño del catéter, la pérdida de sangre durante la aspiración y la capacidad limitada para extirpar el trombo, particularmente si es más viejo y fibrótico. La terapia combinada mecánica y fibrinolítica puede desempeñar un papel para mejorar el aclaramiento de los trombo.21 Los datos para CDT mecánico se limitan a series de cajas pequeñas de un solo centro, aunque demuestran un éxito técnico razonable.22-25 CDT también ofrece una opción de tratamiento de rescate para pacientes con shock persistente a pesar de la fibrinólisis sistémica o pacientes que han sido colocados en oxigenación por membrana extracorpórea.26
«No hay estudios de alta calidad que comparen los diversos CDT entre sí o contra la trombólisis sistémica.»
No hay estudios de alta calidad que comparen los diversos CDT entre sí o contra la trombólisis sistémica. Dada la tasa actual de uso de CDT en la TEP de riesgo intermedio y los riesgos y costos potenciales de estas intervenciones, es necesaria la evaluación de los resultados a largo plazo, incluida la hipertensión pulmonar y la tolerancia al ejercicio, además de datos de resultados clínicos a corto plazo de mayor calidad.
En conclusión, la CDT es una opción de manejo prometedora para pacientes con TEP aguda y ofrece una terapia avanzada alternativa para pacientes que son candidatos pobres para trombolisis sistémica o embolectomía pulmonar. Sigue siendo un campo emocionante con un rápido desarrollo de nuevas terapias, pero requiere más investigación antes de su uso generalizado en la EP de riesgo intermedio.
Brett Carroll, MD, recientemente completó su Beca de Medicina Vascular en Brigham and Women’s Hospital y ahora es director de Medicina Vascular en Beth Israel Deaconess Medical Center, ambos en Boston, MA.
- Jiménez D, de Miguel-Diez J, Guijarro R, et al. J Am Coll Cardiol 2016; 67: 162-70.
- Huang W, Goldberg RJ, Anderson FA, et al. Am J Med 2014; 127: 829-39 e5.
- Cohen AT, Agnelli G, Anderson FA, et al. Thromb Haemost 2007; 98: 756-764.
- Mozaffarian D, Benjamin EJ, Go AS, et al. Circulación 2016; 133: e38-360.
- Piazza G, Goldhaber SZ. Circulation 2010; 122: 1124-9.
- Aujesky D, Obrosky S, Stone RA, et al. Am J Resp Crit Care Med 2005; 172: 1041-6.
- Kearon C, Akl EA, Ornelas J, et al. Chest 2016; 149: 315-52.
- Piazza G, Goldhaber SZ. N Eng J Med 2011; 364: 351-60.
- Sista AK, Miller LE, Kahn SR, Kline JA. Vasc Med 2017;22: 37-43.
- Goldhaber SZ, Haire WD, Feldstein ML, et al. Lancet 1993;341:507-11.
- Goldhaber SZ, Visani L, De Rosa M. Lancet 1999; 353: 1386-9.
- Stein PD, Mat F. Am J Med 2012; 125: 465-70.
- Siddiqi F, Odrljin TM, Fay PJ, et al. Blood 1998;91: 2019-25.
- Kucher N, Boekstegers P, Muller OJ, et al. Circulation 2014; 129: 479-86.
- Piazza G, Hohlfelder B, Jaff MR, et al. JACC Cardiovasc Interv 2015; 8: 1382-92.
- Liang NL, Avgerinos ED, Marone LK, et al. Cirugía endovascular Vasc 2016; 50: 405-10.
- Graif A, Grilli CJ, Kimbiris G, et al. J Vasc Interv Radiol 2017;28: 1339-47.
- Avgerinos ED, Mohapatra A, Rivera-Lebron B, et al. J Vasc Surg Venous Lymphat Disord 2018;6:126-32.
- Bloomer TL, El-Hayek GE, McDaniel MC, et al. Catheter Cardiovasc Interv 2017;89:754-60.
- Arora S, Panaich SS, Ainani N, et al. Am J Cardiol 2017;120:1653-61.
- Liu B, Liu M, Yan L, et al. J Int Med Res 2017;Jan 1; .
- Ciampi-Dopazo JJ, Romeu-Prieto JM, Sanchez-Casado M, et al. J Vasc Interv Radiol 2018;29:101-6.
- Tukaye DN, McDaniel M, Liberman H, et al. JACC Cardiovasc Interv 2017;10:94-5.
- Hubbard J, Saad WE, Sabri SS, et al. Trombosis 2011; 2011: 246410.
- Donaldson CW, Baker JN, Narayan RL, et al. Catéter Cardiovasc Interv 2015; 86: e81-7.
- George B, Parazino M, Omar HR, et al. Resucitación 2018; 122:1-5.
Temas Clínicos: Manejo Anticoagulante, Arritmias y EP Clínica, Cirugía Cardíaca, Dislipidemia, Insuficiencia Cardíaca y Cardiomiopatías, Angiografía e Intervención Cardiovascular Invasiva, Hipertensión Pulmonar y Tromboembolismo Venoso, Medicina Vascular, MSC/Arritmias Ventriculares, Fibrilación Auricular/Arritmias Supraventriculares, Cirugía Cardíaca y Arritmias, Cirugía Cardíaca e Insuficiencia Cardíaca, Metabolismo Lipídico, Estatinas, Insuficiencia Cardíaca Aguda, Hipertensión Pulmonar, Intervenciones y Medicina Vascular
Palabras clave: Publicaciones del ACC, Intervenciones Cardiológicas, Administración de Alimentos y Medicamentos de los Estados Unidos, Presión Arterial, Bypass Cardiopulmonar, Dilatación, Embolectomía, Tolerancia al Ejercicio, Oxigenación de Membrana Extracorpórea, Vena Femoral, Fibrina, Fibrinólisis, Agentes Fibrinolíticos, Estudios de Seguimiento, Heparina, Mortalidad Hospitalaria, Hipertensión Pulmonar, Índigo Carmín, Hemorragias Intracraneales, Venas Yugulares, Readmisión de Pacientes, Arteria Pulmonar, Embolia Pulmonar, Calidad de Vida, Estudios Retrospectivos, Shock Cardiogénico, Esternotomía, Succión, Taquicardia, Trombectomía, Terapia Trombolítica, Trombosis, Activador del Plasminógeno Tisular, Ondas de Choque de Alta Energía, Vasoconstricción, Agentes Vasoconstrictores
< Volver a la Lista de Productos