Todas las células tisulares dependen del metabolismo aeróbico para la generación de la energía (en forma de trifosfato de adenosina, ATP) necesaria para la supervivencia y la función. Este proceso mitocondrial fundamentalmente vital se caracteriza por el consumo de oxígeno y la producción de dióxido de carbono, que puede variar de alrededor de 200 ml/minuto en estado de reposo a más de cinco veces esta velocidad durante el ejercicio.
El destino final de este dióxido de carbono es la eliminación del cuerpo en el aire espirado, y una función importante de la sangre es el transporte de dióxido de carbono de las células tisulares a los pulmones.
La comprensión de este proceso de transporte depende de una apreciación de lo que se entiende por presión parcial de un gas, así como de algunas leyes físicas básicas que rigen la solubilidad y el movimiento (difusión) de los gases.
- ¿QUÉ ES LA PRESIÓN PARCIAL DE UN GAS?
- SOLUBILIDAD Y DIFUSIÓN DE GASES
- TRANSPORTE DE DIÓXIDO DE CARBONO DE LAS CÉLULAS TISULARES AL PULMÓN
- DIÓXIDO DE CARBONO Y PH SANGUÍNEO
- EN EL LABORATORIO – DEFINICIÓN DE PARÁMETROS DE CO2
- PRESIÓN PARCIAL DE DIÓXIDO DE CARBONO pCO2
- CONCENTRACIÓN DE BICARBONATO (HCO3-)
- CONCENTRACIÓN TOTAL DE DIÓXIDO DE CARBONO EN PLASMA (ctCO2)
- MÉTODOS QUÍMICOS PARA MEDIR ctCO2
- DISCORDANCIA ENTRE EL ctCO2 MEDIDO Y EL BICARBONATO CALCULADO
- RESUMEN
¿QUÉ ES LA PRESIÓN PARCIAL DE UN GAS?
La cantidad de gas en un sistema, incluidos los sistemas biológicos, se define por la presión que ejerce, medida tradicionalmente como la altura de una columna de mercurio (mmHg). Por lo tanto, al decir que la presión atmosférica es de 760 mmHg, queremos decir que los gases (oxígeno, nitrógeno y dióxido de carbono) en el aire que respiramos tienen una presión combinada suficiente para soportar una columna estándar de mercurio de 760 mm de altura.
Esta presión total es simplemente la suma de las presiones parciales de cada gas constituyente. Por lo tanto, dado que el aire comprende aproximadamente un 20% de oxígeno, un 79% de nitrógeno y un 0.03% de dióxido de carbono, la presión parcial de oxígeno (pO2) en el aire inspirado es aproximadamente (20 x 760) / 100 = 152 mmHg y la presión parcial de dióxido de carbono (pCO2) es (0,03 x 760) / 100 = 0,2 mmHg.
La unidad de presión systeme internationale (SI), utilizada en laboratorios clínicos fuera de América del Norte, es el kilopascal (kPa). El factor de conversión 0,133 se puede utilizar para convertir mmHg a kPa.
SOLUBILIDAD Y DIFUSIÓN DE GASES
La ley de Henry establece que en equilibrio la cantidad de gas disuelto en un líquido es proporcional a la presión parcial de ese gas, siempre que la temperatura sea constante:
Gas disuelto = presión parcial (p) x coeficiente de solubilidad (S)
Donde S es una constante dependiente de la temperatura para el gas en particular. El coeficiente de solubilidad del dióxido de carbono a temperatura corporal es de 0,23 mmol / L / kPa (o 0,03 mmol/mmHg) . Por lo tanto, ya que la pCO2 arterial es de aproximadamente 5.3 kPa (40 mmHg), la cantidad de CO2 disuelto en sangre arterial (dCO2) es (5,3 x 0,23) o 40 x 0,03) = 1,2 mmol/L.
El movimiento (difusión) de los gases está determinado en gran parte por gradientes de concentración. El gas se difunde de presión parcial alta a presión parcial baja .
TRANSPORTE DE DIÓXIDO DE CARBONO DE LAS CÉLULAS TISULARES AL PULMÓN
El viaje del dióxido de carbono (FIGURA 1a) comienza en la mitocondria de las células tisulares donde se produce. Debido al gradiente de concentración predominante, el dióxido de carbono se difunde desde las mitocondrias (donde la pCO2 es más alta) a través del citoplasma, fuera de la célula y dentro de la red capilar.
FIGURA 1a: CO2 en los tejidos
Clic para ampliar
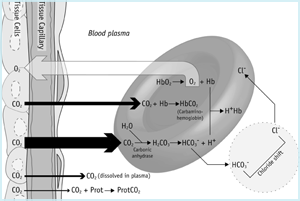
Un poco del CO2 que llega a la sangre de las células de los tejidos permanece físicamente disuelto en el plasma sanguíneo (véase más arriba) y una proporción aún menor se une a grupos terminales de proteínas plasmáticas NH2 (amino), formando los llamados compuestos de carbamino. La mayoría, sin embargo, se difunde por un gradiente de concentración en glóbulos rojos.
Un poco de esto permanece disuelto en el citoplasma de los glóbulos rojos y algunos se unen libremente a grupos terminales amino de hemoglobina reducida que forman carbamino-Hb. Sin embargo, la mayor parte del dióxido de carbono que llega a los glóbulos rojos es rápidamente hidratado a ácido carbónico por la isoforma de los glóbulos rojos de la enzima anhidrasa carbónica. A pH fisiológico, casi todo (≈96 %) de este ácido carbónico se disocia a iones de bicarbonato e hidrógeno:
Ecuación 1:
![]()
Los iones de hidrógeno son amortiguados por la hemoglobina reducida y la mayoría de los iones de bicarbonato pasan de los glóbulos rojos al plasma a cambio de iones cloruro (este llamado ‘desplazamiento de cloruro’ mantiene la neutralidad electroquímica). De lo anterior se desprende claramente que la mayor parte del dióxido de carbono se transporta en forma de bicarbonato (predominantemente en el plasma sanguíneo), pero hay en total cuatro modos de transporte de CO2 :
- 90 % se transporta en forma de bicarbonato en plasma (65%) y glóbulos rojos(25 %)
- 5 % se transporta físicamente disuelto en plasma y citoplasma de glóbulos rojos
- el 5% se transporta unido libremente a la hemoglobina en los glóbulos rojos y
El contenido total de dióxido de carbono en sangre es la suma de estos cuatro componentes.
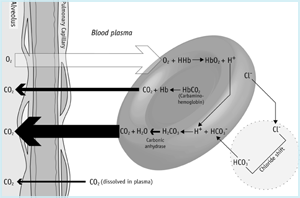
Dentro de la microvasculatura de los pulmones (FIGURA 1b), el gradiente de presión parcial a través de la membrana alveolar determina que el CO2 disuelto pasa de la sangre a los alvéolos. Esta pérdida de dióxido de carbono de la sangre favorece la reversión de las reacciones de los glóbulos rojos descritas anteriormente.
Por lo tanto, el bicarbonato pasa del plasma a los glóbulos rojos, amortiguando los iones de hidrógeno liberados de la hemoglobina, a medida que se oxigena. La reversión de la reacción de anhidrasa carbónica da lugar a la producción de CO2 que se difunde de los glóbulos rojos al plasma y en adelante a los alvéolos.
La sangre venosa mixta que llega a los pulmones tiene un contenido total de CO2 de aproximadamente 23,5 mmol/L (o 52 ml/dL), mientras que la sangre arterial que sale de los pulmones tiene un contenido total de CO2 de 21,5 mmol/L (48 ml/dL).
Esta diferencia arteriovenosa (2 mmol/L o 4 ml/dL) representa la cantidad de CO2 añadido a la sangre de las células tisulares y perdido de la sangre a medida que pasa a través de la microvasculatura pulmonar, para ser finalmente excretado del cuerpo en aire espirado.
FIGURA 1b: CO2 en los pulmones
Haga clic para ampliar
DIÓXIDO DE CARBONO Y PH SANGUÍNEO
El potencial ácido del CO2, debido a su reacción de hidratación al ácido carbónico (véase la ecuación 1 anterior), asegura que su concentración en sangre sea un determinante importante del pH sanguíneo. A medida que aumenta la concentración de CO2, también lo hace la concentración de iones de hidrógeno (H+). La regulación del CO2 en la sangre, que corresponde a la tasa de eliminación de CO2 en el aire espirado con la tasa de producción en las mitocondrias de células tisulares, esencial para mantener un pH sanguíneo normal, es el negocio del sistema respiratorio.
La tasa de respiración (controlada por quimiorreceptores sensibles a la pCO2 ubicados en el tronco encefálico y la arteria carótida) aumenta si la pCO2 aumenta y disminuye si la pCO2 disminuye. El aumento de la frecuencia respiratoria (respiraciones / min) resulta en un aumento de la tasa de eliminación de CO2 y una disminución de la frecuencia respiratoria promueve la retención de CO2.
La relación entre el pH y el dióxido de carbono se describe mediante una forma de la ecuación de Henderson-Hasselbach (ecuación 2). Esto se deriva de la aplicación de la ley de acción de masas a las reacciones de hidratación y disociación descritas en la ecuación 1 .
Ecuación 2:
![]()
donde
| pK/1 | = | ‘la aparente constante de disociación del ácido carbónico = 6.1 |
| = | concentración de bicarbonato plasmático (mmol / L) | |
| S | = | coeficiente de solubilidad del CO2 a 37 oC (0,23 si la pCO2 se mide en kPa o 0,03 si la pCO2 se mide en mmHg) |
| pCO2 | = | presión parcial de pCO2 (kPa o mmHg) |
Como se explicó anteriormente, el denominador en esta ecuación (S x pCO2) es la cantidad de dióxido de carbono disuelto (dCO2) mmol / L.
Al eliminar todas las constantes, la ecuación 2 se puede simplificar a:
Ecuación 3:
pH ∞ / pCO2
Por lo tanto, el pH de la sangre depende de la relación entre la concentración plasmática de bicarbonato (el componente metabólico) y la pCO2 (el componente respiratorio). Por lo tanto, si la pCO2 aumenta sin un aumento equivalente en el bicarbonato, el pH disminuye. Por el contrario, si la pCO2 cae sin una caída equivalente en bicarbonato, el pH aumenta.
La relación inversa se mantiene para la concentración de bicarbonato, a saber, aumento de HCO3– = aumento del pH; disminución del bicarbonato = disminución del pH.
El bicarbonato es el principal tampón sanguíneo y su concentración en un momento determinado refleja el equilibrio entre el producido a partir de CO2 y el consumido en iones de hidrógeno tampón (H+) (véase la ecuación 1).
EN EL LABORATORIO – DEFINICIÓN DE PARÁMETROS DE CO2
Los parámetros de CO2 generados por el analizador de gases sanguíneos son:
- Presión parcial de dióxido de carbono (pCO2) (kPa/mmHg)
- Concentración plasmática de bicarbonato (HCO3 -) (mmol/L)
- concentración plasmática total de dióxido de carbono (ctCO2) (mmol / L)
El último de ellos, el ctCO2, también se puede medir en plasma o suero por métodos químicos independientes del analizador de gases sanguíneos.
PRESIÓN PARCIAL DE DIÓXIDO DE CARBONO pCO2
Este parámetro es una medida de la presión ejercida por esa pequeña porción (≈ 5 %) de dióxido de carbono total en sangre que permanece en estado gaseoso, «disuelto» en la fase acuosa del citoplasma de plasma y células sanguíneas. La medición se realiza utilizando un electrodo de pH específico de CO2 incorporado en analizadores de gases sanguíneos.
En salud, la pCO2 de la sangre arterial se mantiene dentro del rango de 4,7-6,0 kPa (35-45 mmHg); la pCO2 de la sangre venosa es un poco más alta 5,6-6,8 kPa (41-51 mmHg).
CONCENTRACIÓN DE BICARBONATO (HCO3-)
Esta es la cantidad de bicarbonato en unidades de volumen de plasma. Como se señaló anteriormente, esta es la forma en la que se transporta la mayor parte del dióxido de carbono (90 %) en la sangre. Este parámetro no se puede medir, sino que se genera mediante cálculo durante el análisis de gases sanguíneos. El cálculo utilizado es un reordenamiento de la ecuación 2:
Ecuación 4:
log = pH + log (S x pCO2) – pK/1
y depende de tener valores de pH y pCO2, los cuales se miden durante el análisis de gases en sangre.
Teóricamente, el bicarbonato plasmático es la diferencia entre el CO2 total (ctCO2) y la suma de todas las demás formas de CO2 en plasma, es decir, CO2 disuelto (dCO2), CO2 unido a proteínas plasmáticas (carbamino CO2) y ácido carbónico (H2CO3).
:
Bicarbonato plasmático (mmol / L) =
ctCO2- (dCO2 + carbamino-CO2 + H2CO3)
En la práctica, debido a que el carbamino-CO2 y el H2CO3 son cuantitativamente insignificantes, se asume que el CO2 total es la suma de solo bicarbonato y CO2 disuelto . Por lo tanto, el bicarbonato en plasma es efectivamente la diferencia entre el CO2 total en plasma (ctCO2) y el CO2 disuelto en plasma (dCO2).
En salud, el bicarbonato plasmático arterial (calculado durante el análisis de gases sanguíneos) se mantiene dentro del rango de referencia aproximado: 22-28 mmol/L. El bicarbonato venoso es un poco más alto: 24-30 mmol/L.
En algunos laboratorios se hace una distinción entre el bicarbonato «real» (el parámetro descrito anteriormente) y el bicarbonato «estándar». El bicarbonato estándar es un segundo parámetro calculado y es la concentración plasmática de bicarbonato en sangre que se ha equilibrado con gas de tensión normal de pCO2 (40 mmHg, 5,3 kPa).
En salud, la concentración real de bicarbonato es la misma que la concentración estándar de bicarbonato porque en ambos casos la pCO2 es normal. Al normalizar la pCO2, el componente respiratorio del equilibrio ácido-base, el bicarbonato estándar es una medida únicamente del componente metabólico y, por lo tanto, se considera útil para dilucidar la causa de perturbaciones complejas en el equilibrio ácido-base.
CONCENTRACIÓN TOTAL DE DIÓXIDO DE CARBONO EN PLASMA (ctCO2)
Esta es teóricamente la suma de todas las formas de dióxido de carbono en plasma. No se mide durante el análisis de gas en sangre, sino – como el bicarbonato – se calcula, suponiendo que el dióxido de carbono total es la suma de bicarbonato y CO2 disuelto:
Dado que dCO2 mmol/L en plasma = (S x pCO2), el ctCO2 se calcula de esta manera :
ctCO2 plasmático (mmol / L) =
bicarbonato plasmático (mmol / L) + (S x pCO2) (mmol / L)
El CO2 disuelto (S x pCO2) contribuye aproximadamente 1.2 mmol / L al CO2 total en el plasma de la sangre arterial (ver arriba), de modo que el ctCO2 es alrededor de 1,2 mmol más alto que el bicarbonato plasmático. Por lo tanto, el rango de referencia de ctCO2 es de aproximadamente 23-29 mmol/L para sangre arterial.
Se observará que así como el valor calculado de bicarbonato generado durante el análisis de gas en sangre depende de la relación descrita en la ecuación 2, también lo hace el valor calculado para ctCO2 generado durante el análisis de gas en sangre.
Aunque el ctCO2 y el bicarbonato proporcionan información clínica equivalente, en la práctica clínica es invariablemente el bicarbonato en lugar del ctCO2 el que se usa junto con el pH y la pCO2 para evaluar el estado ácido-base. Por lo tanto, el valor clínico del ctCO2 calculado generado durante el análisis de gases en sangre es limitado.
MÉTODOS QUÍMICOS PARA MEDIR ctCO2
A diferencia del bicarbonato, que no se puede medir, el ctCO2 puede y el ensayo es comúnmente un componente del perfil de urea y electrolito (U&E) del plasma venoso/suero. Dado que U& E se ordena con mucha más frecuencia que los gases sanguíneos arteriales, el ctCO2 medido puede ser la primera indicación de alteración en la homeostasis de dióxido de carbono (y, por lo tanto, ácido-base).
Es una práctica común para algunos laboratorios clínicos referirse a este componente medido del perfil U&E como «bicarbonato plasmático». Esto es erróneo porque los métodos químicos miden todo el CO2 liberado del plasma (o suero) mediante la adición de ácido fuerte o, alternativamente, todo el bicarbonato producido como resultado de la adición de un álcali fuerte al plasma .
Por lo tanto, incluye no solo bicarbonato, sino también CO2 disuelto y ácido carbónico. Si el plasma o el suero utilizados en estos ensayos se derivaran de sangre arterial, entonces el ctCO2 medido se aproximaría teóricamente al valor de ctCO2 calculado generado durante el análisis de gasometría arterial.
De hecho, los perfiles U&E se realizan exclusivamente en plasma o suero recuperado de sangre venosa, de modo que existe una pequeña diferencia teórica inevitable de 1-2 mmol/L (ctCO2 medido > ctCO2 calculado) debido a la diferencia arteriovenosa.
La diferencia teórica entre el ctCO2 medido y el bicarbonato plasmático calculado es un poco mayor (ctCO2 medido > bicarbonato plasmático calculado) porque, además de la diferencia arteriovenosa de 1-2 mmol/L, hay una diferencia adicional de 1,5 mmol/L debido a la inclusión de CO2 disuelto y ácido carbónico en el ctCO2 medido.
Sin embargo, esta diferencia presupone que no se pierde dióxido de carbono disuelto en la atmósfera antes del análisis. Este podría no ser el caso porque las muestras de U&E no se manejan anaeróbicamente.
Algunos han argumentado que el término ‘bicarbonato sérico/plasmático’ para el ctCO2 medido se justifica con el argumento de que la práctica normal de laboratorio está asociada con una pérdida inevitable de CO2 disuelto de la muestra U& E antes del análisis, en cuyo caso el ctCO2 medido, al menos teóricamente, se aproximaría al bicarbonato calculado.
DISCORDANCIA ENTRE EL ctCO2 MEDIDO Y EL BICARBONATO CALCULADO
A pesar de las ligeras diferencias teóricas entre los valores medidos y calculados descritos anteriormente, existe una aceptación general de la noción de que el ctCO2 medido generado como parte de un perfil U&E es, a todos los efectos clínicos prácticos, el mismo que la concentración de bicarbonato en plasma calculada durante el análisis de gases en sangre.
Esto se refleja en el uso del término «bicarbonato plasmático» para describir el ctCO2 medido.
La mejor evidencia hasta la fecha de que los resultados medidos y calculados de bicarbonato pueden en la práctica ser clínicamente intercambiables se encuentra en un informe muy reciente de la Clínica Mayo. Los autores de este informe recuperaron 17.621 registros de concentración de bicarbonato medida y calculada para muestras colectadas simultáneamente de los mismos pacientes durante 2006/7. La concentración de bicarbonato de esta enorme base de datos varió de 5 a 49 mmol/L.
La diferencia media (DE) entre los valores medidos y calculados fue de -0,36 (1,23 mmol / L) y de 98.el 5% de los resultados de las muestras apareadas se encontraban a menos de 3 mmol/L uno del otro. Aunque, como sugiere el informe de Mayo, generalmente hay un acuerdo aceptable entre los dos parámetros, no es raro que los resultados sean totalmente discordantes, ya que el ctCO2 medido difiere del bicarbonato calculado en hasta 15 mmol/L .
Numerosos estudios en los últimos cuarenta años han tratado de establecer la frecuencia, magnitud y causa de la discrepancia entre el bicarbonato calculado y el ctCO2 medido.
Un enfoque temprano de este trabajo cuestionó la confiabilidad del cálculo del bicarbonato, que depende crucialmente de la constancia de pK/1 (ver ecuación 4). De hecho, esta no es una constante termodinámica verdadera, sino una constante de disociación «aparente» determinada experimentalmente a partir de la medición del pH, pCO2 y CO2 disuelto utilizando la siguiente relación derivada de la ecuación de Henderson-Hasselbach:
pK / 1 = pH + log dCO2-log
Varios estudios revelaron suficiente variabilidad en la pK / 1, particularmente entre los enfermos críticos, para un error clínicamente significativo en el bicarbonato calculado. Por ejemplo, en un estudio se encontró que la farmacocinética/1 oscilaba entre 5,84 y 6,29.
Los autores calculan que desviaciones de pK / 1 6,1 de esta magnitud resultarían en errores en el bicarbonato calculado del orden ± 60 %. Otro describe el caso de un niño diabético en cetoacidosis cuya fC/1 varió de 5,49 a 6,02 en un período de siete horas.
En un estudio de 79 bebés atendidos en una unidad de cuidados intensivos pediátricos , se encontró que el 25% tenía pK/1 fuera del rango «normal» 6,055-6,195 definido por el estudio, y en tres casos la pK/1 fue > 6,3, con un valor «asombroso» de 7,11. Estos y otros informes de variabilidad clínicamente significativa en la farmacocinética/1 han sido discutidos y la fiabilidad o no del bicarbonato calculado sigue siendo una cuestión controvertida y sin resolver.
La base teórica para la opinión de que el bicarbonato calculado no es fiable en enfermedades críticas ha sido establecida por Flear . Un enfoque igualmente teórico acompañado de una gran cantidad de evidencia experimental ha sido desplegado por Mass et al para hacer el caso opuesto en defensa del bicarbonato calculado.
Los autores de estudios que no han demostrado una variabilidad clínicamente significativa en la farmacocinética/1 sugieren que la mayor discordancia entre el bicarbonato calculado y el ctCO2 medido, observada ocasionalmente en la práctica clínica, es probablemente el resultado de una combinación de variables preanalíticas, diferencia analítica y error analítico aleatorio .
La medición de ctCO2 es particularmente propensa a la variabilidad preanalítica porque la sangre para el perfilado de U&E se recoge y procesa de forma aeróbica de forma universal. Las muestras se pueden dejar sin tapar durante horas antes del análisis. Dado que el aire ambiente contiene menos CO2 que la sangre, existe una tendencia a la pérdida de CO2 disuelto de la muestra. Se ha estimado que esto reduce el CO2 medido a razón de 6 mmol / hora.
Por el contrario, el bicarbonato calculado no se asocia con el mismo riesgo de variación preanalítica porque los análisis de sangre para gases sanguíneos se muestrean de forma rutinaria anaeróbica y hay un retraso mínimo (casi invariablemente
Otra causa que contribuye a la discordancia entre los valores medidos y calculados podría ser la diferencia de la muestra, ya que la sangre arterial se utiliza para calcular un valor y las muestras de suero o plasma se utilizan para medir un valor.
Cualquiera que sea la causa, los estudios continúan demostrando discordancia moderada pero clínicamente significativa entre los dos parámetros entre los enfermos críticos . Sin embargo, como para confirmar la naturaleza polémica del debate, el estudio más reciente de pacientes críticamente enfermos proporciona evidencia de acuerdo aceptable entre el bicarbonato calculado y el ctCO2 medido .
A pesar de este último estudio, existe una opinión de que, al menos para los pacientes críticamente enfermos , podría ser prudente abandonar el bicarbonato calculado en favor del ctCO2 medido, aunque se debe enfatizar que este punto de vista es controvertido y podría ser que el impacto clínico de las diferencias es limitado.
Lamentablemente, la evidencia de acuerdo aceptable proporcionada por el estudio muy amplio de Mayo Clinic no se puede utilizar en el debate particular que se centra en los enfermos críticos, porque la población de pacientes no estaba definida.
De los dos parámetros, el bicarbonato calculado tiene la ventaja distintiva de conveniencia sobre el ctCO2 medido porque permite que los tres parámetros (pH pCO2 y bicarbonato) utilizados en la evaluación de ácido-base estén disponibles al mismo tiempo a partir de una sola muestra.
No hay consenso en la literatura sobre muchos de los temas discutidos anteriormente. Por lo tanto, aún no está claro si hay o no discordancia entre el CO2 medido y el calculado, aunque el balance de la evidencia recientemente se ha desplazado a favor de la ausencia de discordancia en el gran estudio de Mayo Clinic .
Para aquellos que creen que el balance de la evidencia sugiere que hay discordancia, hay dos cuestiones aún sin resolver.
Estos son: el significado clínico de esa discordancia y la causa de esa discordancia. El debate sobre la causa de la discordancia se ha centrado principalmente en si la pKl1 varía significativamente entre los pacientes y en qué medida las diferencias preanalíticas, las diferencias analíticas y el error aleatorio contribuyen a la discordancia.
Finalmente, al menos un comentarista ha cuestionado la necesidad clínica de bicarbonato calculado o ctCO2 medido, sugiriendo que el pH y la pCO2 por sí solos permiten una evaluación completa de las alteraciones ácido-base.
RESUMEN
El dióxido de carbono es un producto del metabolismo celular aeróbico que se transporta en sangre a los pulmones para su excreción en el aire espirado. Un poco se transporta sin cambios disuelto en la sangre, pero la mayoría se transporta en forma de bicarbonato.
La regulación de la cantidad de dióxido de carbono en la sangre, o más precisamente la regulación de la proporción de bicarbonato a la concentración de dióxido de carbono disuelto, es esencial para el mantenimiento del pH sanguíneo (equilibrio ácido-base normal).
La investigación clínica de la alteración ácido-base incluye el análisis de gasometría arterial, una prueba que genera tres parámetros del estado del dióxido de carbono. De estos, solo uno, pCO2, se mide realmente; los otros dos, bicarbonato plasmático y concentración total de dióxido de carbono, se obtienen mediante cálculos a partir del pH y pCO2 medidos.
La validez de estos cálculos ha sido cuestionada y la evidencia es contradictoria que en algunos grupos de pacientes podría ser clínicamente más fiable para medir el dióxido de carbono total por métodos químicos, que se basan en los valores calculados.
Este último sigue siendo un tema muy polémico que solo puede resolverse finalmente mediante un estudio más a fondo.