Introducción
Helicobacter pylori (H. pylori) es una bacteria microaerofílica Gram negativa, cuyo hábitat natural es el estómago. Aunque por lo general tiene una forma bacilar con varios flagelos en un extremo, adopta una apariencia cocoide en condiciones ambientales desfavorables.1,2
H. el pylori es un factor etiológico importante en la gastritis crónica activa, la úlcera péptica, el linfoma de tejido linfoide asociado a la mucosa gástrica (MALT) y el cáncer gástrico. Aunque se estima que la bacteria está presente en la mucosa gástrica de la mitad de la población mundial, estas enfermedades solo se desarrollan en aproximadamente el 15-20% de los individuos colonizados.2,3
Los regímenes de tratamiento más comunes han dado lugar a una tasa de erradicación de alrededor del 85% en muchas áreas geográficas4-6,pero la eficacia se ha visto comprometida, especialmente en los últimos años, por la rápida aparición de cepas resistentes a los antibióticos y la escasa adherencia al tratamiento.5,7
Es importante considerar que la cura (así como la prevención de complicaciones) para la gastritis crónica activa y la úlcera péptica y para algunas formas de linfoma MALT gástrico de bajo grado depende del éxito de la erradicación de H. pylori. Además, asegurar y mantener la erradicación exitosa de este microorganismo en todas sus formas biológicas evitaría la recrudescencia de la infección y, por lo tanto, las recaídas de la enfermedad.
El objetivo de esta revisión es presentar una visión general de la forma cocoide de H. pylori, destacando su perfil microbiológico, susceptibilidad a los antibióticos y virulencia. También se analizará su participación en la enfermedad gástrica y se examinará el grado en que se asocia con la recrudescencia de la infección y la recaída de la enfermedad.
Supervivencia y adaptación celular de H.
Todos los organismos vivos están equipados con mecanismos que les permiten sobrevivir en entornos adversos. Para algunos, su respuesta implica (además de adaptaciones metabólicas) cambios en la morfología celular.8,9 Varios microorganismos tienen la capacidad de diferenciarse en un estado viable pero no cultivable (VBNC) en respuesta a condiciones ambientales que son desfavorables para la supervivencia y el crecimiento. Esta estrategia es ampliamente utilizada por microorganismos como Salmonella, Campylobacter y Escherichia.10,11
En el estado VBNC, las bacterias generalmente disminuyen su tamaño y cambian de forma para convertirse en pequeños cuerpos esféricos. Reducen la frecuencia respiratoria y el transporte de nutrientes, y cambian la expresión génica y la síntesis molecular. En este estado no se pueden detectar utilizando técnicas de cultivo convencionales. Sin embargo, los cambios en las condiciones ambientales pueden llevar a estos microorganismos a «revivir» (y reconvertirse a su estado activo) o degenerar.10-13
Del mismo modo, H. pylori, cuando experimenta condiciones ambientales dañinas (dentro o fuera de su hábitat natural), cambia su forma bacilar clásica y entra en un estado VBNC que conduce a cambios morfológicos y metabólicos, así como modificaciones en el comportamiento de crecimiento.14,15
Estado viable pero no cultivable de H. pylori
Aunque algunos autores intentaron inicialmente demostrar que la conversión de la forma bacilar a cocoide fue un proceso pasivo que resultó en muerte celular y, por lo tanto, que las formas cocoides eran los restos degenerados de bacterias muertas,16,17 tres formas de H. los pylori se consideran actualmente existentes, a saber (en orden de más a menos virulentos), la forma bacilar viable y culturable, la forma cocoidea VBNC y la forma degenerativa inviable.18-20
Morfológicamente, la conversión de la forma bacilar a la cocoide se produce a través de formas intermedias en V y u13, 14 (Figs. 1 y 2), en las que estructuras celulares como el citoplasma y la membrana celular permanecen intactas,15, 21 mientras que los flagelos tienden a envolver la estructura celular cocoide, volviéndose casi invisibles. Otras modificaciones ultraestructurales de la forma cocoidea dan como resultado dos subtipos. El tipo A tiene bordes irregulares con una superficie rugosa y se considera una célula muerta, mientras que el tipo B tiene una superficie más lisa, es más pequeño y se considera una célula viva.21,22
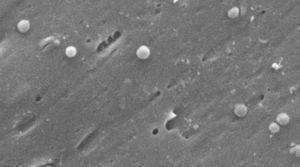
Imágenes de la forma cocoidea de Helicobacter pylori. Microscopio electrónico de barrido imagen cortesía del Dr. Nuno F. Azevedo. LEPABE – Departamento de Ingeniería Química de la Facultad de Ingeniería de la Universidad de Oporto (Portugal).
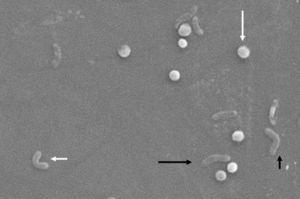
Cambios morfológicos en Helicobacter pylori. Forma espiral (flecha negra larga), forma V (flecha negra corta), forma U (flecha blanca corta) y forma cocoide (flecha blanca larga). Microscopio electrónico de barrido imagen cortesía del Dr. Nuno F. Azevedo. LEPABE – Departamento de Ingeniería Química de la Facultad de Ingeniería de la Universidad de Oporto (Portugal).
En análisis con microscopio electrónico de barrido (SEM) de la capa de gel mucoso superficial de pacientes con cáncer gástrico infectados con H. pylori, Ogata et al.23 observaron la coexistencia de formas bacilares y cocoides. Otros autores han confirmado la presencia de la forma cocoidea tanto en el estómago humano como en el duodeno 24-26, aunque parece que el porcentaje de formas cocoideas es mayor en el duodeno que en el estómago, hasta el punto de que solo se observa la forma cocoidea en algunas biopsias duodenales.26,27 Este hecho sugiere que H. pylori se ve obligado a adaptarse a las condiciones biológicas en el duodeno o que estas condiciones son ideales para que H. pylori se refugie allí en el estado VBNC.
Los experimentos in vitro e in vivo han demostrado que, en condiciones desfavorables como aerobiosis,28,29 pH alcalino,29,30 alta temperatura,31 largos períodos de incubación,29,32 incubación prolongada en agua33 o tratamiento con inhibidores de bomba de protón32 o antibióticos,34 el fenotipo cocoide puede mantener un cierto nivel de actividad metabólica, ya que expresa una amplia variedad de genes presentes en la forma bacilar35,mantiene niveles detectables de actividad ureasa,36 continúa sintetizando proteínas, aunque en cantidades menores (menos del 1% de la cantidad de proteínas sintetizadas por el forma bacilar) 37 y produce pequeñas cantidades de ADN, mantenidas incluso después de 3 meses de almacenamiento en solución salina fisiológica a 4°C. 29,38 Todos estos datos subrayan el hecho de que los cambios biológicos en H. pylori en respuesta a estímulos dañinos reflejan su poderosa capacidad, durante su vida útil, para preservar la especie.
Formación de biopelículas
Al igual que con otras bacterias, la capacidad de H. pylori para persistir como entidad infecciosa y resistir el arsenal de agentes antimicrobianos destinados a erradicarla se debe a la variabilidad genética que le permite desarrollar resistencia bacteriana. Su estrategia de supervivencia se mejora aún más cuando las células bacterianas forman lo que se llaman biopelículas.20 Las biopelículas son una especie de «comunidad» microbiana en la que las bacterias se adhieren firmemente a superficies bióticas o abióticas mediante una matriz de producción propia. Esta matriz, compuesta por sustancias poliméricas extracelulares39, 40, crea un ambiente muy tolerante a los agentes antimicrobianos y fuertemente resistente a la fagocitosis. Por lo tanto, se evaden diversos mecanismos de defensa de los huéspedes, lo que dificulta la erradicación. Las biopelículas se consideran sistemas dinámicos y verdaderamente complejos que facilitan la transferencia horizontal de genes entre bacterias. Por lo tanto, confieren a las poblaciones bacterianas nuevos genomas modificados que contribuyen significativamente a la resistencia bacteriana, la variabilidad de las cepas y la adaptabilidad.41-43
En un estudio de 21 biopsias de pacientes en los que la bacteria había sido erradicada previamente, se aisló H. pylori por cultivo en 7 de las biopsias, mientras que las técnicas de expresión génica detectaron células viables de H. pylori en la mayoría de las biopsias. SEM, por su parte, mostró bacterias cocoides agrupadas dispuestas en un biofilm microbiano, lo que sugiere que las formas cocoides podrían facilitar la persistencia bacteriana y la resistencia a los antibióticos.44
Susceptibilidad a los antibióticos en forma de cocoides
Muchos estudios han demostrado que H. pylori puede cambiar de la forma bacilar a la forma de cocoides al exponerse (in vitro) a diversos agentes antimicrobianos. Diferentes concentraciones de amoxicilina, claritromicina, metronidazol y eritromicina (por mencionar solo algunos de los antibióticos disponibles) pueden inducir esta transformación morfológica.34,35,45 El mayor efecto de inducción se ha observado con la amoxicilina 27,34, 46, que se sabe que es altamente efectiva in vitro contra H. pylori; sin embargo, las observaciones morfológicas de los cultivos muestran que las formas bacilares disminuyen en número a favor de las formas cocoides.34,46 Faghri y otros, 47 logró efectos bactericidas para las formas cocoides, a más del 60% con metronidazol al doble de la concentración mínima inhibitoria (CMI), y al 80-90% con claritromicina en la CMI; sin embargo, el tratamiento con amoxicilina con CMI y CMI× 2 no inhibió las formas cocoides viables. De manera similar, Berry et al.34 observaron que mientras la amoxicilina en la CMI× 10 eliminaba las formas bacilares de H. pylori, también indujo la formación de formas cocoides. Perkins et al.48 observaron, en un estudio de gatos infectados naturalmente con H. pylori, que 6 semanas después del tratamiento de erradicación, los jugos gástricos fueron positivos para H. pylori en un solo gato, pero el análisis de reacción en cadena de la polimerasa (PCR) identificó material genético de H. pylori en todos los gatos del estudio. Aunque H. se detectó pylori en un solo gato, las lesiones histológicas fueron compatibles con gastritis crónica y se caracterizaron por la presencia de folículos linfoides.
Teniendo en cuenta estos datos microbiológicos y de investigación básica, en un estudio previo realizado en pacientes infectados con H. pylori, en el que se determinó previamente la sensibilidad de las cepas aisladas a la amoxicilina, la terapia dual (inhibidores de la bomba de protones y amoxicilina) obtuvo una tasa de curación para las cepas sensibles a la amoxicilina de solo 66%. Este resultado demuestra la presencia de importantes factores de resistencia bacteriana independientes adicionales relacionados con el uso exitoso de este antibiótico.49 Esto es especialmente cierto si consideramos que parece imposible que las formas cocoides puedan ser sensibles a los antibióticos β-lactámicos, porque las formas cocoides tienen perfiles de proteínas de unión a penicilina diferentes de las formas bacilares.50 Por lo tanto, es probable que no todos los organismos de H. pylori se eliminen por completo después del tratamiento de erradicación; más bien, es probable que algunos se conviertan en formas cocoides y, por lo tanto, se vuelvan resistentes a los medicamentos antibacterianos. Esto explicaría el fracaso del tratamiento y la recrudescencia.13,34,45
Cabe destacar que algunos estudios muy recientes han demostrado que los ácidos grasos libres, como el ácido linolénico y el ácido linolénico liposomal, tienen un efecto bactericida en ambas formas de H. pylori, independientemente de su resistencia a los antibióticos.51,52 Por lo tanto, estas moléculas podrían tener un efecto antimicrobiano potencialmente efectivo en el tratamiento de la infección por H. pylori, especialmente en su forma cocoide.
Virulencia y patogenicidad de la forma cocoidea
Los factores de virulencia de la forma bacilar de H. pylori y los mecanismos por los cuales esta bacteria está involucrada en el desarrollo de enfermedades gastrointestinales han sido ampliamente estudiados.1,3,4 Sin embargo, se sabe poco sobre la virulencia y patogenicidad de la forma cocoide. A continuación revisamos los hallazgos más relevantes sobre este tema.
Al igual que la forma bacilar, la forma cocoide expresa genes de virulencia principales, como la ureA, ureB, AAP, vacA y cagA, cagE y BabA.35,53,54 Esta expresión, que ocurre durante un período prolongado, probablemente juega un papel importante en los trastornos estomacales crónicos graves.
Adherencia de H. se sabe que el pylori al epitelio gastroduodenal es un paso importante en la inducción de la inflamación crónica activa de la capa mucosa. Los estudios SEM han encontrado que la forma cocoide de H. pylori puede presentarse en la superficie de la membrana plasmática de las células epiteliales gástricas y, al igual que la forma bacilar, tiene la capacidad de invadir estas células.15,55 Si se produce invasión celular, las formas cocoides están encerradas en vesículas de membrana de doble capa y las células epiteliales gástricas aparecen hinchadas y líticas, mostrando erosión de la capa mucosa.56 Dado que la forma cocoide es menos susceptible a los antibióticos, se cree que estas formas de membrana plasmática latente pueden propagarse e infectar a otras células epiteliales vecinas en ausencia de una concentración efectiva de antibióticos.57
También se sabe que la infección por H. pylori induce una respuesta inmune local que no logra erradicar la bacteria, lo que permite que la enfermedad gástrica se vuelva crónica. La respuesta inmunitaria se puede determinar mediante la detección de anticuerpos utilizando métodos serológicos desarrollados utilizando la forma bacilar de H. pylori.58 De hecho, la presencia de estos anticuerpos específicos puede utilizarse como indicador epidemiológico de infección y para confirmar el éxito del tratamiento. Sin embargo, no existen métodos serológicos que detecten formas cocoides. Con el fin de determinar si las formas cocoides tuvieron algún efecto en la respuesta inmune en individuos colonizados, Figueroa et al.59 ideó una técnica específica de ensayo de inmunoabsorción enzimática (ELISA) para evaluar y comparar la respuesta inmunitaria a las formas cocoides y bacilares con un panel de sueros de individuos infectados sintomáticos y asintomáticos. Las formas cocoides de H. se demostró que pylori induce una respuesta inmune humoral similar a la inducida por las formas bacilares en individuos infectados. En otro estudio realizado en niños con dolor epigástrico, se examinó el posible papel de la forma cocoidea en la infección por H. pylori utilizando una técnica de ELISA y antígenos preparados a partir de formas de células bacilares y cocoides. Se encontró que 13,3% y 55,8% de las células eran seropositivas para antígenos de la forma bacilar y de la forma cocoide, respectivamente, mientras que los valores de seropositividad para niños asmáticos fueron de solo 7,0% y 26,5%, respectivamente. Esta diferencia de aproximadamente cuatro veces en la seropositividad entre los antígenos de forma cocoidea y bacilar en pacientes sintomáticos y asintomáticos podría sugerir un posible papel infeccioso de la forma cocoidea de H. pylori.60
Cellini et al.61 suspensiones concentradas inoculadas intragástricamente de H. pylori en forma de cocoides en un modelo de ratón BALB / c. H. pylori fue aislado 2 semanas después, los cambios histopatológicos ocurrieron 1 mes después y todos los ratones colonizados mostraron una respuesta sistémica de anticuerpos a H. pylori. En otros experimentos con ratones BALB/c, los animales inoculados con formas cocoides desarrollaron cambios patológicos significativos en el estómago, incluidas lesiones erosivas e infiltración de células inflamatorias de la mucosa gástrica.36 She et al., 53 para comparar virulencia e infectividad, ratones BALB/c inoculados intragástricamente con H. pylori, un grupo con la forma bacilar y un segundo grupo con la forma cocoide. En el examen SEM de muestras de los 2 grupos, se observó adherencia de las formas bacilar y cocoides a las células epiteliales de la pared gástrica y la presencia de flagelos en las formas cocoides. El examen histológico mostró diferentes grados de lesiones en la mucosa gástrica, desde infiltración leve de células inflamatorias hasta erosiones y úlceras. La lesión de la mucosa fue más leve en los ratones infectados por la forma cocoide, mientras que no se obtuvo un resultado positivo en el grupo control que recibió agua estéril.53 Rabelo-Gonçalves et al.62 mostró que las formas cocoides de H. pylori indujo una respuesta inflamatoria aguda en el estómago de ratones desde las primeras etapas de la infección. Los resultados anteriores destacan la capacidad de las formas cocoides para colonizar e infectar la mucosa gástrica in vivo.
Varios estudios han revelado la presencia de la forma cocoide en el agua.33,63 Un estudio de este tipo, realizado por nuestro grupo, comparó 2 grupos de ratones Wistar destetados, uno administrado agua de pozo y agua del grifo durante un período prolongado y el otro administrado agua destilada estéril, encontrando que los ratones del grupo de estudio desarrollaron un proceso inflamatorio crónico con formación de placas linfocíticas y la presencia de bacilos compatibles con H. pylori.64
Como se mencionó anteriormente, sería lógico suponer que, en condiciones desfavorables, H. pylori entra en un estado» quiescente», modificando su forma bacilar clásica a la forma cocoide sin producir cambios degenerativos en su genoma y conservando la capacidad de revertir a la forma bacilar una vez que las condiciones ambientales o naturales del hábitat mejoren.
La participación de la forma cocoidea en la recrudescencia
La recurrencia de H. pylori después de la erradicación exitosa es rara en los países desarrollados en comparación con los países en desarrollo, con tasas anuales de recurrencia de 2,67% y 13%, respectivamente.65,66
Hay dos tipos de recurrencia de la infección por H. pylori: recrudescencia, cuando la cepa bacteriana responsable de la recurrencia es genéticamente idéntica a la aislada antes de la erradicación; y reinfección, cuando la recurrencia es causada por una cepa diferente.67 Diferenciar la recrudescencia de la reinfección requiere PCR o análisis de polimorfismo genético para identificar cepas bacterianas.67,68 Dado que estos métodos no se aplican de forma rutinaria, a menudo es imposible diferenciar entre recrudescencia y reinfección en la práctica clínica de rutina.
H. la recidiva de pylori es clínicamente relevante, ya que se puede observar recidiva de úlcera péptica en una proporción considerable de pacientes infectados, mientras que la reaparición de microorganismos podría explicar algunas recidivas de linfoma MALT después del tratamiento.69 Se cree que factores como beber agua del grifo, enfermedades dentales y de las encías, amigdalitis recurrente, hospitalización, equipo dental y médico y contacto con familiares afectan la recurrencia de H. pylori.70-72 Otros factores asociados con la recidiva de la infección son la edad más joven, la diabetes en pacientes jóvenes, los bajos ingresos anuales y la inhibición a largo plazo del ácido gástrico después de la erradicación.73-76
La recrudescencia se considera la razón más probable de recurrencia en el primer año después de la erradicación, mientras que la reinfección puede ocurrir después de un período más largo.68,77 Muchos casos de recurrencia en los países desarrollados se deben en realidad al recrudecimiento. La reinfección es más común en los países en desarrollo, ya que aparentemente las personas están constantemente expuestas a H. pylori.65,78
Utilizando técnicas de electroforesis de proteínas en gel de poliacrilamida, Costas et al.79 encontraron que los pacientes con recidiva 4 semanas después del tratamiento de erradicación no estaban infectados de hecho con otra cepa de H. pylori; más bien, la cepa que había causado la infección original no había sido completamente erradicada por el tratamiento, lo que llevó a la recrudescencia de la infección. Por lo tanto, es importante tener en cuenta la eficacia del régimen terapéutico: H. la recidiva de pylori es frecuente en pacientes tratados con terapias de baja eficacia, pero es poco frecuente cuando se utilizan terapias de alta eficacia. Esto se demostró en un estudio sobre la incidencia de recurrencia de H. pylori en España realizado por Gisbert et al., 80 la oms encontró que la recidiva de H. pylori 6 meses después de la erradicación fue de 8,2% en pacientes tratados con terapias de baja eficacia, pero solo de 1,7% en pacientes tratados con terapias de alta eficacia.
En un estudio realizado en Corea entre 2007 y 2010, H. las tasas de recidiva de pylori se analizaron después de 6 meses de terapias de erradicación exitosas de primera y segunda línea, con seguimiento anual, hasta el final del período del estudio, basado en pruebas de aliento, biopsia de estómago y pruebas rápidas de ureasa.81 Se encontró que las tasas de recidiva anual dentro y después del seguimiento de 2 años fueron de 9,3 y 2,0%, respectivamente, después de la terapia de primera línea, y de 4,5 y 2,9%, respectivamente, después de la terapia de segunda línea. Los autores concluyeron que el informe anual H. las tasas de recidiva de pylori para los pacientes que recibieron tratamiento de erradicación mostraron una fuerte caída después del período de seguimiento de 2 años. Esto se consideró tiempo suficiente después del tratamiento para confirmar la erradicación, y también tiempo suficiente para permitir hacer una distinción entre recurrencia y recrudescencia de cepas de H. pylori.81
Consideraciones y conclusiones finales
Dada la capacidad de H. pylori para entrar en un estado VBNC cuando se somete a condiciones desfavorables dentro o fuera de su hábitat, es razonable suponer que los regímenes de tratamiento antibiótico utilizados para erradicar la forma bacilar de H. pylori pueden inducir formas cocoides VBNC capaces de sobrevivir durante largos períodos en el medio gastroduodenal. A partir de aquí, pueden tener un potencial patógeno directo e indirecto que conduce a la recrudescencia de la infección y, como resultado, fallas del tratamiento, recaídas de infección y recurrencia de la enfermedad gastroduodenal. Por lo tanto, la erradicación exitosa puede requerir no solo la erradicación de las formas bacilares, sino también de las formas cocoides, o asegurar que las formas cocoides no sean inducidas.
Teniendo en cuenta que, dado que los métodos de rutina actualmente implementados en la práctica clínica para confirmar la erradicación de H. pylori no pueden detectar formas cocoides, los huéspedes pueden ser diagnosticados incorrectamente como libres de infección; además, estos métodos pueden no ser capaces de proporcionar evidencia completa del potencial clínico de los medicamentos utilizados para erradicar H. pylori. Por lo tanto, para que la erradicación se considere exitosa, se recomienda un seguimiento anual, utilizando técnicas no invasivas o, si están disponibles, métodos moleculares, para determinar si las bacterias se han eliminado por completo, especialmente en áreas de alta prevalencia y en pacientes con riesgo de recidiva.
Finalmente, son necesarios estudios adicionales de la forma cocoide VBNC de H. pylori, su potencial patógeno, su participación en infecciones y recrudescencia y su papel en la formación de biopelículas en el estómago y otras ubicaciones dentro del huésped. Tales estudios permitirían el desarrollo de protocolos de diagnóstico más eficaces que eviten subestimar la colonización por H. pylori y de nuevas estrategias terapéuticas dirigidas a eliminar las formas de cocoides y «desarmar» las biopelículas.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.