A pesar de la drástica disminución de la morbilidad y mortalidad relacionadas con el virus de inmunodeficiencia humana de tipo 1 (VIH-1) tras el descubrimiento de los inhibidores de la proteasa y la llegada de la terapia antirretroviral altamente activa combinada (ARV) a mediados de la década de 1990, muchos pacientes seguían fallando el tratamiento debido a la resistencia y / o intolerabilidad (1). Estaba claro que se necesitaban más antirretrovirales que actuaran en diferentes etapas del ciclo de vida del virus, activos contra virus resistentes y mejor tolerados. La demostración del papel clave de los receptores de quimiocinas CCR5 y CXCR4 en la entrada del VIH-1 despertó el interés en este proceso como un nuevo objetivo de ARV (2, 3). CCR5 es el co-receptor de la mayoría de las cepas de VIH-1, y estos virus se denominan tropic CCR5 (R5). Las cepas de virus que usan CXCR4 se llaman CXCR4-tropic (X4), mientras que las cepas que pueden usar ambos receptores son de trópico dual (4). El virus de un paciente a menudo puede contener mezclas de cepas R5, X4 y de dos trópicos, denominadas colectivamente CXCR4.
El papel clave del CCR5 en la entrada del VIH-1, junto con la demostración de que los individuos que eran homocigotos para una deleción de 32 pares de bases en el gen CCR5 (CCR5Δ32), y posteriormente no expresaban el CCR5 funcional, estaban altamente protegidos de la infección con el VIH-1 R5, enfocaron la atención en el CCR5 como un objetivo atractivo (5). Aunque algunos estudios han demostrado efectos sutiles de la mutación CCR5Δ32 en la función inmune, como puntuaciones inflamatorias disminuidas en individuos infectados por hepatitis C y recuperación de la hepatitis B en heterocigotos; mientras que los homocigotos son más susceptibles a la encefalitis transmitida por garrapatas y a la enfermedad grave por el virus del Nilo Occidental, estos individuos sufren pocos efectos adversos aparentes en su salud (5, 6). Esto, junto con el hecho de que los miembros de la superfamilia de receptores acoplados a proteínas G a menudo son manejables para el desarrollo de fármacos potentes, selectivos y biodisponibles por vía oral (7), llevó a la iniciación de programas de descubrimiento de ligandos CCR5 por parte de múltiples grupos, incluido un equipo de Investigación y Desarrollo Global de Pfizer con sede en los laboratorios Sándwich en el Reino Unido.
Maraviroc (UK-427,857, MVC) se descubrió a través de un cribado de alto rendimiento de la biblioteca de compuestos Pfizer utilizando un ensayo de unión a radiofrecuencias de quimioquinas. El compuesto más prometedor del proceso de selección se optimizó para la potencia contra el receptor, la actividad antiviral, las características farmacocinéticas y la selectividad contra objetivos celulares humanos a través de un gran esfuerzo químico medicinal en el que se caracterizaron casi 1000 moléculas (7). El MVC se une a la bolsa transmembrana del CCR5 y es un antagonista funcional de desplazamiento lento que evita la internalización (7, 8). Tiene una potente actividad antiviral contra una amplia gama de aislados del VIH-1 (7). Esto, unido a su excelente perfil de seguridad preclínica y a su aceptable farmacocinética, dio lugar a su nombramiento como candidato clínico en diciembre de 2000 (7).
Siempre estaba claro que el desarrollo clínico de antagonistas CCR5 sería un desafío, ya que estos serían los primeros medicamentos antirretrovirales dirigidos al huésped y, por lo tanto, nos aventurábamos en un territorio desconocido. Con el fin de evitar problemas clave, se estableció un equipo de desarrollo clínico muy poco después del inicio del programa de descubrimiento y fui reclutado para dirigir el equipo de desarrollo inicial, uniéndome a Pfizer en febrero de 1999. Identificamos varios desafíos clave a abordar en el diseño del programa clínico, además de demostrar seguridad y eficacia. El primero de ellos fue que no existía ningún ensayo disponible en el mercado y validado clínicamente para identificar a los pacientes infectados con el VIH-1 R5. Esto fue crítico, ya que el MVC solo es activo contra las cepas R5 del VIH-1 (7). En segundo lugar, a pesar del fenotipo aparentemente sano de individuos con CCR5Δ32 (5, 6), seguía habiendo preocupaciones con respecto a la seguridad de la exposición a largo plazo a antagonistas de CCR5, ya que el bloqueo de CCR5 puede ser diferente de la ausencia congénita del receptor CCR5, donde el sistema inmunitario ha madurado en ausencia de CCR5 y pueden haberse desarrollado mecanismos compensatorios. Por último, en individuos infectados por el VIH-1, la incidencia de cepas de VIH-1 que usan CXCR4 aumenta con la progresión de la enfermedad y la disminución del recuento de células CD4 (9), aunque no se ha demostrado una relación causal entre el virus que usa CXCR4 y la depleción de células CD4. Esto ha dado lugar a la preocupación de que la presión selectiva de un antagonista CCR5 pueda llevar a la población vírica a utilizar CXCR4 y provocar una disminución de las células CD4.
Los estudios de fase 1 de dosis única y múltiple en voluntarios sanos, realizados en 2001 y en el primer semestre de 2002, demostraron que el CMV era seguro y bien tolerado en dosis múltiples de hasta 300 mg dos veces al día (dos veces al día), tenía un perfil farmacocinético compatible con la administración oral de una vez al día (dos veces al día) o dos veces al día, podía combinarse con otros antirretrovirales, y que dosis ≥100 mg dos veces al día daban lugar a una exposición por encima de la media geométrica CI90 antiviral in vitro (7, 10). Para demostrar pruebas de farmacología, se midió la saturación del receptor CCR5 utilizando un ensayo de internalización ex vivo MIP-1β a medida. Dependiente de la dosis de saturación se ha demostrado, con dosis de ≥25 mg QD resultando en cerca de máxima saturación, niveles, aumentando la interesante posibilidad de que MVC podría ser eficaz en dosis tan bajas como 25 mg QD. La saturación del receptor permaneció elevada durante varios días después de suspender la administración, lo que refleja un desplazamiento lento del receptor in vivo (11).
Nos entusiasmaron y alentaron los datos de la fase 1 y rápidamente pasamos a un programa de prueba de concepto de la fase 2a. Los pacientes infectados por el VIH-1 fueron examinados para detectar la presencia del virus R5 únicamente, utilizando un nuevo ensayo de tropismo fenotípico (Trofile®, Monogram Biosciences, South San Francisco, CA, EE.UU.), y recibieron MVC en monoterapia durante 10 días (12). En este estudio se midió la saturación del receptor CCR5 para evaluar la posibilidad de utilizarla como biomarcador para la eficacia y en la monitorización terapéutica. Los datos tan esperados estuvieron a la altura de nuestras expectativas y demostraron que dosis de ≥100 mg dos veces al día resultaron en reducciones medias máximas de ARN del VIH-1 de >1.5log10 (Figura 1A), con todos los pacientes, excluyendo un paciente con virus X4 que se ha incluido por error, logrando una reducción del ARN del VIH-1 de al menos 1log10 (12). Esto nos dio la confianza de que el ensayo identificó correctamente a los pacientes con probabilidades de responder a MVC. El nadir del ARN del VIH-1 se produjo 1-5 días después de la última dosis de MVC, consistente con una saturación prolongada del receptor, como se demostró en los estudios de fase 1 (12). Para todas las dosis, excepto 25 mg, se observó una saturación del receptor QD de >80% a lo largo del periodo de dosificación. Sin embargo, no hubo correlación entre la reducción de la carga viral y el grado de saturación del receptor. La explicación más probable de esto es que se requieren niveles muy altos de saturación de receptores para la eficacia antiviral y la variabilidad inherente del ensayo no permite la diferenciación en ese grado (11, 12).FIGURA
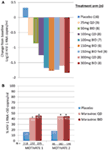
Gráfico 1 Prueba de concepto Maraviroc y resultados de eficacia de fase 3. A) Cambio máximo medio desde el valor basal en el ARN del VIH-1 en pacientes que reciben monoterapia con CMV. Sobre la base de los datos de la fase 1 y de la modelización y simulación, se seleccionaron dosis que oscilaban entre 25 mg una vez al día y 300 mg dos veces al día (incluidos 150 mg dos veces al día alimentados y en ayunas). Se evaluaron el ARN del VIH-1, la seguridad y la farmacocinética del MVC (12). B) MOTIVAR a 1 y 2 – proporción de pacientes que alcanzaron ARN del VIH-1 < 50 copias / ml en la semana 48. Los pacientes infectados por el VIH-1 con experiencia de VIH-1 R5 y resistencia de clase triple y/o fueron aleatorizados para recibir MVC QD o BID, o placebo, en combinación con un régimen antirretroviral de base optimizado (TBO). P < 0.001 (13, 14).
Los datos de la fase 2a generaron entusiasmo en toda la empresa y estábamos ansiosos por avanzar en el programa de desarrollo clínico lo antes posible, ya que había una gran necesidad médica de nuevos antirretrovirales para tratar a pacientes con opciones de tratamiento limitadas o inexistentes. El extenso programa de fase 1 (que incluye múltiples estudios de interacción farmacológica) y el amplio rango de dosis evaluado en los estudios de prueba de concepto de fase 2a, junto con el modelado y la simulación, nos dieron una muy buena comprensión de la dosis probablemente eficaz de MVC en combinación con otros ARVs. Por lo tanto, pudimos pasar directamente a los estudios de eficacia de fase 3 que evaluaban MVC a 300 mg (o equivalente, dependiendo de los medicamentos administrados de forma conjunta) QD y BID, sin la necesidad de realizar estudios independientes de rango de dosis de fase 2b, lo que acortó significativamente el cronograma de desarrollo. A finales de 2004, iniciamos cuatro grandes estudios; MOTIVATE 1 y 2 en pacientes con VIH-1 R5 previamente tratados (13, 14), MERIT (un estudio de fase 3 con un roll-in de fase 2b) en pacientes sin tratamiento previo con VIH-1 R5 (15), y el estudio A4001029, un estudio de seguridad de fase 2b en pacientes previamente tratados con virus con tropismo no CCR5 (virus que utiliza CXCR4 o no fenotipable) (16).
Esta fue una empresa masiva, con 4794 pacientes examinados en más de 200 sitios en los EE.UU., Canadá, Europa, Australia, Sudáfrica, México y Argentina. Otros dos antagonistas de moléculas pequeñas CCR5 (aplaviroc y vicriviroc) también se estaban evaluando en estudios de fase 2b en este momento (17, 18). Además de los desafíos habituales de manejar grandes estudios clínicos, se nos lanzaron dos bolas curvas, la primera de ellas fue la interrupción del aplaviroc debido a hepatotoxicidad idiosincrásica. Se especuló que esto podría ser un efecto de clase de los antagonistas CCR5, ya que los ratones knockout CCR5 son más susceptibles a la concanavalina, una hepatotoxicidad mediada (17). Además, un paciente en el estudio MERIT desarrolló hepatotoxicidad grave. Los datos implicaban que probablemente estaba relacionado con la isoniazida o el cotrimoxazol, pero no se podía excluir un papel contributivo de la MVC (15). Una revisión en profundidad de todos los datos para la evidencia de hepatotoxicidad para MVC y un alto nivel de vigilancia para cualquier señal, no encontró evidencia de un aumento sistemático de enzimas hepáticas u otros marcadores de hepatotoxicidad. Poco después se plantearon dudas sobre un posible aumento del riesgo de ciertas neoplasias malignas, tras la aparición de linfoma en cuatro pacientes que recibieron vicriviroc en el estudio ACTG5211 (18). Inicialmente, se temía que esto pudiera ser un efecto de clase basado en el potencial inmunomodulador de los antagonistas CCR5, pero la revisión de los datos de otros estudios de vicriviroc, así como de los estudios en curso de MVC, no respaldaron esta teoría (18).
Los datos de MOTIVATE 1 y 2 y A4001029 estaban disponibles antes que los de MERIT, ya que la duración del estudio suele ser más corta para los estudios en pacientes previamente tratados. Esperamos con gran entusiasmo los análisis intermedios de la semana 24 para los estudios MOTIVATE en octubre de 2006 y nos alegramos al ver que significativamente más pacientes que recibían MVC tenían un ARN del VIH-1 de <50 copias/ml (el marcador clave de la eficacia) en comparación con los que recibían TBO con placebo. Esto fue confirmado por los datos de la semana 48, lo que demuestra la durabilidad de la respuesta (Figura 1B) (13, 14). Por el contrario, los pacientes con VIH-1 sin tropismo CCR5 que recibieron MVC en A4001029 no parecían obtener un beneficio virológico significativo en comparación con placebo (16). El análisis de los datos de seguridad no planteó problemas significativos. Específicamente, no hubo evidencia de un efecto adverso sobre la función inmune, sin aumento de episodios de infección o neoplasias malignas en pacientes tratados con MVC. La evaluación del tropismo viral en el momento del fracaso demostró que 50% de los pacientes que fracasaron en el tratamiento con MVC tenían virus CXCR4 en el momento del fracaso, pero no hubo evidencia de un efecto perjudicial en el recuento de células CD4 (14). La evaluación virológica demostró que el virus con CXCR4 que surgió bajo presión selectiva de MVC provenía de una población minoritaria preexistente y no surgió de novo (19). En conjunto, estos resultados demostraron claramente el beneficio de la CMV en el manejo de pacientes con VIH-1 R5 previamente tratados. Un esfuerzo supremo por parte del equipo resultó en la presentación de expedientes para el registro tanto en los EE.UU. como en Europa solo 2 meses después de que los datos provisionales estuvieran disponibles. MVC (300 mg BID) recibió la aprobación para su uso (en combinación con otros antirretrovirales) en los EE.UU. en agosto de 2007, solo 6.5 años después de ser nominado como candidato para desarrollo clínico. Un mes más tarde, también fue aprobado para su uso en esta población en la UE.
El análisis de la semana 48 del estudio MERIT fue decepcionante, ya que MVC más zidovudina / lamivudina (ARN del VIH-1 <50 copias/ml, 65,3%) no cumplía los criterios preestablecidos de no inferioridad (límite inferior del intervalo de confianza de 97,5 a 1 cara por debajo del -10%) a efavirenz más zidovudina/lamivudina (ARN del VIH-1 <50 copias/ ml, 69,3%) (15). Sin embargo, los pacientes de este estudio se sometieron a pruebas de detección del virus R5 utilizando el ensayo Trofile original. Mientras tanto, este ensayo se ha mejorado para ser más sensible a la detección de poblaciones minoritarias de virus que utilizan CXCR4. Posteriormente, todas las muestras de cribado para los pacientes con MÉRITO se volvieron a analizar utilizando el ensayo mejorado y se realizó un análisis post hoc que incluyó solo a los pacientes que tenían el virus R5 mediante el ensayo más sensible. En este análisis, las tasas de respuesta para MVC y efavirenz fueron de 68,3 y 68,5%, respectivamente, con el límite inferior del intervalo de confianza del 97,5% por encima del -10% (15). Con base en estos datos, la Administración de Alimentos y Medicamentos de los Estados Unidos también aprobó el uso de MVC en pacientes sin tratamiento previo en noviembre de 2009.
MVC no solo ha demostrado ser una valiosa adición al armamentario de medicamentos ANTIRRETROVIRALES en constante crecimiento, sino que los datos de estos estudios han mejorado nuestra comprensión del tropismo del VIH y la relación entre el tropismo y la progresión de la enfermedad. Para mí, personalmente, esto representó un período de gran emoción y satisfacción, tanto como médico como científico.
Contribuciones de los autores
ER redactó este manuscrito basado en su experiencia personal como miembro del equipo de desarrollo de MVC. Todos los datos se han publicado en su totalidad en otra parte. Todos los estudios se realizaron de conformidad con los principios de la Declaración de Helsinki y con todas las Directrices de la Conferencia Internacional sobre Armonización de Buenas Prácticas Clínicas y los requisitos reglamentarios y legales locales. Todos los estudios fueron aprobados por comités de ética independientes y todos los pacientes dieron su consentimiento informado por escrito.
Declaración de conflicto de intereses
Elna Van Der Ryst era empleada de Pfizer Global Research and development en el momento en que se desarrolló MVC. Actualmente presta servicios de consultoría a Pfizer.
Agradecimientos
Me gustaría agradecer a los colegas de Pfizer que contribuyeron al programa de descubrimiento y desarrollo de MVC, así como a los investigadores y pacientes que participaron en los estudios clínicos.
1. Richman DD, Morton SC, Wrin T, Hellmann N, Berry S, Schapiro MF, et al. La prevalencia de la resistencia a los medicamentos antirretrovirales en los Estados Unidos. AIDS (2004) 18:1393-401. doi: 10.1097 / 01.SIDA.0000131310.52526.c7
Resumen de Pubmed / Texto Completo de Pubmed / Texto Completo de CrossRef / Google Scholar
2. Dragic T, Litwin V, Allaway GP, Martin SR, Huang Y, Nagashima KA, et al. La entrada del VIH-1 en las células CD4+ está mediada por el receptor de quimioquinas CC-CKR-5. Nature (1996) 381:667-73. doi: 10.1038 / 381667a0
Resumen de Pubmed / Texto Completo de Pubmed / Texto Completo de CrossRef / Google Scholar
3. Feng Y, Broder CC, Kennedy PE, Berger EA. Cofactor de entrada de VIH-1: clonación funcional de ADNc de un receptor acoplado a proteína G de siete transmembranas. Science (1996) 272:872-7. doi: 10.1126 / ciencia.272.5263.872
Texto completo de CrossRef / Google Scholar
4. Berger EA, Doms RW, Fenyö EM, Korber BT, Littman DR, Moore JP, et al. Una nueva clasificación para el VIH-1. Nature (1998) 391:240. doi:10.1038/34571
Texto completo de CrossRef | Google Scholar
5. Samson M, Libert F, Doranz BJ, Rucker J, Liesnard C, Farber C, et al. Resistencia a la infección por VIH-1 en individuos caucásicos portadores de alelos mutantes del gen receptor de quimioquinas CCR5. Nature (1996) 382:722-5. doi: 10.1038 / 382722a0
Resumen de Pubmed / Texto Completo de Pubmed / Texto Completo de CrossRef / Google Scholar
6. Gilliam BL, Riedel DJ, Redfield RR. Uso clínico de inhibidores de CCR5 en VIH y más allá. J Transl Med(2011) 9 (Suppl 1): S9. doi: 10.1186 / 1479-5876-9-S1-S9
Resumen de Pubmed / Texto Completo de Pubmed / Texto Completo de CrossRef / Google Scholar
7. Dorr P, Westby M, Dobbs S, Griffin P, Irvine B, Macartney M, et al. Maraviroc (UK-427,857), un potente inhibidor selectivo de moléculas pequeñas biodisponibles por vía oral del receptor de quimiocinas CCR5 con actividad anti virus de inmunodeficiencia humana de amplio espectro tipo 1. Agentes Antimicrob Chemother (2005) 49:4721-32. doi: 10.1128 / AAC.49.11.4721-4732.2005
Texto completo de CrossRef / Google Scholar
8. Kondru R, Zhang J, Ji C, Mirzadegan T, Rotstein D, Sankuratri S, et al. Interacciones moleculares del CCR5 con las principales clases de antagonistas del CCR5 anti-VIH-1 de moléculas pequeñas. Mol Pharmacol (2008) 73: 789-800. doi: 10.1124 / mol.107.042101
Resumen de Pubmed / Texto Completo de Pubmed / Texto Completo de CrossRef / Google Scholar
9. Berger EA, Murphy PM, Farber JM. Receptores de quimiocinas como co-receptores del VIH-1: roles en la entrada viral, tropismo y enfermedad. Annu Rev Immunol (1999) 17:657-700. doi: 10.1146 / annurev.inmunol.17.1.657
Resumen de Pubmed / Texto Completo de Pubmed / Texto Completo de CrossRef / Google Scholar
10. Abel S, van der Ryst E, Rosario MC, James I, Ridgway C, Medhurst C, et al. Evaluación de la farmacocinética, seguridad y tolerancia de maraviroc, un nuevo antagonista CCR5, en voluntarios sanos. Br J Clin Pharmacol (2008) 65(S1):5-18. doi: 10.1111 / j. 1365-2125. 2008. 03130.x
Resumen de Pubmed / Texto Completo de Pubmed / Texto Completo de CrossRef / Google Scholar
11. Rosario MC, Jacqmin P, Dorr P, James I, Jenkins T, Abel S, et al. Análisis farmacocinético-farmacodinámico de la ocupación de los receptores CCR5 por maraviroc en sujetos sanos y pacientes VIH positivos. Br J Clin Pharmacol (2008) 65(S1):86-94. doi: 10.1111 / j. 1365-2125. 2008. 03140.x
Resumen de Pubmed / Texto Completo de Pubmed / Texto Completo de CrossRef / Google Scholar
12. Fätkenheuer G, Pozniak AL, Johnson MA, Plettenberg A, Staszewski S, Hoepelman AIM, et al. Eficacia de la monoterapia a corto plazo con maraviroc, un nuevo antagonista del CCR5 en pacientes infectados por VIH-1. Nat Med (2005) 11:1170-2. doi: 10.1038 / nm1319
Resumen de Pubmed / Texto Completo de Pubmed / Texto Completo de CrossRef / Google Scholar
13. Gulick RM, Lalezari J, Goodrich J, Clumeck N, DeJesus E, Horban A, et al. Maraviroc para pacientes previamente tratados con infección por VIH-1 R5. N Engl J Med (2008) 359:1429-41. doi: 10.1056 / NEJMoa0803152
Texto completo de CrossRef / Google Scholar
14. Fätkenheuer G, Nelson M, Lazzarin A, Konourina I, Hoepelman IM, Lampiris H, et al. Análisis de subgrupos de maraviroc en infección por VIH-1 R5 previamente tratada. N Engl J Med (2008) 359:1442-55. doi: 10.1056 / NEJMoa0803154
Resumen de Pubmed / Texto Completo de Pubmed / Texto Completo de CrossRef / Google Scholar
15. Cooper DA, Heera J, Goodrich J, Tawadrous M, Saag M, DeJesus E, et al. Maraviroc frente a efavirenz, ambos en combinación con zidovudina / lamivudina, para el tratamiento de sujetos naïve a antirretrovirales con VIH-1 con tropismo CCR5. J Infect Dis (2010) 201: 803-13. doi:10.1086/650697
Resumen de Pubmed / Texto Completo de Pubmed / Texto Completo de CrossRef / Google Scholar
16. Saag M, Goodrich J, Fätkenheuer G, Clotet B, Clumeck N, Sullivan J, et al. Un ensayo doble ciego controlado con placebo de maraviroc en pacientes previamente tratados infectados con VIH-1 sin tropismo CCR5: resultados de 24 semanas. J Infect Dis (2009) 11: 1638-47. doi:10.1086/598965
Resumen de Pubmed / Texto Completo de Pubmed / Texto Completo de CrossRef / Google Scholar
17. Nichols WG, Steel HM, Bonny T, Adkison K, Curtis L, Millard J, et al. Hepatotoxicidad observada en ensayos clínicos de aplaviroc (GW873140). Agentes Antimicrob Chemother (2008) 52:858-65. doi: 10.1128 / AAC.00821-07
Resumen de Pubmed / Texto Completo de Pubmed / Texto Completo de CrossRef / Google Scholar
18. Tsibris AM, Paredes R, Chadburn A, Su Z, Henrich TJ, Krambrink A, et al. Diagnóstico de linfoma y carga plasmática de virus de Epstein-Barr durante el tratamiento con vicriviroc: resultados del grupo de ensayos clínicos sobre el SIDA A5211. Clin Infect Dis (2009) 48:642-9. doi:10.1086/597007
Resumen de Pubmed / Texto Completo de Pubmed / Texto Completo de CrossRef / Google Scholar
19. Lewis M, Simpson P, Fransen S, Huang W, Whitcomb J, Mosley M, et al. El virus que usa CXCR4 detectado en pacientes que recibieron maraviroc en los estudios de fase III MOTIVATE 1 y 2 se origina en una minoría preexistente de virus que usa CXCR4. Antivir Ther (2007) 12:S65.
Google Scholar