- Introducción
- Resultados
- El Controlador DBH-Cre Marca y Se Limita a las Regiones Noradrenérgicas de Expresión TH en el Tronco cerebral Que son Inhibidas por la Administración de CNO
- Perturbación Mediada por CNO-hM4D de Neuronas Noradrenérgicas en Ratones adultos
- La perturbación CNO-hM4D de las neuronas DBH-Cre Resulta en un Déficit Hipercápnico
- Los Controles de Hermanos Habituados Inyectados Con CNO de 10 mg/kg Mostraron un Déficit Ventilatorio Hipercápnico
- Los animales de Tipo Silvestre Habituados y No Habitados Inyectados con Solución Salina No Mostraron Cambios de Presalina y Postsalina
- Las proporciones de concentración de Clozapina a CNO Son más altas en el cerebro Que en el suero
- Discusión
- Materiales y métodos
- Aprobación ética
- Cría, Antecedentes Genéticos y Mantenimiento de Ratones
- Histología
- Electrofisiología
- Pletismografía
- Cromatografía líquida-Espectrometría de masas
- Recolección y Análisis de datos
- Pletismografía
- Estadística
- Pletismografía
- Cromatografía Líquida-Espectrometría de masas
- Declaración de Ética
- Contribuciones de los autores
- Financiación
- Declaración de Conflicto de Intereses
- Agradecimientos
Introducción
Las redes neuronales que subyacen al reflejo quimiosensorial respiratorio son un objetivo primario para comprender la etiología de varios trastornos fisiológicos y de comportamiento. Se supone que los reflejos quimiosensoriales perturbados desempeñan un papel en trastornos congénitos y adultos, incluidos el Síndrome de Muerte Súbita del Lactante (SMSL), el Síndrome de Hipoventilación Central Congénita (CCHS), las apneas centrales del sueño, la respiración anormal en el Síndrome de Rett y el síndrome de hipoventilación por obesidad (Obonai et al., 1998; Ozawa et al., 2003; Amiel et al., 2009; Ramanantsoa et al., 2011; Lavezzi et al., 2013). Bajo la hipótesis de la falsa alarma de asfixia, se cree que la activación quimiosensorial inapropiada o la hipersensibilidad desempeñan un papel en subconjuntos de pacientes que sufren de trastorno de pánico (Klein, 1993). La disfunción quimiosensorial también puede desempeñar un papel en las enfermedades neurodegenerativas a través de trastornos respiratorios del sueño que se asocian con una progresión acelerada (Hakim et al., 2012; Verbraecken y McNicholas, 2013; Bahia y Pereira, 2015; Snyder et al., 2017). Por lo tanto, una mejor comprensión de las redes quimiosensoriales del tallo cerebral proporcionará pistas importantes para una serie de patologías conductuales y fisiológicas.
Receptores farmacogenéticos de diseño activados exclusivamente por drogas de diseño (DREADDs) (Armbruster et al., 2007) se han empleado en varios estudios para mapear poblaciones neuronales en el quimioreflex respiratorio (respuesta respiratoria a niveles elevados de CO2 en sangre). La tecnología DREADD en combinación con el despliegue genético interseccional se ha utilizado para silenciar poblaciones neuronales altamente específicas mientras se observa la función respiratoria en ratones conscientes y desenfrenados por nuestro laboratorio y otros, evitando muchas confusiones de enfoques de mapeo de circuitos anteriores (Ray et al., 2011, 2013; Brust et al., 2014; Hennessy et al., 2017; Sun y Ray, 2017; Sun et al., 2017). Estos y la mayoría de los otros estudios casi siempre incluyeron CNO solo controles de hermanos no DREADD que expresaban que no mostraban efectos quimiosensoriales u otros efectos respiratorios, argumentando que CNO no tenía efectos fuera del objetivo sobre la respiración en ratones conscientes y desenfrenados a pesar de la alta dosis utilizada, 10 mg/kg. Sin embargo, se encontró en varios otros estudios que el CNO y sus productos de metabolismo de la espalda podrían tener efectos fuera del objetivo en el comportamiento y la locomoción en una variedad de ensayos, pero no se abordó el gasto respiratorio (Guettier et al., 2009; Joober, 2010; MacLaren et al., 2016; Gómez et al., 2017; Ilg et al., 2018; Mahler y Aston-Jones, 2018; Manvich et al., 2018; Padovan-Hernandez y Knackstedt, 2018). También se demostró que el CNO y sus metabolitos no se distribuyen de forma equivalente entre el sistema circulatorio y el cerebro (Gómez et al., 2017).
Una segunda preocupación no abordada surge del estrés inducido por el paradigma experimental, que incluye la retención de animales en una cámara de pletismografía barométrica de cuerpo completo, el manejo, la inyección intraperitoneal y las mediciones de temperatura rectal. En estudios respiratorios previos de DREADD, los ratones naïve se introdujeron en una cámara pequeña (140-400 mls) y se les permitió aclimatarse 20-40 minutos antes de la adquisición de datos (Ray et al., 2011, 2013; Brust et al., 2014; Hennessy et al., 2017; Sun y Ray, 2017; Sun et al., 2017). Sin embargo, no está claro si esta cantidad de tiempo es suficiente para minimizar los cambios respiratorios inducidos por el estrés que pueden actuar como un factor de interacción con los efectos de la clozapina.
En nuestros estudios para examinar el papel del sistema noradrenérgico (NA) en el control respiratorio, buscamos emplear el RC bien establecido::Alelo DREADD P_hM4D (Ray et al., 2011) para probar el papel de las neuronas NA en la respiración basal e hipercápnica en animales adultos sin restricciones utilizando pletismografía de cuerpo completo. Porque también se sabe que la noradrenalina y las neuronas NA desempeñan un papel central en las respuestas al estrés (Valentino y Van Bockstaele, 2008; Chen et al., 2018), realizamos una serie de estudios para comparar la habituación extensa (exposiciones múltiples al paradigma experimental en el que el animal aprende que la experiencia no es amenazante o que puede sobrevivir) y alta vs. dosis bajas de CNO (1 mg / kg) con protocolos DREADD publicados anteriormente (Ray et al., 2011, 2013; Brust et al., 2014; Hennessy et al., 2017; Sun y Ray, 2017; Sun et al., 2017). Aquí, mostramos por primera vez que altas dosis sistémicas de CNO son capaces de provocar efectos fuera del objetivo en una función respiratoria autónoma en ratones conscientes. También revelamos que el efecto fuera del objetivo de la CNO en la producción respiratoria quimiosensorial se desenmascara de manera efectiva mediante una habituación extensa y, por lo tanto, no sería evidente en estudios de control de CNO anteriores que no habituaron a los animales antes de la medición respiratoria, utilizando solo un corto período de aclimatación antes de la recopilación de datos. En conjunto, estos resultados sugieren que las poblaciones neuronales previamente mapeadas pueden afectar indirectamente el control respiratorio a través de roles potenciales en la regulación de las respuestas al estrés. En particular, estos datos se alinean con informes recientes que sugieren que la CNO no es biológicamente inerte a dosis altas a través de la conversión metabólica a clozapina (MacLaren et al., 2016; Gómez et al., 2017) y que los efectos de comportamiento fuera del objetivo pueden manifestarse no solo por la perturbación de los circuitos de comportamiento, sino también por las interrupciones de los circuitos autónomos subyacentes y la homeostasis.
Resultados
El Controlador DBH-Cre Marca y Se Limita a las Regiones Noradrenérgicas de Expresión TH en el Tronco cerebral Que son Inhibidas por la Administración de CNO
Para examinar la expresión y especificidad de la línea DBH-Cre, utilizamos un esquema de reproducción recombinasa única (Figura 1A) en el que cruzamos el controlador a la línea Ai9 (Madisen et al., 2010), que expresa un tdTomato floxeado. La tinción con un anticuerpo tirosina hidroxilasa (TH) reveló que la expresión de tdTomato en el tronco encefálico se limitaba a las regiones de expresión TH, incluidos los núcleos de locus coeruleus, A5, A1, A2, A7, SubCV y SubCD como se esperaba (Figura 1B). Para confirmar que las neuronas NA que expresaban el receptor hM4D respondían al CNO, realizamos grabaciones en neuronas del locus coeruleus (LC), donde observamos una inhibición de la activación neuronal al aplicar el baño de CNO (n = 3, Figura 1C).FIGURA
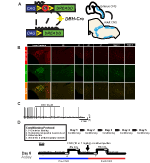
Gráfico 1 Esquemas de reproducción y protocolos respiratorios. El RC::El alelo P_hM4D se combina con una línea de dopamina-beta-hidroxilasa (DBH)-Cre para lograr la expresión celular específica del receptor hM4D en neuronas noradrenérgicas (NA) (A). Expresión fluorescente de tdTomato en DBH-Cre; las secciones coronales del cerebro Ai9 coexpresan con tirosina-hidroxilasa (TH) en los núcleos del tronco cerebral NA (B). En el registro de cortes de NA locus coeruleus antes y después de la aplicación de CNO, demostrando la funcionalidad del receptor DREADD en neuronas dirigidas (C). Protocolo respiratorio. Los ratones habituados se someten a un protocolo habituado de 5 días que consiste en manipulación, medición de temperatura con sonda rectal, inyección de solución salina y exposición a la cámara de pletismografía. En el sexto día, ratones habituados y no habitados bajo un ensayo hipercápnico en el que se coloca al animal en la cámara respiratoria y se le permite aclimatarse en condiciones de aire ambiente basales. A continuación, el animal se expone a 20 minutos de CO2 al 5%, seguidos de 20 minutos de aire ambiente. Luego se inyecta al animal por vía intraperitoneal con CNO o solución salina, seguido de otros 20 minutos de aire ambiente después de la inyección, 20 minutos de 5% de CO2 y 20 minutos de aire ambiente. Los recuadros abiertos delinean los tiempos de recopilación de datos (D).
Perturbación Mediada por CNO-hM4D de Neuronas Noradrenérgicas en Ratones adultos
Para examinar el papel de las neuronas NA bajo respiración basal e hipercápnica, empleamos el sistema DREADD inhibitorio RC:P_hM4D cruzado con el controlador DBH-Cre. Usando pletismografía de cuerpo entero (Ray et al., 2011), se midieron las respuestas ventilatorias de animales adultos sin restricciones en condiciones de aire ambiente (21% O2/79% N2) e hipercápnicas (5% CO2/21% O2/74% N2) antes y después de la administración de CNO (Figura 1D). Para abordar la dosificación de CNO y el estrés potencial inducido por nuestro diseño experimental, los animales fueron sometidos a una de cuatro condiciones: (1) no habitados e inyectados con 10 mg/kg de CNO; (2) habituados e inyectados con 10 mg/kg de CNO; (3) no habitados e inyectados con 1 mg/kg de CNO; o (4) habituados e inyectados con 1 mg/kg de CNO. La habituación consistió en un proceso de 5 días que incluía manipulación, sonda de temperatura rectal, inyección de solución salina y exposición a la cámara de pletismografía cada día durante 30 minutos, mientras que los animales naïve solo se expusieron a un período de aclimatación de la cámara de 20-45 minutos inmediatamente antes de la recolección de datos, como se hizo en estudios anteriores (Ray et al., 2011, 2013; Brust et al., 2014; Hennessy et al., 2017; Sun y Ray, 2017; Sun et al., 2017). Los parámetros respiratorios medidos incluyeron frecuencia respiratoria RR, volumen corriente (TV), ventilación por minutos (VE), consumo de oxígeno (VO2), ventilación por minutos normalizada al consumo de oxígeno (VE/VO2), frecuencia de apnea, frecuencia de suspiros y coeficientes de variación para intervalo entre respiraciones y amplitud (inestabilidad periódica y de volumen). Como control adicional, también comparamos animales silvestres habituados y no habitados inyectados con solución salina.
La perturbación CNO-hM4D de las neuronas DBH-Cre Resulta en un Déficit Hipercápnico
Bajo tres de las condiciones, DBH-Cre; RC::Los animales de P_hM4D mostraron una reducción de VE y VE / VO2 después de la administración de CNO, mientras que los controles de hermanos no mostraron diferencias en los valores pre y post – CNO. Unhabituated animales inyectados con 10 mg/kg de CNO mostraron una reducción significativa de la RR (-12.17%, p = 0,034) y VT (-30.87%, p = 0.0016), resultando en una reducción de CINCO (-38.64%, p = 0.0031) y una ligera reducción en el VO2 (-14.25%, p = 0,042) (Figura 2). La reducción de VE fue mayor que la disminución de VO2, resultando en una reducción global de VE/VO2 (-26,89%, p = 0,0095). Los animales no habitados a los que se les inyectó 1 mg/kg de CNO mostraron una tendencia hacia una reducción del RR (-12,88%, p = 0,066) y una reducción significativa de la TV (-16,52%, p = 0,00085) y VE (-28,08%, p = 0,0070), lo que llevó a una reducción general de VE/VO2 (-22,23%, p = 0,016) (Figura 3). Finalmente, los animales habituados inyectados con 1 mg/kg de CNO mostraron un RR reducido (-10,77%, p = 0,074), una tendencia hacia la VE reducida (-25,07%, p = 0,074) y una VE/VO2 global reducida (-23,70%, p = 0,024) (Figura 4). No se observaron cambios significativos en la frecuencia de apnea, frecuencia de suspiros, inestabilidad periódica o de volumen o temperatura en ninguna cohorte.FIGURA
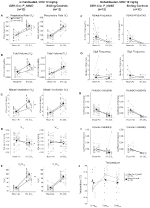
Gráfico 2 DBH-Cre no habitado; RC:: P_hM4D los animales a los que se administró 10 mg/kg de CNO muestran un déficit hipercápnico, mientras que los controles de los hermanos no muestran cambios. Después de la administración de CNO, DBH-Cre; RC::Los animales P_hM4D no muestran cambios en la ventilación del aire ambiente y reducciones en RR (A), VT (B), VE (C), VO2 (D) y VE/VO2 (E) en condiciones hipercápnicas sin cambios en la frecuencia de apnea (F), frecuencia de suspiros (G), inestabilidad periódica (H) o de volumen (I) y temperatura (J). Los controles de hermanos no mostraron diferencias en todos los valores pre y post – CNO.FIGURA
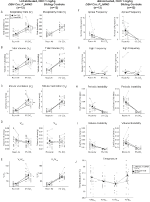
Gráfico 3 DBH-Cre no habitado; RC:: P_hM4D los animales a los que se administra 1 mg/kg de CNO muestran un déficit hipercápnico, mientras que los controles de hermanos no muestran cambios. Después de la administración de CNO, DBH-Cre; RC::Los animales de P_hM4D no mostraron cambios significativos en la ventilación del aire ambiente o el RR (A) y mostraron reducciones en la TV (B), VE (C) y VE/VO2 (E) en condiciones hipercápnicas sin cambios en el VO2 (D), la frecuencia de apnea (F), la frecuencia de suspiros (G), la inestabilidad periódica (H) o del volumen (I) y la temperatura (J). Los controles de hermanos no mostraron diferencias en todos los valores pre y post – CNO.FIGURA
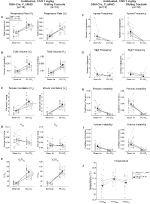
Gráfico 4 DAB-Cre habituados; RC:: P_hM4D los animales a los que se administra 1 mg/kg de CNO muestran un déficit hipercápnico, mientras que los controles de los hermanos no muestran cambios. Después de la administración de CNO, DBH-Cre; RC:: P_hM4D los animales no muestran cambios en la ventilación del aire ambiente y una reducción en RR (A) y VE/VO2 (E) en condiciones hipercápnicas sin cambios significativos en VT (B),VE (C),VO2 (D), frecuencia de apnea (F), frecuencia de suspiros (G), inestabilidad periódica (H) o de volumen (I) y temperatura (J). Los controles de hermanos no mostraron diferencias en todos los valores pre y post – CNO.
Los Controles de Hermanos Habituados Inyectados Con CNO de 10 mg/kg Mostraron un Déficit Ventilatorio Hipercápnico
En ambos DAP-Cre; RC::P_hM4D y control de hermanos animales habituados inyectados con 10 mg/kg de CNO, notamos una reducción significativa en VE / VO2 (p = 0,0235) mediada por disminuciones en RR (p = 0,00036) y VE (p = 0,037) (Figura 5). Sin embargo, a diferencia de los otros grupos, no hubo diferencias entre el DAP-Cre; RC::P_hM4D y hermano de control de animales en estos parámetros: RR (-12.72 vs -10.22%, p = 0.6268), CINCO (-24.88 vs -23.94%, p = 0.4150), o VE/VO2 (-15.4 vs -22.55%, p = 0.4643).FIGURA
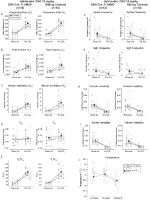
Gráfico 5 Ambos habituados DBH-Cre; RC::P_hM4D los animales y los controles de hermanos a los que se administró 10 mg/kg de CNO muestran un déficit hipercápnico. Después de la administración de CNO, DBH-Cre; RC::P_hM4D los animales y los controles de hermanos no muestran ningún cambio en la ventilación del aire ambiente y una reducción en RR (A), VE (C) y VE/VO2 (E) en condiciones hipercápnicas sin cambios significativos en VT (B), VO2 (D), frecuencia de apnea (F), frecuencia de suspiro (G), inestabilidad periódica (H) o de volumen (I) y temperatura (J).
Los animales de Tipo Silvestre Habituados y No Habitados Inyectados con Solución Salina No Mostraron Cambios de Presalina y Postsalina
Aunque no se observaron fenotipos en los controles inyectados con 1 mg/kg de CNO, abordamos la posibilidad de que la inyección en sí causara el fenotipo observado en los controles inyectados con 10 mg/kg de CNO mediante pruebas con animales de tipo silvestre habituados y no habitados inyectados con solución salina (Figura 6). Tanto en cohortes habituadas como no habitadas, los animales no mostraron ninguna diferencia en los parámetros respiratorios de la administración de presalina y postsalina. No se observaron cambios significativos en la frecuencia de apnea, frecuencia de suspiros, inestabilidad periódica o de volumen o temperatura.FIGURA
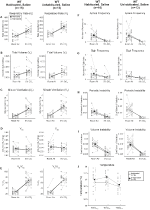
Gráfico 6 Tanto los animales salvajes no habitados como los habituados a los que se les administró solución salina no muestran diferencias entre los valores previos y posteriores a la inyección. Después de la administración de solución salina, los animales salvajes no habitados y habituados no mostraron cambios en condiciones de aire ambiente o hipercápnicas en RR (A), VT (B), VE (C), VO2 (D), VE/VO2 (E), frecuencia de apnea (F), frecuencia de suspiros (G), inestabilidad periódica (H) o de volumen (I) y temperatura (J).
Las proporciones de concentración de Clozapina a CNO Son más altas en el cerebro Que en el suero
Para determinar la biodisponibilidad de CNO y clozapina, medimos sus concentraciones en suero y cerebro a través de espectrometría de masas. Treinta minutos después de una inyección intraperitoneal de CNO en ratones, el CNO se encuentra en menor abundancia relativa en comparación con su metabolito posterior clozapina en el suero y el cerebro para todas las dosis analizadas, 0,1 mg/kg (p sérico = 0,0054, p cerebral = 0,0001) (Figura 7A), 1 mg/kg (p sérico > 0,05, p cerebral = 0,0197) (Figura 7B), y 10 mg/kg (p sérico = 0,0197) (Figura 7B), y 10 mg / kg (p sérico = 0,0197) (Figura 0,0036, cerebro p = 0.0005) (figura 7C). Cuando se analizaron las proporciones generales de clozapina a CNO, siempre estuvieron por encima de cero y fueron más altas en el cerebro que en el suero (vehículo p > 0,5, 0,1 mg/kg p > 0,5, 1 mg/kg p = 0,0018, 10 mg/kg p = 0,0160) (Figura 7D).FIGURA
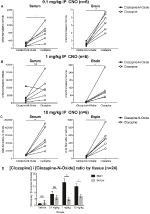
Gráfico 7 Las proporciones de concentraciones de clozapina a CNO son más altas en el cerebro que en el suero. Se recogieron muestras de suero y cerebro de ratones silvestres 30 minutos después de la administración de CNO a 3 dosis diferentes de 0,1 mg/kg (A), 1 mg/kg (B) y 10 mg / kg (C). Los puntos de datos individuales representan la abundancia relativa de clozapina-N-óxido o clozapina obtenida por LC-MS. También se muestra la relación Clozapina a CNO para cada dosis y SEM (D).
Discusión
El objetivo inicial de este estudio fue examinar el papel de las neuronas DBH-Cre en la fisiología respiratoria después de una perturbación aguda en animales adultos libres y conscientes. Debido a que la noradrenalina y las neuronas NA desempeñan un papel bien documentado en los comportamientos de estrés (Valentino y Van Bockstaele, 2008; Chen et al., 2018), también buscamos examinar si la habituación a un protocolo fisiológico probablemente estresante tendría un efecto en los fenotipos respiratorios observados previamente. En el protocolo DREADD de pletismografía de cuerpo completo utilizado en nuestro laboratorio y en otros, se manipula a los animales, se los sondea rectalmente para determinar la temperatura, se los expone a un entorno novedoso (la cámara de pletismografía) y se los inyecta intraperitonealmente. Estudios previos han demostrado que el manejo y la habituación a la inyección y otros procedimientos «rutinarios» pueden modificar los parámetros fisiológicos y de comportamiento, incluida la respiración (Misslin et al., 1982; Andrews and File, 1993; Lapin, 1995; Ryabinin et al., 1999). Otros factores estresantes aplicados también modifican la respiración en condiciones ventilatorias tanto basales como hipercápnicas (Isom y Elshowihy, 1982; Kinkead et al., 2001).
En nuestros estudios que utilizaron dosis altas de CNO, encontramos que la inhibición mediada por hM4D de neuronas NA definidas por DBH-Cre resultó en una reducción del reflejo hipercápnico en VE/VO2 en cuatro cohortes experimentales definidas, con reducción de RR, VT y VE, lo que respalda estudios previos (Biancardi et al., 2008; Viemari, 2008; Gargaglioni et al., 2010). Sin embargo, los controles de hermanos habituados a los que se administró una dosis de 10 mg/kg de CNO utilizada en estudios respiratorios previos mostraron un déficit ventilatorio en condiciones hipercápnicas de la misma magnitud que el observado en animales DBH-Cre; RC::P_hM4D. Ningún otro grupo de control de hermanos mostró este fenotipo, incluida la cohorte habituada que recibió solo (1 mg/kg de CNO) o solución salina. Estos resultados sugieren que dosis más altas de CNO (10 mg / kg) tienen un efecto en la respuesta hipercápnica que se desenmascara después de una habituación extensa, mientras que presumiblemente reducen los niveles de estrés animal, y que dosis más bajas de CNO no tienen un efecto en el control respiratorio en animales habituados. Estos resultados también están de acuerdo con el trabajo de Korsak et al. la OMS demostró que la dosis baja de CNO (2 mg/kg) no produce efectos fuera del objetivo en la capacidad de trabajo en un ensayo de ejercicio que incluyó entrenamiento previo (Korsak et al., 2018) y Fleury Curado et al. la OMS no mostró efectos específicos de CNO a dosis bajas (1 mg/kg) sobre el gasto respiratorio (Fleury Curado et al., 2018).
El aumento de la proporción de niveles de clozapina a CNO en suero y en el cerebro (Figura 7) está en concordancia con estudios recientes que sugieren que la CNO se metaboliza rápidamente a clozapina y muestra una mayor permeabilidad cerebral en comparación con la CNO en ratones y en otros lugares (Jann et al., 1994; Chang et al., 1998; Guettier et al., 2009; Gómez et al., 2017; Raper et al., 2017). Sin embargo, no está claro si los efectos fuera del objetivo observados se deben a CNO o clozapina. Como nuestras mediciones hipercápnicas ocurrieron < 30 min después de la aplicación de CNO, es probable que los efectos respiratorios fuera del objetivo estén mediados por la clozapina. Nuestros resultados (Figura 7) muestran altos niveles relativos de clozapina en el cerebro, aunque la CNO no está completamente ausente. Sin embargo, Huckstepp y sus colegas utilizaron la aplicación directa de CNO a la médula ventral en ratas anestesiadas para demostrar que solo al aire ambiente, y no bajo desafíos hipercápnicos o hipóxicos, la aplicación de CNO tiene un efecto pequeño, aumenta la frecuencia y disminuye la duración espiratoria, pero deja la TV sin cambios, sin un efecto claro observado durante la hipercapnia (Huckstepp et al., 2015). Dada la aplicación directa en ratas anestesiadas y el marco de tiempo de los experimentos, es probable que los pequeños efectos fuera del objetivo observados fueran mediados por CNO y no por clozapina.
El metabolito posterior clozapina es un fármaco sedante y antipsicótico de uso común en esquizofrenia con muchas dianas endógenas, incluidas acciones antagonistas de baja-alta afinidad en los receptores dopaminérgicos D1, D2 y D4, receptores serotoninérgicos 5-HT2A, 5-HT2C, 5-HT3, 5-HT6 y 5-HT7, receptores de histamina H1 y receptores adrenérgicos α1 y α2, entre otros (Fitton y Heel, 1990; Ashby y Wang, 1996). Los efectos no previstos que se observan aquí pueden ser el resultado de mecanismos y objetivos distintos o combinados. La clozapina puede afectar la respiración como sedante. Un estudio previo mostró una reducción del RR y la TV por debajo del 5 y el 10% de CO2 durante los estados de sueño de onda lenta y movimiento ocular rápido en comparación con el estado de vigilia tranquila en ratones (Nakamura et al., 2007). Alternativamente, la inhibición de las neuronas que expresan DREADD dirigidas puede resultar en un efecto antianxiogénico o ansiolítico similar a nuestro protocolo de habituación para revelar efectos quimiosensoriales fuera del objetivo mediados por CNO/clozapina. Ambas explicaciones están respaldadas por varios estudios que han demostrado que el CO2 desempeña un papel en las respuestas de miedo innatas y aprendidas y en los comportamientos relacionados con la ansiedad (Ziemann et al., 2009; Feinstein et al., 2013; Taugher et al., 2014; Dlouhy et al., 2015; Winter et al., 2017). Por lo tanto, las neuronas objetivo en algunos de estos estudios pueden desempeñar un papel en la conducción de respuestas conductuales ansiogénicas en lugar de reflejos quimiosensoriales fisiológicos, ya que los sistemas catecolaminérgico y serotoninérgico están involucrados en comportamientos de miedo/ansiedad y homeostasis quimiosensorial (Brust et al., 2014; Hennessy et al., 2017).
Por el contrario, los fenotipos quimiosensoriales observados con niveles altos de CNO pueden ser genuinos, ya que pudimos recapitular el déficit hipercápnico mediado por NA a dosis de CNO, una magnitud de orden menor en ratones habituados, mientras que los grupos control no mostraron efecto de CNO. Sin embargo, las comparaciones completas entre estudios anteriores son difíciles debido a la falta, en algunos casos, de datos notificados de VO2, TV, RR y VE/VO2. Por ejemplo, los cambios en la temperatura corporal o la tasa metabólica también pueden afectar de varias maneras a la producción respiratoria y quimiosensorial, y las temperaturas de la cámara pletismográfica fueron muy diferentes en algunos casos (34 frente a 30°C en nuestros estudios), afectando el rango dinámico del componente barométrico de la forma de onda y, por lo tanto, el volumen de marea. En particular, no vimos cambios apreciables en las características de la forma de onda respiratoria en ninguna de nuestras afecciones ni un paro cardiorrespiratorio agudo que se observó en nuestros estudios anteriores de rombómeros completos a dosis altas (Sun et al., 2017).
Nuestros resultados muestran por primera vez que el CNO tiene un efecto inesperado en el reflejo quimiosensorial hipercápnico que es desenmascarado por la habituación extensa. Es importante destacar que, a pesar de los altos niveles, se había descartado previamente un efecto CNO fuera del objetivo debido a la falta de fenotipo en los controles de hermanos, pero que mostramos se hace evidente al habituarse. Ofrecemos una caracterización de CNO fuera de objetivo en el sistema modelo de ratón para complementar los estudios en ratas y primates no humanos. Los resultados aquí plantean la posibilidad de que existan efectos adicionales mediados por CNO, fuera del objetivo en los circuitos en estudio o en los circuitos autonómicos o homeostáticos, pero que puedan enmascararse en otros experimentos controlados. Es importante destacar que estos datos revelan que los investigadores deben esforzarse por usar las dosis mínimas posibles del ligando activador en combinación con altos niveles de habituación, y que los controles adecuados deben incluirse en las manipulaciones genéticas químicas para apreciar e interpretar completamente los datos experimentales.
Materiales y métodos
Aprobación ética
Los estudios fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales de la Facultad de Medicina de Baylor bajo el protocolo AN-6171.
Cría, Antecedentes Genéticos y Mantenimiento de Ratones
Mantuvimos colonias de todas nuestras cepas de ratones heterocigotos mediante retrocruzamiento a ratones C57BL/6J y cepas homocigotas mediante cruces de hermanos. Para experimentos histológicos, la DB-Cremice se acopló con el ratón homocigoto Ai9 (Madisen et al., 2010) (JAX 007909). Para experimentos de pletismografía, ratones DBH-Cre fueron apareados con homocigotos RC::P_hM4D (Ray et al., 2011) ratones para derivar animales, en los que todos los ratones portaban el alelo RC::P_hM4D. Los animales hermanos que no heredaron el alelo Cre se utilizaron como animales de control para la descendencia positiva de Cre. Los cebadores Rosa26 específicos para los ratones Ai9, RC::P_hM4D y RC::ePe eran 5′-GCACTTGCTCTCCCCAAAGTC, 5′-GGGCGTACTTGGCATATGAT y 5′-CTTTAAGCCTGCCCAGAAGA y producen una banda de 495 pb (objetivo) y una banda de 330 pb (peso). Los cebadores Cre específicos para todos los drivers Cre de rombómeros fueron 5′-ATCGCCATCTTCCAGCAGGCGCACCATTGCCC y 5 ‘ – GCATTTCTGGGGATTGCTTA y produjeron una banda de 550 bp si era positiva. Para experimentos LC-MS, se obtuvieron ratones C57BL / 6J del Centro de Medicina Comparativa (CCM) de la Facultad de Medicina de Baylor.
Histología
DBH-Cre de cuatro a ocho semanas de edad; ratones adultos Ai9 se perfundieron transcardialmente con solución salina tamponada con fosfato (PBS) de 0,1 M y luego con paraformaldehído (PFA) al 4% en PBS. Se diseccionaron los cerebros y se fijaron las gotas durante 2 h en PFA al 4% antes de un enjuague con PBS y un equilibrio en sacarosa al 20% en PBS. Los cerebros se seccionaron en secciones de 30 µm, se montaron en portaobjetos y se etiquetaron con anticuerpos inmunofluorescentes. Teñimos durante la noche con anticuerpo antitirosina hidroxilasa para identificar neuronas catecolaminérgicas (1:1,000, Milipora AB152) seguido de 2 h con secundario Cy3 anti-conejo de burro (1:500, Jackson 711-165-152) en Tritón-X al 0.1% en PBS (PBST) con suero de burro al 5%. Las imágenes se recogieron en un microscopio epifluorescente vertical Zeiss.
Electrofisiología
Se cortaron cortes cerebrales horizontales que contenían el locus coeruleus (300 µm) con un vibratomo (Leica VT 1000S, Leica Microsystems, Buffalo Grove, IL) de ratones adultos DBH-Cre; RR2P; RC::ePe (~1 mes de edad) en líquido cefalorraquídeo artificial (FCA) a 4°C. Las lonchas se sumergieron en una cámara perfundida con ACSF oxigenado (95% de O2 y 5% de CO2) conteniendo en mM: 124 NaCl, 2,0 KCl, 1,3 MgSO4, 2,5 CaCl2, 1,2 KH2PO4, 25 NaHCO3 y 10 glucosa (2-3 ml/min). Las grabaciones de células enteras se realizaron a 30°C utilizando técnicas convencionales de pinza de parche y un amplificador MultiClamp 700B (Dispositivos Moleculares, Union City, CA). Las neuronas GFP positivas del locus coeruleus se identificaron visualmente y posteriormente se obtuvieron imágenes por medio de un video infrarrojo de contraste de interferencia diferencial en el escenario de un microscopio vertical (Axioskope FS2, Carl Zeiss, Oberkochen, Alemania). Las pipetas de parche (resistencias 4-6 MU) se rellenaron con (en mm): 110 K-gluconato, 10 KCI, 10 HEPES, 10 Na2-fosfocreatina, 2 Mg3-ATP y 0,2 Na3-GTP; el pH se ajustó a 7,2 y la osmolaridad a 300 mOsm. El potencial de retención era de -70 mV. CNO se aplicó al baño.
Pletismografía
La pletismografía en ratones conscientes y sin restricciones se llevó a cabo como se describe en animales adultos de 6 a 12 semanas de edad (Ray et al., 2011). Los ratones habituados se sometieron a un protocolo de habituación de 5 días, cada día consistió en varios minutos de manipulación, toma de temperatura por sonda rectal, inyección de solución salina intraperitoneal y 30 minutos en la cámara de pletismografía. Los ratones se sometieron a pruebas en el plazo de 1 semana desde el último día de habituación. Los ratones no habitados no estaban expuestos a la manipulación ni a la cámara pletismográfica. Todos los ratones fueron naïve a CNO y se usaron solo una vez.
El día de la prueba, los ratones se sacaron de su jaula de casa, se pesaron y se tomó la temperatura rectal. A continuación, se colocó a los animales en una cámara pletismográfica de flujo continuo con temperatura controlada (con camisa de agua a 30°C) y se les permitió aclimatarse durante al menos 20 minutos en condiciones de aire ambiente (21% de O2/79% de N2). Después de la aclimatación y la medición bajo el aire ambiente, el gas de la cámara se cambió a una mezcla hipercápnica de 5% de CO2/21% de O2/74% de N2 durante 20 min. El gas de la cámara se volvió a cambiar al aire de la habitación durante 20 minutos. Los ratones se retiraron brevemente para la medición de la temperatura rectal y la inyección intraperitoneal de CNO (Programa de Síntesis Química y Suministro de Medicamentos del Instituto Nacional de Salud Mental) disuelto en solución salina (1 o 0,1 mg/ml) para una concentración efectiva de 10 o 1 mg/kg, respectivamente. El animal fue devuelto a la cámara por otros 20 minutos de aire de la habitación, 20 minutos de hipercapnia y 20 minutos de aire de la habitación. El animal fue retirado de la cámara, y la temperatura rectal se tomó inmediatamente después de la terminación del experimento.
Cromatografía líquida-Espectrometría de masas
Se pesaron veinticuatro ratones de tipo salvaje, divididos uniformemente por sexo, y se trataron con 10 mg/kg CNO, 1 mg/kg CNO, 0,1 mg/kg CNO o vehículo. Treinta minutos después de la inyección, se recogieron muestras de sangre por punción cardíaca y se colocaron en microtondas de DO. Las muestras se centrifugaron a 4 ° C a 13.500 rpm en una centrífuga de sobremesa y se recogieron sobrenadantes. El suero y el cerebro se mantuvieron a -20 ° C hasta la extracción.
Disolventes de grado HPLC se obtuvieron agua, cloroformo de acetonitrilo y metanol y ácido fórmico de grado espectrométrico de masas de Sigma-Aldrich (St. Louis, MO). La solución de calibración que contiene múltiples calibradores en una solución de acetonitrilo, ácido trifluoracético y agua se compró a Agilent Technologies (Santa Cruz, CA). Metabolitos y patrones internos, incluyendo ácido N-acetil aspártico-d3, triptófano-15N2, ácido glutámico-d5, timina-d4, ácido giberélico, trans-zeatina, ácido jasmónico, ácido antranílico 15N y testosterona-d3 fueron comprados a Sigma-Aldrich (St.Louis, MO). El microtainer R SST TM se obtuvo de Becton Dickinson (Franklin Lakes, NJ).
La extracción consistió en 750 µl de metanol helado: agua (4:1) que contenía 20 µl de patrones internos enriquecidos que se agregaron a cada muestra de cerebro (50 mg) y controles de calidad y luego se homogeneizó durante 1 min cada una. Luego, se agregaron 750 µl de acetonitrilo al 100% que contenía 20 µl de patrones internos con puntas a la muestra de lavado (100 µl) y los controles de calidad y luego se sonicaron durante 5 minutos. Todas las muestras se centrifugaron a 5.000 rpm durante 10 minutos a 4°C. Se recolectó el sobrenadante resultante y se inyectaron 20 µl en LC-MS.
Todas las muestras se analizaron utilizando 6.490 espectrómetros de masas cuadrupolares triples (Agilent Technologies, Santa Clara, CA) acoplados al sistema de HPLC (Agilent Technologies, Santa Clara, CA) mediante monitorización de reacciones múltiples (MRM). Se obtuvieron aproximadamente 8-11 puntos de datos por metabolito detectado. Los metabolitos detectados fueron clozapina, CNO y norclozapina (N-desmetil clozapina). El modo ESI positivo se utilizó en el método. La columna de HPLC era columna ACQUITUPLC C18 (100 Å, 1,8 µm y 2,1 mm × 100 mm). Milford, MA, EE. UU.) con un caudal de 0,5 ml / min.
Recolección y Análisis de datos
Pletismografía
Los cambios de presión de Pletismografía se midieron utilizando un transductor de presión diferencial Validyne DP45 y una cámara de referencia y un demodulador portador CD15 y se registraron con LabChartPro en tiempo real. Las formas de onda se analizaron sin conexión utilizando LabChartPro y código MATLAB escrito a medida para determinar la frecuencia respiratoria (RR), el volumen corriente (VT) (Ray et al., 2011), ventilación por minuto (VE) y análisis de patrones. Las formas de onda respiratorias se recolectaron sin conexión durante los períodos en que el animal estaba en reposo, y las lecturas estaban libres de artefactos de movimiento. Se analizó un mínimo de 1 minuto de datos acumulativos compilados a partir de trazas de al menos 10 segundos de los últimos 10 minutos de una condición experimental dada. El consumo de O2 se determinó comparando la composición del gas entre la calibración en una cámara vacía y la respiración en vivo utilizando un sensor y analizador de oxígeno AEI. La temperatura de la cámara se monitoreaba constantemente utilizando un microtermo 2 y una sonda de termopozos y se registraba con LabChartPro en tiempo real.
Las mediciones de Poincaré y la frecuencia de suspiro y apnea se determinaron utilizando 1 min de trazas sin movimiento de cada condición respiratoria. Los suspiros se definieron como una respiración con una amplitud de al menos el doble de grande que la respiración promedio. Las apneas se definieron como un intervalo entre respiraciones (IBI) al menos dos veces más grande que el IBI promedio. El coeficiente de variación (CV) del IBI y la amplitud también se calculó a partir de la misma compilación de trazas de 1 minuto de cada condición respiratoria (error estándar IBI o amplitud/IBI medio o amplitud).
Estadística
Pletismografía
Se compararon los resultados (RR, VT, VE, VO2, VE/VO2, número de apneas y suspiros, y CV de IBI y amplitud) para datos de aire ambiente e hipercápnicos entre cohortes DBH-Cre; RC::P_hM4D y controles de hermanos utilizando un modelo de regresión lineal de efectos mixtos con tipo animal (experimental vs.control) y la administración de CNO (antes o después de la inyección) como efectos fijos y la identificación del animal como un efecto aleatorio. Los datos de temperatura se compararon utilizando un modelo de regresión lineal de efectos mixtos con el tipo animal (experimental vs.control) como efecto fijo. Se utilizó una p < 0,05 para indicar la significación estadística, y los puntos de datos individuales, la media y el error estándar de la media se muestran en todos los gráficos.
Cromatografía Líquida-Espectrometría de masas
El área obtenida bajo el pico para cada muestra fue normalizada por el control interno y luego al vehículo antes de realizar el análisis estadístico. Se utilizó la prueba de t no apareada para comparar la abundancia relativa de clozapina y CNO en cada tejido por grupo de concentración.
Declaración de Ética
Todos los experimentos fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales de la Facultad de Medicina de Baylor. Los experimentos se ajustaron a las normas nacionales para el cuidado y el uso de animales de experimentación establecidas por la Asociación para la Evaluación y Acreditación del Cuidado de Animales de Laboratorio.
Contribuciones de los autores
JS, FS-M, MC-M y RR concibieron y diseñaron los experimentos. JS, FS-M y PZ realizaron los experimentos y contribuyeron al análisis de los datos. JS, FS-M, VM, MC-M y RR escribieron el artículo.
Financiación
Este estudio fue apoyado por las subvenciones R01HL130249 y R01HL130249-S1 del Instituto Nacional del Corazón, los Pulmones y la Sangre; el Premio Basil O’Connor de March of Dimes; y el Instituto Médico McNair.
Declaración de Conflicto de Intereses
Los autores declaran que la investigación se realizó en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Agradecimientos
Agradecemos a los Dres. Shaila K. Mani y Benjamin Arenkiel por sus útiles discusiones. También agradecemos al Centro de Proteómica de la Facultad de Medicina de Baylor por la ejecución de Cromatografía Líquida-Espectrometría de Masas.
Amiel, J., Dubreuil, V., Ramanantsoa, N., Fortin, G., Gallego, J., Brunet, J.-F., et al. (2009). PHOX2B in respiratory control: lessons from congenital central hypoventilation syndrome and its mouse models. Respire. Fisiol. Neurobiol. 168, 125–132. doi: 10.1016 / j.resp.2009.03.005
Texto completo de CrossRef | Google Scholar
Andrews, N., and File, S. E. (1993). El historial de manipulación de ratas modifica los efectos conductuales de los fármacos en la prueba de ansiedad de laberinto elevado plus. EUR. J. Pharmacol. 235, 109–112. doi: 10.1016/0014-2999(93)90827-5
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Armbruster, B. N., Li, X., Pausch, M. H., Herlitze, S., and Roth, B. L. (2007). La evolución de la cerradura para que se ajuste a la llave para crear una familia de receptores acoplados a proteínas G activados de forma potente por un ligando inerte. Proc. Natl. Acad. Sci. USA 104, 5163-5168. doi: 10.1073 / pnas.0700293104
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
Ashby, C. R., y Wang, R. Y. (1996). Acciones farmacológicas del fármaco antipsicótico atípico clozapina: una revisión. Sinapsis 24, 349-394. doi: 10.1002 / (SICI)1098-2396(199612)24:4<349::AID-SYN5>3.0.CO; 2-D
Resumen de PubMed | Texto completo de CrossRef / Google Scholar
Bahia, C. M. C. d. S., y Pereira, J. S. (2015). Apnea obstructiva del sueño y enfermedades neurodegenerativas: una relación bidireccional. Dement. Neuropsicol. 9, 9–15. doi: 10.1590 / S1980-57642015DN91000003
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
Biancardi, V., Bícego, K. C., Almeida, M. C., and Gargaglioni, L. H. (2008). Locus coeruleus las neuronas noradrenérgicas y el CO2 impulsan la respiración. Pflugers Arch. – EUR. J. Physiol. 455, 1119–1128. doi: 10.1007 / s00424-007-0338-8
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Brust, R. D., Corcoran, A. E., Richerson, G. B., Nattie, E., and Dymecki, S. M. (2014). Identificación funcional y de desarrollo de un subtipo molecular de neurona serotoninérgica cerebral especializada en regular la dinámica respiratoria. Celular República 9, 2152-2165. doi: 10.1016 / j.celrep.2014.11.027
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
Chang, W. H., Lin, S. K., Lane, H. Y., Wei, F. C., Hu, W. H., Lam, Y. W., et al. (1998). Metabolismo reversible de clozapina y N-óxido de clozapina en pacientes esquizofrénicos. Prog. Neuro-Psicofarmacol. Biol. Psychiatry 22, 723-739. doi: 10.1016 / S0278-5846(98)00035-9
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Chen, Y.-W., Das, M., Oyarzabal, E. A., Cheng, Q., Plummer, N. W., Smith, K. G., et al. (2018). Identificación genética de una población de neuronas noradrenérgicas implicadas en la atenuación de las respuestas relacionadas con el estrés. Mol. Psiquiatría 1-16. doi: 10.1038 / s41380-018-0245-8
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Dlouhy, B. J., Gehlbach, B. K., Kreple, C. J., Kawasaki, H., Oya, H., Buzza, C., et al. (2015). Se inhibe la respiración cuando las convulsiones se extienden a la amígdala y cuando se estimula la amígdala. J. Neurocirujano. 35, 10281–10289. doi: 10.1523 / JNEUROSCI.0888-15. 2015
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
Feinstein, J. S., Buzza, C., Hurlemann, R., Follmer, R. L., Dahdaleh, N. S., Coryell, W. H., et al. (2013). Miedo y pánico en humanos con daño bilateral de la amígdala. NAT. Neurociencia. 16, 270–272. doi: 10.1038 / nn.3323
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
Fitton, A., and Heel, R. C. (1990). Clozapina. Una revisión de sus propiedades farmacológicas y su uso terapéutico en esquizofrenia. Drogas 40, 722-747. doi: 10.2165/00003495-199040050-00007
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Fleury Curado, T. A., Pho, H., Dergacheva, O., Berger, S., Lee, R., Freire, C., et al. (2018). El silenciamiento de las motoneuronas hipoglosas conduce a trastornos respiratorios del sueño en ratones delgados. Delantero. Neurol. 9:962. doi: 10.3389 / fneur.2018.00962
Texto completo de CrossRef | Google Scholar
Gargaglioni, L. H., Hartzler, L. K., and Putnam, R. W. (2010). El locus coeruleus y la quimiosensibilidad central. Respire. Fisiol. Neurobiol. 173, 264–273. doi: 10.1016 / j.resp.2010.04.024
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
Gomez, J. L., Bonaventura, J., Lesniak, W., Mathews, W. B., Sysa-Shah, P., Rodriguez, L. A., et al. (2017). La quimogenética reveló: ocupación de DREADD y activación a través de clozapina convertida. Science 357, 503-507. doi: 10.1126 / ciencia.aan2475
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
Guettier, J. M., Gautam, D., Scarselli, M., Ruiz de Azua, I., Li, J. H., Rosemond, E., et al. (2009). Un enfoque químico-genético para estudiar la regulación de la proteína G de la función de las células beta in vivo. Proc. Natl. Acad. Sci. USA 106, 19197-19202. doi: 10.1073 / pnas.0906593106
Texto completo de CrossRef / Google Scholar
Hakim, F., Gozal, D., and Kheirandish-Gozal, L. (2012). Alteraciones simpáticas y catecolaminérgicas en la apnea del sueño, con especial énfasis en los niños. Delantero. Neurol. 3:7. doi: 10.3389 / fneur.2012.00007
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
Hennessy, M. L., Corcoran, A. E., Brust, R. D., Chang, Y., Nattie, E. E., and Dymecki, S. M. (2017). La actividad de las neuronas rafe Pet1 que expresan Taquicinina1 modula el quimioreflejo respiratorio. J. Neurocirujano. 37, 1807–1819. doi: 10.1523 / JNEUROSCI.2316-16. 2016
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
Huckstepp, R. T. R., Cardoza, K. P., Henderson, L. E., and Feldman, J. L. (2015). Papel de los núcleos parafaciales en el control de la respiración en ratas adultas. J. Neurocirujano. 35, 1052–1067. doi: 10.1523 / JNEUROSCI.2953-14. 2015
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
Ilg,A.-K., Enkel, T., Bartsch, D., and Bähner, F. (2018). Efectos conductuales de la clozapina sistémica aguda de dosis bajas en ratas silvestres: implicaciones para el uso de acorazados en neurociencia conductual. Delantero. Behav. Neurociencia. 12:173. doi: 10.3389 / fnbeh.2018.00173
Texto completo de CrossRef | Google Scholar
Isom, G. E., and Elshowihy, R. M. (1982). Interacción del estrés agudo y crónico con la respiración: modificación por naloxona. Pharmacol. Bioquímica. Behav. 16, 599–603. doi: 10.1016/0091-3057(82)90422-1
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Jann, M. W., Lam, Y. W., and Chang, W. H. (1994). Formación rápida de clozapina en cobayas y hombres tras la administración de clozapina-N-óxido. Arco. Int. Farmacodina. Allí. 328, 243–250.
Resumen de PubMed | Google Scholar
Joober, R. (2010). Clozapina: una molécula distinta, poco conocida y poco utilizada. J. Psiquiatría Neurociencia. 35, 147–149. doi: 10.1503 / jpn.100055
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
Kinkead, R., Dupenloup, L., Valois, N., and Gulemetova, R. (2001). Atenuación inducida por estrés de la respuesta ventilatoria hipercápnica en ratas despiertas. J. Appl. Fisiol. 90, 1729–1735. doi: 10.1152 / jappl.2001.90.5.1729
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
Klein, D. F. (1993). Falsas alarmas de asfixia, pánico espontáneo y afecciones relacionadas. Una hipótesis integradora. Arco. Gén. Psiquiatría 50, 306-317. doi: 10.1001 / archpsyc.1993.01820160076009
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
Korsak, A., Sheikhbahaei, S., Machhada, A., Gourine, A. V., and Huckstepp, R. T. R. (2018). El papel de las neuronas parafaciales en el control de la respiración durante el ejercicio. Sci. República 8:400. doi: 10.1038 / s41598-017-17412-z
Texto completo de CrossRef / Google Scholar
Lapin, I. P. (1995). Controles únicos: efecto de la manipulación, la inyección simulada y la inyección intraperitoneal de solución salina en el comportamiento de ratones en un laberinto positivo elevado. J. Pharmacol. Toxicol. Methods 34, 73-77. doi: 10.1016 / 1056-8719 (95)00025-D
Resumen de PubMed / Texto completo de CrossRef / Google Scholar
Lavezzi, A. M., Alfonsi, G., y Matturri, L. (2013). Fisiopatología del complejo del locus coeruleus humano en la muerte súbita inexplicable fetal / neonatal. Neurol. Res. 35, 44 a 53. doi: 10.1179/1743132812Y.0000000108
PubMed Abstract | CrossRef Texto Completo | Google Scholar
MacLaren, D. A. A., Browne, R. W., Shaw, J. K., Krishnan Radhakrishnan, S., Khare, P., España, R. A., et al. (2016). La administración de N-óxido de clozapina produce efectos conductuales en ratas long-evans: implicaciones para el diseño de experimentos DREADD. eNeuro 3, 1-14. doi: 10.1523 / ENEURO.0219-16. 2016
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
Madisen, L., Zwingman, T. A., Sunkin, S. M., Oh, S. W., Zariwala, H. A., Gu, H., et al. (2010). Un sistema de informes y caracterización Cre robusto y de alto rendimiento para todo el cerebro de ratón. NAT. Neurociencia. 13, 133–140. doi: 10.1038 / nn.2467
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
Mahler, S. V., y Aston-Jones, G. (2018). CNO mal? Considerations for the use of dreadds in behavioral neuroscience (en inglés). Neuropsicofarmacología 43, 934-936. doi: 10.1038 / npp.2017.299
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
Manvich, D. F., Webster, K. A., Foster, S.L., Farrell, M. S., Ritchie, J.C., Porter, J. H., et al. (2018). El agonista DREADD N-óxido de clozapina (CNO) se metaboliza de forma inversa a clozapina y produce efectos de estímulo interoceptivo similares a la clozapina en ratas y ratones. Sci. El representante. 8, 3840. doi: 10.1038 / s41598-018-22116-z
Texto completo de CrossRef / Google Scholar
Misslin, R., Herzog, F., Koch, B., and Ropartz, P. (1982). Efectos de aislamiento, manipulación y novedad en la pituitaria response respuesta suprarrenal en el ratón. Psychoneuroendocrinology 7, 217-221. doi: 10.1016/0306-4530(82)90015-4
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Nakamura, A., Zhang, W., Yanagisawa, M., Fukuda, Y., and Kuwaki, T. (2007). Vigilancia atenuación dependiente del estado de la quimiorrefleja hipercápnica y la apnea exagerada del sueño en ratones knockout de orexina. J. Appl. Fisiol. 102, 241–248. doi: 10.1152 / japplfisiol.00679.2006
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
Obonai, T., Yasuhara, M., Nakamura, T., and Takashima, S. (1998). Alteración de las neuronas de catecolaminas en el tronco encefálico de víctimas del síndrome de muerte súbita del lactante. Pediatrics 101, 285-288. doi: 10.1542 / pediatría.101.2.285
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
Ozawa, Y., Takashima, S., y Tada, H. (2003). Alteraciones del subtipo de receptor adrenérgico Alfa2 en el tronco encefálico en el síndrome de muerte súbita del lactante. Zumbido temprano. Dev. 75 (Supl.), S129 a S138. doi: 10.1016 / j. pathophys.2004.01.015
Texto completo de CrossRef | Google Scholar
Padovan-Hernandez, Y., y Knackstedt, L. A. (2018). Reducción dosis-dependiente de la locomoción inducida por cocaína por clozapina-N-óxido en ratas con antecedentes de autoadministración de cocaína. Neurociencia. Lett. 674, 132–135. doi: 10.1016 / j.neulet.2018.03.045
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
Ramanantsoa, N., Hirsch, M.-R., Thoby-Brisson, M., Dubreuil, V., Bouvier, J., Ruffault, P.-L., et al. (2011). Respiración sin quimiosensibilidad al CO(2) en mutantes condicionales de Phox2b. J. Neurocirujano. 31, 12880–12888. doi: 10.1523 / JNEUROSCI.1721-11.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
Raper, J., Morrison, R. D., Daniels, J. S., Howell, L., Bachevalier, J., Wichmann, T., et al. (2017). Metabolism and distribution of clozapine-N-oxide: implications for nonhuman primate chemogenetics. ACS Chem. Neurosci. 8, 1570–1576. doi: 10.1021/acschemneuro.7b00079
PubMed Abstract | CrossRef Full Text | Google Scholar
Ray, R. S., Corcoran, A. E., Brust, R. D., Soriano, L. P., Nattie, E. E., and Dymecki, S. M. (2013). Las neuronas Egr2 controlan la respuesta respiratoria del adulto a la hipercapnia. Brain Res .. 1511, 115-125. doi: 10.1016 / j. brainres.2012.12.017
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
Ray, R. S., Corcoran, A. E., Brust, R. D., Kim, J.C., Richerson, G. B., Nattie, E., et al. (2011). Alteración del control respiratorio y de la temperatura corporal en caso de inhibición aguda de las neuronas serotoninérgicas. Science 333, 637-642. doi: 10.1126 / ciencia.1205295
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
Ryabinin, A. E., Wang, Y. M. y Finn, D. A. (1999). Diferentes niveles de inmunorreactividad de Fos después de manipulación repetida y estrés por inyección en dos cepas endogámicas de ratones. Pharmacol. Bioquímica. Behav. 63, 143–151. doi: 10.1016 / S0091-3057(98)00239-1
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Snyder, B., Shell, B., Cunningham, J. T., and Cunningham, R. L. (2017). La hipoxia intermitente crónica induce estrés oxidativo e inflamación en regiones cerebrales asociadas con neurodegeneración en estadio temprano. Fisiol. El representante. 5, 1-13. doi: 10.14814 / phy2.13258
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
Sun, J. J., Huang, T.-W., Neul, J. L., and Ray, R. S. (2017). Los genes embrionarios del patrón del cerebro posterior delinean poblaciones cardiorrespiratorias y homeostáticas metabólicas distintas en el adulto. Sci. República 7:9117. doi: 10.1038 / s41598-017-08810-4
Texto completo de CrossRef | Google Scholar
Sun, J. J., y Ray, R. S. (2017). Tg (Th-Cre)FI172Gsat (Th-Cre) define las neuronas que se requieren para los reflejos hipercápnicos e hipóxicos completos. Biol. Abierto 6, 1200-1208. doi: 10.1242 / bio.026823
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
Taugher, R. J., Lu, Y., Wang, Y., Kreple, C. J., Ghobbeh, A., Fan, R., et al. (2014). El núcleo del lecho de la estría terminal es crítico para el comportamiento relacionado con la ansiedad evocado por el CO2 y la acidosis. J. Neurocirujano. 34, 10247–10255. doi: 10.1523 / JNEUROSCI.1680-14. 2014
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
Valentino, R. J., y Van Bockstaele, E. (2008). Regulación convergente de la actividad del locus coeruleus como respuesta adaptativa al estrés. EUR. J. Pharmacol. 583, 194–203. doi: 10.1016 / j. ejphar.2007.11.062
Texto completo de CrossRef | Google Scholar
Verbraecken, J., y McNicholas, W. T. (2013). Mecánica respiratoria y control ventilatorio en síndrome de superposición e hipoventilación de obesidad. Respire. Res. 14: 132. doi: 10.1186/1465-9921-14-132
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Viemari, J.-C. (2008). Modulación noradrenérgica de la red neural respiratoria. Respire. Fisiol. Neurobiol. 164, 123–130. doi: 10.1016 / j.resp.2008.06.016
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
Winter, A., Ahlbrand, R., Naik, D., and Sah, R. (2017). Sensibilidad diferencial de comportamiento a la inhalación de dióxido de carbono (CO2) en ratas. Neuroscience 346, 423-433. doi: 10.1016 / j.neurociencia.2017.01.003
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
Ziemann, A. E., Allen, J. E., Dahdaleh, N. S., Drebot, I. I., Coryell, M. W., Wunsch, A. M., et al. (2009). La amígdala es un quimiosensor que detecta dióxido de carbono y acidosis para provocar un comportamiento de miedo. Cell 139, 1012–1021. doi: 10.1016/j.cell.2009.10.029
PubMed Abstract | CrossRef Full Text | Google Scholar