- Introducción
- Materiales y Métodos
- Se recolectaron Ovocitos y Microinyección de ARN
- Aislamiento de Fracciones de Membrana e Inmunobloque
- Inmunohistoquímica
- Microscopía electrónica de fractura por congelación
- Ensayo de Ovocitos emparejados y Cuantificación de Áreas de Contacto
- Ensayo de Impulso de presión hidrostática
- Incubación de caprato
- Análisis estadístico
- Resultados
- Expresión de Claudin-5 e Integración en X. membrana Plasmática de Ovocitos de laevis
- Se ven parches de Hebras de Unión Estrecha en Ovocitos que Expresan Claudina-5
- Ensayo pareado de ovocitos para el Análisis de la Trans-Interacción de Claudina
- El Ensayo de Impulso de Presión Hidrostática Revela la Unión Específica de Claudina de Pares de Ovocitos
- Incubación Con Caprato
- Discusión
- Las claudinas Contribuyen a Propiedades de Adhesión más Fuertes
- Conclusión
- Declaración de disponibilidad de datos
- Declaración ética
- Contribuciones de los autores
- Financiación
- Conflicto de intereses
- Agradecimientos
- Material suplementario
Introducción
La familia de proteínas de unión estrecha es crucial para la fisiología celular, ya que la falta o el deterioro se asocian con enfermedades y disfunción de muchos órganos y tejidos, como se muestra, por ejemplo, en el oído interno (Wilcox et al., 2001; Florian et al., 2003), riñón (Konrad et al., 2006; Günzel et al., 2009), tracto gastrointestinal (Resnick et al., 2005; Amasheh et al., 2009), epidermis (Furuse et al., 2002; Tebbe et al., 2002), y los capilares cerebrales (Nitta et al., 2003; Wolburg et al., 2003). Las claudinas representan una familia de proteínas transmembrana que comprende al menos 27 miembros (Mineta et al., 2011). Además de sus cuatro dominios de hélice transmembrana, contienen dos bucles extracelulares (ECL1 y ECL2), un corto terminal N y un terminal C (Suzuki et al., 2014). Los patrones específicos de expresión de claudina determinan y reflejan la permeabilidad selectiva de los epitelios, y la capacidad de las proteínas de claudina para interactuar en cis (dentro de la misma membrana) y en trans (entre las membranas de la célula vecina) permite la formación de barreras formadoras y de poros formando hebras de unión apretadas (Van Itallie y Anderson, 2006).
La claudina – 5 se expresa fuertemente en endotelia capilar y domina la unión estrecha (TJ) de la barrera hematoencefálica (BBB), ya que la expresión es >100 veces mayor en comparación con cualquier otra claudina (Ohtsuki et al., 2007). Además, se expresa en una variedad de tejidos epiteliales, incluidos los pulmonares (Soini, 2011), los tejidos exocrinos (Comper et al., 2009), intestinal (García-Hernández et al., 2017) y del tracto urinario (Koda et al., 2011). Sin embargo, la claudina-5 causa una barrera más fuerte en los capilares cerebrales que en otros tejidos (Reinhold y Rittner, 2017) y su función se ve afectada en trastornos neurodegenerativos y neuroinflamatorios (Greene et al., 2019). Por lo tanto, claudin-5 es crucial para mantener la acreditación. Pero la BBB no solo es protectora, sino que también limita las opciones terapéuticas, ya que los medicamentos no pueden penetrar esta barrera.
Nitta et al. (2003) informaron que el BBB es más permeable a moléculas de 800 Da de tamaño en ratones deficientes en claudina-5 en comparación con ratones de tipo salvaje (Nitta et al., 2003). Esto fue de acuerdo con los experimentos de transfección que demostraron un efecto de sellado de claudina-5 en monocapas de células Caco-2 (Amasheh et al., 2005).
Otra claudina formadora de barreras importante es la claudina-3, que se ha informado sella selectivamente la barrera contra el paso de iones de carga y solutos sin carga (Milatz et al., 2010). También se expresa en la unión endotelial estrecha de los capilares cerebrales y su pérdida funcional se observa en fases de inflamación del microvaso, glioblastoma y plexo coroideo de pacientes con esclerosis múltiple (Engelhardt et al., 2001; Wolburg et al., 2003).
Las propiedades de barrera se pueden modificar dinámicamente, p. ej., se demostró que la incubación con caprato de sodio disminuye de forma rápida y reversible la resistencia eléctrica transepitelial en la línea celular intestinal humana HT-29/B6 (Krug et al., 2013). El caprato de sodio abre transitoriamente barreras que contienen claudina-5 en uniones estrechas de células epiteliales y endoteliales (Del Vecchio et al., 2012).
Esto indica que claudin – 5 es un objetivo prometedor para la mejora de la administración de medicamentos en la BBB.
En este estudio, nuestro objetivo fue emplear el sistema de expresión heteróloga de ovocitos Xenopus laevis (Vitzthum et al., 2019) para el análisis de la interacción y pertubación de claudina-5 y claudina-3. Debido a la falta de contactos celulares endógenos, este sistema de expresión unicelular permite el análisis de claudinas específicas sin interferencia de otras proteínas de unión estrecha.
Materiales y Métodos
Se recolectaron Ovocitos y Microinyección de ARN
Ovocitos de ranas africanas adultas por laparotomía quirúrgica. Para la anastesia, 0.Se utilizó MS222 al 2% (metanosulfonato de 3-aminobenzoato de etilo, Sigma-Aldrich, Taufkirchen, Alemania) como solución de baño durante 5-10 minutos a 20°C. Una vez alcanzada la anastesia quirúrgica, se hicieron incisiones en la piel y el músculo abdominal, se exteriorizó la masa ovárica y se extirpó tejido ovárico. El aislamiento de ovocitos se llevó a cabo mediante digestión enzimática a temperatura ambiente durante 90 min en 1,5 mg/ml de colagenasa Fisher BioReagents BP2649-1 (Fisher Scientific, Schwerte, Alemania) disuelta en solución de timbre de ovocitos (ORi), según lo descrito por Vitzthum et al. (2019). Las células foliculares se eliminaron por incubación en ORi libres de Ca2 + que contenían (en mm): NaCl (90), KCl (1), EGTA (ácido tetraacético trietilenglicol diamina) (1), 5 HEPES (5); pH 7,4 durante 10 min en un agitador mecánico a 50 rpm. Se inyectaron ovocitos de estadios V y VI (>1000 µm) (Nanolitro 2010, World Precision Instruments, Sarasota, FL, Estados Unidos) con 1 ng de ARN que codificaba claudina-5 humana, claudina-3 o agua libre de RNasa como controles. El volumen de inyección fue de 50,6 nl por ovocito. Después de la inyección, los ovocitos se incubaron a 16°C durante 3 días para la expresión de proteínas.
Aislamiento de Fracciones de Membrana e Inmunobloque
Se agruparon diez ovocitos inyectados para análisis de western blot y se resuspendieron en tampón de homogeneización de 500 µl que contenía (en mM) MgCl2 (5), NaH2PO4 (5), EDTA (ácido etilendiaminotetraacético) (1), sacarosa (80) y Tris (Tris(hidroximetil)aminometano) (20); pH 7.4. Los extractos de ovocitos se centrifugaron dos veces a 200 rpm durante 10 minutos a 4 ° C para desechar los restos celulares. El sobrenadante se centrifugó a 13.000 rpm durante 30 min a 4 ° C para pelletear la membrana celular, tal como lo describen Leduc-Nadeau et al. (2007). Los gránulos se resuspendieron en tampón de homogeneización de 80 µl. La cuantificación de proteínas se realizó colorimétricamente utilizando el Kit de Ensayo de Proteínas Pierce de 600 nm (Thermo Fisher Scientific, Hennigsdorf, Alemania) de acuerdo con las instrucciones del fabricante en una placa de 96 pocillos. El lector de placas (Lector de Placas Multimodo PerkinElmer EnSpire, Waltham, MA, Estados Unidos) se ajustó a 562 nm y se empleó el Estándar de Albúmina Sérica Bovina (Thermo Fisher Scientific, Hennigsdorf, Alemania) de 125 a 2000 µg/ml para la evaluación. Antes de la inmunoblocción, las muestras se mezclaron con tampón 4× Laemmli (Laboratorios Bio-Rad, Múnich, Alemania), se cargaron en un gel de poliacrilamida SDS al 10% y se electroforizaron. Para la transferencia de proteínas, se utilizaron membranas de PVDF y se bloquearon en leche seca descremada al 5% en solución salina tamponada Tris durante 120 min. Las proteínas se detectaron mediante inmunoblocción utilizando anticuerpos primarios elevados contra claudina – 3 o claudina-5 (invitrogen #35-2500, #34-1700, #34-1600, Life Technologies, Carlsbad, CA, Estados Unidos).
Se utilizaron anticuerpos conjugados con peroxidasa contra conejos y ratones de cabra (#7074, #7076 Cell Signaling Technology, Danvers, MA, Estados Unidos) para unirse a los anticuerpos primarios y, por lo tanto, incubarse durante un mínimo de 45 minutos a temperatura ambiente. Para la detección, se utilizó el sustrato Clarity Western ECL (#1705061, Bio-Rad Laboratories GmbH, Múnich, Alemania) y se visualizaron las señales mediante un sistema ChemiDoc MP (Bio-Rad Laboratories).
Inmunohistoquímica
Los ovocitos inyectados se fijaron en un 4% de PFA (16% de paraformaldehído, E15700, Science Service, Múnich, Alemania) durante 4 horas a temperatura ambiente, seguido de un gradiente de deshidratación del 70% de etanol al xilol (Carl Roth, Karlsruhe, Alemania) en 48 horas. Las muestras se incrustaron en parafina y se seccionaron (5 µm) utilizando un microtomo Leica RM 2245 (Leica Microsystems Heidelberg, Alemania). Poco antes del tratamiento inmunohistoquímico, la parafina se eliminó a través del gradiente de xilol a etanol. Los puntos de unión inespecíficos se bloquearon utilizando suero de cabra al 5% en solución salina tamponada con fosfato y se incubaron con los mismos anticuerpos primarios que para la inmunoblocción. Las muestras se incubaron con los anticuerpos secundarios Alexa Fluor – 488 goat anti-rabbit y Alexa Fluor-594 goat anti-mouse (Life Technologies, Carlsbad, CA, Estados Unidos) y se examinaron mediante microscopía de inmunofluorescencia de barrido láser confocal (LSM 710, Zeiss, Oberkochen, Alemania).
Microscopía electrónica de fractura por congelación
La microscopía electrónica de fractura por congelación se realizó como se informó recientemente (Greene et al., 2019). Para la fijación, los ovocitos inyectados se incubaron en glutaraldehído (2,5% en tampón de cacodilato de 0,1 M) durante la noche a 4°C. Después del lavado con tampón de cacodilato, los ovocitos se prepararon para la fractura por congelación. Las muestras se crioprotegieron en glicerol al 30% y se congelaron en nitrógeno líquido. Después de fracturarse y sombrearse con platino y carbono (BAF400D; Balzers, Liechtenstein), el material orgánico restante se eliminó mediante un lavado de hipoclorito de sodio. Los ovocitos se analizaron en un microscopio electrónico de transmisión (EM-10, Zeiss, Oberkochen, Alemania) y se fotografiaron con una cámara digital (Tröndle GmbH). El análisis morfométrico de los hilos de unión apretados se realizó con un aumento de 20.000×.
Ensayo de Ovocitos emparejados y Cuantificación de Áreas de Contacto
El manitol se implementó para reducir el tamaño de los ovocitos inyectados y permitir la extracción mecánica de la membrana vitelina con fórceps sin dañar la membrana plasmática. se colocaron de 5 a 10 ovocitos en una placa de petri (35 mm de diámetro, Thermo Fisher, Henningsdorf, Alemania, #153066) llena de ORi. Se añadió manitol y se disolvió hasta lograr una contracción hipertónica de las células (aproximadamente 400 mOsmol/l durante 10 min). Tras la desvitelinización manual, los ovocitos se transfirieron inmediatamente a una placa de 24 pocillos (1. 86 cm2 de superficie, TPP Techno Plastic Products, Trasadingen, Suiza, # 92024) que contienen 2 ml de ORi. En cada pozo, dos células se agruparon suavemente empujándolas juntas con una pipeta Pasteur (1 ml, Thermo Fisher, Henningsdorf, Alemania, #PP88SB) y una sonda bulbosa.
Los pares de ovocitos con expresión de claudina-5 (cldn5-cldn5), expresión de claudina − 3 (cldn3-cldn3), coexpresación de claudina-3 y claudina − 5 (cldn3,5-cldn3,5) y ovocitos de control (control-control) se mantuvieron juntos hasta 48 h en ORi a 16°C.
se empleó para cuantificar el área de contacto de ovocitos agrupados después de 1, 24 y 48 h. En estos momentos se tomaron imágenes de pares de ovocitos naïve en platos de cultivo de 24 pocillos utilizando un microscopio Leica DMI6000 B (Leica Microsystems, Wetzlar, Alemania). El diámetro del área de contacto se midió utilizando la escala de micrones (LAS-AF 3.2.0). Las áreas de contacto se consideran circulares y, por lo tanto, el área de contacto se calculó utilizando la ecuación circular A=π∙r2.
Ensayo de Impulso de presión hidrostática
Las membranas de vitelina se eliminaron mecánicamente como se describió anteriormente y los ovocitos se agruparon de forma analágica en el ensayo de ovocitos emparejados. Además, se probaron pares mixtos de ovocitos (control–cldn5 y control–cldn3) en el ensayo de impulso de presión hidrostática (HPI). Después de 24 h de estabilización, se creó un impulso hidrostático definido utilizando una pipeta electrónica de un solo canal (EE-300R, Eppendorf Research Pro, versión de software 2.06.00, Hamburgo, Alemania).
Los ovocitos se mantuvieron en placas de 24 pocillos que contenían 2 ml de ORi y se comprobó la posición central antes de la aplicación del volumen de pipeteo de 250 µl de ORi. La velocidad de dispensación se ajustó uniformemente a la velocidad máxima, lo que equivale a una velocidad de dispensación de 0,9 s. Además, el ángulo (45°) y la distancia de aplicación (∼1,3 cm) se aplicaron uniformemente. La presión ambiental, la viscosidad de los ORi y el diámetro de la abertura de la punta de la pipeta se mantuvieron en condiciones constantes. Se empleó microscopía de campo brillante para cuantificar las áreas de contacto 30 min después de aplicar la presión hidrostática y compararlas con las áreas de contacto antes de la aplicación. La configuración experimental se describe en la Figura 1.FIGURA
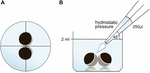
Gráfico 1 Configuración experimental del ensayo de impulso de presión hidrostática (A) vista superior esquemática del pozo: se comprobó la posición central del par de ovocitos antes de aplicar la presión hidrostática. B) Vista lateral esquemática del pozo: se añadieron 250 µl de ORi utilizando una pipeta electrónica de un solo canal. La velocidad de dispensación se ajustó uniformemente a la velocidad máxima. El ángulo (45°) y la distancia de aplicación se aplicaron uniformemente. La presión ambiental, la viscosidad de los ORi y el diámetro de la abertura de la punta de la pipeta se mantuvieron en condiciones constantes.Incubación de caprato
Incubación de caprato
Para la incubación de caprato, se añadió caprato sódico (#C4151, Sigma Aldrich, Taufkirchen, Alemania) en concentraciones finales de 50, 100 y 500 µM, u ORi como grupo de referencia, a los ovocitos 24 h después del emparejamiento. Los ovocitos se mantuvieron en 24 placas de pocillos que contenían 2 ml de ORi y la solución de caprato se disolvió en un volumen de adición definido de 250 µl de ORi por pocillo. El ancho del área de contacto se cuantificó a los 30, 60 y 120 minutos después de la adición.
Análisis estadístico
El análisis estadístico se realizó con JMP Pro 14.0.0 (NC, Estados Unidos). Los datos se presentan como medianas y se muestran como cambios porcentuales basados en la combinación agrupada en los primeros puntos de examen. Las figuras 4 y 5 se presentan como gráficos de caja, que representan el primer cuartil (25%), la mediana (50%) y el segundo cuartil (75%). Los bigotes se dibujan hacia abajo hasta el percentil 10 y hasta el percentil 90. Se comprobó la distribución normal mediante la prueba de Shapiro-Wilk.
Se utilizó la prueba de Kruskal–Wallis para la comparación múltiple, seguida de una corrección de Dunn-Bonferroni. los valores de p se dan como números continuos.
Resultados
Expresión de Claudin-5 e Integración en X. membrana Plasmática de Ovocitos de laevis
Para probar la expresión e integración exitosas de la proteína de unión apretada claudina-5 en la membrana plasmática de ovocitos, 3 días después de la inyección de claudina-5 cRNA, se analizaron fracciones de membrana mediante inmunoblotaje. Todas las muestras de tres animales individuales (d1–d3) revelaron señales específicas de claudina-5 a 23 kDa, mientras que los ovocitos inyectados con agua libre de RNasa no mostraron señales específicas para la expresión de claudina-5 (Figura 2A).FIGURA
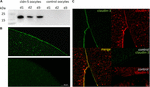
Gráfico 2 Detección de heteróloga se expresa claudinas en ovocitos de Xenopus laevis. A) Análisis de inmunoblots de la proteína de unión estrecha claudina-5 en ovocitos X. laevis de tres animales (d1-d3). Los lisados de membrana celular se sometieron a SDS-PAGE seguido de inmunoblot en membranas de PVDF. Las membranas se incubaron con anticuerpos primarios y anticuerpos conjugados con peroxidasa secundaria (n = 3). B) La tinción inmunofluorescente reveló señales específicas de claudina-5 (verde) en las membranas de los ovocitos de todos los ovocitos inyectados con cRNA, mientras que en los controles inyectados con agua, no se detectaron señales específicas de claudina en la microscopía confocal. Imágenes representativas de ovocitos procedentes de tres animales. Barras de escala: 50 µm. C) La tinción inmunofluorescente de ovocitos que expresan claudina-5 y claudina-3 reveló señales específicas de claudina-3 (verde) y señales de claudina-5 (rojo) en membranas de ovocitos de ovocitos inyectados con cRNA, mientras que en controles inyectados con agua no se detectaron señales específicas de claudina. La colocalización de las proteínas de claudina expresadas dentro de la membrana plasmática de los ovocitos se revela mediante tinción inmunofluorescente doble (amarilla). Barra de escala: 10 µm.
Para la visualización de las proteínas expresadas dentro de la membrana plasmática, se realizaron tinciones inmunohistoquímicas y se analizaron mediante microscopía de escaneo láser confocal (Figura 2B). Se detectaron señales específicas y se distribuyeron uniformemente por toda la membrana plasmática de los ovocitos que expresaban claudina-5. De acuerdo con los inmunoblots, no se detectaron señales específicas en las membranas plasmáticas de los ovocitos de control.
Así, después de la inyección de cRNA, la claudina-5 se expresó con éxito e integró en la membrana plasmática de los ovocitos de X. laevis.
La coexpresión de claudina-3 y claudina-5 en pares de ovocitos reveló señales específicas para claudina-5 (roja) y claudina-3 (verde) en ambas células (Figura 2C). Las membranas plasmáticas de los ovocitos mostraron una fusión de las células vecinas proporcionada por la interacción directa cldn3, 5-cldn3, 5 (amarillo).
Se ven parches de Hebras de Unión Estrecha en Ovocitos que Expresan Claudina-5
Se analizaron membranas plasmáticas de ovocitos y la visualización de hebras de unión estrecha fue exitosa (Figura 3). La microscopía electrónica de fractura por congelación mostró parches de morfología de hebras en las membranas plasmáticas de ovocitos inyectados con claudina-5, y la organización de hebras de ovocitos que expresan claudina-5 fue altamente organizada y de forma angular (Figura 3A). Las hebras de unión apretadas se detectaron principalmente en la cara protoplasmática (P-) de la membrana. Los ovocitos inyectados con Claudina-3 mostraron hebras de unión apretadas redondeadas y altamente organizadas, como se informó anteriormente (Vitzthum et al., 2019; Figura 3B). La microscopía electrónica de fractura por congelación de los ovocitos coexpresores de claudina-3 y claudina-5 reveló fibrillas que tienen propiedades de claudina-3 y claudina-5. La arquitectura de la hebra fibrilar de los ovocitos coexpresores apareció redondeada y compleja como ovocitos que expresan claudina – 3, pero también discontinua y más angulada como se muestra para las células que expresan claudina-5 (Figura 3C). Los ovocitos de control tenían una superficie lisa típica (Figura 3D).FIGURA
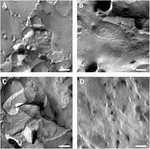
Gráfico 3 Microscopía electrónica de fractura por congelación. (A) La microscopía electrónica de fractura por congelación revela una proteína de unión apretada cldn-5 como una malla de fibrillas angulares discontinuas en filas en ovocitos de Xenopus laevis. (B) La microscopía electrónica de fractura por congelación revela una proteína de unión apretada cldn-3 como una malla de fibrillas redondeadas en ovocitos X. laevis. C) La microscopía electrónica de fractura por congelación de los ovocitos coexpresores de claudina-3 y claudina-5 revela fibrillas que tienen propiedades de claudina-3 y claudina-5. D) Los ovocitos de control inyectados con agua tienen una superficie lisa. Imágenes representativas de ovocitos procedentes de tres animales. Barra de escala: 250 nm.FIGURA
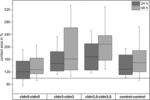
Gráfico 4 Mediana de las áreas de contacto de las combinaciones de ovocitos agrupados cldn5–cldn5, cldn3–cldn3, cldn3,5–cldn3,5 y control–control 24 y 48 h después de la agrupación en % de las áreas de contacto iniciales poco después de la agrupación (n = 8-38).FIGURA

Gráfico 5 Áreas de contacto de claudina-5, claudina-3 y ovocitos coexpresores de claudina-3 y claudina-5 en desafío de impulso de presión hidrostática (IPH) después del período de estabilización y 30 min después de IPH (n = 16-70, *p < 0,05, **p < 0.01, Kruskal-Wallis seguido de una corrección Dunn–Bonferroni).
Ensayo pareado de ovocitos para el Análisis de la Trans-Interacción de Claudina
Todas las combinaciones agrupadas mostraron un aumento dependiente del tiempo en el área de contacto durante el período de tiempo medido (Figura 4 y Tabla 1).CUADRO
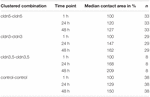
Cuadro 1 Áreas de contacto de ovocitos dentro de las 48 h después de la agrupación.
El área de contacto de los ovocitos de control inyectados con agua aumentó al 129% después de 24 h y al 150% después de 48 h. Los pares agrupados de ovocitos que expresaban claudina – 3 también mostraron un aumento de las áreas de contacto al 147% (24 h) y al 162% (48 h). Pares agrupados de ovocitos coexpresores de claudina – 3 y claudina-5 mostraron áreas de contacto del 168% (24 h) y del 209% (48 h). Pares agrupados de ovocitos que expresaban claudina – 5 sola mostraron áreas de contacto del 120% (24 h) y del 127% (48 h). Por lo tanto, las áreas de contacto en todas las combinaciones probadas fueron comparables.
El Ensayo de Impulso de Presión Hidrostática Revela la Unión Específica de Claudina de Pares de Ovocitos
En un enfoque separado, los ovocitos que expresaban claudina-3 o claudina-5 o coexpresaban ambas claudinas se agruparon después de la desvitelinización mecánica. Los ovocitos se desafiaron utilizando un IPH y las áreas de contacto se midieron y calcularon 30 min después del desafío y se compararon con las áreas iniciales después del período de estabilización de 24 h (Figura 5 y Tabla 2). Después del desafío de presión hidrostática, el área de contacto de los ovocitos de control inyectados con agua disminuyó al 89%. Pares agrupados de ovocitos que expresaban claudina-5, claudina-3 o que coexpresaban claudina-3 y claudina-5 retuvieron áreas de contacto más grandes (97%, p = 0,0235; 96%, p = 0,003; 98%, p = 0,0253). Las áreas de contacto de los ovocitos de control inyectados con agua mezclada y los ovocitos que expresan claudina (control-cldn5 y control-cldn3) no difieren significativamente de los ovocitos de control (93%, p = 0,2900; 83%, p = 0,4455).CUADRO
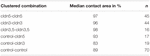
Cuadro 2 Ensayo de impulso de presión hidrostática.
Incubación Con Caprato
En un experimento piloto de incubación, se inyectaron ovocitos y se emparejaron en combinaciones que expresaban claudina-5 (cldn5–cldn5) o se inyectaron con agua libre de RNasa como controles (control–control). Se incubaron pares con concentraciones finales de caprato de sodio de 50, 100 o 500 µM. La incubación de pares de ovocitos con ORi sirvió como grupo de referencia. Los ovocitos se agruparon y después de 24 h de estabilización, se inició la incubación y se midieron los anchos de contacto 30, 60 y 120 min después de la adición (Figura suplementaria S1).
La adición de ORi dio lugar a una disminución inicial de las áreas de contacto tanto en pares de ovocitos que expresan claudina como en pares de ovocitos inyectados con agua que se dispersan 60 o 120 minutos después de la adición. Esto está delineado por la forma parabólica de la línea de conexión entre las áreas de contacto medianas a lo largo del tiempo (curvas rojas en la Figura Suplementaria S1). Sin embargo, la incubación con caprato de sodio de 100 y 500 µM aumentó las áreas de contacto ligeramente (100 µM) o fuertemente (500 µM) 30 minutos después de la adición de caprato de 5,1 × 105 a 5,2 × 105 µm2 y de 4,3 × 105 a 4,9 × 105 µm2.
Discusión
En el presente estudio, empleamos el modelo clásico para modelar transportadores y enfermedades humanas (Tammaro et al., 2009; Nenni et al., 2019), los ovocitos X. laevis, para un análisis en profundidad de la interacción de claudina-5 y la contribución funcional al sello de unión. Con este fin, se estableció un enfoque novedoso, la introducción de un IPH para la interacción desafiante dentro del área de contacto de ovocitos Xenopus agrupados.
Las claudinas Contribuyen a Propiedades de Adhesión más Fuertes
De acuerdo con los resultados anteriores de Vitzthum et al. (2019), las claudinas individuales expresadas en ovocitos no dieron lugar a un aumento de las áreas de contacto de interacción en comparación con los ovocitos de control. Sin embargo, la visualización inmunoblot e inmunohistoquímica demostró la expresión e integración exitosas en la membrana plasmática de ovocitos de X. laevis. Además, el uso de microscopía de escaneo láser confocal permitió una localización precisa de las claudinas expresadas en la membrana plasmática, ya que el agujero de alfiler bloqueaba la fluorescencia fuera de foco. No se buscó una cuantificación de las señales inmunohistoquímicas, ya que la afinidad de los anticuerpos para unirse a sus objetivos difiere.
Vedula et al. (2009) utilizaron una técnica de aspiración con micropipeta para investigar aspectos de la interacción claudina-claudina utilizando fibroblastos L transfectados con ocludina marcada con GFP, cldn-1 y cldn-2. La fuerza de separación necesaria para separar dos células entre sí era mayor en las células transfectadas cldn-1 y cldn-2 (∼2,8 y 2,3 nN, respectivamente). Aunque este enfoque podría parecer también prometedor para el análisis de interacción claudina-claudina de los ovocitos que expresan, las pruebas preliminares revelaron que un desprendimiento de ovocitos agrupados no es posible sin la interrupción de las membranas plasmáticas de los ovocitos.
Por lo tanto, como un enfoque novedoso, la fuerza de las conexiones se midió mediante un IPH. Aunque el IPH no proporciona una cuantificación de la fuerza de separación en valores absolutos (p. ej., en Newton), permite un análisis rápido y rentable de la interacción de claudina sin perturbar otras proteínas de unión apretada (p. ej., ocludina, tricelulina, mermelada-A). Las claudinas contribuyen a la unión de pares de ovocitos, ya que muestran un área de contacto más grande en comparación con los ovocitos inyectados con agua después del IPH. Esto indica una fuerte interacción trans homofílica entre las células que expresan claudina.
La arquitectura de fibras de hilo es específica para claudinas individuales (Colegio et al., 2002). En microscopía electrónica de fractura por congelación, se informó que claudin-3 ensamblaba una malla de hebras más redondeada en formas de bucle en ovocitos Xenopus (Vitzthum et al., 2019; Figura 3B) mientras que en nuestro estudio, claudin – 5 formó una malla más angular y ordenada en filas. Las imágenes revelaron que la proteína de unión apretada claudina-5 forma una malla de fibrillas en filas discontinuas de forma angular en ovocitos X. laevis. Esto está de acuerdo con las hebras de claudina-5 conocidas como cadenas de partículas asociadas a la fase P (Pionek et al., 2011). En nuestros experimentos, la forma geométrica de las fibrillas parecía no tener ningún efecto en las propiedades de adhesión de los ovocitos. De acuerdo con eso, se informó que la resistencia paracelular no estaba relacionada con el número de fibras y las propiedades formadoras de fibras (Colegio et al., 2002). Además, se ha demostrado que la claudina-3 y la claudina-5 tienen una capacidad similar para la trans-interacción homofílica en células HEK293 (Pionek et al., 2011).
Este modelo de ovocitos X. laevis, que expresa proteínas de unión única y apretada, permite observar el efecto de sustancias como el caprato de sodio en la formación de áreas de contacto entre ovocitos agrupados. Por lo tanto, puede proporcionar una herramienta útil para una detección eficiente de sustancias que afecten a la barrera de unión estrecha.
Las concentraciones de caprato de sodio de 100 y 500 µM pueden transmitir un efecto protector sobre los ovocitos que expresan claudina-5, lo que resulta en un aumento de las áreas de contacto después de 30 minutos de incubación.
Krug et al. (2013) demostraron que la incubación con caprato de sodio condujo a una disminución rápida y reversible de la resistencia transepitelial en la línea celular intestinal humana HT-29/B6. Además, la microscopía de escaneo láser confocal reveló una marcada reducción de claudina-5 en células HT-29/B6 tratadas con laurato de ácidos grasos de cadena media (Dittmann et al., 2014). El primer bucle extracelular de claudinas (ECL1) es importante para las propiedades de barrera de la unión estrecha, mientras que el segundo bucle extracelular (ECL2) está involucrado en la formación de cadenas de trans-interacción (Pionek et al., 2008; Rossa et al., 2014; Greene et al., 2019). Los aglutinantes de claudina – 5 dirigidos a ECL1 o ECL2 de claudina-5 pueden inducir la captación intracelular de la proteína de unión apretada, frustrando así las trans-interacciones de claudina-5 en el sello de unión apretada entre las células adyacentes y aflojando el espacio paracelular (Hashimoto et al., 2017).
Por lo tanto, planteamos la hipótesis de que la incubación con caprato de sodio conduciría a una disminución en el área de contacto de los ovocitos X. laevis expresados en claudina-5 agrupados. Inesperadamente, el aumento de las concentraciones de caprato de sodio (100 y 500 µM) condujo a un aumento de las áreas de contacto de ovocitos agrupados que expresaban claudina-5, lo que indica un efecto protector del caprato de sodio en el sellado de unión apretado. Además, se describe que el caprato de sodio induce la contracción del anillo perijuncional de actomiosina, ensanchando el espacio paracelular (Lindmark et al., 1998; Maher et al., 2009). Este efecto se basa en la fosforilación de la cadena ligera reguladora de la miosina a través de una activación de la fosfolipasa C que conduce a una escisión del fosfatidilinositol 4,5-bisfosfato (PIP2) en trifosfato de inositol (IP3) y diacilglicerol (Tomita et al., 1995). El complejo de unión apretada unido por la proteína de andamiaje ZO-1 al citoesqueleto de actina se redistribuye desde la unión apretada al citoplasma (Lindmark et al., 1998; Turner, 2000). La citoarquitectura del ovocito de X. laevis es crucial para la regionalización citoplasmática durante la ovogénesis (Wylie et al., 1985). Sin embargo, antes de la fertilización, la expresión del gen tjp-1, el gen que codifica para ZO-1 solo se expresa 1,9 TPM en los estadios V–VI de los ovocitos (Session et al., 2016). Por lo tanto, una interacción reducida de las claudinas con el armazón citoesquelético puede explicar el resultado inesperado de la incubación de capratos. Es el alcance de futuros estudios para verificar la base mecanicista del hallazgo.
Sin embargo, un efecto variante del caprato de sodio sobre la permeabilidad paracelular se describió en la literatura anterior. En el tejido del parche de Peyer extraído del intestino de cerdos adultos, se detectó un efecto de fortalecimiento similar. Claudin-5 se incrementó significativamente después de la incubación con caprato de 5 mm. En este estudio, el caprato condujo a una resistencia eléctrica transepitelial (TEER) significativamente mayor en el epitelio asociado al folículo (Radloff et al., 2019).
Conclusión
En conclusión, expresión heteróloga de la proteína de unión apretada claudina-5 en X. los ovocitos de laevis permiten nuevos conocimientos sobre la contribución de las claudinas individuales a la interacción celular y las propiedades de adhesión de las células adyacentes. Por lo tanto, el uso del modelo de unión estrecha X. laevis para claudin-5 permite el análisis de componentes BBB en un modelo de una sola célula.
Declaración de disponibilidad de datos
Los conjuntos de datos generados para este estudio están disponibles a petición del autor correspondiente.
Declaración ética
Los tratamientos para animales se ajustaron a las directrices de la legislación alemana, con la aprobación del responsable de bienestar animal de la Freie Universität Berlin y bajo la dirección de la Inspección Veterinaria de Salud de Berlín (Landesamt für Gesundheit und Soziales Berlin, permiso G0025/16).
Contribuciones de los autores
Todos los autores han leído y aprobado el manuscrito. NB y SA diseñaron, planificaron y supervisaron los experimentos y escribieron el manuscrito. NB, LS, VC, RK y PF-B realizaron los experimentos y el análisis de datos.
Financiación
Este estudio fue financiado por la Deutsche Forschungsgemeinschaft, Grant No. AM141/11-1 y la Fundación H. Wilhelm Schaumann.
Conflicto de intereses
Los autores declaran que la investigación se realizó en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un conflicto de intereses potencial.
Agradecimientos
Agradecemos a Martin Grunau, Gisela Manz, Katharina Söllig y Susanne Trappe por su excelente asistencia técnica. Agradecemos el apoyo de la Iniciativa de Publicación de Acceso Abierto de la Freie Universität Berlin.
Material suplementario
El Material Suplementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fphys.2020.00857/full#supplementary-material
FIGURA S1 / Áreas de contacto de claudina-5 que expresan pares de ovocitos en µm2 durante la incubación con caprato de sodio en diferentes concentraciones (n = 6-8, respectivamente) y ovocitos inyectados en agua como controles (n = 5-7, respectivamente).
Amasheh, S., Dullat, S., Fromm, M., Schulzke, J. D., Buhr, H. J., and Kroesen, A. J. (2009). La mucosa inflamada posee uniones estrechas alteradas que indican la recurrencia de la enfermedad inflamatoria intestinal. Int. J. Colorect. Dis. 24, 1149–1156. doi: 10.1007 / s00384-009-0737-8
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Amasheh, S., Schmidt, T., Mahn, M., Florian, P., Mankertz, J., Tavalali, S., et al. (2005). Contribución de claudin-5 a las propiedades de barrera en uniones estrechas de células epiteliales. Cell Tissue Res. 321, 89-96. doi: 10.1007 / s00441-005-1101-0
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Colegio, O. R., Van Itallie, C., Rahner, C., and Anderson, J. M. (2002). The role of claudin extracelular domains in tight junction fibril architecture and paracelular charge selectivity. Célula Mol Biol. 13:286.
Google Scholar
Comper, F., Antonello, D., Beghelli, S., Gobbo, S., Montagna, L., Pederzoli, P., et al. (2009). El patrón de expresión de las claudinas 5 y 7 distingue los tumores sólidos pseudopapilares del pancreatoblastoma, las células acinares y los tumores endocrinos del páncreas. Ser. J. Luchando Pathol. 33, 768–774. doi: 10.1097 / pas.0b013e3181957bc4
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
Del Vecchio, G., Tscheik, C., Tenz, K., Helms, H. C., Winkler, L., Blasig, R., et al. (2012). El caprato de sodio abre transitoriamente barreras que contienen claudina-5 en uniones estrechas de células epiteliales y endoteliales. Mol. Farmacéuticas. 9, 2523–2533. doi: 10.1021 | mp3001414
Resumen de PubMed / Texto completo de CrossRef / Google Scholar
Dittmann, I., Amasheh, M., Krug, S. M., Markov, A. G., Fromm, M., and Amasheh, S. (2014). El laurato penetra en la vía paracelular para moléculas pequeñas en el modelo de células epiteliales intestinales HT-29 / B6 a través de la apertura de las uniones estrechas mediante la reubicación reversible de claudina-5. Farmacéuticas. Res.Dordr. 31, 2539–2548. doi: 10.1007 / s11095-014-1350-2
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Engelhardt, B., Wolburg-Buchholz, K., y Wolburg, H. (2001). Compromiso del plexo coroideo en la inflamación del sistema nervioso central. Microsc. Res. Techniq. 52, 112–129. doi: 10.1002/1097-0029(20010101)52:1<112::ayuda-jemt13>3.0.co;2-5
Texto completo de CrossRef | Google Scholar
Florian, P., Amasheh, S., Lesidrensky, M., Todt, I., Bloedow, A., Ernst, A., et al. (2003). Claudinas en las uniones estrechas de las células marginales de la estría vascular. Bioquímica. Biophys. Res. Co. 304, 5–10. doi: 10.1016 / s0006-291x(03)00498-4
Texto completo de CrossRef | Google Scholar
Furuse, M., Hata, M., Furuse, K., Yoshida, Y., Haratake, A., Sugitani, Y., et al. (2002). Las uniones estrechas a base de claudina son cruciales para la barrera epidérmica de los mamíferos: una lección de los ratones deficientes en claudina-1. J. Cell Biol. 156, 1099–1111. doi: 10.1083 / jcb.200110122
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
Garcia-Hernandez, V., Quiros, M., and Nusrat, A. (2017). Claudinas epiteliales intestinales: expresión y regulación en homeostasis e inflamación. Ana. NY Acad. Sci. 1397, 66–79. doi: 10.1111 / nyas.13360
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
Greene, C., Hanley, N., and Campbell, M. (2019). Claudin-5: guardián de la función neurológica. Fluidos Barr. CNS 16: 4321.
Google Scholar
Günzel, D., Amasheh, S., Pfaffenbach, S., Richter, J. F., Kausalya, P. J., Hunziker, W., et al. (2009). Claudin – 16 afecta la secreción de Cl transcelular en las células MDCK. J. Physiol. Lond. 587, 3777–3793. doi: 10.1113 / jfisiol.2009.173401
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
Hashimoto, Y., Shirakura, K., Okada, Y., Takeda, H., Endo, K., Tamura, M., et al. (2017). Los aglutinantes de claudina-5 mejoran la permeabilidad de los solutos a través de la barrera hematoencefálica en un modelo de mamíferos. J. Pharmacol. Exp. Allí. 363, 275–283. doi: 10.1124 / jpet.117.243014
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
Koda, R., Zhao, L. N., Yaoita, E., Yoshida, Y., Tsukita, S., Tamura, A., et al. (2011). Expresión novedosa de claudina-5 en podocitos glomerulares. Cell Tissue Res. 343, 637-648. doi: 10.1007 / s00441-010-1117-y
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Konrad, M., Schaller, A., Seelow, D., Pandey, A. V., Waldegger, S., Lesslauer, A., et al. (2006). Las mutaciones en el gen de unión estrecha claudina 19 (CLDN19) se relacionan con emaciación renal de magnesio, insuficiencia renal y compromiso ocular grave. Ser. J. Hum. Genet. 79, 949–957. doi: 10.1086/508617
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Krug, S. M., Amasheh, M., Dittmann, I., Christoffel, I., Fromm, M., and Amasheh, S. (2013). Caprato de sodio como potenciador de la permeabilidad de macromoléculas a través de uniones estrechas tricelulares de células intestinales. Biomaterials 34, 275-282. doi: 10.1016 / j.biomateriales.2012.09.051
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
Leduc-Nadeau, A., Lahjouji, K., Bissonnette, P., Lapointe, J. Y., and Bichet, D. G. (2007). Elaboración de una nueva técnica para la purificación de membranas plasmáticas a partir de ovocitos Xenopus laevis. Ser. J. Physiol. Celular. 292, C1132-C1136.
Google Scholar
Lindmark, T., Kimura, Y., and Artursson, P. (1998). Mejora de la absorción a través de la regulación intracelular de la permeabilidad de las uniones estrechas por ácidos grasos de cadena media en células Caco-2. J. Pharmacol. Exp. Allí. 284, 362–369.
Google Scholar
Maher, S., Leonard, T. W., Jacobsen, J., and Brayden, D. J. (2009). Seguridad y eficacia del caprato sódico en la promoción de la absorción oral de fármacos: desde in vitro hasta la clínica. Adv. Entrega de Medicamentos. Apo. 61, 1427-1449. doi: 10.1016 / j.addr.2009.09.006
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
Milatz, S., Krug, S. M., Rosenthal, R., Gunzel, D., Muller, D., Schulzke, J. D., et al. (2010). Claudin – 3 actúa como un componente de sellado de la unión apretada para iones de carga y solutos sin carga. Biochim. Biophys. Acta 1798, 2048-2057. doi: 10.1016 / j. bbamem.2010.07.014
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
Mineta, K., Yamamoto, Y., Yamazaki, Y., Tanaka, H., Tada, Y., Saito, K., et al. (2011). Predijo la expansión de la familia de los múltiples claudin. FEBS Lett. 585, 606–612. doi: 10.1016 / j. febslet.2011.01.028
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
Nenni, M. J., Fisher, M. E., James-Zorn, C., Pells, T. J., Ponferrada, V., Chu, S., et al. (2019). Xenbase: facilitar el uso de Xenopus para modelar enfermedades humanas. Delantero. Fisiol. 10:154. doi: 10.3389 / fphys.2019.00154
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
Nitta, T., Hata, M., Gotoh, S., Seo, Y., Sasaki, H., Hashimoto, N., et al. (2003). Aflojamiento selectivo de tamaño de la barrera hematoencefálica en ratones deficientes en claudina-5. J. Cell Biol. 161, 653–660. doi: 10.1083 / jcb.200302070
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
Ohtsuki, S., Sato, S., Yamaguchi, H., Kamoi, M., Asashima, T., and Terasaki, T. (2007). La expresión exógena de claudina-5 induce propiedades de barrera en células endoteliales capilares cerebrales de rata cultivadas. Fisiol de células J. 210, 81–86. doi: 10.1002 / jcp.20823
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
Piontek, J., Fritzsche, S., Cordones, J., Richter, S., Hartwig, J., Walter, M., et al. (2011). Dilucidar los principios de la organización molecular de las hebras de unión herméticas heteropolímeras. Cell Mol. Ciencias de la Vida. 68, 3903–3918. doi: 10.1007 / s00018-011-0680-z
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Piontek, J., Winkler, L., Wolburg, H., Muller, S.L., Zuleger, N., Piehl, C., et al. (2008). Formation of tight junction: determinants of homophilic interaction between classic claudins (en inglés). FASEB J. 22, 146-158. doi: 10.1096 / fj.07-8319com
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
Radloff, J., Cornelius, V., Markov, A. G., and Amasheh, S. (2019). Caprate modula la función de barrera intestinal en el epitelio asociado al folículo del parche de Peyer porcino. Int. J. Mol. Sci. 20:1418. doi: 10.3390 / ijms20061418
Resumen de PubMed / Texto completo de CrossRef | Google Scholar
Reinhold, A. K., y Rittner, H. L. (2017). Función de barrera en el sistema nervioso central y periférico-una revisión. Pflug. Arco. EUR. J. Phys. 469, 123–134. doi: 10.1007/s00424-016-1920-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Resnick, M. B., Gavilanez, M., Newton, E., Konkin, T., Bhattacharya, B., Britt, D. E., et al. (2005). Claudin expression in gastric adenocarcinomas: a tissue microarray study with prognostic correlation. Hum. Pathol. 36, 886–892. doi: 10.1016/j.humpath.2005.05.019
PubMed Abstract | CrossRef Full Text | Google Scholar
Rossa, J., Ploeger, C., Vorreiter, F., Saleh, T., Protze, J., Gunzel, D., et al. (2014). El plegamiento y el ensamblaje de las proteínas Claudina-3 y Claudina-5 en la unión apretada están controlados por residuos no conservados en los segmentos transmembrana 3 (TM3) y asa extracelular 2 (ECL2). J. Biol. Chem. 289, 7641–7653. doi: 10.1074 / jbc.m113. 531012
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
Session, A. M., Uno, Y., Kwon, T., Hapman, J. A. C., Toyoda, A., Takahashi, S., et al. (2016). Genome evolution in the allotetraploid frog Xenopus laevis. Nature 538, 336-343.
Google Scholar
Soini, Y. (2011). Claudinas en enfermedades pulmonares. Resp. Res. 12: 70.
Google Scholar
Suzuki, H., Nishizawa, T., Tani, K., Yamazaki, Y., Tamura, A., Ishitani, R., et al. (2014). La estructura cristalina de un claudin proporciona una visión de la arquitectura de uniones estrechas. Science 344, 304-307. doi: 10.1126 / ciencia.1248571
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
Tammaro, P., Shimomura, K., y Proks, P. (2009). «Xenopus Oocytes as a heterologous expression system for studying ion channels with the patch-clamp technique,» en Potassium Channels: Methods and Protocols, ed. J. D. Lippiat (Totowa, NJ: Humana Press), págs. 127 a 139.
Google Scholar
Tebbe, B., Mankertz, J., Schwarz, C., Amasheh, S., Fromm, M., Assaf, C., et al. (2002). Proteínas de unión estrecha: una nueva clase de proteínas de membrana integral: expresión en la epidermis humana y en los queratinocitos HaCaT. Arch Dermatol. Res. 294, 14 a 18. doi: 10.1007 / s00403-001-0290-y
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Tomita, M., Hayashi, M., and Awazu, S. (1995). Mecanismo de mejora de la absorción de caprato de sodio y decanoilcarnitina en células Caco – 2. J. Pharmacol. Exp. Allí. 272, 739–743.
Google Scholar
Turner, J. R. (2000). «Apretando» la unión apretada: comprender la regulación del citoesqueleto. Semen. Dev de Celulares. Biol. 11, 301–308. doi: 10.1006 / scdb.2000.0180
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
Van Itallie, C. M., and Anderson, J. M. (2006). Claudinas y transporte paracelular epitelial. Annu. Apo. Physiol. 68, 403–429. doi: 10.1146 / annurev.fisiol.68.040104.131404
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
Vedula, S. R. K., Lim, T. S., Kausalya, P. J., Lane, E. B., Rajagopal, G., Hunziker, W., et al. (2009). Fuerzas cuantificadoras mediadas por proteínas integrales de unión apretada en la adhesión celular-celular. Exper. Mech. 49, 3–9. doi: 10.1007/s11340-007-9113-1
CrossRef Full Text | Google Scholar
Vitzthum, C., Stein, L., Brunner, N., Knittel, R., Fallier-Becker, P., and Amasheh, S. (2019). Xenopus oocytes as a heterologous expression system for analysis of tight junction proteins. FASEB J. 33, 5312–5319. doi: 10.1096/fj.201801451rr
PubMed Abstract | CrossRef Full Text | Google Scholar
Wilcox, E. R., Burton, Q. L., Naz, S., Riazuddin, S., Smith, T. N., Ploplis, B., et al. (2001). Las mutaciones en el gen que codifica la unión estrecha claudina – 14 causan sordera autosómica recesiva DFNB29. Celda 104, 165-172. doi: 10.1016 / s0092-8674(01)00200-8
Texto completo de CrossRef | Google Scholar
Wolburg, H., Wolburg-Buchholz, K., Kraus, J., Rascher-Eggstein, G., Liebner, S., Hamm, S., et al. (2003). La localización de claudina – 3 en uniones estrechas de la barrera hematoencefálica se pierde selectivamente durante la encefalomielitis autoinmune experimental y el Glioblastoma multiforme humano. Acta Neuropatol. 105, 586–592. doi: 10.1007 / s00401-003-0688-z
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Wylie, C. C., Brown, D., Godsave, S. F., Quarmby, J., and Heasman, J. (1985). El citoesqueleto de los ovocitos Xenopus y su papel en el desarrollo. J. Embryol. Exp. Morph. 89, 1–15.
Google Scholar