Nombre genérico: clorhidrato de clonidina
Forma de dosificación: tableta
Revisado médicamente por Drugs.com. Última actualización: 1 de julio de 2020.
- Visión general
- Efectos Secundarios
- Dosis
- Profesional
- Consejos
- Interacciones
- Más
- Clonidine Hydrochloride Tablets USP
- Descripción de Clonidina
- Clonidina-Farmacología clínica
- Farmacocinética
- Indicaciones y uso para Clonidina
- Contraindicaciones
- Advertencias
- Retirada
- Precauciones
- General
- Uso perioperatorio
- Información para pacientes
- Interacciones medicamentosas
- Toxicología
- Carcinogénesis, Mutagénesis, Alteración de la Fertilidad
- Embarazo
- Madres lactantes
- Uso pediátrico
- Reacciones adversas
- Sobredosis
- Dosis y administración de clonidina
- Cómo se suministra Clonidina
- PANEL DE VISUALIZACIÓN PRINCIPAL
- PANEL DE VISUALIZACIÓN PRINCIPAL
- PRINCIPAL DISPLAY PANEL
- Más sobre clonidina
- Recursos para el consumidor
- Recursos profesionales
- Guías de tratamiento relacionadas
Clonidine Hydrochloride Tablets USP
Orales, Antihipertensivos
Tabletas de 0.1 mg, 0.2 mg y 0.3 mg
Rx Solo
Información de prescripción
Descripción de Clonidina
Clorhidrato de clonidina, USP es un agente hipotensor alfa-agonista de acción central disponible en comprimidos para administración oral en tres dosis: 0,1 mg, 0,2 mg y 0,3 mg. El comprimido de 0,1 mg equivale a 0,087 mg de la base libre.
Los ingredientes inactivos son dióxido de silicio coloidal, almidón de maíz, fosfato de calcio dibásico, hidroxipropilcelulosa, celulosa microcristalina, lactosa monohidrato y estearato de magnesio. Además, el 0.los comprimidos de 1 mg contienen FD&C Rojo No.40, y los comprimidos de 0,2 mg y 0,3 mg contienen FD&C Amarillo No. 6 como aditivos colorantes, respectivamente.
El clorhidrato de clonidina es un derivado de imidazolina y existe como un compuesto mesomérico. El nombre químico es 2-(2,6-dichlorophenylamino)-2-imidazolina clorhidrato. La siguiente es la fórmula estructural:
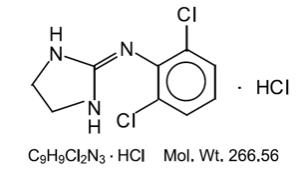
El clorhidrato de clonidina es una sustancia inodora, amarga, blanca y cristalina soluble en agua y alcohol.
Clonidina-Farmacología clínica
La clonidina estimula los receptores adrenérgicos alfa en el tronco encefálico. Esta acción resulta en una reducción de la salida simpática del sistema nervioso central y en una disminución de la resistencia periférica, la resistencia vascular renal, la frecuencia cardíaca y la presión arterial. Las tabletas de clorhidrato de clonidina actúan con relativa rapidez. La presión arterial del paciente disminuye entre 30 y 60 minutos después de una dosis oral, la disminución máxima ocurre entre 2 y 4 horas. El flujo sanguíneo renal y la tasa de filtración glomerular permanecen esencialmente inalterados. Los reflejos posturales normales están intactos; por lo tanto, los síntomas ortostáticos son leves e infrecuentes.
Los estudios agudos con clorhidrato de clonidina en seres humanos han demostrado una reducción moderada (15% a 20%) del gasto cardíaco en decúbito supino sin cambios en la resistencia periférica: a una inclinación de 45 pies hay una reducción menor del gasto cardíaco y una disminución de la resistencia periférica. Durante el tratamiento a largo plazo, el gasto cardíaco tiende a volver a los valores de control, mientras que la resistencia periférica permanece disminuida. Se ha observado un enlentecimiento de la frecuencia del pulso en la mayoría de los pacientes que recibieron clonidina, pero el fármaco no altera la respuesta hemodinámica normal al ejercicio.
En algunos pacientes puede desarrollarse tolerancia al efecto antihipertensivo, por lo que es necesario reevaluar el tratamiento.
Otros estudios en pacientes han demostrado una reducción de la actividad de la renina plasmática y de la excreción de aldosterona y catecolaminas. La relación exacta de estas acciones farmacológicas con el efecto antihipertensivo de la clonidina no ha sido completamente dilucidada.
La clonidina estimula de forma aguda la liberación de hormona de crecimiento tanto en niños como en adultos, pero no produce una elevación crónica de la hormona de crecimiento con el uso a largo plazo.
Farmacocinética
La farmacocinética de la clonidina es proporcional a la dosis en el intervalo de 100 a 600 mcg. La biodisponibilidad absoluta de clonidina en administración oral es del 70% al 80%. Los niveles plasmáticos máximos de clonidina se alcanzan en aproximadamente 1 a 3 horas.
Tras la administración intravenosa, la clonidina muestra una disposición bifásica con una semivida de distribución de unos 20 minutos y una semivida de eliminación de 12 a 16 horas. La semivida aumenta hasta 41 horas en pacientes con insuficiencia renal grave. La clonidina atraviesa la barrera placentaria. Se ha demostrado que atraviesa la barrera hematoencefálica en ratas.
Después de la administración oral, aproximadamente el 40% al 60% de la dosis absorbida se recupera en la orina como fármaco inalterado en 24 horas. Aproximadamente el 50% de la dosis absorbida se metaboliza en el hígado. Ni la comida ni la raza del paciente influyen en la farmacocinética de la clonidina.
El efecto antihipertensivo se alcanza a concentraciones plasmáticas de aproximadamente 0,2 a 2,0 ng/ml en pacientes con función excretora normal. Un aumento adicional de los niveles plasmáticos no potenciará el efecto antihipertensivo.
Indicaciones y uso para Clonidina
Tabletas de clorhidrato de clonidina, USP están indicadas en el tratamiento de la hipertensión. Las tabletas de clorhidrato de clonidina, USP se pueden emplear solas o concomitantemente con otros agentes antihipertensivos.
Contraindicaciones
Los comprimidos de clorhidrato de clonidina no deben utilizarse en pacientes con hipersensibilidad conocida a la clonidina (ver PRECAUCIONES).
Advertencias
Retirada
Se debe indicar a los pacientes que no interrumpan el tratamiento sin consultar a su médico. La interrupción repentina del tratamiento con clonidina ha dado lugar, en algunos casos, a síntomas como nerviosismo, agitación, dolor de cabeza y temblor acompañados o seguidos de un rápido aumento de la presión arterial y concentraciones elevadas de catecolaminas en el plasma. La probabilidad de tales reacciones a la interrupción del tratamiento con clonidina parece ser mayor tras la administración de dosis más altas o la continuación del tratamiento concomitante con betabloqueantes, por lo que se recomienda especial precaución en estas situaciones. Se han notificado casos raros de encefalopatía hipertensiva, accidentes cerebrovasculares y muerte después de la retirada de clonidina. Al interrumpir el tratamiento con clonidina, el médico debe reducir la dosis gradualmente durante 2 a 4 días para evitar la sintomatología de abstinencia.
Un aumento excesivo de la presión arterial tras la interrupción del tratamiento con clonidina puede revertirse mediante la administración de clorhidrato de clonidina oral o fentolamina intravenosa. Si se va a interrumpir el tratamiento en pacientes que reciben un betabloqueante y clonidina simultáneamente, el betabloqueante se debe retirar varios días antes de la interrupción gradual de la clonidina.
Debido a que los niños tienen comúnmente enfermedades gastrointestinales que conducen a vómitos, pueden ser particularmente susceptibles a episodios hipertensivos como resultado de la incapacidad repentina de tomar medicamentos.
Precauciones
General
En pacientes que han desarrollado sensibilización de contacto localizada a la clonidina transdérmica, la continuación de la clonidina transdérmica o la sustitución de la terapia con clorhidrato de Clonidina oral pueden estar asociadas con el desarrollo de una erupción cutánea generalizada.
En pacientes que desarrollan una reacción alérgica a la clonidina transdérmica, la sustitución del clorhidrato de clonidina oral también puede provocar una reacción alérgica (incluyendo erupción generalizada, urticaria o angioedema).)
La acción simpaticolítica de la clonidina puede empeorar la disfunción de los ganglios sinusales y el bloqueo auriculoventricular (AV), especialmente en pacientes que toman otros medicamentos simpaticolíticos. Hay informes postcomercialización de pacientes con anomalías de la conducción y / o que toman otros medicamentos simpaticolíticos que desarrollaron bradicardia grave que requirió atropina IV, isoproterenol IV y estimulación cardíaca temporal mientras tomaban Clonidina.
En la hipertensión causada por feocromocitoma, no se puede esperar un efecto terapéutico de las tabletas de clorhidrato de clonidina.
Uso perioperatorio
La administración de comprimidos de clorhidrato de clonidina debe continuarse dentro de las cuatro horas posteriores a la cirugía y reanudarse lo antes posible a partir de entonces. La presión arterial debe monitorizarse cuidadosamente durante la cirugía y, en caso necesario, deben disponerse de medidas adicionales para controlar la presión arterial.
Información para pacientes
Se debe advertir a los pacientes contra la interrupción del tratamiento con comprimidos de clorhidrato de clonidina sin el consejo de su médico.
Dado que los pacientes pueden experimentar un posible efecto sedante, mareos o trastornos de acomodación con el uso de Clonidina, se debe advertir a los pacientes sobre la posibilidad de realizar actividades como conducir un vehículo o manejar aparatos o maquinaria. Además, informe a los pacientes que este efecto sedante puede aumentar por el uso concomitante de alcohol, barbitúricos u otros medicamentos sedantes.
Se debe advertir a los pacientes que usan lentes de contacto que el tratamiento con comprimidos de clorhidrato de clonidina puede causar sequedad de los ojos.
Interacciones medicamentosas
La clonidina puede potenciar los efectos depresivos del SNC del alcohol, barbitúricos u otros medicamentos sedantes. Si un paciente que recibe clorhidrato de clonidina también está tomando antidepresivos tricíclicos, el efecto hipotensor de la clonidina puede reducirse, lo que requiere un aumento de la dosis de clonidina. Si un paciente que recibe clonidina también está tomando neurolépticos, pueden inducirse o exacerbarse alteraciones de la regulación ortostática (por ejemplo, hipotensión ortostática, mareos, fatiga).
Controlar la frecuencia cardíaca en pacientes que reciben Clonidina de forma concomitante con fármacos que se sabe que afectan a la función de los ganglios sinusales o a la conducción ganglionar AV, por ejemplo, digitálicos, bloqueantes de los canales de calcio y betabloqueantes. Se ha informado de bradicardia sinusal que resultó en hospitalización e inserción de marcapasos en asociación con el uso de clonidina concomitantemente con diltiazem o verapamilo.
La amitriptilina en combinación con clonidina aumenta la manifestación de lesiones corneales en ratas (Ver Toxicología).
En base a las observaciones en pacientes en estado de delirio alcohólico, se ha sugerido que dosis intravenosas altas de clonidina pueden aumentar el potencial arritmogénico (prolongación del intervalo QT, fibrilación ventricular) de dosis intravenosas altas de haloperidol. No se ha establecido la relación causal ni la relevancia de los comprimidos orales de Clonidina.
Toxicología
En varios estudios con clorhidrato de clonidina oral, se observó un aumento dosis dependiente de la incidencia y gravedad de la degeneración retiniana espontánea en ratas albinas tratadas durante seis meses o más. Los estudios de distribución tisular en perros y monos mostraron una concentración de clonidina en la coroides.
En vista de la degeneración retiniana observada en ratas, se realizaron exploraciones oculares durante los ensayos clínicos en 908 pacientes antes y periódicamente después del inicio del tratamiento con clonidina. En 353 de estos 908 pacientes, los exámenes oculares se llevaron a cabo durante períodos de 24 meses o más. A excepción de cierta sequedad de los ojos, no se registraron hallazgos oftalmológicos anormales relacionados con el medicamento y, de acuerdo con pruebas especializadas como electrorretinografía y deslumbramiento macular, la función retiniana no se modificó.
En combinación con amitriptilina, la administración de clorhidrato de clonidina condujo al desarrollo de lesiones corneales en ratas en 5 días.
Carcinogénesis, Mutagénesis, Alteración de la Fertilidad
La administración crónica de Clonidina en la dieta no fue carcinogénica en ratas (132 semanas) o ratones (78 semanas) a dosis, respectivamente, de hasta 46 ó 70 veces la dosis diaria máxima recomendada en humanos en mg/kg (9 ó 6 veces la MRDHD en mg/m2). No hubo evidencia de genotoxicidad en la prueba de mutagenicidad de Ames ni en la prueba de clastogenicidad de micronúcleos de ratón.
La fertilidad de ratas macho o hembra no se vio afectada por dosis de clonidina de hasta 150 mcg/kg (aproximadamente 3 veces la DMRHD). En otro experimento, la fertilidad de ratas hembra pareció verse afectada a niveles de dosis de 500 a 2000 mcg/kg (10 a 40 veces la MRDHD oral en mg/kg; 2 a 8 veces la MRDHD en mg/m’).)
Embarazo
Efectos teratogénicos: Categoría de embarazo C. Los estudios de reproducción realizados en conejos a dosis de hasta aproximadamente 3 veces la dosis oral máxima diaria recomendada en humanos (MRDHD) de comprimidos de clorhidrato de clonidina no mostraron evidencia de potencial teratogénico o embriotóxico en conejos. En ratas, sin embargo, dosis tan bajas como 1/3 de la MRDHD oral (1/15 de la MRDHD en mg/m2) de Clonidina se asociaron con un aumento de las reabsorciones en un estudio en el que las madres fueron tratadas de forma continua desde 2 meses antes del apareamiento. El aumento de las reabsorciones no se asoció con el tratamiento al mismo tiempo o a niveles de dosis más altos (hasta 3 veces la ERM oral) cuando las madres fueron tratadas en los días de gestación 6 a 15. Se observaron aumentos en la reabsorción a niveles de dosis mucho más altos (40 veces la MRDHD oral en mg / kg; 4 a 8 veces la MRDHD en mg / m2) en ratones y ratas tratados en los días de gestación 1 a 14 (la dosis más baja empleada en el estudio fue de 500 mcg/kg).
No se han realizado estudios adecuados y bien controlados en mujeres embarazadas. La clonidina atraviesa la barrera placentaria (ver FARMACOLOGÍA CLÍNICA, Farmacocinética). Debido a que los estudios de reproducción animal no siempre predicen la respuesta humana, este medicamento debe usarse durante el embarazo solo si es claramente necesario.
Madres lactantes
Dado que el clorhidrato de clonidina se excreta en la leche materna, se debe tener precaución cuando se administran comprimidos de clorhidrato de clonidina a una mujer lactante.
Uso pediátrico
La seguridad y la eficacia en pacientes pediátricos no se han establecido en ensayos adecuados y bien controlados (Ver ADVERTENCIAS, Retirada).
Reacciones adversas
La mayoría de las reacciones adversas son leves y tienden a disminuir con el tratamiento continuado. Los más frecuentes (que parecen estar relacionados con la dosis) son la sequedad de boca, que ocurre en aproximadamente 40 de cada 100 pacientes; somnolencia, aproximadamente 33 de cada 100; mareos, aproximadamente 16 de cada 100; estreñimiento y sedación, cada uno aproximadamente 10 de cada 100.
También se han notificado las siguientes reacciones adversas menos frecuentes en pacientes que recibieron comprimidos de clorhidrato de clonidina, pero en muchos casos los pacientes estaban recibiendo medicación concomitante y no se ha establecido una relación causal.
El cuerpo en su conjunto: Fatiga, fiebre, dolor de cabeza, palidez, debilidad y síndrome de abstinencia. También se reportó una prueba de Coombs débilmente positiva y una mayor sensibilidad al alcohol.
Cardiovascular: Bradicardia, insuficiencia cardíaca congestiva, anomalías electrocardiográficas (es decir, parada del nódulo sinusal, bradicardia de unión, bloqueo AV de alto grado y arritmias), síntomas ortostáticos, palpitaciones, fenómeno de Raynaud, síncope y taquicardia.
Se han notificado casos de bradicardia sinusal y bloqueo auriculoventricular, tanto con como sin el uso concomitante de digitálicos.
Sistema Nervioso Central: Agitación, ansiedad, delirio, percepción ilusoria, alucinaciones (incluyendo visuales y auditivas), insomnio, depresión mental, nerviosismo, otros cambios de comportamiento, parestesia, inquietud, trastornos del sueño y sueños vívidos o pesadillas.
Dermatológico: Alopecia, edema angioneurótico, urticaria, prurito, erupción cutánea y urticaria.
Gastrointestinal: Dolor abdominal, anorexia, estreñimiento, hepatitis, malestar general, anomalías transitorias leves en las pruebas de función hepática, náuseas, parotitis, pseudoobstrucción (incluyendo pseudoobstrucción colónica), dolor de las glándulas salivales y vómitos.
Genitourinario: Disminución de la actividad sexual, dificultad para la micción, disfunción eréctil, pérdida de la libido, nicturia y retención urinaria.
Hematológica: Trombocitopenia.
Metabólico: Ginecomastia, elevación transitoria de la glucosa en sangre o creatinfosfoquinasa sérica y aumento de peso.
Musculoesquelético: calambres en las piernas y dolor muscular o articular.
orotolaríngeo: Sequedad de la mucosa nasal.
Oftalmológico: Trastorno de acomodación, visión borrosa, ardor en los ojos, disminución del lagrimeo y sequedad de los ojos.
Sobredosis
La hipertensión puede desarrollarse de forma temprana y puede ir seguida de hipotensión, bradicardia, depresión respiratoria, hipotermia, somnolencia, disminución o ausencia de reflejos, debilidad, irritabilidad y miosis. La frecuencia de depresión del SNC puede ser mayor en niños que en adultos. Las sobredosis grandes pueden provocar defectos de conducción cardíaca reversibles o arritmias, apnea, coma y convulsiones. Los signos y síntomas de sobredosis generalmente ocurren entre 30 minutos y dos horas después de la exposición. Tan solo 0,1 mg de clonidina ha producido signos de toxicidad en niños.
No existe un antídoto específico para la sobredosis de clonidina. La sobredosis de clonidina puede provocar el rápido desarrollo de depresión del SNC; por lo tanto, no se recomienda la inducción de vómitos con jarabe de ipecacuana. El lavado gástrico puede estar indicado después de ingestiones recientes y / o grandes. La administración de carbón activado y/o un catártico puede ser beneficiosa. Los cuidados de apoyo pueden incluir sulfato de atropina para la bradicardia, líquidos intravenosos y / o agentes vasopresores para la hipotensión y vasodilatadores para la hipertensión. La naloxona puede ser un complemento útil para el tratamiento de la depresión respiratoria, la hipotensión y/o el coma inducidos por la clonidina; se debe controlar la presión arterial, ya que la administración de naloxona ha dado lugar ocasionalmente a hipertensión paradójica. La administración de tolazolina ha dado resultados inconsistentes y no se recomienda como tratamiento de primera línea. No es probable que la diálisis mejore significativamente la eliminación de la clonidina.
La sobredosis más grande notificada hasta la fecha involucró a un varón de 28 años que ingirió 100 mg de clorhidrato de clonidina en polvo. Este paciente desarrolló hipertensión, seguida de hipotensión, bradicardia, apnea, alucinaciones, semicoma y contracciones ventriculares prematuras. El paciente se recuperó completamente después del tratamiento intensivo. Los niveles plasmáticos de clonidina fueron de 60 ng/ml después de 1 hora, 190 ng/mL después de 1,5 horas, 370 ng/mL después de 2 horas y 120 ng / ml después de 5,5 y 6,5 horas. En ratones y ratas, la LD50 oral de clonidina es de 206 y 465 mg/kg, respectivamente.
Dosis y administración de clonidina
Adultos
La dosis de los comprimidos de clorhidrato de Clonidina debe ajustarse de acuerdo con la respuesta individual de la presión arterial del paciente. La siguiente es una guía general para su administración.
Dosis inicial
Comprimido de 0,1 mg dos veces al día (por la mañana y a la hora de acostarse). Los pacientes de edad avanzada pueden beneficiarse de una dosis inicial más baja.
Dosis de mantenimiento
Se pueden realizar incrementos adicionales de 0,1 mg al día a intervalos semanales si es necesario hasta alcanzar la respuesta deseada. Tomar la porción más grande de la dosis diaria oral a la hora de acostarse puede minimizar los efectos de ajuste transitorios de la boca seca y la somnolencia. Las dosis terapéuticas empleadas con mayor frecuencia han oscilado entre 0,2 mg y 0,6 mg al día administrados en dosis divididas.
Los estudios han indicado que 2,4 mg es la dosis diaria máxima eficaz, pero raramente se han empleado dosis tan altas.
Insuficiencia renal
Los pacientes con insuficiencia renal pueden beneficiarse de una dosis inicial más baja. Se debe monitorizar cuidadosamente a los pacientes. Dado que solo se elimina una cantidad mínima de clonidina durante la hemodiálisis de rutina, no es necesario administrar clonidina suplementaria después de la diálisis.
Cómo se suministra Clonidina
Las tabletas de clorhidrato de clonidina, USP se suministran de la siguiente manera:
0,1 mg: Una tableta rosa, en forma de «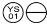 «.
«.
NDC 58657-647-01 (Frasco de 100)
NDC 58657-647-50 (Frasco de 500)
NDC 58657-647-10 (Frasco de 1000)
0,2 mg: Comprimido de color naranja, en forma de » 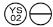 «.
«.
NDC 58657-648-01 (Frasco de 100)
NDC 58657-648-50 (Frasco de 500)
NDC 58657-648-10 (Frasco de 1000)
0,3 mg: Comprimido de color naranja claro con forma de » 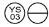 «.
«.
NDC 58657-649-01 (Botella de 100)
NDC 58657-649-50 (Botella de 500)
NDC 58657-649-10 (Botella de 1000)
Almacenar a 25°C (77°F); se permiten excursiones a 15°C-30°C (59°F-86°F) . Dispense en un recipiente hermético y resistente a la luz.
Fabricado por:
Yung Shin Pharmaceutical Ind. Co., Ltd.
Tachia, Taichung 43769
TAIWÁN
Distribuido por:
Method Pharmaceuticals, LLC
7333 Jack Newell Blvd. North, Suite 300
Fort Worth, Texas 76118
Para informar DE EXPERIENCIAS ADVERSAS CON MEDICAMENTOS, llame a Method Pharmaceuticals al 1-877-250-3427
Revisado: 06/20
PANEL DE VISUALIZACIÓN PRINCIPAL
NDC 58657-647-10
Clonidina
HIDROCLORURO
COMPRIMIDOS, USP
0,1 mg
Solo Rx
1000 Comprimidos

PANEL DE VISUALIZACIÓN PRINCIPAL
NDC 58657-648-10
Clonidina
CLORHIDRATO
COMPRIMIDOS, USP
0.2 mg
Rx Only
1000 Tablets

PRINCIPAL DISPLAY PANEL
NDC 58657-649-10
Clonidine
HYDROCHLORIDE
TABLETS, USP
0.3 mg
Rx Only
1000 Tablets

| Clonidine HYDROCHLORIDE Clonidine hydrochloride tablet |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
| Clonidine HYDROCHLORIDE Clonidine hydrochloride comprimido |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
| Clonidine HYDROCHLORIDE Clonidine hydrochloride comprimido |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Etiquetadora – Método Pharmaceuticals, LLC (060216698)
Más sobre clonidina
- Efectos secundarios
- Durante el embarazo o la lactancia
- Información de dosificación
- Consejos para pacientes
- Imágenes de medicamentos
- Interacciones con medicamentos
- Comparar alternativas
- Grupo de apoyo
- Precios & Cupones
- 619 Comentarios
- Clase de medicamentos: agentes antiadrenérgicos de acción central
- Alertas de la FDA (1)
Recursos para el consumidor
- Información para el paciente
- … +5 más
Recursos profesionales
- Información de prescripción
- CloNIDina (Consejo profesional para el Paciente)
- Tabletas de liberación prolongada de Clonidina (FDA)
- Inyección de Clonidina (FDA)
- Parche de Clonidina (FDA)
- Tabletas de clonidina (FDA)
Otras marcas Catapres, Kapvay, Catapres-TTS, Duraclon, Nexiclon XR
Guías de tratamiento relacionadas
- Ansiedad
- TDAH
- Abstinencia de alcohol
- Auricular Fibrilación
- … + 19 más
Descargo de responsabilidad médica