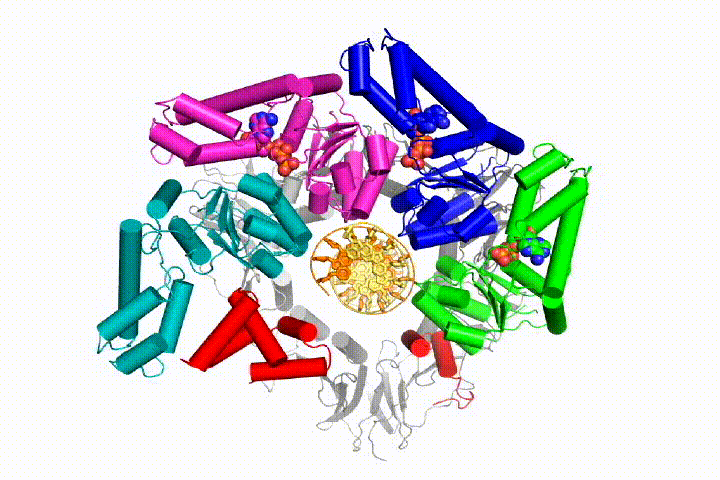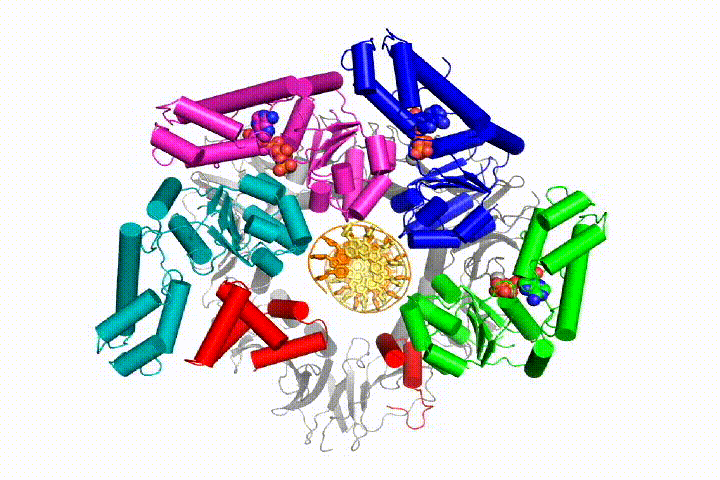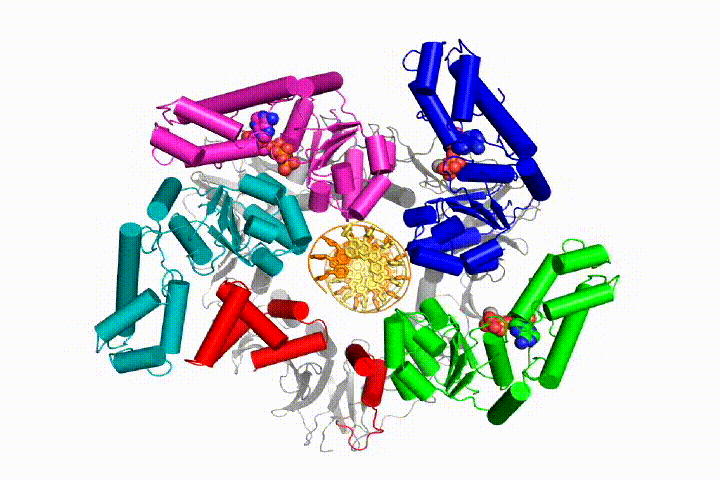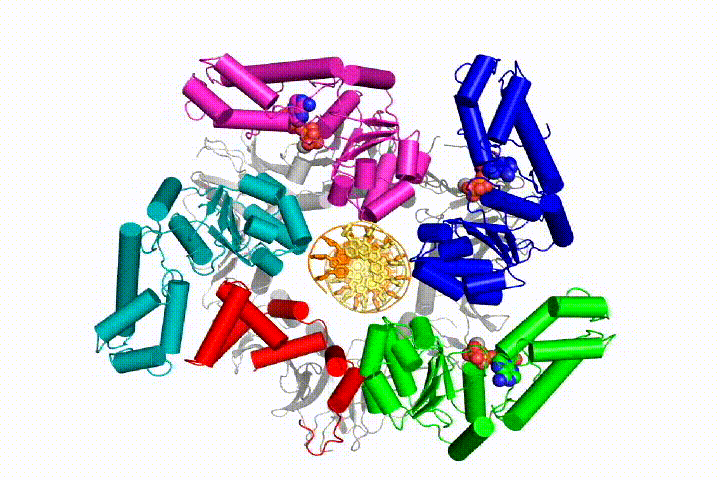
chromosomale DNA-replicatie vereist dat DNA-polymerasen worden gebonden aan ringvormige glijklemmen die het DNA omringen en een snelle, processieve replicatie mogelijk maken. De glijdende klemmen worden geladen op DNA door het complex van de klemlader, een pentameric assemblage van proteã nen van de AAA+ familie van ATPases.
we willen de functie en het mechanisme van klemladers in atomair detail begrijpen. Recente structuren van de T4 bacteriofaag klemlader in complex met primer-template DNA en de glijdende klem hebben een werkend model voorgesteld voor het klemlader mechanisme zoals hieronder getoond (zie Kelch et al Science 2011):
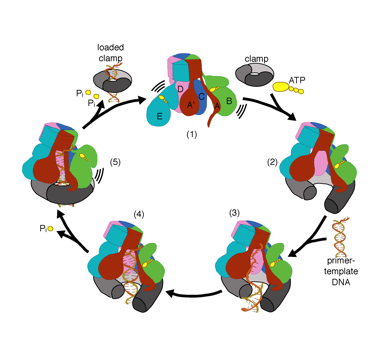
Ons model voorspelt dat ATP hydrolyse begint aan het einde van de AAA+ spiraal en op een sequentiële manier de spiraal omhoog gaat, wat resulteert in het uitwerpen van de klemlader uit het DNA en de gesloten klem. Onze hypothese wordt geïllustreerd in deze animatie van drie opeenvolgende ATP hydrolyse gebeurtenissen:
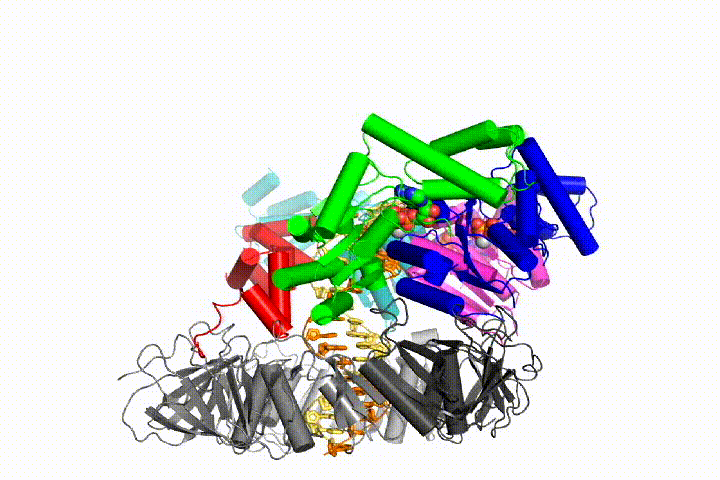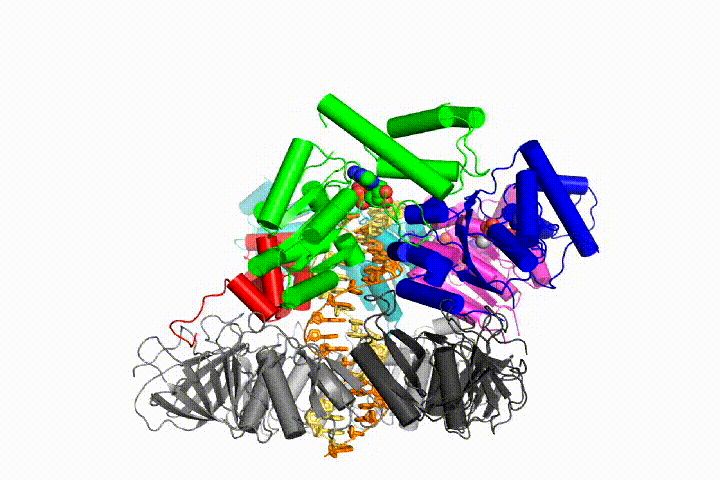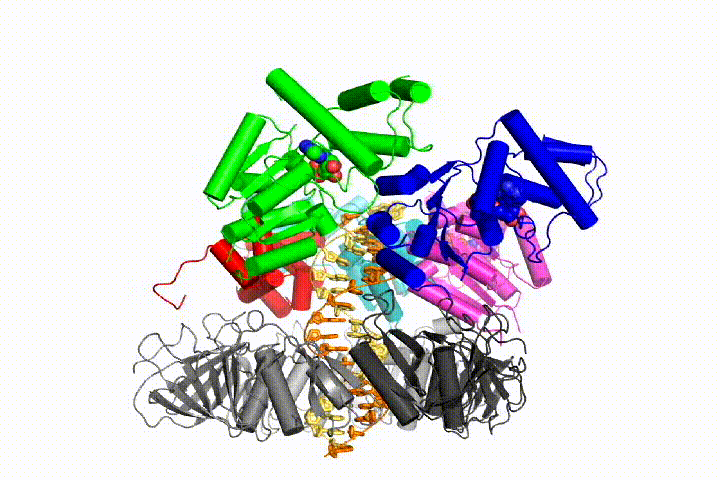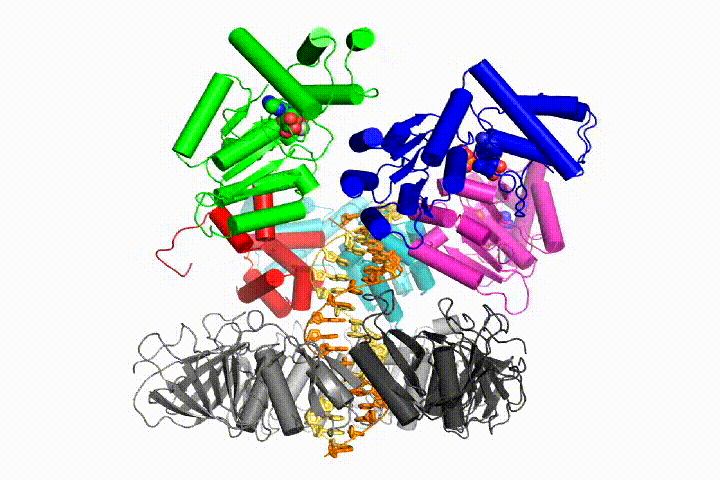
we zullen deze modellen testen voor klemlader mechanisme met behulp van een breed scala aan biochemische, biofysische en structurele methoden. Het begrijpen van het mechanisme van de klemlader in atomair detail zal belangrijke implicaties voor het begrijpen van de replicatie van DNA evenals het mechanisme van verwante AAA+ eiwitassemblages hebben. Uiteindelijk verwachten we onze mechanistische kennis te gebruiken om nieuwe nanodevices en kleine molecule-effectoren van AAA+ – functie te ontwikkelen.