Zusammenfassung
Die zirrhotische Kardiomyopathie ist eine kürzlich anerkannte Erkrankung, die aus einer Myokardfunktionsstörung besteht, die sich bei zirrhotischen Patienten ohne vorherige Herzerkrankung manifestiert. Die zugrunde liegenden pathogenetischen Mechanismen umfassen eine „miokardiotoxische“ Umgebung, die zu einer abgestumpften Herzreaktion auf physischen oder pharmakologischen Stress führt. Dieser Zustand ist jetzt besser verstanden und kann klinisch durch Laborelektrokardiographie- und Echokardiographiekriterien diagnostiziert werden. Klinisch ist die systolische Inkompetenz am deutlichsten, wenn zirrhotische Patienten unter physischem oder pharmakologischem Stress stehen. Obwohl es gut verstanden wird, mangelt es an Wissen für eine ordnungsgemäße praktische Anwendung. Jüngste Fallberichte deuten darauf hin, dass CCM frühzeitig behandelt werden muss, da dies ein auslösender Faktor für Zirrhosekomplikationen sein kann. Studien sind erforderlich, um mögliche Behandlungen zu identifizieren, die die natürliche Vorgeschichte von Herzerkrankungen bei Patienten mit Leberzirrhose verändern, insbesondere in den Phasen, in denen die Patienten asymptomatisch sind.
Schlüsselwörter
Leberzirrhose, Herzinsuffizienz, Kardiomyopathie
Einleitung
Die zirrhotische Kardiomyopathie (CCM) ist eine Herzfunktionsstörung, die durch eine suboptimale kontraktile Reaktion auf Stress und eine beeinträchtigte diastolische Funktion ohne vorherige Herzerkrankung gekennzeichnet ist . Heutzutage hat die Forschung vorgeschlagen, dass zirrhotische Patienten eine intrinsische Herzfunktionsstörung haben, die dies beeinflussen kann in der Entwicklung von Nierenversagen bei fortgeschrittener Lebererkrankung .
Seit 2002 haben sich die Erkenntnisse über Kreislauffunktionsstörungen bei Lebererkrankungen durch diagnostische Methoden weiterentwickelt, was die Bedeutung der Identifizierung von CCM in der klinischen Praxis unterstreicht . Es gibt jedoch immer noch eine Wissenslücke in Bezug auf das Management dieser Erkrankung . Das Vorhandensein einer Myokardfunktionsstörung bei Zirrhose erhöht das Risiko eines hepatorrenalen Syndroms (HRS) und unerwünschter kardialer Ereignisse und hängt mit einer höheren Mortalität zusammen .
Wir überprüften die verfügbare Literatur in PubMed in Bezug auf die Marker für Zirrhose Komplikationen und die Wechselwirkungen von Herz und Leber. Der Zweck dieser Überprüfung ist es, die Notwendigkeit zu diskutieren, CCM frühzeitig zu verfolgen und zu behandeln, da dies ein auslösender Faktor für Zirrhosekomplikationen sein kann, wodurch neue Erkenntnisse in die klinische Praxis gebracht werden.
Definition und Prävalenz
CCM beschreibt kardiale chronische Dysfunktion bei Patienten mit Zirrhose trotz keiner vorherigen strukturellen Herzerkrankung . Es wird durch eine oder mehrere der folgenden definiert: strukturelle Anomalien in Herzkammern; diastolische Dysfunktion; normale oder erhöhte systolische Funktion in Ruhe, aber schlechte kontraktile Reaktion auf Stress; und elektrophysiologische Veränderungen . Diese Anomalien können bei bis zu 50% der zirrhotischen Patienten beobachtet werden .
Physiopathologie
Zirrhose Physiopathologie ist bekannt durch Überproduktion von Stickoxid (NO) in splanchnischen Gefäßen und daraus resultierende systemische Vasodilatation. Dieser Mechanismus löst die Aktivierung des Rennin-Angiotensin-Aldosteron-Systems (RAAS) und des sympathischen Nervensystems aus und erhöht den Vasopressin-Spiegel im Serum, was zu einem hyperdinamischen Zustand führt, der sich von zellulären auf klinische Umgebungen auswirken kann.
Diese Patienten haben ein erhöhtes Serumkohlenmonoxid (CO) infolge sympathischer Hyperaktivität und entzündlicher Zytokine. Es gibt einen Anstieg von CO, verbunden mit hohen NO-Spiegeln, Akkumulation von Endocannabinoiden und anderen Vasodilatatoren. Diese Substanzen erhöht zyklisches Guanosinmonophosphat (cGMP) leves, die hemmt zyklisches Adenosinmonophosphat (cAMP) in cardiomyocites, verantwortlich für Calcium-Zustrom und eine größere Kontraktionskraft (Abbildung 1,2) . Myokardzellanalysen zeigen eine Verringerung der Plasmamembranfluidität aufgrund von Cholesterinablagerungen, die die Wechselwirkung von Substanzen wie beta-adrenergen Rezeptoren und G-Proteinen hemmen . Der ventrikuläre Myokit kann auch eine Abnahme der Kaliumkanalfunktion aufweisen, was zu einer suboptimalen Herzrelaxation und einer daraus resultierenden diastolischen Dysfunktion führt .
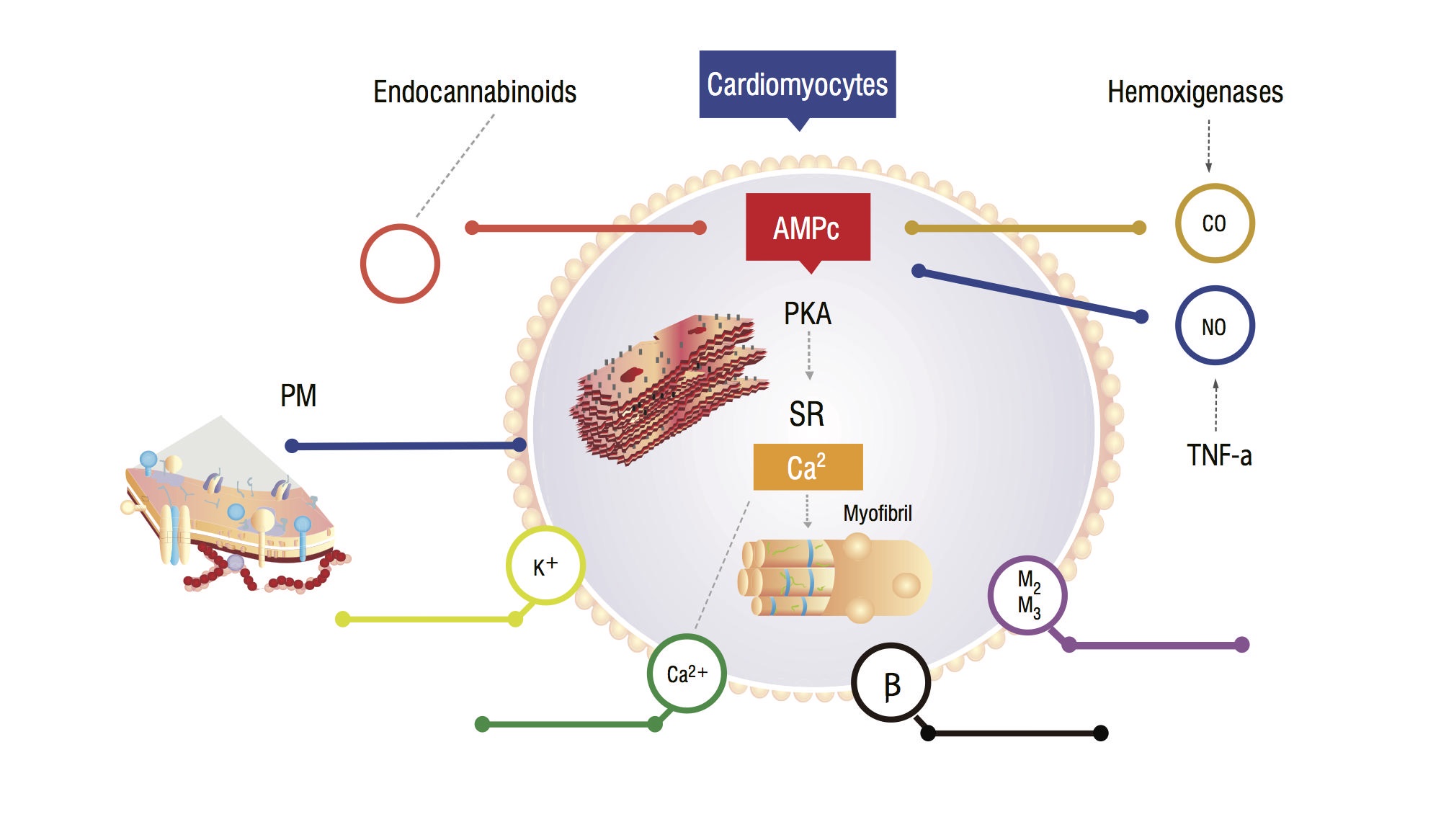
Abbildung 1. Physiopathologisches Modell von Kardiomyozyten, das Hauptsignalwege zeigt, die zu einer abgestumpften myokardialen Reaktion auf Stress führen. PM: Plasmatische Membran; CO: Kohlenstoffoxid; NO: Stickoxid; TNF-a: Tumornekrosefaktor alfa; SR: Sarkoplasmatisches Retikullum; AMPc: Zyklisches Adenosinmonophosphat; PKA: Proteinkinase A.
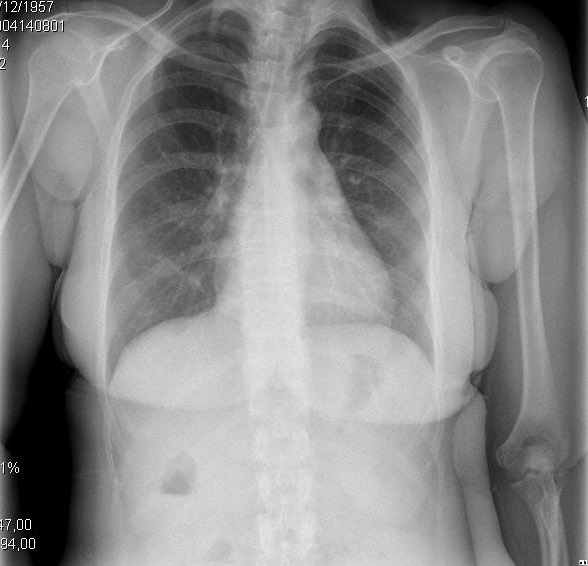
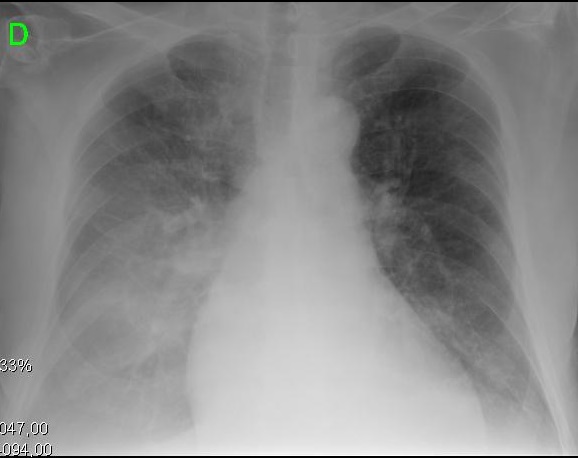
Abbildung 2. Klinische und radiologische Darstellungen verschiedener Entwicklungsstadien der zirrhotischen Kardiomyopathie. A. Das linke Bild zeigt einen kleinen Pleuraerguss und einen CTI von 0,50. B. Das rechte Bild zeigt eine schwere Lungenverstopfung und einen CTI von 0,67.
Tabelle 1. Klinische und diagnostische Kriterien für die Diagnose von CCM. Angepasst von Referenz 29 mit Genehmigung.
Die anhaltenden beta-adrenergen Stimuli induzieren eine Herunterregulierung und verringern die Dichte der Herzrezeptoren, wodurch die für die Aktivierung des Kalziumkanals verantwortlichen Signalkaskaden modifiziert werden . Klinische Auswirkungen dieses Signalwegs sind eine abgestumpfte Myokardfunktion und ein Anstieg der kardialen Biomarker .
Die Identifizierung von CCM beruht auf subtilen klinischen Merkmalen, die im Verlauf der Krankheit entlarvt werden können oder in bestimmten klinischen Belastungsszenarien deutlich werden können und zu einer Herausforderung hinsichtlich der Frage werden, ob und wann eine Behandlung erforderlich ist.
Naturgeschichte und Diagnose
Die diagnostischen Kriterien sind in Tabelle 1 zusammengefasst und basieren auf klinischen, bildgebenden und Biomarkern.
Klinische Merkmale
Klinische Merkmale von CCM können bei Patienten mit einer scheinbar normalen Herzfunktion auftreten, da eine chronische Anpassung des Kardiomyozyten an die zirrhotische Umgebung zu all diesen zellulären Veränderungen führt .
Zirrhotische Patienten entwickeln sich mit Natrium- und Flüssigkeitsretention, peripherer Vasodilatation, sympathischer Hyperaktivität und Akkumulation von „miokardiotoxischen“ Substanzen , die einen adaptiven Prozess von Kardiomyozyten erfordern. Dieses Kontinuumsgleichgewicht kann gebrochen werden und eine latente Herzinsuffizienz in Stresssituationen wie Lebertransplantation, transjugulärem intrahepatischem portosystemischem Shunt oder Infektionen demaskieren .
Obwohl die zirrhotische Kardiomyopathie tendenziell chronisch ist, zeigen Studien, dass sich die klinischen Anzeichen einer Myokardfunktionsstörung bis zu 15 Monate nach erfolgreicher Lebertransplantation sowie die QT-Verlängerung umkehren können .
Laborbefunde
Da Herzfunktionsstörungen durch entzündliche Biomarker reflektiert werden können, werden neuartige kardiale und proinflammatorische Marker kürzlich untersucht und korreliert mit der Entwicklung von Komplikationen, die zu einer erhöhten Mortalität führen .
Neuere Studien beschreiben die Korrelation zwischen den Spiegeln des Prohormons von ANP (proANP) und des natriuretischen Peptids vom B-Typ (BNP), Copeptin und hochempfindlichem Troponin T (hs-TnT) sowie löslicher Urokinase-Typ Plasminogenaktivatorrezeptor (suPAR) und hochempfindliches C-reaktives Protein (hs-CRP) und kardiovaskuläre Komplikationen bei Zirrhose. Die klinische Anwendung wird jedoch noch evaluiert .
Natriuretische Peptide werden von den Kardiomyozyten als Reaktion auf Volumen- oder Drucküberlastung oder Myokardischämie sezerniert, um den RAAS-Effekt im Natrium- und Wasserhaushalt auszugleichen . BNP kann einer der am besten verfügbaren Biomarker sein, der eine frühzeitige Erkennung von Herzbeteiligung ermöglicht . Die Serumkonzentration ist umso höher, je schwerer die Leber- und Herzerkrankungen sind .
Vielversprechende Studien belegen, dass hohe Adrenomedullinspiegel auch bei Zirrhose mit oder ohne klinischer kardialer Beteiligung beobachtet werden; diese Substanz wird im Blutfluss freigesetzt, um als Vasodilatator zu wirken, und zielt darauf ab, die Nachlast zu reduzieren . Galectin-3, der zuletzt untersuchte Biomarker, der bei Patienten mit Leberzirrhose erhöht ist, wurde mit Myokardfibrose in Verbindung gebracht und korreliert möglicherweise mit dem Schweregrad der Zirrhose. Dieser Marker erweist sich bei der Beurteilung der diastolischen Dysfunktion als empfindlicher als BNP, ist jedoch weniger spezifisch .
Elektrokardiogramm
Elektrokardiographische (EKG-) Anomalien können bei einem asymptomatischen CCM-Patienten frühzeitig bemerkt werden und können mit ventrikulären Arrhythmien und plötzlichem Tod korrelieren . Der häufigste EKG-Befund ist eine Verlängerung des QT-Intervalls, die bei etwa 30-40% der Patienten mit Zirrhose, hauptsächlich Child-Pugh B oder C, unabhängig von der Ätiologie beobachtet werden kann .
Dieses EKG-Muster kann sekundär zu Kardiomyozyten-Repolarisationsanomalien in Kaliumkanälen und einer Verringerung der Konzentration dieser Kanäle in der Plasmamembran als Reaktion auf geringfügige Änderungen des Portaldrucks sein . Ionenkanäle Dysfunktionen verursacht dadurch Myokardzellen Aktionspotential Verlängerung, was zu einer längeren ventrikulären Systole und QT . Eine längere Kontraktionszeit impliziert eine beeinträchtigte Entspannung, was zu einer diastolischen Dysfunktion führt .
Elektromechanische Entkopplung wird als Dyssynchronität zwischen elektrischem Reiz und systolischer mechanischer Reaktion des Herzens beschrieben, die bei diesen Patienten zu fortschreitendem Verlust der Myokardfunktion und kongestiver Herzinsuffizienz führt1 . Die chronotrope Inkompetenz ist gekennzeichnet durch die Unfähigkeit des Sinusknotens, auf physiologische oder pharmakologische Reize zu reagieren Determinante Tatsache in der CCM-Physiopathologie. Diese Veränderungen sind auch sekundär zu portaler Hypertension, autonomer Dysfunktion, hyperdynamischer Zirkulation und dem Vorhandensein der entzündungsfördernden Faktoren, die das Myokard des Patienten beeinflussen .
Echokardiogramm
Das Echokardiogramm liefert relevante Daten über die Herzfunktion und dient als diagnostisches Kriterium für eine zirrhotische Kardiomyopathie .
Die Hauptergebnisse bei diesen Patienten sind die enddiastolische Vergrößerung des linken Ventrikels (LV), die Verringerung der Spitzengeschwindigkeit und die systolische Deformitätsrate; erhöhter enddiastolischer linksventrikulärer Druck ohne entsprechende LVEF-Expansion. Vergrößerung des linken Vorhofs (LA) um mehr als 34 ml / m2kann auf eine chronische diastolische Dysfunktion hindeuten und, wenn sie mit einer Verringerung der LV-Masse verbunden ist, auf eine schlechtere Prognose hindeuten . Die LA-Bewertung kann durch zweidimensionale Echokardiographie und Speckle-Tracking erfolgen .
Häufige Befunde in der Herz-Doppler-Echokardiographie weisen auf eine beeinträchtigte Myokardrelaxation bei Patienten mit Leberzirrhose hin: abnahme des E / A-Verhältnisses (< 1) und verlängerte E-Wellen-Verzögerungszeit (DT) und isovolumetrische Relaxationszeit (IVRT) > 80 ms .Je schwerer die diastolische Dysfunktion ist, desto kürzer sind IVRT und Mitral DT und desto höher ist das E / A-Geschwindigkeitsverhältnis, was eine fortgeschrittene diastolische Dysfunktion, einen erhöhten Blutdruck und eine schlechtere Funktionsklasse charakterisiert.
Neuere Studien mit Global Longitudinal Strain (GLS) Evaluation zeigen, dass dies eine hilfreiche Methode zur Früherkennung von Herzfunktionsstörungen bei zirrhotischen Patienten sein kann, hauptsächlich die systolische Dysfunktion in Ruhe .
Das E / A-Verhältnis kann ein zuverlässiger Parameter bei der Diagnose einer diastolischen Dysfunktion bei zirrhotischen Patienten sein, selbst wenn die Werte vom Hydratationsgrad des Patienten beeinflusst werden, obwohl sie aufgrund von Aszites und einer Volumenüberlastung variieren können . In der Zwischenzeit repräsentiert die isovolumetrische Relaxationszeit, obwohl sie hochempfindlich ist, nicht die LV-Füllung und variiert, wenn sich die Herzfrequenz ändert .
Eine leichte systolische Dysfunktion und eine diastolische Dysfunktion können unabhängig vom Grad der Zirrhose dargestellt werden. Die diastolische Dysfunktion tritt jedoch am häufigsten bei zirrhotischen Patienten auf und geht im Allgemeinen der ersteren voraus .
Diskussion
Diese Übersicht befasst sich mit einer zunehmenden Identifizierung und Verständnis der Physiopathologie auf CCM, es ist Korrelation mit schlechter Prognose bei zirrhotischen Patienten und ergibt sich die Besorgnis über den therapeutischen Ansatz.
Dieser Artikel fasste die in der medizinischen Literatur bereits etablierten diagnostischen Kriterien (Tabelle 1) zusammen, wobei der Schwerpunkt auf den neuen Biomarkern lag, die zur diagnostischen Ergänzung untersucht wurden. Studien haben gezeigt, dass Myokardfunktionsstörungen in verschiedenen Stadien der Leberzirrhose vorliegen. Es wurde beschrieben, dass, wenn der Patient eine hohe BNP und ventrikuläre Dysfunktion auf dem Echokardiogramm hat, die Behandlung des Nierenversagens sehr schwierig ist; Andererseits ist eine frühzeitige Intervention bei Patienten, die noch keine Herzerkrankung festgestellt haben, ein Bereich, der noch nicht erforscht wurde.
Tabelle 1. Klinische und diagnostische Kriterien für die Diagnose von CCM. Angepasst von Referenz 29 mit Genehmigung.
Klinische Merkmale
Keine kardiopulmonalen Symptome in Ruhe
Niedrige funktionelle Herzreserve
Hiperadrenerger Zustand mit Natrium- und Flüssigkeitsretention
Biomarker (Troponin I, pro- BNP und BNP, andere)
Elektrokardiographie
Elektrophysiologische Anomalien (QT-Verlängerung und andere)
Echokardiographische Kriterien
Diastolische Bewertung
E / A-Verhältnis <1.0 (Alter korrigiert)
Verlängerte isovolumische Relaxationszeit (> 80msec)
Verlängerte Verzögerungszeit (> 200msec)
Linksventrikuläre Hypertrophie
Systolische Bewertung
Ejektionsfraktion in Ruhe < 55%
Kontraktionsdefizit bei Stress
Die Anzeichen und Symptome eines Leberversagens sind in der Regel spät, mit subtilen klinischen und Labormanifestationen, die manchmal schwer zu interpretieren sind. Der Facharzt oder sogar der Allgemeinarzt kann sich einem Patienten mit Dyspnoe-Beschwerden ohne pathologische Jugularschwellung, normalen kardiologischen Erstuntersuchungen, aber mit hohem BNP stellen, was einen Fall von CCM darstellen kann.
Im Gegensatz zu anderen Studien schlägt unsere Gruppe einen Fortschritt auf diesem Gebiet vor, da das Verständnis von Herzerkrankungen, die mit Zirrhose einhergehen, eine frühzeitige therapeutische Intervention von Komplikationen ermöglichen kann, die auf nicht diagnostiziertes Myokardversagen zurückzuführen sind. Lebertransplantation und TIPPS sind spezielle klinische Einstellungen, die Herzinsuffizienz bei diesen Patienten verpuffen können. Da Patienten nach diesen Eingriffen länger überleben, wären Kliniker mit einer Verschlechterung der Herzparameter konfrontiert .
Wir glauben, dass eine frühzeitige therapeutische Intervention bei CCM vielversprechend ist, wenn sie sich manifestiert durch Komplikationen wie refraktäre HRS, bevor eine klare Lungenstauung auftritt, die auf Myokardversagen zurückzuführen ist. Die Literatur belegt, dass Situationen von physischem oder pharmakologischem Stress oder Infektionen, die mit einer latenten zirrhotischen Kardiomyopathie verbunden sind, zu HRS führen können, die gegenüber herkömmlichen Behandlungen refraktär sein können und mit einer schlechteren Prognose verbunden sind, wenn eine systolische Dysfunktion vorliegt .
Unsere Erfahrung legt nahe, dass die Präsentation von HRS ein Hinweis darauf ist, die Behandlung der Myokardkomponente einzuleiten. Diese Progression zu HRS wird verstanden, da die Existenz von CCM ein Auslöser und ein fortbestehender Faktor von HRS ist, also wenn CCM in diesem Zusammenhang früh angegangen wird, HRS kann eine bessere Prognose haben .
Unsere Gruppe hat Pionierarbeit bei der Behandlung von Patienten mit einer klinischen Diagnose von CCM in Progression zu SHR geleistet, die auf konventionelle Behandlungen nicht ansprechen, bei denen die Verwendung von Dobutamin als Rettungstherapie für die Nierenfunktion erfolgreich war. Ziel ist es, dieses theoretische Wissen anzuwenden, um diese Komplikation bei Patienten mit Lebererkrankungen im Endstadium zu antizipieren .
Trotz des guten Verständnisses fehlt es an Wissen für eine ordnungsgemäße praktische Anwendung. Ein hohes Maß an klinischem Verdacht ist erforderlich, um CCM bei asymptomatischen Patienten ohne offensichtliche funktionelle Einschränkungen, aber mit subklinischen zellulären und strukturellen Herzerkrankungen zu erkennen.
Studien sind erforderlich, um mögliche Behandlungen zu identifizieren, die die natürliche Vorgeschichte von Herzerkrankungen bei Patienten mit Zirrhose verändern, insbesondere in den Phasen, in denen die Patienten asymptomatisch sind. Dies stellt einen Wissensbereich dar, der noch nicht erforscht ist, insbesondere in Bezug auf zukünftige therapeutische Optionen.
Interessenkonflikte
Die Autoren erklärten, dass es keine Interessenkonflikte in Bezug auf die Veröffentlichung dieses Papiers gibt.
Finanzielle Unterstützung
Keine.
- Sampaio F, Pimenta J (2016) Linksventrikuläre Funktionsbewertung bei Zirrhose: Aktuelle Methoden und zukünftige Richtungen. Welt J Gastroenterol 22: 112-125.
- Shin WJ, Song JG, Juni IG, Mond YJ, Kwon HM, et al. (2016) Einfluss der ventrikulo-arteriellen Kopplung auf die Transplantationsergebnisse bei Zirrhotikern: Analyse der Druck-Volumen-Kurvenbeziehungen. J Hepatol.
- Carvalheiro F, Rodrigues C, Adrego T, Viana J, Vieira H, et al. (2016) Diastolische Dysfunktion bei Leberzirrhose: Prognostischer Prädiktor bei Lebertransplantation? 48: 128-31.
- Merli M, Torromeo C, Giusto M, Iacovone G, Riggio O, et al. (2016) Das Überleben nach 2 Jahren bei Patienten mit Leberzirrhose wird durch das Volumen des linken Vorhofs und die linksventrikuläre Masse beeinflusst. Leber Int.
- Møller S, Henriksen JH (2002) Zirrhotische Kardiomyopathie: eine pathophysiologische Überprüfung der Kreislauffunktionsstörung bei Lebererkrankungen. Herz 87: 9-15.
- Mocarzel LO, Bicca J, Jarske L, Oliveira T, Lanzieri P, et al. (2016) Zirrhotische Kardiomyopathie: Ein weiterer Fall eines erfolgreichen Ansatzes zur Behandlung des hepatorenalen Syndroms. Fall Rep Gastroenterol 10: 531-7.
- Timoh T, Protano MA, Wagman G, Bloom M, Vittorio TJ (2011) Eine Perspektive auf zirrhotische Kardiomyopathie. Transplantation Proc 43: 1649-1653.
- Ma Z, Lee SS (1996) Zirrhotische Kardiomyopathie: Auf den Punkt gebracht. Hepatologie 24: 451-459.
- Zardi EM, Abbate A, Zardi DM, Dobrina A, Margiotta D, et al. (2010) Kardiomyopathie. J Am Coll Cardiol 56: 539-549.
- Myers RP, Lee SS (2000) Zirrhotische Kardiomyopathie und Lebertransplantation. Lebertransplantation: S44-52.
- Wiese S, Mortensen C, Gøtze JP, Christensen E, Andersen O, et al. (2014) Kardiale und proinflammatorische Marker sagen die Prognose bei Zirrhose voraus. Leber Int 34: e19-30.
- Fattouh AM, El-Shabrawi MH, Mahmoud EH, Ahmed WO (2016) Bewertung der Herzfunktionen von zirrhotischen Kindern unter Verwendung von Serum-Gehirn-Natriuretikum-Peptid und Gewebe-Doppler-Bildgebung. Ann Pediatr Cardiol 9: 22-8.
- Rahman S, Mallett S V (2015) Zirrhotische Kardiomyopathie?: Implikationen für das perioperative Management von Lebertransplantationspatienten 7: 507-20.
- Farr M, Schulze PC (2015) Jüngste Fortschritte in der Diagnose und Behandlung von Zirrhose-assoziierter Kardiomyopathie bei Lebertransplantationskandidaten: Fortgeschrittene Echobildgebung, kardiale Biomarker und fortgeschrittene Herzinsuffizienztherapie. Clin Med Erkenntnisse Cardiol 8: 67-74.
- Licata A, Corrao S, Petta S, Genco C, Cardillo M, et al. (2013) NT pro BNP Plasmaspiegel und Vorhofvolumen sind mit der Schwere der Leberzirrhose verbunden. Plus Eins 8: e68364.
- Abbas WA, Kasem Ahmed SM, Abdel Aal AM, Mahmoud AA, Abdelmalek MO, Mekky MA, et al. Galactin-3 und natriuretisches Peptid des Gehirns im Vergleich zur konventionellen Echokardiographie bei der Früherkennung einer zirrhotischen Kardiomyopathie. Türke Jodol 27: 367-74.
- Wong F, Siu S, Liu P, Blendis LM (2001) Natriuretisches Peptid im Gehirn: Ist es ein Prädiktor für Kardiomyopathie bei Zirrhose? Clin Sci (Lond) 101: 621-628.
- Wong F (2009) Zirrhotische Kardiomyopathie. Hepatol Int 3: 294-304.
- Mimidis K, Papadopoulos V, Thomopoulos K, Tziakas D, Ritis K, et al. (2003) Verlängerung des QTc-Intervalls bei Patienten mit Zirrhose. Ann Gastroenterol 16: 155-8.
- Mozos I (2015) Arrhythmierisiko bei Leberzirrhose. Welt J Hepatol 7: 662-672.
- Mocarzel LO, Bicca J, Jarske L, Oliveira T, Lanzieri P, et al. (2016) Zirrhotische Kardiomyopathie: Ein weiterer Fall eines erfolgreichen Ansatzes zur Behandlung des hepatorenalen Syndroms. Fall Rep Gastroenterol 10: 531-537.
- Batchvarov V, Camm AJ (2014) QT-Dispersion: Messung und Interpretation.
- Páll A, Czifra A, Vitális Z, Papp M, Paragh G, et al. (2014) Pathophysiologischer und klinischer Ansatz zur zirrhotischen Kardiomyopathie. J Gastrointestinale Leber Dis 23: 301-310.
- Castro Hevia J, Antzelevitch C, Tornés Bárzaga F, Dorantes Sánchez M, Dorticós Balea F, et al. (2006) Tpeak-Tend und Tpeak-Tend Dispersion als Risikofaktoren für ventrikuläre Tachykardie / Kammerflimmern bei Patienten mit dem Brugada-Syndrom. J Am Coll Cardiol 47(9): 1828-34.
- Demir C, Demir M (2013) Bewertung des Tp-e-Intervalls und des Tp-e / QT-Verhältnisses bei Patienten mit chronischer Hepatitis B. Prague Med Rep 114: 239-245.
- Jewell DP (2006) Neue Patienten, neue Lektionen, neues Denken bei entzündlichen Darmerkrankungen: Weltkongress für Gastroenterologie Symposium, Montreal, Kanada. Kolorektale Dis 8 Suppl 1(s1):1-2.
- Gassanov N, Caglayan E, Semmo N, Massenkeil G, Er F (2014) Zirrhotische Kardiomyopathie: die Perspektive eines Kardiologen. Welt J Gastroenterol 20: 15492-15498.
- Chayanupatkul M, Liangpunsakul S (2014) Zirrhotische Kardiomyopathie: review of pathophysiology and treatment. Hepatol Int 8: 308-315.
- Møller S, Henriksen JH, Bendtsen F (2014) Extrahepatic complications to cirrhosis and portal hypertension: haemodynamic and homeostatic aspects. World J Gastroenterol 20: 15499–517.
- Møller S, Bendtsen F (2015) Cirrhotic Multiorgan Syndrome. Dig Dis Sci 60: 3209-3225.