Genetisches Material wird in Zellen in Strukturen gespeichert, die Chromosomen genannt werden und an jedem Ende eine sich wiederholende Sequenz aufweisen, die als Telomer bekannt ist. Spezialisierte Proteine binden an diese Sequenzen, um eine schützende ‚Kappe‘ zu bilden, die das Chromosom schützt und verhindert, dass es mit anderen Chromosomen verschmilzt. Das Enzym Telomerase hilft auch bei der Aufrechterhaltung der Chromosomen, indem es repetitive DNA-Sequenzen an die Enden der Telomere hinzufügt.
Eines der am weitesten untersuchten Capping-Moleküle ist ein Protein namens Cdc13, das an bestimmte Arten von einzelsträngiger DNA in Knospenhefe bindet und mit zwei anderen Proteinen (Stn1 und Ten1) einen Komplex bildet, der Telomerase rekrutiert (Wellinger und Zakian, 2012). Mehrere Beweislinien deuten darauf hin, dass dieser CST-Komplex auch ein DNA-Replikationsenzym namens Primase-Pola rekrutiert und die Aktivität dieses Enzyms an den Enden der Chromosomen sowie an anderen Stellen im Genom regulieren kann (Giraud-Panis et al., 2010; Preis et al., 2010; Barbero Barcenilla und Shippen, 2019).
Ähnliche Komplexe wurden auch in anderen Eukaryoten, einschließlich Säugetieren, identifiziert, die Stn1, Ten1 und ein anderes Protein namens CTC1 in ihrem CST-Komplex enthalten (Giraud-Panis et al., 2010; Preis et al., 2010). Es hat sich jedoch als schwierig erwiesen, die Rolle der verschiedenen Proteine im CST-Komplex herauszufinden, da Zellen, denen nur eines dieser Proteine fehlt, ums Überleben kämpfen (Abbildung 1A). Jetzt berichten Jin-Qiu Zhou und Mitarbeiter der Chinesischen Akademie der Wissenschaften und der Shanghaier Universität – darunter Zhi–Jing Wu als Erstautor – in eLife über die Ergebnisse von Experimenten, die unser Verständnis des CST–Komplexes verbessern (Wu et al., 2020).
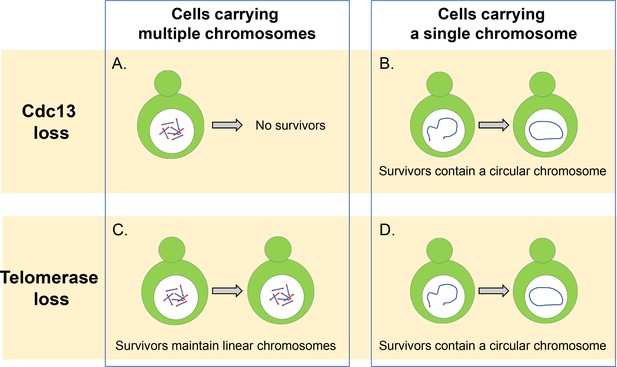
Cdc13 und Telomerase sind essentiell für die Aufrechterhaltung linearer Chromosomen.
( A) Hefezellen mit mehreren linearen Chromosomen benötigen das Capping-Protein Cdc13, um ihre Telomere zu schützen und zu verhindern, dass Chromosomen verschmelzen. Ohne dieses Protein können diese Zellen nicht überleben. (B) Zellen, die ein einzelnes lineares Chromosom haben, können ohne Cdc13 überleben, indem sie die Enden ihres Chromosoms zu einem kreisförmigen Ring verschmelzen. (C) In Abwesenheit des Enzyms Telomerase können Zellen mit mehreren linearen Chromosomen überleben, indem sie DNA-Rekombinationswege verwenden, die die Telomersequenz oder die DNA-Segmente, die zwischen der Chromatin- und der Telomersequenz liegen, amplifizieren können. (D) Zellen mit einem einzelnen linearen Chromosom überleben den Verlust der Telomerase, indem sie durch homologe Rekombination zu einem zirkulären Chromosom verschmelzen, ähnlich wie dies bei Zellen ohne das Protein Cdc13 der Fall ist.
Bildnachweis: Constance Nugent und Katsunori Sugimoto.
Zunächst Wu et al. untersuchte, wie das Löschen des CST-Komplexes die Lebensfähigkeit eines Knospenhefestamms beeinflusste, bei dem alle seine 16 Chromosomen zu einem einzigen zirkulären Chromosom fusioniert waren (Shao et al., 2019). Sie fanden heraus, dass das Entfernen von CST die Zellen nicht davon abhielt, sich zu vermehren oder zu mehr Zelltod zu führen, selbst wenn das zirkuläre Chromosom die repetitiven Telomersequenzen enthielt. Es scheint daher, dass die Hauptaufgabe des CST-Komplexes darin besteht, lineare Chromosomen aufrechtzuerhalten und zu verhindern, dass Chromosomen mit anderen Chromosomen verschmelzen, und dass er für die Replikation interner Telomersequenzen nicht wesentlich ist.
Neben der Bildung eines Kreisrings können die 16 Chromosomen der Knospenhefe auch zu einem einzigen linearen Chromosom fusioniert werden (Shao et al., 2018). Wu et al. fand heraus, dass das Entfernen des CST-Komplexes die Lebensfähigkeit dieser Zellen stark reduzierte, aber einige dieser Zellen konnten überleben, indem sie die Enden ihres linearen Chromosoms zu einem kreisförmigen Ring verschmolzen (Abbildung 1B). Das individuelle Löschen der Gene, die für die verschiedenen Proteine des CST-Komplexes kodieren, ergab, dass Zellen, denen Cdc13 fehlte, eine höhere Fusionsrate aufwiesen als Zellen, denen die Gene für Stn1 und Ten1 fehlten. Dies deutet darauf hin, dass Cdc13 eine dominierende Rolle bei der Hemmung der Fusion von Chromosomen spielt und dass Stn1 und Ten1 unabhängig von Cdc13 zum Schutz von Telomeren beitragen. Die Einzelheiten dieses Mechanismus sind jedoch noch unklar und müssen weiter untersucht werden.
In Wildtyp-Zellen, die mehrere Chromosomen enthalten, ist es selten, fusionierte oder zirkuläre Chromosomen zu finden, selbst wenn die Aktivität der Telomerase beeinträchtigt wurde: Dies liegt daran, dass Zellen Telomere verlängern und aufrechterhalten können, indem sie einen Mechanismus namens homologiegesteuerte Rekombination verwenden, der doppelsträngige DNA-Brüche repariert (Abbildung 1C). Wu et al. fand heraus, dass die Verringerung der Anzahl der Chromosomen dazu führte, dass mehr Fusionen in Zellen nachgewiesen wurden, denen das Enzym Telomerase fehlte. Dies deutet darauf hin, dass die Verringerung der Anzahl der Chromosomen die Wahrscheinlichkeit erhöht, dass Zellen zirkularisierte Chromosomen produzieren und den Verlust von Telomerase überleben können.
Es wurde angenommen, dass die Verschmelzung der beiden Enden des singulären linearen Chromosoms auf einem DNA-Reparaturweg beruht, der als nonhomologous End-Joining (NHEJ) -Weg bezeichnet wird (Haber, 2016). Wu et al. zeigte, dass in Abwesenheit von Telomerase die Chromosomenfusion von Rad52 abhing, das eine entscheidende Rolle bei der homologen Rekombination von DNA-Brüchen in Knospenhefe spielt (Abbildung 1D). Es ist möglich, dass die in dieser Studie verwendeten Zellen für die Chromosomenzirkularisierung auf den Rad52-Weg angewiesen sind, da das einzelne Chromosom nahe einem Ende des Chromosoms eine invertierte Telomersequenz aufweist. Wenn eine solche Sequenz gelöscht würde, könnten Zellen eine End-to-End-Fusion über den NHEJ-Weg durchlaufen, der in menschlichen Zellen häufiger vorkommt (Palm und de Lange, 2008). Zusätzliche Experimente zeigten, dass dieser Befund nicht auf einen Verlust der NHEJ-Aktivität zurückzuführen war und dass dieser Weg linearisierte Plasmide in angehenden Hefezellen verschmelzen kann.
Die Arbeit von Wu et al. bietet neue Erkenntnisse darüber, wie Chromosomen miteinander verschmelzen und wie Telomere unabhängig vom Telomeraseenzym erhalten bleiben. Darüber hinaus könnten die Ergebnisse dieser Studie über Hefe hinausgehen und unser Verständnis verschiedener menschlicher medizinischer Syndrome verbessern, die durch die Verschmelzung der Enden von Chromosomen zu Ringformen verursacht werden (Pristyazhnyuk und Menzorov, 2018).