Einleitung
Helicobacter pylori (H. pylori) ist ein gramnegatives mikroaerophiles Bakterium, dessen natürlicher Lebensraum der Magen ist. Obwohl es typischerweise eine Bazillenform mit mehreren Flagellen an einem Ende hat, nimmt es unter ungünstigen Umweltbedingungen ein kokkoides Aussehen an.1,2
H. pylori ist ein wichtiger ätiologischer Faktor bei aktiver chronischer Gastritis, Magengeschwür, Magenschleimhaut-assoziiertem Lymphgewebe (MALT) Lymphom und Magenkrebs. Obwohl das Bakterium schätzungsweise in der Magenschleimhaut der Hälfte der Weltbevölkerung vorhanden ist, entwickeln sich diese Krankheiten nur bei etwa 15-20% der kolonisierten Individuen.2,3
Die gängigsten Behandlungsschemata haben in vielen geografischen Gebieten zu einer Eradikationsrate von rund 85% geführt,4-6 Die Wirksamkeit wurde jedoch insbesondere in den letzten Jahren durch das rasche Auftreten antibiotikaresistenter Stämme und eine schlechte Therapietreue beeinträchtigt.5,7
Es ist wichtig zu berücksichtigen, dass die Heilung (sowie die Vorbeugung von Komplikationen) bei aktiver chronischer Gastritis und Magengeschwüren und bei einigen minderwertigen Formen des Magen-MALT-Lymphoms vom Erfolg der H. pylori-Eradikation abhängt. Darüber hinaus würde die Sicherstellung und Aufrechterhaltung einer erfolgreichen Ausrottung dieses Mikroorganismus in all seinen biologischen Formen ein Wiederauftreten der Infektion und damit Krankheitsrückfälle verhindern.
Ziel dieses Reviews ist es, einen allgemeinen Überblick über die kokkoide Form von H. pylori zu geben und sein mikrobiologisches Profil, seine Antibiotikaempfindlichkeit und seine Virulenz hervorzuheben. Seine Beteiligung an Magenerkrankungen wird ebenfalls analysiert, und das Ausmaß, in dem es mit Infektionsrekrudeszenz und Krankheitsrückfall verbunden ist, wird untersucht.
Überleben und zelluläre Anpassung von H. pyloriGeneral considerations
Alle lebenden Organismen sind mit Mechanismen ausgestattet, die es ihnen ermöglichen, in widrigen Umgebungen zu überleben. Für einige impliziert ihre Reaktion (zusätzlich zu metabolischen Anpassungen) Veränderungen der Zellmorphologie.8,9 Mehrere Mikroorganismen haben die Fähigkeit, sich als Reaktion auf überlebens- und wachstumsfeindliche Umweltbedingungen in einen lebensfähigen, aber nicht kultivierbaren Zustand (VBNC) zu differenzieren. Diese Strategie wird häufig von Mikroorganismen wie Salmonellen, Campylobacter und Escherichia verwendet.10,11
Im VBNC-Zustand verringern Bakterien im Allgemeinen ihre Größe und ändern ihre Form, um kleine kugelförmige Körper zu werden. Sie reduzieren ihre Atmungsrate und ihren Nährstofftransport und verändern die Genexpression und molekulare Synthese. In diesem Zustand können sie mit herkömmlichen Kulturtechniken nicht nachgewiesen werden. Änderungen der Umweltbedingungen können jedoch dazu führen, dass diese Mikroorganismen entweder „wiederbeleben“ (und in ihren aktiven Zustand zurückkehren) oder degenerieren.10-13
In ähnlicher Weise H. pylori verändert, wenn es schädlichen Umweltbedingungen (in oder außerhalb seines natürlichen Lebensraums) ausgesetzt ist, seine klassische Bazillenform und tritt in einen VBNC-Zustand ein, der zu morphologischen und metabolischen Veränderungen sowie zu Veränderungen des Wachstumsverhaltens führt.14,15
Lebensfähiger, aber nicht kultivierbarer Zustand von H. pylori
Obwohl einige Autoren zunächst zu demonstrieren versuchten, dass die Umwandlung von der Bazillen- in die Kokkenform ein passiver Prozess war, der zum Zelltod führte, und daher die Kokkenformen die degenerierten Überreste toter Bakterien waren,16,17 drei Formen von H. pylori werden derzeit als vorhanden angesehen, nämlich (in der Reihenfolge der meisten bis am wenigsten virulenten), die lebensfähige, kultivierbare Bazillenform, die VBNC-Kokkoidform und die nicht lebensfähige degenerative Form.18-20
Morphologisch erfolgt die Umwandlung von der Bazillen- in die Kokkenform durch intermediäre V- und U-Formen13,14 (Abb. 1 und 2), in denen Zellstrukturen wie Zytoplasma und Zellmembran intakt bleiben,15,21, während die Flagellen dazu neigen, sich um die kokkoide Zellstruktur zu wickeln und dadurch nahezu unsichtbar zu werden. Andere ultrastrukturelle Modifikationen der Kokkenform führen zu zwei Untertypen. Typ A hat unregelmäßige Kanten mit einer rauen Oberfläche und wird als tote Zelle angesehen, während Typ B eine glattere Oberfläche hat, kleiner ist und als lebende Zelle angesehen wird.21,22
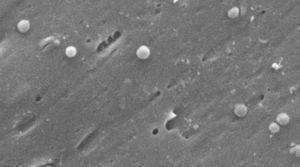
Bilder der kokkoiden Form von Helicobacter pylori. Rasterelektronenmikroskop Bild mit freundlicher Genehmigung von Dr. Nuno F. Azevedo. LEPABE-Chemieingenieurwesen der Fakultät für Ingenieurwissenschaften an der Universität von Porto (Portugal).
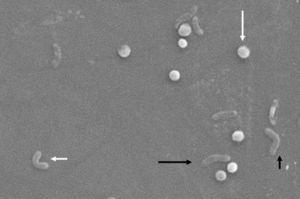
Morphologische Veränderungen bei Helicobacter pylori. Spiralform (langer schwarzer Pfeil), V-Form (kurzer schwarzer Pfeil), U-Form (kurzer weißer Pfeil) und Kokkoidform (langer weißer Pfeil). Rasterelektronenmikroskop Bild mit freundlicher Genehmigung von Dr. Nuno F. Azevedo. LEPABE-Chemieingenieurwesen der Fakultät für Ingenieurwissenschaften an der Universität von Porto (Portugal).
In rasterelektronenmikroskopischen (REM) Analysen der oberflächlichen Schleimgelschicht von mit H. pylori infizierten Magenkrebspatienten haben Ogata et al.23 beobachtete die Koexistenz von Bazillen- und Kokkoidenformen. Andere Autoren haben das Vorhandensein der Kokkoidform sowohl im menschlichen Magen als auch im Zwölffingerdarm bestätigt,24-26 obwohl es scheint, dass der Prozentsatz der Kokkoidformen im Zwölffingerdarm höher ist als im Magen, bis zu dem Punkt, an dem nur die Kokkoidform beobachtet wird in einigen Zwölffingerdarmbiopsien.26,27 Diese Tatsache legt entweder nahe, dass H. pylori ist gezwungen, sich an biologische Bedingungen im Zwölffingerdarm anzupassen, oder diese Bedingungen sind ideal, damit H. pylori dort im VBNC-Zustand Zuflucht sucht.
In-vitro- und In-vivo-Experimente haben gezeigt, dass unter ungünstigen Bedingungen wie Aerobiose,28,29 alkalischem pH-Wert,29,30 hoher Temperatur, 31 langen Inkubationszeiten,29,32 längerer Inkubation in wasser33 oder Behandlung mit Protonenpumpenhemmern32 oder Antibiotika,34 der Kokkoid-Phänotyp ein gewisses Maß an metabolischer Aktivität aufrechterhalten kann, da er eine Vielzahl von Genen exprimiert, die in der Bazillenform vorhanden sind,35 nachweisbare Niveaus der Ureaseaktivität beibehält,36 weiterhin Proteine synthetisiert, wenn auch in kleineren Mengen (weniger als 1% der Menge an Proteinen, die von der bazilläre Form)37 und produziert kleine Mengen DNA, die auch nach 3-monatiger Lagerung in physiologischer Kochsalzlösung bei 4 ° C erhalten bleiben.29,38 Alle diese Daten unterstreichen die Tatsache, dass die biologischen Veränderungen in H. pylori als Reaktion auf schädliche Reize seine starke Fähigkeit widerspiegeln, während seiner Nutzungsdauer die Art zu erhalten.
Biofilmbildung
Wie bei anderen Bakterien ist die Fähigkeit von H. pylori, als infektiöse Entität zu bestehen und dem Arsenal antimikrobieller Mittel zur Ausrottung zu widerstehen, auf die genetische Variabilität zurückzuführen, die es ihm ermöglicht, bakterielle Resistenzen zu entwickeln. Seine Überlebensstrategie wird weiter verbessert, wenn Bakterienzellen sogenannte Biofilme bilden.20 Biofilme sind eine Art mikrobielle „Gemeinschaft“, in der die Bakterien mittels einer selbst produzierten Matrix fest an biotischen oder abiotischen Oberflächen haften. Diese Matrix, bestehend aus extrazellulären polymeren Substanzen,39,40 schafft eine Umgebung, die sehr tolerant gegenüber antimikrobiellen Mitteln und stark resistent gegen Phagozytose ist. Verschiedene Wirtsabwehrmechanismen werden daher umgangen, was die Eradikation erschwert. Biofilme gelten als wirklich komplexe, dynamische Systeme, die den horizontalen Gentransfer zwischen Bakterien erleichtern. Sie verleihen Bakterienpopulationen somit neue modifizierte Genome, die wesentlich zur Bakterienresistenz, Stammvariabilität und Anpassungsfähigkeit beitragen.41-43
In einer Studie mit 21 Biopsien von Patienten, bei denen das Bakterium zuvor ausgerottet worden war, wurde H. pylori in 7 der Biopsien durch Kultur isoliert, während Genexpressionstechniken in den meisten Biopsien lebensfähige H. pylori-Zellen nachwiesen. SEM zeigte unterdessen gruppierte Kokkoidbakterien, die in einem mikrobiellen Biofilm angeordnet sind, was darauf hindeutet, dass die Kokkoidformen die bakterielle Persistenz und Antibiotikaresistenz erleichtern könnten.44
Empfindlichkeit gegenüber Antibiotika der Kokkoidenform
Viele Studien haben gezeigt, dass H. pylori bei Exposition (in vitro) gegenüber verschiedenen antimikrobiellen Mitteln von der Bazillen- in die Kokkoidenform übergehen kann. Unterschiedliche Konzentrationen von Amoxicillin, Clarithromycin, Metronidazol und Erythromycin (um nur einige der verfügbaren Antibiotika zu nennen) können diese morphologische Transformation induzieren.34,35,45 Der größte Induktionseffekt wurde mit Amoxicillin beobachtet,27,34,46 bekannt als hochwirksam in vitro gegen H. pylori; morphologische Beobachtungen der Kulturen zeigen jedoch, dass die Anzahl der Bazillenformen zugunsten der Kokkenformen abnimmt.34,46 Faghri et al., 47 erzielte bakterizide Wirkungen für die Kokkoidformen bei über 60% mit Metronidazol bei doppelter minimaler Hemmkonzentration (MHK) und bei 80-90% mit Clarithromycin an der MHK; Die Amoxicillin-Behandlung mit MHK und MHK × 2 hemmte jedoch keine lebensfähigen Kokkoidformen. In ähnlicher Weise haben Berry et al.34 beobachtet, dass Amoxicillin bei MIC × 10 bazilläre Formen von H. pylori eliminierte, aber auch die Bildung von Kokkoidformen induzierte. In: Perkins et al.48 beobachteten in einer Studie an Katzen, die auf natürliche Weise mit H. pylori infiziert waren, dass 6 Wochen nach der Eradikationsbehandlung Magensäfte bei nur einer Katze positiv auf H. pylori waren, während die Polymerase-Kettenreaktion (PCR) -Analyse bei allen Katzen in der Studie H. pylori-genetisches Material identifizierte. Obwohl H. pylori wurde bei einer einzelnen Katze nachgewiesen, die histologischen Läsionen stimmten mit chronischer Gastritis überein und waren durch das Vorhandensein von Lymphfollikeln gekennzeichnet.
Unter Berücksichtigung dieser mikrobiologischen und grundlegenden Forschungsdaten wurde in einer früheren Studie an mit H. pylori infizierten Patienten — bei der zuvor die Empfindlichkeit der isolierten Stämme gegenüber Amoxicillin bestimmt wurde — eine Doppeltherapie (Protonenpumpenhemmer und Amoxicillin) durchgeführt eine Heilungsrate für Amoxicillin-empfindliche Stämme von nur 66%. Dieses Ergebnis zeigt das Vorhandensein wichtiger zusätzlicher unabhängiger bakterieller Resistenzfaktoren im Zusammenhang mit der erfolgreichen Anwendung dieses Antibiotikums.49 Dies gilt insbesondere, wenn man bedenkt, dass es unmöglich erscheint, dass Kokkoidformen gegenüber β-Lactam-Antibiotika empfindlich sein könnten, da Kokkoidformen andere Penicillin-bindende Proteinprofile aufweisen als bazilläre Formen.50 Es ist daher wahrscheinlich, dass nicht alle H. pylori-Organismen nach der Eradikationsbehandlung vollständig eliminiert werden; Vielmehr werden einige wahrscheinlich in kokkoide Formen umgewandelt und werden so resistent gegen antibakterielle Arzneimittel. Dies würde Behandlungsversagen und Rekrudeszenz erklären.13,34,45
Hervorzuheben ist, dass einige neuere Studien gezeigt haben, dass freie Fettsäuren wie Linolensäure und liposomale Linolensäure unabhängig von ihrer Antibiotikaresistenz eine bakterizide Wirkung auf beide H. pylori-Formen haben.51,52 Diese Moleküle könnten daher eine potenziell wirksame antimikrobielle Wirkung bei der Behandlung von Infektionen mit H. pylori, insbesondere in seiner kokkoiden Form, haben.
Virulenz und Pathogenität der Kokkoidform
Die Virulenzfaktoren für die bazilläre Form von H. pylori und die Mechanismen, durch die dieses Bakterium an der Entwicklung von Magen-Darm-Erkrankungen beteiligt ist, wurden ausführlich untersucht.1,3,4 Über die Virulenz und Pathogenität der Kokkoidform ist jedoch wenig bekannt. Im Folgenden überprüfen wir die wichtigsten Ergebnisse zu diesem Thema.
Wie die bazilläre Form exprimiert die Kokkoidform wichtige Virulenzgene wie Harnstoff, ureB, hpaA, vacA und cagA, cagE und BabA.35,53,54 Dieser Ausdruck, der über einen längeren Zeitraum auftritt, spielt wahrscheinlich eine wichtige Rolle bei chronisch schweren Magenerkrankungen.
Einhaltung von H. es ist bekannt, dass Pylori zum gastroduodenalen Epithel ein wichtiger Schritt bei der Induktion einer aktiven chronischen Entzündung der Schleimhautschicht ist. SEM-Studien haben gezeigt, dass die kokkoide Form von H. pylori auf der Plasmamembranoberfläche der Magenepithelzellen vorhanden sein kann und wie die Bazillenform in diese Zellen eindringen kann.15,55 Wenn eine Zellinvasion auftritt, sind die kokkoiden Formen in doppelschichtigen Membranvesikeln eingeschlossen, und die Magenepithelzellen erscheinen geschwollen und lytisch, was eine Erosion der Schleimhautschicht zeigt.56 Da die Kokkoidform weniger anfällig für Antibiotika ist, wird angenommen, dass sich diese latenten Plasmamembranformen ausbreiten und andere benachbarte Epithelzellen infizieren können, wenn keine wirksame Antibiotikakonzentration vorliegt.57
Es ist auch bekannt, dass eine H. pylori-Infektion eine lokale Immunantwort induziert, die die Bakterien nicht ausrottet, wodurch die Magenerkrankung chronisch werden kann. Die Immunantwort kann durch Antikörpernachweis unter Verwendung serologischer Methoden bestimmt werden, die unter Verwendung der Bazillenform von H. pylori entwickelt wurden.58 Tatsächlich kann das Vorhandensein dieser spezifischen Antikörper als epidemiologischer Infektionsindikator und zur Bestätigung des Behandlungserfolgs verwendet werden. Es gibt jedoch keine serologischen Methoden, die Kokkoidformen nachweisen. Um festzustellen, ob Kokkoidformen einen Einfluss auf die Immunantwort bei kolonisierten Individuen hatten, Figueroa et al.59 entwickelte eine spezifische ELISA-Technik (Enzyme-Linked Immunosorbent Assay), um die Immunantwort auf Kokken- und Bazillenformen gegen eine Gruppe von Seren von symptomatischen und asymptomatischen infizierten Personen zu bewerten und zu vergleichen. Die kokkoiden Formen von H. es wurde gezeigt, dass Pylori eine humorale Immunantwort induzieren, die der durch die Bazillenformen bei infizierten Personen induzierten ähnelt. In einer anderen Studie, die bei Kindern mit epigastrischen Schmerzen durchgeführt wurde, wurde die mögliche Rolle der Kokkoidform bei der H. pylori-Infektion unter Verwendung einer ELISA-Technik und Antigenen, die aus Bazillen- und Kokkoidzellformen hergestellt wurden, untersucht. Es wurde festgestellt, dass 13,3% und 55,8% der Zellen für Antigene der Bazillenform bzw. der Kokkoidform seropositiv waren, während die Seropositivitätswerte für asthmatische Kinder nur 7,0% bzw. 26,5% betrugen. Dieser etwa vierfache Unterschied in der Seropositivität zwischen den Antigenen der Kokkoid- und Bazillenform bei symptomatischen und asymptomatischen Patienten könnte auf eine mögliche infektiöse Rolle der Kokkoidform von H. pylori hindeuten.60
Cellini et al.61 intragastrisch inokulierte konzentrierte Suspensionen von H. pylori in kokkoider Form in einem BALB/c-Mausmodell. H. pylori wurde 2 Wochen später isoliert, histopathologische Veränderungen traten 1 Monat später auf und alle kolonisierten Mäuse zeigten eine systemische Antikörperantwort auf H. pylori. In anderen Experimenten mit BALB / c-Mäusen entwickelten Tiere, die mit kokkoiden Formen geimpft wurden, signifikante pathologische Veränderungen im Magen, einschließlich erosiver Läsionen und entzündlicher Zellinfiltration der Magenschleimhaut.36 Sie et al.,53 um Virulenz und Infektiosität zu vergleichen, intragastrisch inokulierte BALB / c-Mäuse mit H. pylori, eine Gruppe mit der Bazillenform und eine zweite Gruppe mit der Kokkoidenform. Bei der SEM-Untersuchung von Proben aus den 2 Gruppen beobachteten sie die Adhäsion von Bazillen- und Kokkoidformen an den Epithelzellen der Magenwand und das Vorhandensein von Flagellen in den Kokkoidformen. Die histologische Untersuchung zeigte verschiedene Grade von Läsionen in der Magenschleimhaut, von leichter entzündlicher Zellinfiltration bis hin zu Erosionen und Geschwüren. Die Schleimhautläsion war bei den mit der Kokkoidform infizierten Mäusen milder, während in der Kontrollgruppe, die steriles Wasser erhielt, kein positives Ergebnis erzielt wurde.53 Rabelo-Gonçalves et al.62 zeigten, dass kokkoide Formen von H. pylori induzierte eine akute Entzündungsreaktion im Magen von Mäusen aus den frühesten Stadien der Infektion. Die obigen Ergebnisse unterstreichen die Fähigkeit von Kokkoidenformen, die Magenschleimhaut in vivo zu besiedeln und zu infizieren.
Mehrere Studien haben das Vorhandensein der Kokkoidform in Wasser gezeigt.33,63 Eine solche Studie — von unserer Gruppe – verglich 2 Gruppen entwöhnter Wistar-Mäuse, von denen eine Brunnenwasser und Leitungswasser über einen längeren Zeitraum und die andere steriles destilliertes Wasser verabreichte, und stellte fest, dass die Mäuse der Studiengruppe einen chronischen Entzündungsprozess mit Bildung von lymphozytären Plaques und das Vorhandensein von Bazillen im Einklang mit H. pylori.64
Wie bereits erwähnt, wäre es logisch anzunehmen, dass H. pylori tritt in einen „ruhenden“ Zustand ein und modifiziert seine klassische Bazillenform in die Kokkenform, ohne degenerative Veränderungen in seinem Genom hervorzurufen, und behält die Fähigkeit, zur Bazillenform zurückzukehren, sobald sich die Umwelt- oder natürlichen Lebensraumbedingungen verbessern.
Beteiligung der Kokkoidform an der Rekrudeszenz
Das Wiederauftreten von H. pylori nach erfolgreicher Eradikation ist in Industrieländern im Vergleich zu Entwicklungsländern mit jährlichen Rezidivraten von 2,67% bzw. 13% selten.65,66
Es gibt zwei Arten des Wiederauftretens einer H. pylori-Infektion: recrudescence, wenn der Bakterienstamm, der für das Wiederauftreten verantwortlich ist, genetisch identisch zu dem ist, der vor der Ausrottung isoliert wurde; und Reinfektion, wenn das Wiederauftreten durch einen anderen Stamm verursacht wird.67 Die Unterscheidung von recrudescence von Reinfektion erfordert PCR oder genetische Polymorphismus-Analyse Bakterienstämme zu identifizieren.67,68 Da diese Methoden nicht routinemäßig angewendet werden, ist es in der klinischen Routinepraxis oft unmöglich, zwischen Rekrudeszenz und Reinfektion zu unterscheiden.
H. das Wiederauftreten von Pylori ist klinisch relevant, da bei einem erheblichen Teil der infizierten Patienten ein Rückfall von Magengeschwüren beobachtet werden kann, während das Wiederauftreten von Mikroorganismen einige MALT-Lymphom-Rezidive nach der Behandlung erklären könnte.69 Faktoren wie Trinkwasser, Zahn- und Zahnfleischerkrankungen, wiederkehrende Mandelentzündung, Krankenhausaufenthalt, zahnärztliche und medizinische Geräte und Kontakt mit Familienmitgliedern beeinflussen vermutlich das Wiederauftreten von H. pylori.70-72 Andere Faktoren, die mit einem Wiederauftreten der Infektion verbunden sind, sind jüngeres Alter, Diabetes bei jungen Patienten, niedriges Jahreseinkommen und langfristige Hemmung der Magensäure nach Eradikation.73-76
Recrudescence gilt als der wahrscheinlichste Grund für ein Wiederauftreten im ersten Jahr nach der Eradikation, während eine erneute Infektion nach einem längeren Zeitraum auftreten kann.68,77 Viele Rezidivfälle in Industrieländern sind in Wirklichkeit auf Rekruten zurückzuführen. Eine erneute Infektion ist in Entwicklungsländern häufiger, da die Menschen anscheinend ständig H. pylori ausgesetzt sind.65,78
Unter Verwendung von Polyacrylamid-Gelproteinelektrophoresetechniken haben Costas et al.79 fanden heraus, dass Patienten mit Rezidiven 4 Wochen nach der Eradikationsbehandlung tatsächlich nicht mit einem anderen Stamm von H. pylori infiziert waren; Vielmehr war der Stamm, der die ursprüngliche Infektion verursacht hatte, durch die Behandlung nicht vollständig ausgerottet worden, was zu einem erneuten Auftreten der Infektion führte. Daher ist es wichtig, die Wirksamkeit des therapeutischen Regimes zu berücksichtigen: H. Pylori-Rezidive treten häufig bei Patienten auf, die mit Therapien mit geringer Wirksamkeit behandelt werden, sind jedoch selten, wenn Therapien mit hoher Wirksamkeit angewendet werden. Dies wurde durch eine Studie zur Inzidenz von H. pylori-Rezidiven in Spanien von Gisbert et al.,80 who fanden heraus, dass das Wiederauftreten von H. pylori 6 Monate nach der Eradikation bei Patienten, die mit Therapien mit geringer Wirksamkeit behandelt wurden, 8, 2% betrug, bei Patienten, die mit Therapien mit hoher Wirksamkeit behandelt wurden, jedoch nur 1, 7%.
In einer Studie, die von 2007 bis 2010 in Korea durchgeführt wurde, hat H. die Pylori-Rezidivraten wurden nach 6 Monaten erfolgreicher First- und Second-Line-Eradikationstherapien mit jährlichem Follow—up — bis zum Ende des Studienzeitraums – basierend auf Atemtests, Magenbiopsie und Urease-Schnelltests analysiert.81 Es wurde festgestellt, dass die jährlichen Rezidivraten innerhalb und nach dem 2-Jahres-Follow-up 9,3% bzw. 2,0% nach der Erstlinientherapie und 4,5% bzw. 2,9% nach der Zweitlinientherapie betrugen. Die Autoren kamen zu dem Schluss, dass jährliche H. die Pylori-Rezidivraten bei Patienten, die eine Eradikationsbehandlung erhielten, zeigten nach der 2-jährigen Nachbeobachtungszeit einen starken Rückgang. Dies wurde als ausreichende Zeit nach der Behandlung angesehen, um die Eradikation zu bestätigen, und auch als ausreichende Zeit, um zwischen einem Wiederauftreten und einem erneuten Auftreten von H. pylori-Stämmen unterscheiden zu können.81
Abschließende Überlegungen und Schlussfolgerungen
Angesichts der Fähigkeit von H. um in einen VBNC-Zustand zu gelangen, wenn er ungünstigen Bedingungen innerhalb oder außerhalb seines Lebensraums ausgesetzt ist, ist anzunehmen, dass Antibiotika-Behandlungsschemata, die zur Ausrottung der Bazillenform von H. pylori verwendet werden, VBNC-Kokkoidformen induzieren können, die in der gastroduodenalen Umgebung längere Zeit überleben können. Von hier aus können sie ein direktes und indirektes pathogenes Potenzial haben, das zu einem erneuten Auftreten der Infektion und infolgedessen zu Behandlungsfehlern, Infektionsrückfällen und Wiederauftreten von gastroduodenalen Erkrankungen führt. Eine erfolgreiche Ausrottung kann daher nicht nur die Ausrottung der Bazillenformen, sondern auch der Kokkoidenformen erfordern oder sicherstellen, dass keine Kokkoidenformen induziert werden.
Da Routinemethoden, die derzeit in der klinischen Praxis zur Bestätigung der Eradikation von H. pylori eingesetzt werden, keine kokkoiden Formen nachweisen können, können Wirte fälschlicherweise als infektionsfrei diagnostiziert werden; Darüber hinaus können diese Methoden möglicherweise keinen vollständigen Nachweis für das klinische Potenzial der zur Eradikation von H. pylori verwendeten Arzneimittel erbringen. Damit die Eradikation als erfolgreich angesehen werden kann, wird eine jährliche Nachsorge empfohlen – mit nicht—invasiven Techniken oder, falls verfügbar, molekularen Methoden -, um festzustellen, ob Bakterien vollständig eliminiert wurden, insbesondere in Gebieten mit hoher Prävalenz und bei Patienten mit Rezidivrisiko.
Schließlich sind weitere Studien über die kokkoide VBNC-Form von H. pylori, ihr pathogenes Potenzial, ihre Beteiligung an Infektionen und Rekrudeszenzen sowie ihre Rolle bei der Bildung von Biofilmen im Magen und an anderen Stellen im Wirt erforderlich. Solche Studien würden die Entwicklung sowohl effektiverer diagnostischer Protokolle ermöglichen, die eine Unterschätzung der Besiedlung durch H. pylori vermeiden, als auch neuartiger therapeutischer Strategien zur Beseitigung von Kokkoidenformen und zur „Entwaffnung“ von Biofilmen.
Interessenkonflikt
Die Autoren erklären, dass sie keinen Interessenkonflikt haben.