Lungenembolie (PE) ist eine häufige Ursache für kardiovaskulären Tod mit zunehmender Inzidenz.1-4 Das Auftreten eines akuten Anstiegs der rechtsventrikulären (RV) Nachlast infolge einer Thrombusobstruktion in den Lungenarterien, einer hypoxämischen Vasokonstriktion und der Freisetzung von Vasokonstriktoren der Lungenarterie kann zu RV-Dysfunktion und -dilatation sowie zu einer verminderten linksventrikulären (LV) Vorlast führen, was in den schwersten Fällen zu einem kardiovaskulären Kollaps führt.5 Die Antikoagulation ist die Hauptstütze der Behandlung aller PEs mit hervorragenden Ergebnissen bei Patienten mit geringem Risiko.6,7
Es gibt jedoch eine Untergruppe von Patienten mit PE mit mittlerem bis hohem und hohem Risiko, die von einer fortgeschritteneren Therapie profitieren können, einschließlich systemischer Fibrinolyse, kathetergerichteter Therapie (CDT) mit oder ohne Infusion von Fibrinolytika oder Lungenembolektomie, da diese Optionen die Thrombusbelastung aktiv reduzieren, um die RV-Nachlast zu verringern. Bei Patienten, die die Erstpräsentation überleben, können sich Langzeitfolgen entwickeln, einschließlich anhaltender RV-Dysfunktion, chronischer thromboembolischer pulmonaler Hypertonie und verminderter Lebensqualität und Belastungstoleranz.8,9
Es wurde nachgewiesen, dass die systemische Fibrinolyse die Thrombusbelastung und den Lungenarteriendruck schnell senkt. Dies ist jedoch mit dem Risiko einer größeren Blutungsrate von mehr als 20 Prozent und der befürchteten Komplikation einer intrakraniellen Blutung (ICH) in 3 Prozent verbunden.10,11 Die Sorge um Blutungskomplikationen hat zu einer Unterauslastung der systemischen Fibrinolyse geführt, wobei ein hoher Anteil der Patienten eine absolute oder relative Kontraindikation aufweist.12 Angesichts der Häufigkeit unerwünschter Ereignisse war die systemische Fibrinolyse im Allgemeinen auf diejenigen mit dem höchsten Risiko mit Anzeichen eines hämodynamischen Kompromisses oder eines kardiogenen Schocks beschränkt. CDT wurde zunehmend genutzt, um eine aktive Verbesserung der RV-Nachlast über die Antikoagulation hinaus zu bieten allein, aber mit einer reduzierten Dosis oder ohne fibrinolytische Therapie.
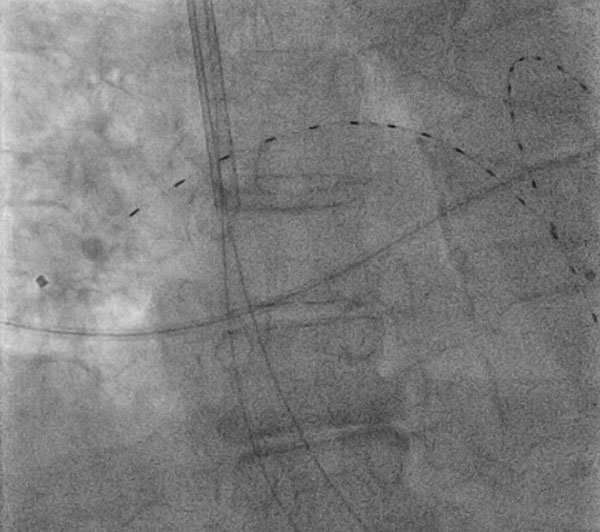 Abbildung 1: Kathetergesteuerte, ultraschallgestützte, niedrig dosierte Fibrinolyse
Abbildung 1: Kathetergesteuerte, ultraschallgestützte, niedrig dosierte FibrinolyseEine 74-jährige Frau mit bilateraler proximaler Lungenembolie mit persistierender Tachykardie erhielt eine kathetergesteuerte, ultraschallgestützte, niedrig dosierte Fibrinolyse unter fluoroskopischer Anleitung über den rechten Zugang zur Vena jugularis interna. Das abgebildete Gerät ist das EkoSonic Endovascular System (EKOS, Bothell, WA) in den bilateralen Lungenarterien.
CDTs umfassen solche, die fibrinolytische Mittel (d.h., Gewebeplasminogenaktivator) mit oder ohne Ultraschallunterstützung sowie Vorrichtungen, die die Gerinnselbelastung durch eine Vielzahl mechanischer Methoden ohne fibrinolytische Mittel verringern. Das am besten untersuchte und einzige von der US-amerikanischen Food and Drug Administration zugelassene kathetergesteuerte Gerät zur Behandlung von PE ist das EkoSonic Endovascular System (EKOS, Bothell, WA) (Abbildung 1). Die 5.4 Französische Infusionskatheter werden direkt in die Lungenarterien eingeführt, normalerweise über den Zugang zur inneren Hals- oder Oberschenkelvene, und enthalten einen Ultraschallkern, der zusätzlich zu einer Reihe von Poren, die T-PA abgeben, Ultraschallwellen freisetzt.
In-vitro-Studien haben eine verbesserte Penetration und Bindung von T-PA an Fibrin in Gegenwart von Ultraschall gezeigt.13 In einer kleinen Studie mit 59 Patienten mit PE mit mittlerem Risiko, randomisiert auf ultraschallgestützte, niedrig dosierte Fibrinolyse plus Antikoagulation vs. Antikoagulation allein, die Interventionsgruppe hatte eine stärkere Abnahme des RV-zu-LV-Durchmesserverhältnisses und des systolischen Drucks der Lungenarterie und eine signifikantere Verbesserung der RV-Funktion nach 24 Stunden.14 Bei 90-tägiger Nachbeobachtung gab es einen Trend zu einer stärkeren Verringerung der RV-Größe in der Interventionsgruppe (p = 0,07); Es gab jedoch keinen Unterschied im systolischen Arteriendruck.
„CDT wurde zunehmend genutzt, um eine aktive Verbesserung der RV-Nachlast über die Antikoagulation hinaus zu bieten allein, aber mit einer reduzierten Dosis oder ohne fibrinolytische Therapie.“
Eine größere, einarmige, multizentrische Studie untersuchte die ultraschallgestützte, niedrig dosierte Fibrinolyse bei 150 Patienten mit massiver oder submassiver PE. Es gab eine signifikante Reduktion des RV-zu-LV-Durchmesserverhältnisses, des systolischen Drucks der Lungenarterie und der Thrombusbelastung nach 48 Stunden.15 Es gab ein schweres und 15 mittelschweres Blutungsereignis ohne intrakranielle Blutung. Infusionskatheter ohne Ultraschall (z. B. Cragg-McNamara, Pigtail-Katheter) bieten auch die Abgabe von Fibrinolytika in die Lungenarterien mit deutlich geringeren Kosten im Vergleich zur ultraschallgestützten Fibrinolyse. Obwohl auf kleine retrospektive Studien beschränkt, kathetergesteuerte Fibrinolyse mit und ohne Ultraschall wurden bewertet und zeigen ähnliche Ergebnisse.16,17 Diese Ergebnisse wurden in einer randomisierten kontrollierten Studie nicht validiert, obwohl eine Studie läuft (NCT02758574).18
Eine Metaanalyse bewertete 16 Studien zur kathetergesteuerten Thrombolyse und ergab eine Hauptkomplikationsrate von 4,7 Prozent und eine intrakranielle Blutungsrate von 0,35 Prozent.19 Eine kürzlich durchgeführte Propensity-Matched-Analyse der Ergebnisse im Krankenhaus nutzte die National Readmission Database, um systemische vs. kathetergesteuerte Fibrinolyse und zeigten eine geringere Mortalität und Blutung im Krankenhaus bei Patienten, die eine kathetergesteuerte Fibrinolyse erhielten.20 Es gab keine prospektiven, randomisierten Studien, in denen die systemische mit der kathetergesteuerten Fibrinolyse verglichen wurde.
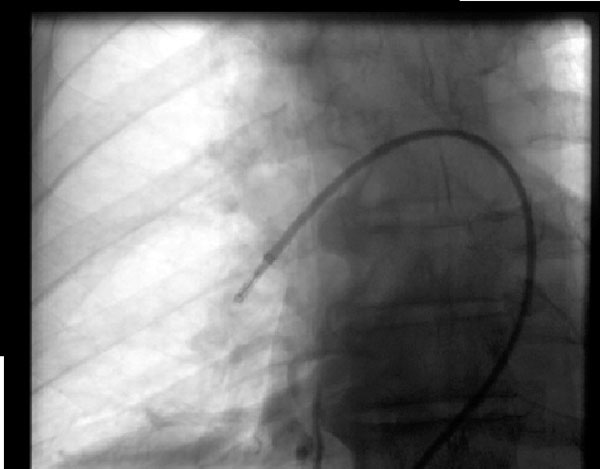 Abbildung 2: Aspirationsthrombektomie
Abbildung 2: AspirationsthrombektomieEin 68-jähriger Mann entwickelte einen Tag nach einer Wirbelsäulenoperation eine massive Lungenembolie und war kein Kandidat für eine Fibrinolyse. Das abgebildete Gerät ist das Indigo-Embolektomiesystem (Penumbra, Alameda, CA) in der rechten Lungenarterie.
Häufig rechtfertigen Patienten eine fortgeschrittene Therapie, haben jedoch Kontraindikationen selbst für niedrige Dosen von T-PA. Bei solchen Patienten ist eine Lungenembolektomie eine mögliche Option. Es erfordert jedoch eine Sternotomie und einen kardiopulmonalen Bypass mit hohen Heparindosen. Mechanische CDT bietet eine perkutane Option, die keine Fibrinolyse verwendet. Es gibt verschiedene mechanische CDTs einschließlich Aspiration oder Absaugung mechanische Thrombektomie (Abbildung 2), Mazeration mit einem Pigtail-Katheter und rheolytische Thrombektomie.
Es gibt verschiedene Einschränkungen für jedes verfügbare System, wie z. B. ausreichende Manipulation in die Lungenarterien aufgrund der Kathetergröße, Blutverlust während der Aspiration und begrenzte Fähigkeit, Thrombus zu entfernen, insbesondere wenn es älter und fibrotischer ist. Es kann eine Rolle für eine kombinierte mechanische und fibrinolytische Therapie für eine verbesserte Thrombusclearance spielen.21 Die Daten für mechanische CDT sind auf kleine, einzelzentrische Gehäuseserien beschränkt, weisen jedoch einen angemessenen technischen Erfolg auf.22-25 CDT bietet auch eine Rettungsoption Behandlungsoption für Patienten mit anhaltendem Schock trotz systemischer Fibrinolyse oder Patienten, die eine extrakorporale Membranoxygenierung erhalten haben.26
„Es gibt keine qualitativ hochwertigen Studien, die die verschiedenen CDT gegeneinander oder gegen systemische Thrombolyse vergleichen.“
Es gibt keine qualitativ hochwertigen Studien, die die verschiedenen CDT gegeneinander oder gegen systemische Thrombolyse vergleichen. Angesichts der aktuellen Rate der CDT-Anwendung bei PE mit mittlerem Risiko und der potenziellen Risiken und Kosten dieser Interventionen Bewertung der Langzeitergebnisse, einschließlich pulmonaler Hypertonie und Belastungstoleranz, zusätzlich zu qualitativ hochwertigeren kurzfristigen klinischen Ergebnisdaten sind notwendig.
Zusammenfassend ist CDT eine vielversprechende Behandlungsoption für Patienten mit akuter PE und bietet eine alternative fortschrittliche Therapie für Patienten, die schlechte Kandidaten für eine systemische Thrombolyse oder Lungenembolektomie sind. Es bleibt ein aufregendes Feld mit der schnellen Entwicklung neuer Therapien, erfordert jedoch weitere Forschung, bevor es in der PE mit mittlerem Risiko weit verbreitet eingesetzt werden kann.
Brett Carroll, MD, hat kürzlich sein Stipendium für Gefäßmedizin am Brigham and Women’s Hospital abgeschlossen und ist jetzt Direktor für Gefäßmedizin am Beth Israel Deaconess Medical Center, beide in Boston, MA.
- Jimenez D, de Miguel-Diez J, Guijarro R, et al. J Am Coll Cardiol 2016;67:162-70.
- Huang W, Goldberg RJ, Anderson FA, et al. Bin J Med 2014;127:829-39 e5.
- Cohen AT, Agnelli G, Anderson FA, et al. Thromb Haemost 2007;98:756-764.
- Mozaffarian D, Benjamin EJ, Go AS, et al. Auflage 2016;133:e38-360.
- Piazza G, Goldhaber SZ. Auflage 2010;122:1124-9.
- Aujesky D, Obrosky S, Stein RA, et al. Am J bzw. Crit Pflege Med 2005;172:1041-6.
- Kearon C, Akl EA, Ornelas J, et al. Brust 2016;149:315-52.
- Piazza G, Goldhaber SZ. N Eng J Med 2011;364:351-60.
- Sista AK, Miller LE, Kahn SR, Kline JA. Vasc Med 2017;22:37-43.
- Goldhaber SZ, Haire WD, Feldstein ML, et al. Lancet 1993;341:507-11.
- Goldhaber SZ, Visani L, De Rosa M. Lanzette 1999;353:1386-9.
- Stein PD, Matte F. Am J Med 2012;125:465-70.
- Siddiqi F, Odrljin TM, Fay PJ, et al. Blut 1998;91:2019-25.
- Kucher N, Boekstegers P, Müller OJ, et al. Auflage 2014;129:479-86.
- Piazza G, Hohlfelder B, Jaffler, et al. JACC Cardiovasc Interv 2015;8:1382-92.
- Liang NL, Avgerinos ED, Marone LK, et al. Vasc Endovaskuläre Surg 2016;50:405-10.
- Graif A, Grilli CJ, Kimbiris G, et al. J Vasc Interv Radiol 2017;28:1339-47.
- Avgerinos ED, Mohapatra A, Rivera-Lebron B, et al. J Vasc Surg Venöse lymphatische Störung 2018;6: 126-32.
- Bloomer TL, El-Hayek GE, McDaniel MC, et al. Katheter Cardiovasc Interv 2017;89: 754-60.
- Arora S, Panaich S, Ainani N, et al. Am J Cardiol 2017;120:1653-61.
- Liu B, Liu M, Yan L, et al. J Int Mit Res 2017; Jan 1;.
- Ciampi-Dopazo JJ, Romeu-Prieto JM, Sanchez-Casado M, et al. J Vasc Interv Radiol 2018;29:101-6.
- Tukaye DN, McDaniel M, Liberman H, et al. JACC Cardiovasc Interv 2017;10:94-5.
- Hubbard J, Saad WE, Sabri SS, et al. Februar 2011;2011:246410.
- Donaldson CW, Baker JN, Narayan RL, et al. Katheter Cardiovasc Interv 2015;86:e81-7.
- George B, Parazino M, Omar HR, et al. Wiederbelebung 2018;122:1-5.
Klinische Themen: Antikoagulationsmanagement, Arrhythmien und klinische Studien, Herzchirurgie, Dyslipidämie, Herzinsuffizienz und Kardiomyopathien, Invasive kardiovaskuläre Angiographie und Intervention, Pulmonale Hypertonie und venöse Thromboembolie, Gefäßmedizin, SCD / ventrikuläre Arrhythmien, Vorhofflimmern / supraventrikuläre Arrhythmien, Herzchirurgie und Arrhythmien, Herzchirurgie und Herzinsuffizienz, Fettstoffwechsel, Statine, Akute Herzinsuffizienz, Pulmonale Hypertonie, Interventionen und Gefäßmedizin
Schlüsselwörter: ACC Publikationen, Kardiologie Interventionen, United States Food and Drug Administration, Blutdruck, Herz-Lungen-Bypass, Dilatation, Embolektomie, Belastungstoleranz, extrakorporale Membranoxygenierung, Oberschenkelvene, Fibrin, Fibrinolyse, fibrinolytische Mittel, Follow-Up-Studien, Heparin, Krankenhaussterblichkeit, Hypertonie, Lungen-, Indigokarmin, intrakranielle Blutungen, Halsvenen, Patientenrückübernahme, Lungenarterie, Lungenembolie, Lebensqualität, Retrospektive Studien, Schock, Kardiogen, Sternotomie, Absaugung, Tachykardie, Thrombektomie, Thrombolytische Therapie, Thrombose, Gewebeplasminogenaktivator, hochenergetische Stoßwellen, Vasokonstriktion, Vasokonstriktor
< Zurück zur Liste