Alle Gewebezellen hängen vom aeroben Stoffwechsel ab, um die für das Überleben und die Funktion erforderliche Energie (in Form von Adenosintriphosphat, ATP) zu erzeugen. Dieser grundlegend lebenswichtige mitochondriale Prozess ist durch den Verbrauch von Sauerstoff und die Produktion von Kohlendioxid gekennzeichnet, die von etwa 200 ml / Minute im Ruhezustand bis zum Fünffachen dieser Rate während des Trainings variieren können.
Das endgültige Schicksal dieses Kohlendioxids ist die Ausscheidung aus dem Körper in der ausgeatmeten Luft, und eine wichtige Funktion des Blutes ist der Transport von Kohlendioxid von Gewebezellen zu Lungen.
Ein Verständnis dieses Transportprozesses hängt davon ab, was unter Partialdruck eines Gases zu verstehen ist, sowie von einigen grundlegenden physikalischen Gesetzen, die die Löslichkeit und Bewegung (Diffusion) von Gasen regeln.
- WAS IST DER PARTIALDRUCK EINES GASES?
- LÖSLICHKEIT UND DIFFUSION VON GASEN
- TRANSPORT VON KOHLENDIOXID VON GEWEBEZELLEN ZUR LUNGE
- KOHLENDIOXID UND BLUT-PH
- IM LABOR – DEFINITION DER CO2-PARAMETER
- PARTIALDRUCK VON KOHLENDIOXID pCO2
- BICARBONATKONZENTRATION (HCO3-)
- GESAMTKOHLENDIOXIDKONZENTRATION IM PLASMA (ctCO2)
- CHEMISCHE METHODEN ZUR MESSUNG VON ctCO2
- DISKREPANZ ZWISCHEN GEMESSENEM ctCO2 UND BERECHNETEM BICARBONAT
- ZUSAMMENFASSUNG
WAS IST DER PARTIALDRUCK EINES GASES?
Die Gasmenge in einem System, einschließlich biologischer Systeme, wird durch den von ihm ausgeübten Druck definiert, der traditionell als Höhe einer Quecksilbersäule (mmHg) gemessen wird. Wenn wir also sagen, dass der atmosphärische Druck 760 mmHg beträgt, meinen wir, dass die Gase (Sauerstoff, Stickstoff und Kohlendioxid) in der Luft, die wir atmen, einen kombinierten Druck haben, der ausreicht, um eine 760 mm hohe Standardsäule aus Quecksilber zu tragen.
Dieser Gesamtdruck ist einfach die Summe der Partialdrücke jedes einzelnen Gases. Somit enthält Luft etwa 20 % Sauerstoff, 79 % Stickstoff und 0.03 % Kohlendioxid, der Partialdruck von Sauerstoff (pO2) in der eingeatmeten Luft beträgt ungefähr (20 x 760) / 100 = 152 mmHg und der Partialdruck von Kohlendioxid (pCO2) beträgt (0,03 x 760) / 100 = 0,2 mmHg.
Die Druckeinheit systeme internationale (SI), die in klinischen Labors außerhalb Nordamerikas verwendet wird, ist Kilopascal (kPa). Der Umrechnungsfaktor 0,133 kann verwendet werden, um mmHg in kPa umzurechnen.
LÖSLICHKEIT UND DIFFUSION VON GASEN
Das Henry-Gesetz besagt, dass die in einer Flüssigkeit gelöste Gasmenge im Gleichgewicht proportional zum Partialdruck dieses Gases ist, solange die Temperatur konstant ist:
Gelöstes Gas = Partialdruck (p) x Löslichkeitskoeffizient (S)
Wobei S eine temperaturabhängige Konstante für das jeweilige Gas ist. Der Löslichkeitskoeffizient (E) für Kohlendioxid bei Körpertemperatur beträgt 0,23 mmol / L / kPa (oder 0,03 mmol / mmHg) . Somit beträgt der arterielle pCO2 ungefähr 5.3 kPa (40 mmHg) beträgt die im arteriellen Blut gelöste CO2-Menge (dCO2) (5,3 x 0,23) oder 40 x 0,03) = 1,2 mmol / L.
Die Bewegung (Diffusion) von Gasen wird zu einem großen Teil durch Konzentrationsgradienten bestimmt. Gas diffundiert von hohem Partialdruck zu niedrigem Partialdruck .
TRANSPORT VON KOHLENDIOXID VON GEWEBEZELLEN ZUR LUNGE
Die Kohlendioxidreise (ABBILDUNG 1a) beginnt in den Mitochondrien der Gewebezellen, wo es produziert wird. Aufgrund des vorherrschenden Konzentrationsgradienten diffundiert Kohlendioxid aus den Mitochondrien (wo pCO2 am höchsten ist) über das Zytoplasma, aus der Zelle und in das Kapillarnetzwerk.
ABBILDUNG 1a: CO2 in Geweben
Zum Vergrößern anklicken
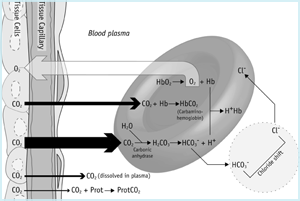
Ein kleiner Teil des aus Gewebezellen ins Blut gelangenden CO2 bleibt physikalisch im Blutplasma gelöst (siehe oben) und ein noch geringerer Anteil bindet an NH2 (Amino)-Endgruppen von Plasmaproteinen unter Bildung sogenannter Carbaminoverbindungen. Die meisten diffundieren jedoch einen Konzentrationsgradienten in rote Blutkörperchen.
Ein wenig davon bleibt im Zytoplasma der roten Blutkörperchen gelöst und ein Teil ist lose an Aminoendgruppen von reduziertem Hämoglobin gebunden, die Carbamino-Hb bilden. Der größte Teil des in roten Blutkörperchen ankommenden Kohlendioxids wird jedoch durch die Isoform der roten Blutkörperchen des Enzyms schnell zu Kohlensäure hydratisiert Carboanhydrase. Bei physiologischem pH-Wert dissoziiert fast die gesamte (≈ 96 %) dieser Kohlensäure zu Bicarbonat und Wasserstoffionen:
Gleichung 1:
![]()
Die Wasserstoffionen werden durch reduziertes Hämoglobin gepuffert und die meisten Bicarbonationen gelangen im Austausch gegen Chloridionen von den roten Blutkörperchen zum Plasma (diese sogenannte Chloridverschiebung behält die elektrochemische Neutralität bei). Aus dem Vorstehenden geht hervor, dass das meiste Kohlendioxid als Bicarbonat (überwiegend im Blutplasma) transportiert wird, es gibt jedoch insgesamt vier Arten des CO2-Transports :
- 90 % wird als Bicarbonat in Plasma (65 %) und roten Blutkörperchen transportiert (25 %)
- 5 % wird physikalisch in Plasma und Erythrozytoplasma gelöst transportiert
- 5% wird lose an Hämoglobin in roten Blutkörperchen gebunden transportiert und
Der Gesamtkohlendioxid-Blutgehalt ist die Summe dieser vier Komponenten.
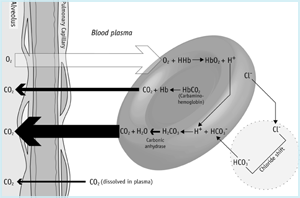
Innerhalb des Mikrogefäßsystems der Lunge (ABBILDUNG 1b) bestimmt der Partialdruckgradient über die Alveolarmembran, dass gelöstes CO2 vom Blut in die Alveolen gelangt. Dieser Kohlendioxidverlust aus dem Blut begünstigt die Umkehrung der oben beschriebenen Erythrozytenreaktionen.
So gelangt Bicarbonat vom Plasma in die roten Blutkörperchen und puffert Wasserstoffionen, die aus Hämoglobin freigesetzt werden, während es mit Sauerstoff angereichert wird. Die Umkehrung der Carboanhydrasereaktion führt zur Produktion von CO2, das von den roten Blutkörperchen zum Plasma und weiter zu den Alveolen diffundiert.
Gemischtes venöses Blut, das in die Lunge gelangt, hat einen Gesamt-CO2-Gehalt von ungefähr 23,5 mmol / l (oder 52 ml / dl), während arterielles Blut, das die Lunge verlässt, einen Gesamt-CO2-Gehalt von 21,5 mmol / l (48 ml / dl) aufweist.
Diese arterio-venöse Differenz (2 mmol / l oder 4 ml / dl) repräsentiert die Menge an CO2, die dem Blut aus Gewebezellen zugesetzt wird und aus dem Blut verloren geht, wenn es durch das pulmonale Mikrogefäßsystem fließt, um schließlich in der Ausatemluft aus dem Körper ausgeschieden zu werden.
ABBILDUNG 1b: CO2 in der Lunge
Zum Vergrößern anklicken
KOHLENDIOXID UND BLUT-PH
Das saure Potential von CO2 stellt aufgrund seiner Hydratationsreaktion zu Kohlensäure (siehe Gleichung 1 oben) sicher, dass seine Konzentration im Blut eine wichtige Determinante für den Blut-pH-Wert ist. Mit steigender CO2-Konzentration steigt auch die Wasserstoffionenkonzentration (H +). Die Regulierung des Blut-CO2, dh die Anpassung der CO2-Eliminationsrate in der Ausatemluft an die Produktionsrate in den Mitochondrien von Gewebezellen, die für die Aufrechterhaltung eines normalen Blut-pH-Werts unerlässlich ist, ist das Geschäft des Atmungssystems.
Die Atemfrequenz (gesteuert durch pCO2-empfindliche Chemorezeptoren im Hirnstamm und in der Halsschlagader) ist erhöht, wenn pCO2 ansteigt, und verringert, wenn pCO2 abnimmt. Eine erhöhte Atemfrequenz (Atemzüge / min) führt zu einer erhöhten CO2-Eliminationsrate und eine verringerte Atemfrequenz fördert die CO2-Retention.
Die Beziehung zwischen pH-Wert und Kohlendioxid wird durch eine Form der Henderson-Hasselbach-Gleichung (Gleichung 2) beschrieben. Dies ergibt sich aus der Anwendung des Massenwirkungsgesetzes auf die in Gleichung 1 beschriebenen Hydratisierungs- und Dissoziationsreaktionen .
Gleichung 2:
![]()
wo
| pK/1 | = | ‚ D‘ Dissoziationskonstante der Kohlensäure = 6.1 |
| = | konzentration von Plasmabikarbonat (mmol/l) | |
| S | = | Löslichkeitskoeffizient für CO2 bei 37 oC (0,23, wenn pCO2 in kPa oder 0,03 gemessen wird, wenn pCO2 in mmHg gemessen wird) |
| PCO2 | = | partialdruck von pCO2 (kPa oder mmHg) |
Wie bereits erläutert, ist der Nenner in dieser Gleichung (S x pCO2) die Menge an gelöstem Kohlendioxid (dCO2) mmol / L.
Durch Entfernen aller Konstanten kann Gleichung 2 vereinfacht werden zu:
Gleichung 3:
pH ∞ / pCO2
Somit ist der pH-Wert des Blutes abhängig vom Verhältnis der Plasmabikarbonatkonzentration (der metabolischen Komponente) zu pCO2 (der respiratorischen Komponente). Wenn also pCO2 ohne einen äquivalenten Anstieg des Bikarbonats ansteigt, sinkt der pH-Wert. Umgekehrt, wenn pCO2 ohne einen äquivalenten Rückgang des Bikarbonats fällt, steigt der pH-Wert an.
Die umgekehrte Beziehung gilt für die Bicarbonatkonzentration, nämlich erhöhtes HCO3- = erhöhter pH-Wert; erniedrigtes Bicarbonat = erniedrigter pH-Wert.
Bicarbonat ist das Prinzip des Puffers und seine Konzentration zu einem bestimmten Zeitpunkt spiegelt das Gleichgewicht zwischen dem aus CO2 erzeugten und dem durch Pufferung von Wasserstoffionen (H+) verbrauchten wider (siehe Gleichung 1).
IM LABOR – DEFINITION DER CO2-PARAMETER
Die vom Blutgasanalysator erzeugten CO2-Parameter sind:
- Partialdruck von Kohlendioxid (pCO2) (kPa / mmHg)
- Plasmabikarbonatkonzentration (HCO3-) (mmol / L)
- Plasma-Gesamtkonzentration Kohlendioxid (ctCO2) (mmol / L)
Der letzte davon, ctCO2, kann auch in Plasma oder Serum durch chemische Methoden unabhängig vom Blutgasanalysator gemessen werden.
PARTIALDRUCK VON KOHLENDIOXID pCO2
Dieser Parameter ist ein Maß für den Druck, den der kleine Teil (≈ 5 %) des gesamten Kohlendioxids im Blut ausübt, der im gasförmigen Zustand verbleibt und in der wässrigen Phase von Plasma und Blutzellenzytoplasma gelöst ist. Die Messung erfolgt mit einer CO2-spezifischen pH-Elektrode, die in Blutgasanalysatoren eingebaut ist.
In der Gesundheit wird pCO2 des arteriellen Blutes im Bereich 4.7-6.0 kPa (35-45 mmHg) aufrechterhalten; pCO2 des venösen Blutes ist etwas höher 5.6-6.8 kPa (41-51 mmHg).
BICARBONATKONZENTRATION (HCO3-)
Dies ist die Menge an Bicarbonat in Volumeneinheit Plasma. Wie bereits erwähnt, ist dies die Form, in der das meiste Kohlendioxid (90 %) im Blut transportiert wird. Dieser Parameter kann nicht gemessen werden, sondern wird durch Berechnung während der Blutgasanalyse generiert. Die verwendete Berechnung ist eine Umlagerung von Gleichung 2:
Gleichung 4:
log = pH + log (S x pCO2) – pK/1
und hängt von Werten für pH und pCO2 ab, die beide während der Blutgasanalyse gemessen werden.
Theoretisch ist Plasmabikarbonat die Differenz zwischen Gesamt-CO2 (ctCO2) und der Summe aller anderen Formen von CO2 im Plasma, d.h. gelöstem CO2 (dCO2), an Plasmaproteine gebundenem CO2 (Carbamino CO2) und Kohlensäure (H2CO3).
Somit:
Plasmabikarbonat (mmol/l) =
ctCO2 – (dCO2 + Carbamino-CO2 + H2CO3)
Da Carbamino-CO2 und H2CO3 quantitativ unbedeutend sind, wird in der Praxis davon ausgegangen, dass das gesamte CO2 die Summe aus Bicarbonat und gelöstem CO2 ist. Somit ist Plasmabikarbonat effektiv die Differenz zwischen Plasma-Gesamt-CO2 (ctCO2) und Plasma-gelöstem CO2 (dCO2).
Im Gesundheitswesen wird arterielles Plasmabikarbonat (wie während der Blutgasanalyse berechnet) innerhalb des ungefähren Referenzbereichs gehalten: 22-28 mmol / L. Venöses Bicarbonat ist etwas höher: 24-30 mmol / L.
In einigen Labors wird zwischen ‚tatsächlichem‘ Bicarbonat (dem oben beschriebenen Parameter) und ‚Standard‘ Bicarbonat unterschieden. Standardbicarbonat ist ein zweiter berechneter Parameter und ist die Plasmabikarbonatkonzentration von Blut, das mit Gas mit normaler pCO2-Spannung (40 mmHg, 5,3 kPa) ausgeglichen wurde .
Im Gesundheitsbereich entspricht die tatsächliche Bicarbonatkonzentration der Standardbicarbonatkonzentration, da in beiden Fällen pCO2 normal ist. Durch die Normalisierung von pCO2, der respiratorischen Komponente des Säure-Basen-Gleichgewichts, ist Natriumbicarbonat ein Maß allein für die metabolische Komponente und wird daher als hilfreich zur Aufklärung der Ursache komplexer Störungen des Säure-Basen-Gleichgewichts angesehen.
GESAMTKOHLENDIOXIDKONZENTRATION IM PLASMA (ctCO2)
Dies ist theoretisch die Summe aller Formen von Kohlendioxid im Plasma. Es wird nicht während der Blutgasanalyse gemessen, sondern – wie Bicarbonat – berechnet, wobei wie oben angenommen wird, dass das Gesamtkohlendioxid die Summe aus Bicarbonat und gelöstem CO IST2:
Da Plasma dCO2 mmol / L = (S x pCO2), wird ctCO2 so berechnet :
plasma ctCO2 (mmol/L) =
plasmabikarbonat (mmol/L) + (S x pCO2) (mmol/l)
Gelöstes CO2 (S x pCO2) trägt ungefähr 1 bei.2 mmol /l zum Gesamt-CO2 im Plasma des arteriellen Blutes (siehe oben), so dass ctCO2 etwa 1,2 mmol höher ist als Plasmabikarbonat. Der ctCO2-Referenzbereich liegt somit bei etwa 23-29 mmol/l für arterielles Blut.
Es wird darauf hingewiesen, dass ebenso wie der berechnete Bicarbonatwert, der während der Blutgasanalyse erzeugt wird, von der in Gleichung 2 beschriebenen Beziehung abhängt, dies auch der berechnete Wert für ctCO2, der während der Blutgasanalyse erzeugt wird.
Obwohl ctCO2 und Bicarbonat gleichwertige klinische Informationen liefern, wird in der klinischen Praxis ausnahmslos Bicarbonat anstelle von ctCO2 in Verbindung mit pH und pCO2 verwendet, um den Säure-Base-Status zu bewerten. Der klinische Wert des berechneten ctCO2, das während der Blutgasanalyse erzeugt wird, ist somit begrenzt.
CHEMISCHE METHODEN ZUR MESSUNG VON ctCO2
Im Gegensatz zu Bicarbonat, das nicht gemessen werden kann, kann ctCO2 und der Assay ist üblicherweise eine Komponente des Harnstoff- und Elektrolytprofils (U & E) von venösem Plasma / Serum. Da U & E viel häufiger bestellt wird als arterielle Blutgase, kann gemessenes ctCO2 der erste Hinweis auf eine Störung der Kohlendioxid- (und damit Säure-Basen-) Homöostase sein.
In einigen klinischen Labors ist es üblich, diese gemessene Komponente des U&E-Profils als ‚Plasmabikarbonat‘ zu bezeichnen. Dies ist falsch, da chemische Methoden das gesamte CO2 messen, das aus Plasma (oder Serum) durch Zugabe starker Säure freigesetzt wird, oder alternativ das gesamte Bicarbonat, das durch Zugabe eines starken Alkalis zum Plasma entsteht .
Es enthält somit nicht nur Bicarbonat, sondern auch gelöstes CO2 und Kohlensäure. Wenn Plasma oder Serum, die in diesen Assays verwendet wurden, aus arteriellem Blut gewonnen wurden, würde sich das gemessene ctCO2 theoretisch dem berechneten CTCO2-Wert annähern, der während der arteriellen Blutgasanalyse erzeugt wurde.
Tatsächlich werden U& E-Profile ausschließlich an Plasma oder Serum durchgeführt, das aus venösem Blut gewonnen wurde, so dass aufgrund des arteriovenösen Unterschieds ein unvermeidlicher kleiner theoretischer Unterschied von 1-2 mmol / l (gemessener ctCO2 > berechneter ctCO2) besteht.
Die theoretische Differenz zwischen gemessenem ctCO2 und berechnetem Plasmabikarbonat ist etwas höher (gemessenes ctCO2 > berechnetes Plasmabikarbonat), da neben der arteriovenösen Differenz von 1-2 mmol/L eine weitere Differenz von 1,5 mmol/l aufgrund des Einschlusses von gelöstem CO2 und Kohlensäure in gemessenes ctCO2 vorliegt.
Dieser Unterschied setzt jedoch voraus, dass vor der Analyse kein gelöstes Kohlendioxid an die Atmosphäre verloren geht. Dies ist möglicherweise nicht der Fall, da U & E-Proben nicht anaerob gehandhabt werden.
Einige haben argumentiert, dass der Begriff ‚Serum / Plasma-Bicarbonat‘ für gemessenes ctCO2 mit der Begründung gerechtfertigt ist, dass die normale Laborpraxis mit einem unvermeidlichen Verlust von gelöstem CO2 aus der U & E-Probe vor der Analyse verbunden ist, in welchem Fall gemessenes ctCO2 theoretisch zumindest dem berechneten Bicarbonat annähern würde.
DISKREPANZ ZWISCHEN GEMESSENEM ctCO2 UND BERECHNETEM BICARBONAT
Ungeachtet der oben skizzierten geringfügigen theoretischen Unterschiede zwischen gemessenen und berechneten Werten wird allgemein angenommen, dass das gemessene ctCO2, das als Teil eines U & E-Profils erzeugt wird, für alle praktischen klinischen Zwecke der bei der Blutgasanalyse berechneten Plasmabikarbonatkonzentration entspricht.
Dies spiegelt sich in der Verwendung des Begriffs ‚Plasmabikarbonat‘ wider, um gemessenes ctCO2 zu beschreiben.
Der bisher beste Beweis dafür, dass gemessene und berechnete Bicarbonat-Ergebnisse in der Praxis klinisch austauschbar sein können, stammt aus einem sehr aktuellen Bericht der Mayo Clinic . Die Autoren dieses Berichts stellten 17.621 Datensätze der gemessenen und berechneten Bicarbonatkonzentration für Proben wieder her, die gleichzeitig von denselben Patienten während 2006/7 gesammelt wurden. Die Bicarbonatkonzentration dieser riesigen Datenbank lag zwischen 5 und 49 mmol / L.
Die mittlere Differenz (SD) zwischen gemessenen und berechneten Werten betrug -0,36 (1,23 mmol / l) und für 98.Die Ergebnisse von 5% der gepaarten Proben lagen innerhalb von 3 mmol / l voneinander. Obwohl, wie der Mayo-Bericht nahelegt, normalerweise eine akzeptable Übereinstimmung zwischen den beiden Parametern besteht, ist es keineswegs selten, dass die Ergebnisse völlig nicht übereinstimmen, wobei sich das gemessene ctCO2 um bis zu 15 mmol / l vom berechneten Bicarbonat unterscheidet .
Zahlreiche Studien in den letzten vierzig Jahren haben versucht, die Häufigkeit, Größe und Ursache der Diskrepanz zwischen berechnetem Bicarbonat und gemessenem ctCO2 festzustellen.
Ein früher Schwerpunkt dieser Arbeit stellte die Zuverlässigkeit der Bicarbonatberechnung in Frage, die entscheidend von der Konstanz von pK/1 abhängt (siehe Gleichung 4). Tatsächlich ist dies keine echte thermodynamische Konstante, sondern eine ’scheinbare‘ Dissoziationskonstante, die experimentell aus der Messung von pH, pCO2 und gelöstem CO2 unter Verwendung der folgenden Beziehung bestimmt wurde, die aus der Henderson-Hasselbach-Gleichung abgeleitet wurde:
pK /1 = pH + log dCO2 – log
Mehrere Studien zeigten eine ausreichende Variabilität der pK / 1, insbesondere bei kritisch Kranken, für klinisch signifikante Fehler in berechnetem Bicarbonat. Beispielsweise wurde in einer Studie festgestellt, dass pK/1 zwischen 5,84 und 6,29 lag.
Die Autoren berechnen, dass Abweichungen von pK / 1 6.1 dieser Größenordnung zu Fehlern im berechneten Bicarbonat in der Größenordnung von ± 60 % führen würden. Ein anderer beschreibt den Fall eines diabetischen Kindes mit Ketoazidose, dessen pK / 1 über einen Zeitraum von sieben Stunden zwischen 5, 49 und 6, 02 lag.
In einer Studie mit 79 Säuglingen, die auf einer pädiatrischen Intensivstation betreut wurden, wurde bei 25% festgestellt, dass pK / 1 außerhalb des in der Studie definierten ’normalen‘ Bereichs von 6,055 bis 6,195 lag, und in drei Fällen betrug pK / 1 > 6,3 mit einem ‚erstaunlichen‘ Wert von 7,11. Diese und andere Berichte über klinisch signifikante Variabilität in pK / 1 wurden umstritten und die Zuverlässigkeit oder nicht von berechnetem Bicarbonat bleibt ein ungelöstes, umstrittenes Problem.
Die theoretische Grundlage für die Ansicht, dass kalkuliertes Bicarbonat bei kritischen Erkrankungen unzuverlässig ist, wurde von Flear dargelegt. Ein ebenso theoretischer Ansatz, der von einer Fülle experimenteller Beweise begleitet wird, wurde von Mass et al.
Autoren von Studien, die keine klinisch signifikante Variabilität in pK / 1 nachweisen konnten, legen nahe, dass die Hauptdiskordanz zwischen berechnetem Bicarbonat und gemessenem ctCO2, die gelegentlich in der klinischen Praxis beobachtet wird, höchstwahrscheinlich das Ergebnis einer Kombination von präanalytischen Variablen, analytischer Differenz und zufälligem Analysefehler ist .
Die Messung von ctCO2 ist besonders anfällig für präanalytische Variabilität, da Blut für U& E2 universell gesammelt und aerob verarbeitet wird. Die Proben können vor der Analyse stundenlang unverschlossen gelassen werden. Da Umgebungsluft weniger CO2 enthält als Blut, besteht die Tendenz, dass gelöstes CO2 aus der Probe verloren geht. Es wurde geschätzt, dass dadurch das gemessene CO2 um 6 mmol / h reduziert wird.
Im Gegensatz dazu ist berechnetes Bicarbonat nicht mit dem gleichen Risiko einer präanalytischen Variation verbunden, da Blut für Blutgasanalysen routinemäßig anaerob entnommen wird und es nur eine minimale Verzögerung gibt (fast immer
Eine weitere Ursache für die Nichtübereinstimmung zwischen gemessenen und berechneten Werten kann die Probendifferenz sein, da arterielles Blut zur Berechnung eines Wertes und Serum- oder Plasmaproben zur Messung eines Wertes verwendet werden.
Unabhängig von der Ursache zeigen Studien weiterhin eine moderate, aber klinisch signifikante Diskrepanz zwischen den beiden Parametern bei kritisch Kranken . Wie um den umstrittenen Charakter der Debatte zu bestätigen, liefert die jüngste Studie an kritisch kranken Patienten jedoch Beweise für eine akzeptable Übereinstimmung zwischen berechnetem Bicarbonat und gemessenem ctCO2 .
Ungeachtet dieser letzten Studie gibt es eine Reihe von Meinungen, dass es zumindest für kritisch kranke Patienten ratsam sein könnte, berechnetes Bicarbonat zugunsten von gemessenem ctCO2 aufzugeben , obwohl betont werden muss, dass diese Ansicht umstritten ist und es sein könnte, dass die klinischen Auswirkungen von Unterschieden begrenzt sind.
Der Nachweis akzeptabler Übereinstimmung, der durch die sehr große Studie der Mayo Clinic erbracht wurde, kann leider nicht in der speziellen Debatte verwendet werden, die sich auf kritisch Kranke konzentriert, da die Patientenpopulation nicht definiert wurde.
Von den beiden Parametern hat berechnetes Bicarbonat den deutlichen Vorteil der Bequemlichkeit gegenüber gemessenem ctCO2, da alle drei Parameter (pH pCO2 und Bicarbonat), die zur Beurteilung der Säure-Base verwendet werden, gleichzeitig von einer einzigen Probe zur Verfügung stehen.
In der Literatur besteht zu vielen der oben diskutierten Fragen weiterhin kein Konsens. So bleibt sogar unklar, ob es eine Diskrepanz zwischen gemessenem und berechnetem CO2 gibt oder nicht, obwohl sich das Gleichgewicht der Evidenz in letzter Zeit durch die große Mayo Clinic-Studie zugunsten einer Nichtdiskordanz verschoben hat .
Für diejenigen, die glauben, dass das Gleichgewicht der Beweise darauf hindeutet, dass es Zwietracht gibt, gibt es zwei weitere ungelöste Probleme.
Dies sind: die klinische Bedeutung dieser Diskordanz und die Ursache dieser Diskordanz. Die Debatte über die Ursache der Diskordanz konzentrierte sich hauptsächlich darauf, ob pKl1 zwischen Patienten signifikant variiert oder nicht, und inwieweit präanalytische Unterschiede, analytische Unterschiede und zufällige Fehler zur Diskordanz beitragen.
Schließlich hat mindestens ein Kommentator den klinischen Bedarf an berechnetem Bicarbonat oder gemessenem CTCO2 in Frage gestellt, was darauf hindeutet, dass pH und pCO2 allein eine vollständige Beurteilung von Säure-Base-Störungen ermöglichen.
ZUSAMMENFASSUNG
Kohlendioxid ist ein Produkt des aeroben Zellstoffwechsels, das im Blut zur Ausscheidung in die Lunge transportiert wird Ausatemluft. Ein wenig wird unverändert im Blut gelöst transportiert, aber das meiste wird als Bicarbonat transportiert.
Die Regulierung der Kohlendioxidmenge im Blut, genauer gesagt die Regulierung des Verhältnisses von Bicarbonat zu gelöster Kohlendioxidkonzentration, ist für die Aufrechterhaltung des pH-Wertes im Blut (normales Säure-Basen-Gleichgewicht) unerlässlich.
Die klinische Untersuchung der Säure-Basen-Störung umfasst die arterielle Blutgasanalyse, einen Test, der drei Parameter des Kohlendioxidstatus erzeugt. Von diesen wird nur einer, pCO2, tatsächlich gemessen; Die anderen beiden – Plasmabikarbonat und Gesamtkohlendioxidkonzentration – werden durch Berechnungen aus gemessenem pH-Wert und pCO2 abgeleitet.
Die Validität dieser Berechnungen wurde in Frage gestellt, und es gibt widersprüchliche Hinweise darauf, dass es in einigen Patientengruppen klinisch zuverlässiger sein könnte, das Gesamtkohlendioxid mit chemischen Methoden zu messen, als sich auf berechnete Werte zu verlassen.
Letzteres bleibt ein höchst umstrittenes Thema, das nur durch weitere Studien endgültig gelöst werden kann.