Das Plattenepithelkarzinom des Kopfes und Halses (SCCHN) ist das sechsthäufigste Neoplasma weltweit mit ~ 600.000 diagnostizierten Fällen jährlich. Die letzten 20 Jahre haben eine Fülle von klinischen Studiendaten erbracht, und dies hat die Behandlungsstandards für die Behandlung von SCCHN verändert. Historisch schlechte lokale Krankheitskontrolle und Gesamtüberleben haben Impulse für eine Vielzahl von klinischen Studien zur Bewertung der multimodalen Therapie bei Patienten mit SCCHN gegeben. Die komplizierte Anatomie und die kritischen funktionellen und sozialen Rollen der Kopf-Hals-Region haben zweifellos auch erhebliche Anstrengungen motiviert, Alternativen zur onkologischen Resektion bösartiger Tumoren in dieser Region zu identifizieren. In dieser Übersicht fassen wir die historische Entwicklung der kombinierten Strahlentherapie bei der Behandlung von SCCHN zusammen, stellen eine Aktualisierung der jüngsten Literatur auf diesem Gebiet bereit und diskutieren aktuelle klinische Fragen, die zukünftige Studien lösen könnten.
Gleichzeitige Radiochemotherapie — Von der experimentellen zur bevorzugten Behandlung
Die klinische Untersuchung der Rolle der kombinierten Radiochemotherapie bei SCCHN reicht mindestens bis in die späten 1960er Jahre zurück, wobei frühe Studien die sequentielle und gleichzeitige Verwendung von Einzelwirkstoffen wie Fluorouracil (5FU), Bleomycin, Cisplatin, Methotrexat und Mitomycin untersuchten.1 Solche Studien zeigten ein schlechtes Ansprechen auf eine Einzelwirkstoff-Chemotherapie allein, während Cisplatin als wirksamstes Einzelwirkstoff mit einer Ansprechrate von 25-30% angegeben wurde.2-4 Nachfolgende Studien untersuchten die Rolle der Multiwirkstoff-Chemotherapie und zeigten eine deutliche Verbesserung der Krankheitsantwort auf 70% mit kombiniertem Cisplatin und Bleomycin5 und > 90% Ansprechraten mit Cisplatin und kontinuierlicher Infusion 5FU.6,7 Wichtig ist, dass diese frühen Studien auf einen potenziellen Überlebensvorteil durch die Zugabe von Chemotherapie zu traditionellen definitiven Behandlungen von Strahlung und / oder Chirurgie für SCCHN hinwiesen und weitere Untersuchungen in größeren randomisierten Phase-III-Studien veranlassten.
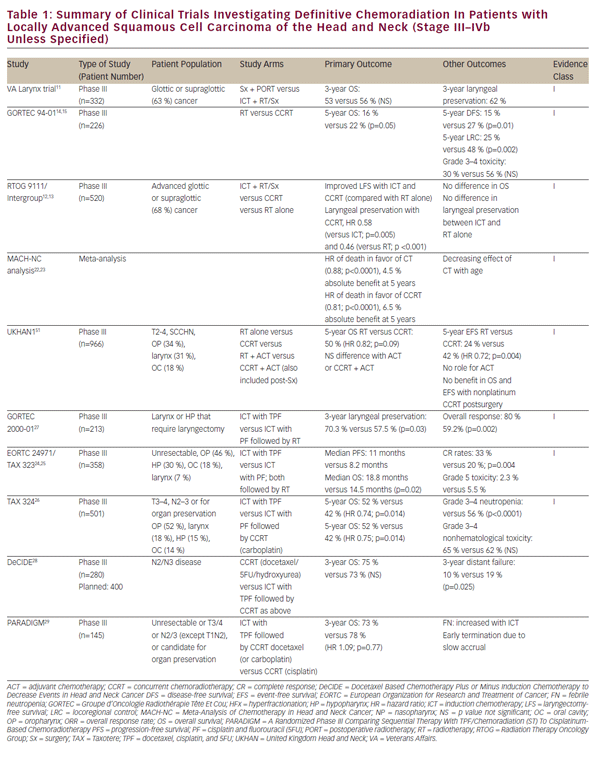
Mit der Verfeinerung der chemotherapeutischen Therapien wurde das Potenzial für definitive und organsparende radiochemische Ansätze bei Patienten mit lokal fortgeschrittenem SCCHN in Betracht gezogen. Diese Arbeit wurde zunächst durch eine Reihe von einzelinstitutionellen Studien vorangetrieben, die die Lebensfähigkeit der definitiven Chemoradiation als Alternative zur Operation bei glottischen und supraglottischen Larynxtumoren belegen.8-10 Die historisch wichtige Veteran Affairs Laryngeal Cancer Study zeigte schließlich, dass Induktionschemotherapie (ICT) gefolgt von Bestrahlung könnte die Organerhaltung bei SCCHN-Patienten ohne Kompromisse beim Gesamtüberleben erreichen.11 Diese Studie begründete die bahnbrechende Studie Radiation Therapy Oncology Group (RTOG) 9111, die sich mit der geeigneten Sequenzierung von Chemotherapie und Bestrahlung bei Patienten mit lokal fortgeschrittenem supraglottischem oder glottischem Kehlkopfkrebs befasste. Die Patienten wurden randomisiert zu: ICT gefolgt von Bestrahlung; gleichzeitige Radiochemotherapie (CCRT); oder Strahlung allein.12,13 Die Ergebnisse von RTOG 9111 zeigten eine Überlegenheit der CCRT in Bezug auf die lokoregionale Krankheitskontrolle und die Erhaltung des Kehlkopfes, während kein Unterschied im Gesamtüberleben zwischen den drei Armen beobachtet wurde. Anschließend randomisierte die 94-01-Studie der Groupe d’Oncologie Radiothérapie Tête Et Cou (GORTEC) Patienten mit lokal fortgeschrittenen oropharyngealen Primärtumoren zur Bestrahlung oder CCRT mit Carboplatin / 5FU und zeigte eine verbesserte lokale Krankheitskontrolle sowie ein verbessertes Gesamtüberleben.14,15 Ähnliche Verbesserungen des Überlebens und der lokoregionalen Kontrolle wurden für nasopharyngeale Patienten berichtet, die mit CCRT behandelt wurden.16-21 Ein Bericht aus der Meta-Analyse der Chemotherapie bei Kopf- und Halskrebs (MACHNC) hat einen Gesamtüberlebensvorteil von 6,5% nach 5 Jahren mit CCRT, aber nicht mit IKT oder adjuvanter Chemotherapie vorgeschlagen.22,23 Die Wirkung der Chemotherapie auf das Überleben in dieser Meta-Analyse wurde beobachtet, mit dem Alter für diejenigen, die älter als 50 Jahre ohne nachweisbaren Nutzen in den 71 Jahren oder älter gezeigt abnehmen. Obwohl sich diese Studien in Bezug auf Einschluss- und Ausschlusskriterien, klinische Endpunkte und Behandlungsmethoden unterscheiden (siehe Tabelle 1), bestätigen sie einen Nutzen der CCRT gegenüber der Strahlentherapie allein als definitive Behandlung für lokal fortgeschrittenes SCCHN.
Induktionschemotherapie vor (Chemo-)Bestrahlung – eine praktikable Strategie?
Obwohl ein direkter Vergleich mit CCRT eine Minderwertigkeit der IKT in Bezug auf die lokale Krankheitskontrolle in der klinischen Studie RTOG 9111 anzeigte,12 besteht weiterhin Interesse an diesem therapeutischen Ansatz. Daten aus RTOG 9111 weisen auf die Äquivalenz dieser Ansätze in Bezug auf hochgradige Toxizitäten hin, was es schwierig macht, die Wahl der IKT aufgrund der Patiententoleranz zu rechtfertigen. Dennoch haben Folgestudien zu RTOG 9111 versucht, sich auf der Plattform von zu entwickeln IKT, um dies zu einer praktikableren Behandlungsoption zu machen. Die EORTC 24971 / TA X 323-Studie24,25 zeigte ein verbessertes Gesamtüberleben mit der Zugabe von Docetaxel (TPF) zum Cisplatin- und 5FU (PF) -ICT-Regime, das in der RTOG 9111-Studie bei Patienten mit inoperablem SCCHN angewendet wurde. Die TA X 324-Studie bewertete in ähnlicher Weise TPF versus PF bei der Einstellung der CCRT und ersetzte wöchentliches Carboplatin durch Cisplatin in diesen Regimen. Diese Studie zeigte eine verbesserte lokoregionale und entfernte Krankheitskontrolle sowie ein verbessertes Gesamtüberleben mit TPF im Vergleich zu PF.26 Eine zusätzliche Follow-up-Studie (GORTEC 2000-01) bei lokal fortgeschrittenem Larynx- und Hypopharynxkarzinom bestätigte eine verbesserte Krankheitsreaktion und Larynxkonservierung mit Induktions-TPF im Vergleich zu PF, zeigte jedoch keinen Effekt auf das Überleben.27 Obwohl sich diese Studien in Bezug auf Einschluss- und Ausschlusskriterien, klinische Endpunkte und Behandlungsmethoden unterscheiden (siehe Tabelle 1), stützen sie gemeinsam die Überlegenheit von TPF gegenüber PF-basierten Studien. Dennoch direkter Vergleich von ICT mit Cisplatin-basierter CCRT nach Behandlungsstandard fehlt.
Die MACH-NC-Metaanalyse, wie bereits erwähnt, deutete auf eine Minderwertigkeit der IKT im Vergleich zur CCRT in Bezug auf das Gesamtüberleben und die lokoregionale Krankheitskontrolle hin.22 Es ist jedoch bemerkenswert, dass der Nutzen der IKT in Bezug auf die Fernmetastasierungsraten ausgeprägter war als der der CCRT.22 Dies könnte eine besondere Rolle der Chemotherapie bei diesen Behandlungsansätzen widerspiegeln. Gleichzeitige Chemotherapie kann eine vorherrschende radiosensibilisierende Rolle spielen, was zu einer dominanten Wirkung auf die lokale Krankheitskontrolle führt, während Multi-Agent-Chemotherapie eine wirksame systemische Behandlung für Mikrometastasen bieten kann. Diese hypothesenerzeugende Beobachtung legt eine potenziell komplementäre Natur dieser Behandlungen nahe und hat Interesse an ihrer Kombination geweckt. Bisher haben die Bemühungen, die Kombination von IKT und CCRT zu untersuchen, zu schlechten Ergebnissen und nicht schlüssigen Ergebnissen geführt (DeCIDE- und PARADIGM-Studien).28,29 Eine laufende randomisierte Phase-III-Studie vergleicht ICT mit PF oder TPF gefolgt von Cisplatin-basierter CCRT versus CCRT allein als Erstlinientherapie für lokal fortgeschrittenes SCCHN (NCT00261703). Die Ergebnisse der oben genannten Studien zu CCRT und ICT sind ebenfalls in Tabelle 1 zusammengefasst.
Adjuvante Radiochemotherapie
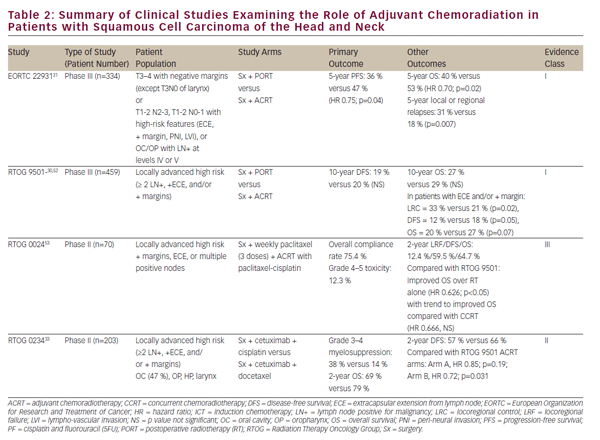
Die oben genannten klinischen Studien haben die CCRT als praktikable definitive Behandlung für die Organerhaltung bei lokal fortgeschrittenem SCCHN etabliert. Dennoch bleibt die definitive onkologische Resektion eine wichtige Behandlungsoption für lokalisierte Erkrankungen und ein wesentlicher Bestandteil der multimodalen Therapie für fortgeschrittene Tumoren der Mundhöhle, des Kehlkopfes und des Hypopharynx. Die Rolle der Chemoradiation im adjuvanten Setting nach onkologischer Resektion wurde in zwei randomisierten Phase—III-Studien – EORTC 22931 und RTOG 950130,31 – weitgehend definiert (siehe Tabelle 2). Diese Studien untersuchten die Verwendung von postoperativer Bestrahlung im Vergleich zur adjuvanten Radiochemotherapie mit Cisplatin, das bei postoperativen SCCHN-Patienten alle 3 Wochen über drei Zyklen verabreicht wurde. Beide Studien zeigten eine Verbesserung der lokoregionalen Krankheitskontrolle und des progressionsfreien Überlebens, während die EORTC-Studie auch eine Verbesserung des Gesamtüberlebens zeigte. Eine Post-hoc-Analyse dieser beiden Studien ergab, dass der Nutzen einer adjuvanten CCRT am größten war bei Patienten mit positiven chirurgischen Rändern und / oder extrakapsulärer Extension (ECE) aus resezierten Lymphknoten.32 Die Rolle der adjuvanten CCRT bei Patienten mit engen Operationsrändern ist weniger klar und wurde durch EORTC 22931 unterstützt, zu der Patienten mit ≤5 mm Operationsrändern gehörten. Auf der anderen Seite umfasste RTOG 9501 Patienten, die auf positiven, aber nicht engen Rändern basierten. Eine Post-hoc-Analyse ergab keinen offensichtlichen Nutzen der CCRT für Patienten, die die Eintrittskriterien für nur eine dieser Studien erfüllen.32 In ähnlicher Weise wurde die adjuvante CCRT bei älteren Patienten nicht ausreichend untersucht, da Patienten über 70 Jahren von EORTC 22931 ausgeschlossen wurden und nur eine kleine Minderheit (5%) der Patienten in RTOG 9501 ausmachen.30,31
Pursuant to EORTC 22931 and RTOG 9501, adjuvant CCRT has now become standard-of-care treatment in high-risk postoperative SCCHN patients. The phase II RTOG 0234 study has explored alternative adjuvant chemoradiation treatment regimens, randomizing patients with multiple involved lymph nodes, ECE, or positive margins to the epidermal growth factor receptor (EGFR) antibody, cetuximab, plus docetaxel or cetuximab plus cisplatin. This study demonstrated an apparent survival benefit from concurrent adjuvant cetuximab and docetaxel.33 Die Ergebnisse dieser faszinierenden Phase-II-Studie müssen vor der Aufnahme in die klinische Praxis in einer Phase-III-Studie validiert werden.
Auswirkungen der Strahlentherapie-Fraktionierung auf die Chemoradiation
In dem Bemühen, die Wirksamkeit zu erhöhen, haben frühere klinische Studien alternative Fraktionierungsschemata für die Strahlentherapie untersucht Verabreichung mit oder ohne gleichzeitige Chemotherapie bei SCCHN-Patienten. Die Studien RTOG 9003 und Danish Head and Neck Cancer Group (DAHANCA) zeigten eine Verbesserung der lokoregionalen Krankheitskontrolle mit beschleunigten oder hyperfraktionierten Strahlentherapieschemata, wenn die Bestrahlung allein angewendet wird.34,35 Eine nachfolgende Metaanalyse hat sogar einen bescheidenen Überlebensvorteil durch Hyperfraktionierung der Strahlung bei Verwendung als einzige Behandlungsmethode nahe gelegt.36 Im Rahmen der gleichzeitigen Chemotherapie zeigten die Studien RTOG 0129 und GORTEC 99-02 jedoch keine Verbesserung des klinischen Ergebnisses unter Verwendung einer beschleunigten gegenüber einer konventionellen Strahlentherapie.37,38 Hyperfraktionierte CCRT führte im Vergleich zu hyperfraktionierter Bestrahlung allein in einer einzelinstitutionellen Studie der Duke University und einer Phase-III-Studie aus Jugoslawien zu einer verbesserten lokoregionalen Krankheitskontrolle, wobei letztere auch ein verbessertes Gesamtüberleben und ein fernmetastasenfreies Überleben zeigte.39,40 Diese Studien zeigen, dass der Nutzen der CCRT bei hyperfraktionierter Strahlentherapie anhält. Ein direkter Vergleich von konventionell fraktionierter CCRT und hyperfraktionierter CCRT wurde bisher nicht durchgeführt. Es ist jedoch bemerkenswert, dass die MACH-NC-Metaanalyse keinen Unterschied im Ergebnis bei Patienten feststellte, die mit CCRT unter Verwendung konventioneller oder veränderter Fraktionierungstechniken behandelt wurden.22
Toxizität — Die Kosten der Chemoradiation
In Übereinstimmung mit vielen einzelinstitutionellen Studien, die ihr vorausgingen, zeigte RTOG 9111, dass die Vorteile der Chemotherapie, ob sequentiell oder gleichzeitig mit der Bestrahlung verabreicht, auf Kosten der zusätzlichen Toxizität gehen.12 In ähnlicher Weise zeigten sowohl die klinischen Studien EORTC 2291 als auch RTOG 9501 im adjuvanten Setting eine ungefähre Verdoppelung der Toxizitäten des Grades 3 mit Chemoradiation im Vergleich zur Bestrahlung allein.30,31 Ein solcher Trend hält auch im Rahmen der hyperfraktionierten Strahlentherapie an.39 Obwohl die aus historischen Studien ermittelte erwartete Rate spezifischer Toxizität in der gegenwärtigen Ära hochkonformer Strahlentherapietechniken wie der intensitätsmodulierten Strahlentherapie (IMRT) wahrscheinlich überschätzt wird. Zwei kleine, randomisierte Studien berichteten über eine signifikante Verringerung der Inzidenz und Schwere der Xerostomie bei Verwendung von IMRT im Vergleich zur konventionellen dreidimensionalen konformen Strahlentherapie bei Kopf- und Halskrebs (parotisparende intensitätsmodulierte versus konventionelle Strahlentherapie bei Kopf- und Halskrebs und Tata Memorial Hospital-Studien).41,42 Jüngste Studien zur Untersuchung der CCRT ermöglichen die IMRT-basierte Behandlungsabgabe als Standardansatz bei der Behandlung von SCCHN. Es bleibt abzuwarten, welche Auswirkungen die IMRT in diesen größeren randomisierten Studien in Kombination mit einer Chemotherapie auf die Toxizitätsraten haben wird.
Verbesserte Strahlentherapietechniken in Verbindung mit zunehmender Bedeutung und Verfügbarkeit von unterstützender Pflege und Zusatzleistungen wie Sprachschluckpathologie und Zahnpflege begrenzen die Inzidenz schwerwiegender nicht hämatologischer Toxizitäten noch weiter. Es wird jedoch erwartet, dass die von CCRT erwartete Toxizität immer noch höher ist als die Strahlentherapie allein. Diese anhaltende Toxizität spiegelt die klinischen Kosten der Kombination von Chemotherapie und Bestrahlung wider. In diesem Zusammenhang ist es nach wie vor von größter Bedeutung, dass Ärzte die Patienten umfassend bewerten, um festzustellen, ob der potenzielle Nutzen von CCRT diese Kosten rechtfertigt. Die Anwendung von strahlentherapiebasierten Einzelmodalitätsbehandlungen bei Patienten mit ausgeprägten Komorbiditäten / niedrigem Ausgangsleistungsstatus oder mit einer Erkrankung im Frühstadium mit geringem Risiko kann ein vernünftiger Ansatz zur Maximierung des therapeutischen Verhältnisses sein. Diese Risiko-Nutzen-Analyse wird mit dem Aufkommen von molekularen zielgerichteten Wirkstoffen, die eine praktikable Alternative für die gleichzeitige Therapie bieten, noch wichtiger.
The Emerging Role of Molecularly Targeted Agents
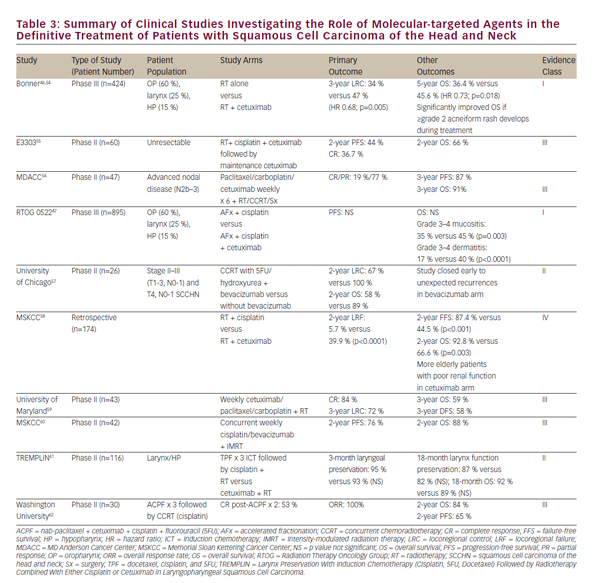
Die Toxizität der Strahlenchemotherapie sowie der Wunsch, die klinischen Ergebnisse weiter zu verbessern, haben ein aufkeimendes Interesse an der Rolle von molekular-gezielten Wirkstoffen für die Behandlung von SCCHN gefördert. EGFR ist in 80-90% der SCCHN-Tumoren überexprimiert oder mutiert und dies ist mit einem verminderten Ansprechen auf Strahlentherapie und schlechteren klinischen Ergebnissen verbunden.43-45 In 2006, Bonner et al. berichtet über eine bahnbrechende Studie bei Patienten mit lokal fortgeschrittenem SCCHN, die entweder mit Bestrahlung allein oder gleichzeitig mit dem EGFR-Antikörper Cetuximab behandelt wurden. Diese Studie zeigte, dass die gleichzeitige Anwendung von Cetuximab und Strahlung die lokoregionale Krankheitskontrolle und das Gesamtüberleben erhöhte, ohne die üblichen Toxizitäten der Strahlung zu verschlimmern.46 Diese Studie definierte eine Rolle für gleichzeitiges Cetuximab und Bestrahlung bei Patienten, die nicht für Cisplatin in Frage kommen.
In nachfolgenden Studien wurde versucht, die CCRT mit gleichzeitigem Cetuximab mit der mit Cisplatin zu vergleichen. Retrospektive und Frühphasenstudien unterschieden sich in dieser Beurteilung und ein randomisierter Phase-III-Vergleich ist in RTOG 1016 im Gange. Insbesondere hat die RTOG 0522-Studie den potenziellen zusätzlichen Nutzen von Cetuximab gegenüber einem Cisplatin-basierten Regime von CCRT47 bewertet. Diese Studie zeigte, dass Cetuximab, wenn es zu einer standardmäßigen platinbasierten CCRT hinzugefügt wurde, das progressionsfreie oder das Gesamtüberleben nicht weiter verbesserte. In der postoperativen Umgebung wird RTOG 0920 die adjuvante Strahlentherapie mit oder ohne Cetuximab bei lokal fortgeschrittenem reseziertem SCCHN bewerten, während die Phase II / III RTOG 1216 Die adjuvante CCRT mit gleichzeitigem Cisplatin gegen Docetaxel gegen Docetaxel und Cetuximab für Hochrisiko-SCCHN.
Zahlreiche klinische Studien in der Frühphase mit zusätzlichen molekular-zielgerichteten Wirkstoffen zusammen mit Strahlung zur Behandlung von SCCHN wurden durchgeführt oder laufen noch. Eine Auswahl davon ist in i>Tabelle 3 zusammengefasst. Mit Ausnahme von Studien zu Cetuximab ist kein anderer molekular gezielter Wirkstoff so weit fortgeschritten, dass er die derzeitige Praxis außerhalb einer klinischen Studie beeinflusst. Während die Aussicht auf molekular gezielte Wirkstoffe vielversprechend ist, bleibt die gleichzeitige hochdosierte Cisplatin-Chemotherapie die bevorzugte Empfehlung der Stufe 1 der aktuellen Richtlinien für die CCRT National Comprehensive Care (NCCN).
Strahlentherapie bei Kopf— und Halskrebs – Ein sich entwickelndes Paradigma
In den letzten 20 Jahren hat sich die Strahlentherapie als Standardtherapie bei der endgültigen Behandlung von SCCHN etabliert. Bei entsprechend ausgewählten Patienten überwiegt der nachweisbare Überlebensvorteil dieser Behandlung die Risiken für zusätzliche Toxizitäten. Es bleiben jedoch noch wichtige Fragen zur optimalen Nutzung der Radiochemie. Eine Reihe klinischer Studien hat den potenziellen klinischen Nutzen von ICT bei lokal fortgeschrittenen SCCHN-Patienten weiter untersucht, und obwohl diese Studien eine Verbesserung der ICT-Therapien auf Kosten der Toxizität gezeigt haben, hat keine schlüssig gezeigt signifikante klinische Verbesserung im Vergleich zu Cisplatin-basierter CCRT.
Zukünftige Studien werden zweifellos weiterhin alternative Chemotherapieregime und Dosierungsschemata sowie Fraktionierungs-, Dosier- und Verabreichungsmethoden für Strahlentherapien untersuchen, um bestehende Techniken voranzutreiben. Darüber hinaus werden zukünftige Studien mit fortgesetzter Entwicklung neuartiger molekular-zielgerichteter Chemotherapeutika mit ziemlicher Sicherheit eine aufkeimende Rolle dieser Wirkstoffe bei der Behandlung von SCCHN definieren. Besonders interessant könnte die Verwendung dieser Wirkstoffe in einer Induktionsumgebung vor der CCRT sein, in der sie auf Mikrometastasen abzielen und den Rückfall von Fernerkrankungen verringern können, ohne toxizitätsbedingte Einschränkungen der CCRT-Abschlussraten aufzuerlegen. Während sich die Verwendung von CCRT weiterentwickelt, ist auch eine fortgesetzte Untersuchung der geeigneten Rolle der Operation bei SCCHN gerechtfertigt. Fortschritte in der Roboterchirurgie und in den Chemoradiationsbehandlungsansätzen stellen equipoise für solche Untersuchung zur Verfügung. Aktuelle Praxisrichtlinien empfehlen eine adjuvante Chemoradiation für postoperative Patienten mit positiven Rändern oder ECE, während eine adjuvante Bestrahlung allein oder die Berücksichtigung einer Chemoradiation für postoperative Patienten mit einer PT3- oder pT4-Primär-, pN2- oder pN3-Knotenerkrankung empfohlen wird, Lymphknotenbeteiligung der Stufe IV oder V, oder mit peri-neuraler oder lympho-vaskulärer Invasion. Zusätzliche Studien zur Identifizierung präoperativer radiologischer und klinischer Prädiktoren für den Hochrisikostatus bei Patienten mit SCCHN im Frühstadium wird sich als wertvoll erweisen, um die Behandlung solcher Patienten zu leiten, denen möglicherweise ein chirurgischer Eingriff mit einem definitiven Chemoradiationsbehandlungsansatz im Vorfeld erspart bleibt.
Die kürzlich erfolgte Erkennung einer Infektion mit dem humanen Papillomavirus (HPV) als Ursache und günstiger prognostischer Faktor bei SCCHN, die aus dem Oropharynx48 und möglicherweise anderen Stellen stammt, verändert die Konzeption von SCCHN als Krankheitseinheit. In einer retrospektiven Analyse von RTOG 0129 betrug das 3-Jahres-Gesamtüberleben für Patienten mit HPV-positiven Tumoren 82,4% gegenüber 57% für HPV-negative Erkrankungen (p49,50) In Anbetracht dessen werden zukünftige Studien notwendigerweise nach HPV-Status geschichtet oder auf eine Untergruppe von HPV-positiven oder -negativen Patienten zugeschnitten sein, was zu einer wachsenden Spaltung der Behandlungsansätze führt. Bereits angehoben wird, ist die Aussicht auf die Untersuchung weniger toxische Behandlungsansätze für HPV-positive Tumoren und aggressivere definitive Behandlungen für HPV-negative Tumoren, um Konto für starke Unterschiede in Ihren jeweiligen Reaktionen auf aktuelle Behandlungsmodalitäten. RTOG 1016 ist eine solche Studie, in der speziell HPV-positive Patienten auf die De-Intensivierung der Behandlung untersucht werden Verwendung von gleichzeitigem Cetuximab mit Strahlung im Vergleich zu Standard-Cisplatin-basierter CCRT. Die Wechselwirkung spezifischer Behandlungsschemata und bestimmter molekular gezielter Wirkstoffe mit dem Tumor-HPV-Status wird sich zweifellos als fruchtbarer Boden für die zukünftige Forschung erweisen. Es bleibt abzuwarten, welche Auswirkungen die aufkeimende HPV-Epidemie und die aktuellen Impfprogramme auf die klinischen Ergebnisse und Behandlungsansätze bei Patienten mit SCCHN haben werden.