- Einleitung
- Ergebnisse
- Der DBH-Cre-Treiber markiert und beschränkt sich auf TH-exprimierende noradrenerge Regionen im Hirnstamm, die durch CNO-Verabreichung inhibiert werden
- CNO-hM4D vermittelte Störung von noradrenergen Neuronen in adulten Mäusen
- CNO-hM4D-Störung von DBH-Cre-Neuronen führt zu einem hyperkapnischen Defizit
- Habituierte Geschwisterkontrollen, denen 10 mg / kg CNO injiziert wurden, zeigten ein hyperkapnisches Beatmungsdefizit
- Habituierte und unbewohnte Wildtyp-Tiere, denen Kochsalzlösung injiziert wurde, zeigten keine Veränderungen Prä- und Postsalin
- Die Konzentrationsverhältnisse von Clozapin zu CNO sind im Gehirn höher als im Serum
- Materialien und Methoden
- Ethische Zulassung
- Zucht, genetischer Hintergrund und Erhalt von Mäusen
- Histologie
- Elektrophysiologie
- Plethysmographie
- Flüssigchromatographie-Massenspektrometrie
- Datenerfassung und -analyse
- Plethysmographie
- Statistik
- Plethysmographie
- Flüssigkeitschromatographie-Massenspektrometrie
- Ethikerklärung
- Autorenbeiträge
- Finanzierung
- Interessenkonflikterklärung
- Danksagung
Einleitung
Die neuronalen Netze, die dem chemosensorischen Reflex der Atemwege zugrunde liegen, sind ein primäres Ziel für das Verständnis der Ätiologie mehrerer verhaltens- und physiologischer Störungen. Es wird vermutet, dass gestörte chemosensorische Reflexe sowohl bei angeborenen als auch bei Erwachsenen eine Rolle spielen Störungen einschließlich plötzlichem Kindstod (SIDS), angeborenem zentralem Hypoventilationssyndrom (CCHS), zentralen Schlafapnoen, abnormaler Atmung beim Rett-Syndrom und Adipositas-Hypoventilationssyndrom (Obonai et al., 1998; Ozawa et al., 2003; Amiel et al., 2009; Ramanantsoa et al., 2011; Lavezzi et al., 2013). Unter der falschen Erstickungsalarmhypothese wird angenommen, dass eine unangemessene chemosensorische Aktivierung oder Überempfindlichkeit eine Rolle spielt Untergruppen von Patienten mit Panikstörung (Klein, 1993). Eine chemosensorische Dysfunktion kann auch bei neurodegenerativen Erkrankungen durch Schlafstörungen eine Rolle spielen Atmung, die mit einem beschleunigten Fortschreiten verbunden ist (Hakim et al., 2012; Verbraecken und McNicholas, 2013; Bahia und Pereira, 2015; Snyder et al., 2017). Ein besseres Verständnis chemosensorischer Netzwerke im Hirnstamm wird daher wichtige Hinweise auf eine Reihe von Verhaltens- und physiologischen Pathologien liefern.
Pharmakogenetische Designer-Rezeptoren, die ausschließlich durch Designer-Medikamente (DDS) aktiviert werden (Armbruster et al., 2007) wurden in einer Reihe von Studien eingesetzt, um neuronale Populationen im respiratorischen Chemoreflex (Atemreaktion auf erhöhte CO2-Spiegel im Blut) abzubilden. Die DREADD-Technologie in Kombination mit dem intersektionalen genetischen Einsatz wurde verwendet, um hochgerichtete neuronale Populationen zum Schweigen zu bringen, während die Atemfunktion bei bewussten und hemmungslosen Mäusen von unserem Labor und anderen beobachtet wurde, wodurch viele Verwirrungen aus früheren Circuit-Mapping-Ansätzen vermieden wurden (Ray et al., 2011, 2013; Brust et al., 2014; Hennessy et al., 2017; Sonne und Strahl, 2017; Sonne et al., 2017). Diese und die meisten anderen Studien schlossen fast immer CNO nur Nicht-DREADDOLL-Geschwisterkontrollen ein, die keine chemosensorischen oder anderen respiratorischen Effekte zeigten, und argumentierten, dass CNO trotz der hohen Dosis keine Off-Target-Effekte auf die Atmung bei bewussten und hemmungslosen Mäusen hatte verwendet, 10 mg / kg. Nichtsdestotrotz wurde in mehreren anderen Studien festgestellt, dass CNO und seine Back-Metabolismus-Produkte Off-Target-Effekte auf Verhalten und Fortbewegung in einer Vielzahl von Assays haben könnten, aber die respiratorische Leistung wurde nicht angesprochen (Guettier et al., 2009; Joober, 2010; MacLaren et al., 2016; Gomez et al., 2017; Ilg et al., 2018; Mahler und Aston-Jones, 2018; Manvich et al., 2018; Padovan-Hernandez und Knackstedt, 2018). Es wurde auch gezeigt, dass CNO und seine Metaboliten nicht äquivalent zwischen dem Kreislaufsystem und dem Gehirn verteilt sind (Gomez et al., 2017).
Eine zweite, nicht adressierte Sorge ergibt sich aus dem Stress, der durch das experimentelle Paradigma induziert wird, einschließlich der Haltung von Tieren in einer Ganzkörper-barometrischen Plethysmographiekammer, Handhabung, intraperitoneale Injektion und rektale Temperaturmessungen. In früheren 3D-Atemstudien wurden naïve Mäuse in eine kleine Kammer (140-400 ml) eingeführt und 20-40 Minuten vor der Datenerfassung akklimatisiert (Ray et al., 2011, 2013; Brust et al., 2014; Hennessy et al., 2017; Sonne und Strahl, 2017; Sonne et al., 2017). Es ist jedoch nicht klar, ob diese Zeitspanne ausreicht, um stressinduzierte Atemveränderungen zu minimieren, die als wechselwirkender Faktor mit den Wirkungen von Clozapin wirken können.
In unseren Studien zur Untersuchung der Rolle des noradrenergen (NA) Systems bei der Atemkontrolle haben wir versucht, das etablierte RC zu verwenden::P_hM4D DREADD-Allel (Ray et al., 2011), um die Rolle von NA-Neuronen bei der Baseline- und hyperkapnischen Atmung bei uneingeschränkten erwachsenen Tieren mithilfe der Ganzkörper-Plethysmographie zu testen. Denn es ist auch bekannt, dass Noradrenalin- und NA-Neuronen eine zentrale Rolle bei Stressreaktionen spielen (Valentino und Van Bockstaele, 2008; Chen et al., 2018), führten wir eine Reihe von Studien durch, um eine ausgedehnte Gewöhnung (mehrfache Exposition gegenüber dem experimentellen Paradigma, bei dem das Tier lernt, dass die Erfahrung nicht bedrohlich oder überlebensfähig ist) und eine hohe vs. niedrige (1 mg / kg) CNO-Dosen mit früher veröffentlichten DREADD-Protokollen (Ray et al., 2011, 2013; Brust et al., 2014; Hennessy et al., 2017; Sonne und Strahl, 2017; Sonne et al., 2017). Hier zeigen wir zum ersten Mal, dass hohe systemische Dosen von CNO in der Lage sind, Off-Target-Effekte auf eine autonome Atmungsfunktion bei bewussten Mäusen auszulösen. Wir zeigen auch, dass der Off-Target-Effekt von CNO auf die chemosensorische respiratorische Leistung wird durch eine umfassende Gewöhnung effektiv entlarvt und wäre daher in früheren CNO-Kontrollstudien, in denen Tiere vor der Atemmessung nicht gewöhnt wurden, nicht offensichtlich nur eine kurze Akklimatisationsphase vor der Datenerfassung. Zusammen deuten diese Ergebnisse darauf hin, dass zuvor kartierte neuronale Populationen indirekt die Atmungskontrolle durch mögliche Rollen bei der Regulierung von Stressreaktionen beeinflussen können. Bemerkenswerterweise stimmen diese Daten mit den jüngsten Berichten überein, die darauf hindeuten, dass CNO bei hohen Dosen durch metabolische Umwandlung in Clozapin nicht biologisch inert ist (MacLaren et al., 2016; Gomez et al., 2017) und dass sich Off-Target-Verhaltenseffekte nicht nur durch Störungen der Verhaltenskreise, sondern auch durch Störungen der zugrunde liegenden autonomen Schaltkreise und der Homöostase manifestieren können.
Ergebnisse
Der DBH-Cre-Treiber markiert und beschränkt sich auf TH-exprimierende noradrenerge Regionen im Hirnstamm, die durch CNO-Verabreichung inhibiert werden
Um die Expression und Spezifität der DBH-Cre-Linie zu untersuchen, verwendeten wir ein einzelnes Rekombinase-Zuchtschema (Abbildung 1A), in dem wir den Treiber mit der Ai9-Linie kreuzten (Madisen et al., 2010), die eine floxierte Tomate ausdrückt. Die Färbung mit einem Tyrosinhydroxylase (TH) -Antikörper ergab, dass die Expression von tdTomato im Hirnstamm wie erwartet auf TH-exprimierende Regionen beschränkt war, einschließlich der Locus coeruleus-, A5-, A1-, A2-, A7-, SubCV- und SubCD-Kerne (Abbildung 1B). Um zu bestätigen, dass NA-Neuronen, die den hM4D-Rezeptor exprimieren, auf CNO ansprechen, führten wir Aufzeichnungen an Locus coeruleus (LC) -Neuronen durch, wo wir eine Hemmung des Neuronenfeuerns bei Anwendung des CNO-Bades beobachteten (n = 3, Abbildung 1C).
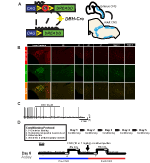
Abbildung 1. Zuchtschema und Atmungsprotokolle. Der RC::Das P_hM4D-Allel wird mit einer Dopamin-Beta-Hydroxylase (DBH) -Cre-Linie kombiniert, um eine zellspezifische Expression des hM4D-Rezeptors in noradrenergen (NA) Neuronen (A) zu erreichen. Fluoreszierende Expression von tdTomato in DBH-Cre; Ai9 coronal brain sections coexprimiert mit Tyrosin-Hydroxylase (TH) in Hirnstamm-NA-Kernen (B). In-Slice-Aufzeichnung von NA locus coeruleus vor und nach der CNO-Anwendung, Demonstration der Funktionalität des DREADD-Rezeptors in gezielten Neuronen (C). Atmungsprotokoll. Habituierte Mäuse werden einem 5-tägigen habituierten Protokoll unterzogen, das aus Handhabung, rektaler Sondentemperaturmessung, Kochsalzlösung besteht Injektion und Exposition gegenüber der Plethysmographiekammer. Am sechsten Tag werden sowohl habituierte als auch unhabituierte Mäuse einem hyperkapnischen Assay unterzogen, bei dem das Tier in die Atemkammer gegeben wird und sich unter normalen Raumluftbedingungen akklimatisieren kann. Das Tier wird dann 20 min 5% CO2 ausgesetzt, gefolgt von 20 min Raumluft. Das Tier wird dann intraperitoneal mit CNO oder Kochsalzlösung injiziert, gefolgt von weiteren 20 min Raumluft nach der Injektion, 20 min 5% CO2 und 20 min Raumluft. Offene Kästchen beschreiben die Datenerfassungszeiten (D).
CNO-hM4D vermittelte Störung von noradrenergen Neuronen in adulten Mäusen
Um die Rolle von NA-Neuronen bei der Baseline- und hyperkapnischen Atmung zu untersuchen, verwendeten wir das RC: P_hM4D-inhibitorische HMD-System, das mit dem DBH-Cre-Treiber gekreuzt wurde. Mittels Ganzkörper-Plethysmographie (Ray et al., 2011), maßen wir die Beatmungsreaktionen von ungezügelten erwachsenen Tieren unter Raumluftbedingungen (21% O2 / 79% N2) und hyperkapnischen Bedingungen (5% CO2 / 21% O2 / 74% N2) vor und nach der CNO-Verabreichung (Abbildung 1D). Um die CNO-Dosierung und den durch unser Versuchsdesign induzierten potenziellen Stress anzugehen, wurden die Tiere einer von vier Bedingungen unterzogen: (1) unbewohnt und mit 10 mg / kg CNO injiziert; (2) gewöhnt und mit 10 mg / kg CNO injiziert; (3) unbewohnt und mit 1 mg / kg CNO injiziert; oder (4) gewöhnt und mit 1 mg / kg CNO injiziert. Die Gewöhnung bestand aus einem 5-tägigen Prozess, der Handhabung, Rektaltemperatursonde, Kochsalzlösung beinhaltete Injektion und Exposition gegenüber der Plethysmographiekammer jeden Tag für 30 min, während naïve Tiere unmittelbar vor der Datenerfassung nur einer Akklimatisationsphase von 20-45 min Kammer ausgesetzt waren, wie in früheren Studien (Ray et al., 2011, 2013; Brust et al., 2014; Hennessy et al., 2017; Sonne und Strahl, 2017; Sonne et al., 2017). Zu den gemessenen Atmungsparametern gehörten Atemfrequenz RR, Atemzugvolumen (VT), Minutenventilation (VE), Sauerstoffverbrauch (VO2), Minutenventilation normalisiert auf Sauerstoffverbrauch (VE / VO2), Apnoefrequenz, Seufzerfrequenz und Variationskoeffizienten für Interatmungsintervall und Amplitude (periodische und Volumeninstabilität). Als zusätzliche Kontrolle verglichen wir auch habituierte und unhabituierte Wildtyp-Tiere, denen Kochsalzlösung injiziert wurde.
CNO-hM4D-Störung von DBH-Cre-Neuronen führt zu einem hyperkapnischen Defizit
Unter drei der Bedingungen, DBH-Cre; RC::P_hM4D-Tiere zeigten eine Reduktion von VE und VE / VO2 nach CNO-Verabreichung, während Geschwisterkontrollen keine Unterschiede in den Prä- und Post-CNO-Werten zeigten. Unhabituierte Tiere, denen 10 mg / kg CNO injiziert wurden, zeigten eine signifikant reduzierte RR (-12,17%, p = 0,034) und VT (-30,87%, p = 0,0016), was zu einer Verringerung der VE (-38,64%, p = 0,0031) und einer leichten Verringerung der VO2 (-14,25%, p = 0,042) führte (Abbildung 2). Die Reduktion von VE war größer als die Abnahme von VO2, was zu einer Gesamtreduktion von VE / VO2 führte (-26,89%, p = 0,0095). Unbewohnte Tiere, denen 1 mg / kg CNO injiziert wurde, zeigten einen Trend zu reduzierter RR (-12,88%, p = 0,066) und signifikant reduzierter VT (-16,52%, p = 0,00085) und VE (-28,08%, p = 0,0070), was zu einer Gesamtreduktion von VE / VO2 (-22,23%, p = 0,016) führte (Abbildung 3). Schließlich zeigten habituierte Tiere, denen 1 mg / kg CNO injiziert wurde, eine verringerte RR (-10,77%, p = 0,074), einen Trend zu einer verringerten VE (-25,07%, p = 0,074) und eine verringerte Gesamt-VE / VO2 (-23,70%, p = 0,024) (Abbildung 4). In keiner Kohorte wurden signifikante Veränderungen der Apnoe-Frequenz, der Seufzerfrequenz, der periodischen oder Volumeninstabilität oder der Temperatur beobachtet.
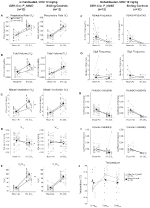
Abbildung 2. Unhabituierte DBH-Cre; RC :: P_hM4D-Tiere, denen 10 mg / kg CNO verabreicht wurden, zeigen ein hyperkapnisches Defizit, während Geschwisterkontrollen keine Veränderung zeigen. Nach CNO-Verabreichung DBH-Cre; RC::P_hM4D-Tiere zeigen unter hyperkapnischen Bedingungen keine Veränderung der Raumluftventilation und keine Verringerung von RR (A), VT (B), VE (C), VO2 (D) und VE / VO2 (E) ohne Änderungen der Apnoefrequenz (F), Seufzerfrequenz (G), periodisch (H) oder Volumeninstabilität (I) und Temperatur (J). Geschwisterkontrollen zeigten keinen Unterschied in allen Prä- und Post-CNO-Werten.
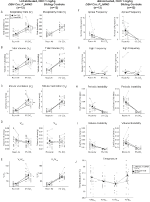
Abbildung 3. Unhabituierte DBH-Cre; RC :: P_hM4D-Tiere, denen 1 mg / kg CNO verabreicht wurde, zeigen ein hyperkapnisches Defizit, während Geschwisterkontrollen keine Veränderung zeigen. Nach CNO-Verabreichung DBH-Cre; RC::P_hM4D-Tiere zeigen keine signifikante Veränderung der Raumluftventilation oder der RR (A) und zeigten unter hyperkapnischen Bedingungen eine Verringerung von VT (B), VE (C) und VE / VO2 (E) ohne Änderungen von VO2 (D), Apnoefrequenz (F), Seufzerfrequenz (G), periodische (H) oder Volumeninstabilität (I) und Temperatur (J). Geschwisterkontrollen zeigten keinen Unterschied in allen Prä- und Post-CNO-Werten.
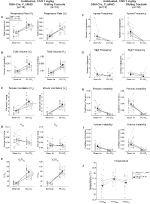
Abbildung 4. Habituierte DBH-Cre; RC :: P_hM4D-Tiere, denen 1 mg / kg CNO verabreicht wurde, zeigen ein hyperkapnisches Defizit, während Geschwisterkontrollen keine Veränderung zeigen. Nach CNO-Verwaltung, DBH-Cre; RC :: P_hM4D Tiere zeigen keine Veränderung der Raumluftbeatmung und eine Reduktion von RR (A) und VE / VO2 (E) unter hyperkapnischen Bedingungen ohne signifikante Veränderungen von VT (B), VE (C), VO2 (D), Apnoefrequenz (F), Seufzerfrequenz (G), periodische (H) oder Volumeninstabilität (I) und Temperatur (J). Geschwisterkontrollen zeigten keinen Unterschied in allen Prä- und Post-CNO-Werten.
Habituierte Geschwisterkontrollen, denen 10 mg / kg CNO injiziert wurden, zeigten ein hyperkapnisches Beatmungsdefizit
In beiden DBH-Cre; RC::P_hM4D und Geschwister Kontrolle habituierten Tieren injiziert mit 10 mg/kg CNO, stellten wir fest, eine signifikante Reduktion der VE/VO2 (p = 0,0235) vermittelt durch eine Abnahme der RR (p = 0,00036) und VE (p = 0,037) (Abbildung 5). Im Gegensatz zu den anderen Kohorten gab es jedoch keinen Unterschied zwischen DBH-Cre; RC ::P_hM4D und Geschwisterkontrolltieren in diesen Parametern: RR (-12,72 vs. -10,22%, p = 0,6268), VE (-24,88 vs. -23,94%, p = 0,4150) oder VE / VO2 (-15,4 vs. -22,55%, p = 0,4643).
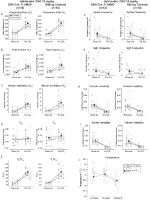
Abbildung 5. Beide gewohnten DBH-Cre; RC::P_hM4D Tiere und Geschwister Kontrollen verabreicht 10 mg / kg CNO zeigen ein hyperkapnisches Defizit. Nach CNO-Verabreichung zeigen DBH-Cre; RC :: P_hM4D-Tiere und Geschwisterkontrollen keine Änderung der Raumluftventilation und eine Verringerung von RR (A), VE (C) und VE / VO2 (E) unter hyperkapnischen Bedingungen ohne signifikante Änderungen in VT (B), VO2 (D), Apnoefrequenz (F), Seufzerfrequenz (G), periodische (H) oder Volumeninstabilität (I) und Temperatur (J).
Habituierte und unbewohnte Wildtyp-Tiere, denen Kochsalzlösung injiziert wurde, zeigten keine Veränderungen Prä- und Postsalin
Obwohl bei Kontrollen, denen 1 mg / kg CNO injiziert wurde, keine Phänotypen beobachtet wurden, haben wir die Möglichkeit untersucht, dass die Injektion selbst den Phänotyp verursachte, der bei Kontrollen beobachtet wurde, denen 10 mg / kg CNO injiziert wurden, indem wir habituierte und unbewohnte Wildtyp-Tiere testeten, denen Kochsalzlösung injiziert wurde (Abbildung 6). Sowohl in habituierten als auch in unhabituierten Kohorten zeigten die Tiere keinen Unterschied in den respiratorischen Parametern prä- und postsalinale Verabreichung. Es wurden keine signifikanten Veränderungen der Apnoefrequenz, der Seufzerfrequenz, der periodischen oder Volumeninstabilität oder der Temperatur beobachtet.
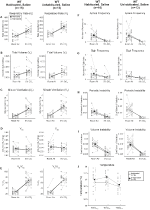
Abbildung 6. Sowohl unhabituierte als auch habituierte Wildtyp-Tiere, denen Kochsalzlösung verabreicht wurde, zeigen keinen Unterschied zwischen den Werten vor und nach der Injektion. Nach Verabreichung von Kochsalzlösung zeigten sowohl unbewohnte als auch habituierte Wildtyp-Tiere keine Veränderungen unter Raumluft- oder hyperkapnischen Bedingungen in RR (A), VT (B), VE (C), VO2 (D), VE / VO2 (E), Apnoe-Frequenz (F), Seufzerfrequenz (G), periodische (H) oder Volumeninstabilität (I) und Temperatur (J).
Die Konzentrationsverhältnisse von Clozapin zu CNO sind im Gehirn höher als im Serum
Um die Bioverfügbarkeit von CNO und Clozapin zu bestimmen, haben wir ihre Konzentrationen im Serum und im Gehirn mittels Massenspektrometrie gemessen. Dreißig Minuten nach einer intraperitonealen Injektion von CNO bei Mäusen wird CNO im Vergleich zu seinem Gegenmetaboliten Clozapin in geringerer relativer Häufigkeit im Serum und Gehirn für alle getesteten Dosen gefunden, 0,1 mg / kg (Serum p = 0,0054, Gehirn p = 0,0001) (Abbildung 7A), 1 mg / kg (Serum p > 0,05, Gehirn p = 0,0197) (Abbildung 7B) und 10 mg / kg (Serum p = 0,0036, Gehirn p = 0.0005) (Abbildung 7C). Wenn das Gesamtverhältnis von Clozapin zu CNO analysiert wurde, lagen sie immer über Null und waren im Gehirn höher als im Serum (Vehikel p > 0, 5, 0, 1 mg / kg p > 0, 5, 1 mg / kg p = 0, 0018, 10 mg / kg p = 0, 0160) (Abbildung 7D).
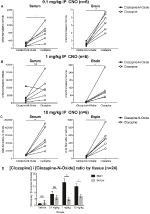
Abbildung 7. Die Konzentrationen von Clozapin zu CNO sind im Gehirn höher als im Serum. Serum- und Gehirnproben wurden von Wildtyp-Mäusen 30 min nach CNO-Verabreichung in 3 verschiedenen Dosen von 0,1 mg / kg (A), 1 mg / kg (B), 10 mg / kg (C) entnommen. Einzelne Datenpunkte repräsentieren die relative Häufigkeit von Clozapin-N-Oxid oder Clozapin, die durch LC-MS erhalten wurde.
Das ursprüngliche Ziel dieser Studie war es, die Rolle von DBH-Cre-Neuronen in der Atmungsphysiologie nach akuter Störung bei ungezügelten und bewussten erwachsenen Tieren zu untersuchen. Weil Noradrenalin und NA-Neuronen eine gut dokumentierte Rolle im Stressverhalten spielen (Valentino und Van Bockstaele, 2008; Chen et al., 2018) wollten wir auch untersuchen, ob die Gewöhnung an ein wahrscheinlich stressiges physiologisches Protokoll Auswirkungen auf die zuvor beobachteten respiratorischen Phänotypen haben würde. Im Ganzkörper-Plethysmographie-3D-Protokoll, das in unserem Labor und anderen verwendet wird, werden Tiere gehandhabt, rektal auf Temperatur untersucht, einer neuartigen Umgebung (der Plethysmographiekammer) ausgesetzt und intraperitoneal injiziert. Frühere Studien haben gezeigt, dass der Umgang und die Gewöhnung an Injektionen und andere „Routine“ -Verfahren Verhaltens- und physiologische Parameter, einschließlich der Atmung, verändern können (Misslin et al., 1982; Andrews und Datei, 1993; Lapin, 1995; Ryabinin et al., 1999). Andere angewandte Stressoren modifizieren auch die Atmung sowohl unter Baseline- als auch unter hyperkapnischen Beatmungsbedingungen (Isom und Elshowihy, 1982; Kinkead et al., 2001).
In unseren Studien mit hohen Dosen von CNO fanden wir, dass die hM4D-vermittelte Hemmung von DBH-Cre-definierten NA-Neuronen in vier definierten experimentellen Kohorten zu einem reduzierten hyperkapnischen Reflex in VE / VO2 führte, mit reduzierter RR, VT und VE, was frühere Studien unterstützt (Biancardi et al., 2008; Viemari, 2008; Gargaglioni et al., 2010). Gewohnte Geschwisterkontrollen, die eine Dosis von 10 mg / kg CNO erhielten, die in früheren Atemwegsstudien verwendet wurde, zeigten jedoch ein Beatmungsdefizit unter hyperkapnischen Bedingungen in der gleichen Größenordnung wie bei DBH-Cre; RC :: P_hM4D-Tieren. Keine andere Geschwisterkontrollgruppe zeigte diesen Phänotyp, einschließlich der gewohnten Kohorte, die nur (1 mg / kg CNO) oder Kochsalzlösung erhielt. Diese Ergebnisse deuten darauf hin, dass höhere CNO-Dosen (10 mg / kg) eine Wirkung auf die hyperkapnische Reaktion haben, die nach ausgedehnter Gewöhnung entlarvt wird, während vermutlich das Stressniveau der Tiere reduziert wird, und dass niedrigere CNO-Dosen keinen Einfluss auf die Atemkontrolle bei habituierten Tieren haben. Diese Ergebnisse stimmen auch mit Arbeiten von Korsak et al. überein. die Who zeigte, dass niedrig dosiertes CNO (2 mg / kg) in einem Belastungstest, der ein vorheriges Training beinhaltete, keine Off-Target-Effekte auf die Arbeitsfähigkeit hervorruft (Korsak et al., 2018) und Fleury Curado et al. die Who zeigte keine spezifischen Wirkungen von niedrig dosiertem CNO (1 mg / kg) auf die Atemleistung (Fleury Curado et al., 2018).
Die erhöhten Verhältnisse von Clozapin zu CNO-Spiegeln im Serum und im Gehirn (Abbildung 7) stimmen mit den jüngsten Studien überein, die darauf hindeuten, dass CNO leicht zu Clozapin zurückverwandelt wird und eine größere Gehirnpermeabilität aufweist im Vergleich zu CNO bei Mäusen und anderswo (Jann et al., 1994; Chang et al., 1998; Guettier et al., 2009; Gomez et al., 2017; Raper et al., 2017). Es ist jedoch nicht klar, ob die beobachteten Off-Target-Effekte auf CNO oder Clozapin zurückzuführen sind. Da unsere hyperkapnischen Messungen < 30 Minuten nach der CNO-Anwendung auftraten, ist es wahrscheinlich, dass die nicht zielgerichteten respiratorischen Effekte durch Clozapin vermittelt werden. Unsere Ergebnisse (Abbildung 7) zeigen hohe relative Clozapinspiegel im Gehirn, obwohl CNO nicht vollständig fehlt. Huckstepp und Kollegen verwendeten jedoch eine direkte CNO-Anwendung auf das ventrale Medulla bei anästhesierten Ratten, um zu zeigen, dass die CNO-Anwendung nur bei Raumluft und nicht unter hyperkapnischen oder hypoxischen Herausforderungen eine geringe Wirkung hat, die Häufigkeit erhöht und die Exspirationsdauer verringert, aber die VT unverändert lässt, ohne dass während der Hyperkapnie ein klarer Effekt beobachtet wird (Huckstepp et al., 2015). Angesichts der direkten Anwendung bei anästhesierten Ratten und des Zeitrahmens der Experimente ist es wahrscheinlich, dass die beobachteten geringen Off-Target-Effekte durch CNO und nicht durch Clozapin vermittelt wurden.
Der Hauptmetabolit Clozapin ist ein häufig verwendetes Beruhigungsmittel und Antipsychotikum bei Schizophrenie mit vielen endogenen Zielen, einschließlich antagonistischer Wirkungen mit niedriger und hoher Affinität an dopaminergen D1-, D2- und D4-Rezeptoren, 5-HT2A, 5-HT2C, 5-HT3, 5-HT6 und 5-HT7 serotonerge Rezeptoren, H1-Histaminrezeptoren und α1- und α2-adrenerge Rezeptoren, unter anderem (Fitton und Heel, 1990 ; Ashby und Wang, 1996). Die hier beobachteten Off-Target-Effekte können aus unterschiedlichen oder kombinierten Mechanismen und Zielen resultieren. Clozapin kann die Atmung als Beruhigungsmittel beeinflussen. Eine frühere Studie zeigte eine reduzierte RR und VT unter 5 und 10% CO2 sowohl im Slow-Wave-Schlaf als auch im Rapid-Eye-Movement-Schlafzustand im Vergleich zum ruhigen Wachzustand bei Mäusen (Nakamura et al., 2007). Alternativ kann die Hemmung gezielter DREADD-exprimierender Neuronen zu einem antianxiogenen oder anxiolytischen Effekt führen, der unserem Gewöhnungsprotokoll ähnelt, um CNO / Clozapin-vermittelte chemosensorische Off-Target-Effekte aufzudecken. Beide Erklärungen werden durch mehrere Studien gestützt, die gezeigt haben, dass CO2 eine Rolle bei angeborenen und erlernten Angstreaktionen und angstbezogenen Verhaltensweisen spielt (Ziemann et al., 2009; Feinstein et al., 2013; Taugher et al., 2014; Dlouhy et al., 2015; Winter et al., 2017). Daher können Neuronen, auf die in einigen dieser Studien abgezielt wird, tatsächlich eine Rolle bei der Steuerung anxiogener Verhaltensreaktionen und nicht physiologischer chemosensorischer Reflexe spielen, da sowohl katecholaminerge als auch serotonerge Systeme an Angst- / Angstverhalten und chemosensorischer Homöostase beteiligt sind (Brust et al., 2014; Hennessy et al., 2017).
Umgekehrt können die chemosensorischen Phänotypen, die mit hohen CNO-Spiegeln beobachtet wurden, echt sein, da wir das NA-vermittelte hyperkapnische Defizit bei CNO-Dosen, die bei habituierten Mäusen um eine Größenordnung niedriger waren, rekapitulieren konnten Kontrollgruppen zeigten keinen CNO-Effekt. Vollständige Vergleiche zwischen früheren Studien sind jedoch schwierig, da in einigen Fällen keine VO2-, VT-, RR- und VE / VO2-Daten vorliegen. Zum Beispiel können Änderungen der Körpertemperatur oder der Stoffwechselrate auch auf verschiedene Weise auf die respiratorische und chemosensorische Leistung einwirken, und die Temperaturen der Plethysmographenkammer waren in einigen Fällen sehr unterschiedlich (34 vs. 30 ° C in unseren Studien), was den dynamischen Bereich der barometrischen Komponente der Wellenform und damit das Atemzugvolumen beeinflusst. Bemerkenswerterweise sahen wir weder nennenswerte Veränderungen der Atmungswellenformeigenschaften unter unseren Bedingungen noch einen akuten Herz-Kreislauf-Stillstand, der in unseren früheren Hochdosis-Rhombomer-Studien beobachtet wurde (Sun et al., 2017).
Unsere Ergebnisse zeigen zum ersten Mal, dass CNO einen unerwarteten Effekt auf den hyperkapnischen chemosensorischen Reflex hat, der durch eine ausgedehnte Gewöhnung entlarvt wird. Wichtig ist, dass trotz hoher Spiegel ein CNO-Off-Target-Effekt zuvor aufgrund des fehlenden Phänotyps bei Geschwisterkontrollen ausgeschlossen wurde, was jedoch nach Gewöhnung deutlich wird. Wir bieten eine Off-Target-Charakterisierung von CNO im Mausmodellsystem an, um Studien an Ratten und nichtmenschlichen Primaten zu ergänzen. Die Ergebnisse hier erhöhen die Möglichkeit, dass zusätzliche CNO-vermittelte, Off-Target-Effekte auf die untersuchten Schaltkreise oder auf autonome oder homöostatische Schaltkreise existieren können, aber in anderen kontrollierten Experimenten maskiert werden können. Wichtig ist, dass diese Daten zeigen, dass die Forscher sich bemühen sollten, die minimalen Dosen des aktivierenden Liganden zu verwenden möglich in Kombination mit einem hohen Maß an Gewöhnung, und dass die richtigen Kontrollen in chemische genetische Manipulationen einbezogen werden müssen, um experimentelle Daten vollständig zu schätzen und zu interpretieren.
Materialien und Methoden
Ethische Zulassung
Studien wurden vom Institutional Animal Care and Use Committee des Baylor College of Medicine gemäß Protokoll AN-6171 genehmigt.
Zucht, genetischer Hintergrund und Erhalt von Mäusen
Wir haben Kolonien aller unserer heterozygoten Mausstämme durch Rückkreuzung zu C57BL / 6J-Mäusen und homozygoten Stämmen durch Geschwisterkreuzungen erhalten. Für histologische Experimente wurden DBH-Cremice mit der homozygoten Ai9 Maus (Madisen et al., 2010) (JAX 007909). Für Plethysmographie-Experimente wurden DBH-Cre-Mäuse mit homozygoten RC::P_hM4D (Ray et al., 2011) Mäuse, um Tiere abzuleiten, bei denen alle Mäuse das RC::P_hM4D-Allel trugen. Geschwistertiere, die das Cre-Allel nicht erbten, wurden als Kontrolltiere für die Cre-positiven Nachkommen verwendet. Rosa26-spezifische Primer für die Ai9-, RC :: P_hM4D- und RC :: ePe-Mäuse waren 5′-GCACTTGCTCTCCCAAAGTC, 5′-GGGCGTACTTGGCATATGAT und 5′-CTTTAAGCCTGCCCAGAAGA und ergaben eine 495-bp-Bande (gezielt) und eine 330-bp-Bande (wt). Cre-spezifische Primer für alle Rhombomer-Cre-Treiber waren 5′-ATCGCCATCTTCCAGCAGGCGCACCATTGCCC und 5′-GCATTTCTGGGGATTGCTTA und ergaben eine 550 bp-Bande, wenn sie positiv war. Für LC-MS-Experimente wurden C57BL / 6J-Mäuse vom Center of Comparative Medicine (CCM) des Baylor College of Medicine erhalten.
Histologie
Vier bis acht Wochen alte erwachsene DBH-Cre; Ai9-Mäuse wurden transkardial mit 0,1 M phosphatgepufferter Kochsalzlösung (PBS) und dann mit 4% Paraformaldehyd (PFA) in PBS perfundiert. Gehirne wurden seziert und Tropfen für 2 h in 4% PFA vor einer PBS-Spülung und Äquilibrierung in 20% Saccharose in PBS fixiert. Die Gehirne wurden dann in 30-µm-Schnitte geschnitten, auf Objektträger montiert und mit immunfluoreszierenden Antikörpern markiert. Wir färbten über Nacht mit Anti-Tyrosin-Hydroxylase-Antikörper, um katecholaminerge Neuronen (1: 1.000, Millipore AB152) zu identifizieren, gefolgt von 2 h mit Esel-Anti-Kaninchen-Cy3-Serum (1:500, Jackson 711-165-152) in 0,1% Triton-X in PBS (PBST) mit 5% Eselsserum. Die Bilder wurden auf einem Zeiss aufrechten Epifluoreszenzmikroskop gesammelt.
Elektrophysiologie
Horizontale Hirnschnitte mit dem Locus coeruleus (300 µm) wurden mit einem Vibratom (Leica VT 1000S, Leica Microsystems, Buffalo Grove, IL) aus adulten DBH-Cre; RR2P; RC::ePe Mäusen (~1 Monat alt) in 4°C künstlicher Liquor cerebrospinalis (ACSF) geschnitten. Die Scheiben wurden in eine Kammer getaucht, die mit oxygeniertem ACSF (95% O2 und 5% CO2) perfundiert war, das in mM: 124 NaCl, 2,0 KCl, 1,3 MgSO4, 2,5 CaCl2, 1,2 KH2PO4, 25 NaHCO3 und 10 Glucose (2-3 ml / min) enthielt. Ganzzellaufnahmen wurden bei 30 °C unter Verwendung herkömmlicher Patch-Clamp-Techniken und eines MultiClamp 700B-Verstärkers (Molecular Devices, Union City, CA) durchgeführt. GFP-positive Neuronen aus dem Locus coeruleus wurden visuell identifiziert und anschließend mittels Infrarot-Differential-Interferenzkontrast-Video auf dem Tisch eines aufrechten Mikroskops (Axioskope FS2, Carl Zeiss, Oberkochen, Deutschland) abgebildet. Patchpipetten (Resistenzen 4-6 MU) wurden gefüllt mit (in mM): 110 K-Gluconat, 10 KCI, 10 HEPES, 10 Na2-Phosphokreatin, 2 Mg3-ATP und 0,2 Na3-GTP; Der pH-Wert wurde auf 7,2 und die Osmolarität auf 300 mOsm eingestellt. Das Haltepotential betrug -70 mV. CNO wurde nicht angewendet.
Plethysmographie
Die Plethysmographie an bewussten, hemmungslosen Mäusen wurde wie beschrieben an 6 bis 12 Wochen alten erwachsenen Tieren durchgeführt (Ray et al., 2011). Habituierte Mäuse wurden einem 5-tägigen Gewöhnungsprotokoll unterzogen, wobei jeder Tag aus mehreren Minuten Handhabung, Temperatur mit Rektalsonde, intraperitonealer Kochsalzlösung und 30 Minuten in der Plethysmographiekammer bestand. Mäuse wurden dann innerhalb von 1 Woche nach dem letzten Tag der Gewöhnung getestet. Unbewohnte Mäuse wurden weder der Handhabung noch der Plethysmographenkammer ausgesetzt. Alle Mäuse waren naïve zu CNO und nur einmal verwendet.
Am Tag des Tests wurden Mäuse aus ihrem Heimkäfig genommen, gewogen und die Rektaltemperatur gemessen. Die Tiere wurden dann in eine durchströmte, temperaturkontrollierte (bei 30 ° C mit Wasser ummantelte) Plethysmographiekammer gebracht und für mindestens 20 min in Raumluft (21% O2 / 79% N2) akklimatisiert. Nach Akklimatisierung und Messung unter Raumluft wurde das Kammergas für 20 min auf ein hyperkapnisches Gemisch aus 5% CO2/21% O2/74% N2 umgestellt. Anschließend wurde Kammergas für 20 min wieder auf Raumluft umgeschaltet. Die Mäuse wurden kurz zur rektalen Temperaturmessung und intraperitonealen Injektion von CNO (National Institute of Mental Health Chemical Synthesis and Drug Supply Program) in Kochsalzlösung (1 oder 0,1 mg / ml) für eine effektive Konzentration von 10 bzw. 1 mg / kg entfernt. Das Tier wurde für weitere 20 min Raumluft, 20 min Hyperkapnie und 20 min Raumluft in die Kammer zurückgebracht. Das Tier wurde dann aus der Kammer entfernt und unmittelbar nach Beendigung des Experiments die Rektaltemperatur gemessen.
Flüssigchromatographie-Massenspektrometrie
Vierundzwanzig Wildtyp-Mäuse, gleichmäßig nach Geschlecht aufgeteilt, wurden gewogen und mit 10 mg / kg CNO, 1 mg / kg CNO, 0,1 mg / kg CNO oder Vehikel behandelt. Dreißig Minuten nach der Injektion wurden Blutproben mittels Herzpunktion entnommen und in BD-Mikrobehälter gegeben. Die Proben wurden bei 4 °C bei 13.500 U / min in einer Tischzentrifuge zentrifugiert und Überstände gesammelt. Serum und Gehirn wurden bis zur Extraktion bei -20 ° C gehalten.
HPLC-Grade Lösungsmittel Wasser, Acetonitril Chloroform und Methanol und Massenspektrometrie-Grade Ameisensäure wurden von Sigma-Aldrich (St. Louis, MO) erhalten. Eine Kalibrierlösung, die mehrere Kalibriermittel in einer Lösung aus Acetonitril, Trifluoressigsäure und Wasser enthielt, wurde von Agilent Technologies (Santa Cruz, Kalifornien) bezogen. Metaboliten und interne Standards, einschließlich N-Acetyl Asparaginsäure-d3, Tryptophan-15N2, Glutaminsäure-d5, Thymin-d4, Gibberellinsäure, trans-Zeatin, Jasmonsäure, 15N Anthranilsäure und Testosteron-d3 wurden von Sigma-Aldrich (St. Louis, MO) gekauft. Microtainer R SST TM wurde von Becton Dickinson (Franklin Lakes, NJ) erhalten.
Die Extraktion bestand aus 750 µl eiskaltem Methanol: Wasser (4: 1) mit 20 µl gespikten internen Standards, die jeder Gehirnprobe (50 mg) und Qualitätskontrollen zugesetzt und dann jeweils 1 min homogenisiert wurden. Dann wurden 750 µl 100% Acetonitril mit 20 µl gespikten internen Standards zu Waschprobe (100 µl) und Qualitätskontrollen gegeben und dann für 5 min beschallt. Alle Proben wurden bei 5.000 U/min für 10 min bei 4°C zentrifugiert. Der resultierende Überstand wurde gesammelt und 20 µl wurden in LC-MS injiziert.
Alle Proben wurden mit einem 6.490 Triple Quadrupole Mass Spectrometer (Agilent Technologies, Santa Clara, CA) in Verbindung mit einem HPLC-System (Agilent Technologies, Santa Clara, CA) durch Multiple Reaction Monitoring (MRM) analysiert. Pro nachgewiesenem Metaboliten wurden ungefähr 8-11 Datenpunkte erfasst. Die nachgewiesenen Metaboliten waren Clozapin, CNO und Norclozapin (N-Desmethylclozapin). Der ESI-positive Modus wurde in der Methode verwendet. Die HPLC-Säule war ACQUITYUPLC C18-Säule (100 Å, 1,8 µm und 2,1 mm × 100 mm. Milford, MA, USA) mit einer Flussrate von 0,5 ml/min.
Datenerfassung und -analyse
Plethysmographie
Plethysmographie Druckänderungen wurden mit einem Validyne DP45 Differenzdruckmessumformer und Referenzkammer sowie CD15 Trägerdemodulator gemessen und mit LabChartPro in Echtzeit aufgezeichnet. Die Wellenformen wurden offline mit LabChartPro und benutzerdefiniertem MATLAB-Code analysiert, um die Atemfrequenz (RR) und das Atemzugvolumen (VT) zu bestimmen (Ray et al., 2011), minute ventilation (VE) und Musteranalyse. Atemwellenformen wurden offline in Zeiten gesammelt, in denen das Tier in Ruhe war, und die Messwerte waren frei von Bewegungsartefakten. Ein Minimum von 1 min kumulative Daten, die aus mindestens 10 s langen Spuren der letzten 10 min eines bestimmten experimentellen Zustands zusammengestellt wurden, wurden analysiert. Der O2-Verbrauch wurde durch Vergleich der Gaszusammensetzung zwischen der Kalibrierung in einer leeren Kammer und der Live-Atmung unter Verwendung eines AEI-Sauerstoffsensors und -analysators bestimmt. Die Kammertemperatur wurde mit einem ThermoWorks MicroThermo 2 und einer Sonde ständig überwacht und mit LabChartPro in Echtzeit aufgezeichnet.
Poincaré-Messungen und Seufzer- und Apnoefrequenz wurden unter Verwendung von 1 min bewegungsfreien Spuren von jedem Atemzustand bestimmt. Seufzer wurden als Atemzug mit einer Amplitude definiert, die mindestens doppelt so groß war wie der durchschnittliche Atemzug. Apnoen wurden definiert als ein Interatmungsintervall (IBI), das mindestens doppelt so groß ist wie das durchschnittliche IBI. Der Variationskoeffizient (CV) von IBI und Amplitude wurde ebenfalls aus derselben 1-min-Trace-Zusammenstellung jedes Atemzustands berechnet (Standardfehler IBI oder Amplitude / Mittelwert IBI oder Amplitude).
Statistik
Plethysmographie
Ergebnisse (RR, VT, VE, VO2, VE / VO2, Anzahl der Apnoen und Seufzer sowie CVs von IBI und Amplitude) für Raumluft und hyperkapnische Daten wurden zwischen DBH-Cre verglichen; RC :: P_hM4D Kohorten und Geschwisterkontrollen unter Verwendung eines linearen Mixed-Effects-Regressionsmodells mit Tiertyp (experimentell vs. Kontrolle) und CNO-Verabreichung (vor vs. nach der Injektion) als feste Effekte und Tier-ID als zufälliger Effekt. Temperaturdaten wurden unter Verwendung eines linearen Mixed-Effects-Regressionsmodells mit Tiertyp (experimentell vs. Kontrolle) als fixem Effekt verglichen. Ein p < 0,05 wurde verwendet, um die statistische Signifikanz anzuzeigen, und einzelne Datenpunkte, Mittelwert und Standardfehler des Mittelwerts werden in allen Diagrammen angezeigt.
Flüssigkeitschromatographie-Massenspektrometrie
Die erhaltene Fläche unter dem Peak für jede Probe wurde durch die interne Kontrolle normalisiert und dann auf Fahrzeug, bevor statistische Analyse durchgeführt wurde. Der ungepaarte t-Test wurde verwendet, um die relative Häufigkeit von Clozapin und CNO in jedem Gewebe nach Konzentrationsgruppe zu vergleichen.
Ethikerklärung
Alle Experimente wurden vom Institutional Animal Care and Use Committee des Baylor College of Medicine genehmigt. Die Experimente entsprachen den nationalen Standards für die Pflege und Verwendung von Versuchstieren, die von der Association for Assessment and Accreditation of Laboratory Animal Care festgelegt wurden.
Autorenbeiträge
JS, FS-M, MC-M und RR konzipierten und gestalteten die Experimente. JS, FS-M und PZ führten die Experimente durch und trugen zur Analyse der Daten bei. JS, FS-M, VM, MC-M und RR schrieben das Papier.
Finanzierung
Diese Studie wurde unterstützt durch Zuschüsse R01HL130249 und R01HL130249-S1 vom National Heart, Lung, and Blood Institute; March of Dimes Basil O’Connor Award; und das McNair Medical Institute.
Interessenkonflikterklärung
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagung
Wir danken Dr. Shaila K. Mani und Benjamin Arenkiel für hilfreiche Gespräche. Wir danken auch dem Baylor College of Medicine Proteomics Core Facility für die Durchführung der Flüssigkeitschromatographie-Massenspektrometrie.
Amiel, J., Dubreuil, V., Ramanantsoa, N., Fortin, G., Gallego, J., Brunet, J.-F., et al. (2009). PHOX2B in der Atemkontrolle: Lehren aus dem kongenitalen zentralen Hypoventilationssyndrom und seinen Mausmodellen. Respir. In: Physiol. Neurobiol. 168, 125–132. doi: 10.1016/j.bzw.2009.03.005
CrossRef Volltext / Google Scholar
Andrews, N. und File, SE (1993). Der Umgang mit Ratten verändert die Verhaltenseffekte von Medikamenten im erhöhten Plus-Labyrinth-Angsttest. EUR. In: J. Pharmacol. 235, 109–112. doi: 10.1016/0014-2999(93)90827-5
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Armbruster, BN, Li, X., Pausch, MH, Herlitze, S. und Roth, BL (2007). Entwickeln Sie das Schloss so, dass es zum Schlüssel passt, um eine Familie von G-Protein-gekoppelten Rezeptoren zu erzeugen, die durch einen inerten Liganden potent aktiviert werden. Prok. Natl. Acad. Sci. USA 104, 5163-5168. doi: 10.1073/pnas.0700293104
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Ashby, CR und Wang, RY (1996). Pharmakologische Wirkungen des atypischen Antipsychotikums Clozapin: eine Überprüfung. Synapse 24, 349-394. doi: 10.1002/(SICI)1098-2396(199612)24:4<349:: AID-SYN5>3.0.CO ;2-D
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Bahia, C. M. C. d. S. und Pereira, J. S. (2015). Obstruktive Schlafapnoe und neurodegenerative Erkrankungen: eine bidirektionale Beziehung. Dement. Neuropsychol. 9, 9–15. doi: 10.1590/S1980-57642015DN91000003
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Biancardi, V., Bícego, KC, Almeida, MC und Gargaglioni, LH (2008). Locus coeruleus noradrenerge Neuronen und CO2 treiben die Atmung an. Pflugers Arch. – EUR. In: J. Physiol. 455, 1119–1128. ust-idnr.: 10.1007/s00424-007-0338-8
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Brust, RD, Corcoran, AE, Richerson, GB, Nattie, E. und Dymecki, SM (2014). Funktionelle und entwicklungspolitische Identifizierung eines molekularen Subtyps eines serotonergen Neurons im Gehirn, das auf die Regulierung der Atemdynamik spezialisiert ist. Zelle Rep. 9, 2152-2165. Ursprungsbezeichnung: 10.1016/j.celrep.2014.11.027
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Chang, W. H., Lin, S. K., Spur, H. Y., Wei, F. C., Hu, W. H., Lam, Y. W., et al. (1998). Reversibler Metabolismus von Clozapin und Clozapin-N-Oxid bei schizophrenen Patienten. Progrock. In: Neuro-Psychopharmacol. Biol. Psychiatrie 22, 723-739. doi: 10.1016/S0278-5846(98)00035-9
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Es sind keine frei zugänglichen ergänzenden Materialien verfügbar Zitation Chen, Y.-W., Das, M., Oyarzabal, E. A., Cheng, Q., Plummer, N. W., Smith, K. G., et al. (2018). Genetische Identifizierung einer Population von noradrenergen Neuronen, die an der Abschwächung stressbedingter Reaktionen beteiligt sind. Mol. Psychiatrie 1-16. artikelnummer: 10.1038/s41380-018-0245-8
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Dlouhy, BJ, Gehlbach, BK, Kreple, CJ, Kawasaki, H., Oya, H., Buzza, C., et al. (2015). Die Atmung wird gehemmt, wenn sich Anfälle auf die Amygdala ausbreiten und wenn die Amygdala stimuliert wird. In: J. Neurosci. 35, 10281–10289. doi: 10.1523/JNEUROSCI.0888-15.2015
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Feinstein, JS, Buzza, C., Hurlemann, R., Follmer, RL, Dahdaleh, NS, Coryell, WH, et al. (2013). Angst und Panik bei Menschen mit bilateralen Amygdala-Schäden. Nat. Neurowissenschaften. 16, 270–272. Ursprungsbezeichnung: 10.1038/nn.3323
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Fitton, A. und Heel, R. C. (1990). Clozapin. Eine Überprüfung seiner pharmakologischen Eigenschaften und therapeutischen Verwendung bei Schizophrenie. Drogen 40, 722-747. doi: 10.2165/00003495-199040050-00007
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Fleury Curado, T. A., Pho, H., Dergacheva, O., Berger, S., Lee, R., Freire, C., et al. (2018). Die Stummschaltung von hypoglossalen Motoneuronen führt bei mageren Mäusen zu Schlafstörungen. Front. Neurol. 9:962. doi: 10.3389/fneur.2018.00962
CrossRef Volltext / Google Scholar
Gargaglioni, L. H., Hartzler, L. K., und Putnam, R. W. (2010). Der Locus coeruleus und zentrale Chemosensitivität. Respir. In: Physiol. Neurobiol. 173, 264–273. doi: 10.1016/j.bzw.2010.04.024
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Es sind keine frei zugänglichen ergänzenden Materialien verfügbar Zitation Gomez, J. L., Bonaventura, J., Lesniak, W., Sysa-Shah, P., Rodriguez, L. A., et al. (2017). Chemogenetik ergab: Dreaddocks und Aktivierung über konvertiertes Clozapin. Wissenschaft 357, 503-507. doi: 10.1126/Wissenschaft.aan2475
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
J. M., Gautam, D., Scarselli, M., Ruiz de Azua, I., Li, JH, Rosemond, E., et al. (2009). Ein chemisch-genetischer Ansatz zur Untersuchung der G-Protein-Regulation der Betazellfunktion in vivo. Prok. Natl. Acad. Sci. USA 106, 19197-19202. doi: 10.1073/pnas.0906593106
Querverweis Volltext / Google Scholar
Hakim, F., Gozal, D. und Kheirandish-Gozal, L. (2012). Sympathische und katecholaminerge Veränderungen bei Schlafapnoe mit besonderem Schwerpunkt auf Kindern. Front. Neurol. 3:7. doi: 10.3389/fneur.2012.00007
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Hennessy, ML, Corcoran, AE, Brust, RD, Chang, Y., Nattie, EE und Dymecki, SM (2017). Die Aktivität von Tachykinin1-exprimierenden Pet1-Raphe-Neuronen moduliert den respiratorischen Chemoreflex. In: J. Neurosci. 37, 1807–1819. doi: 10.1523/JNEUROSCI.2316-16.2016
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Huckstepp, RTR, Cardoza, KP, Henderson, LE und Feldman, JL (2015). Rolle der parafazialen Kerne bei der Kontrolle der Atmung bei erwachsenen Ratten. In: J. Neurosci. 35, 1052–1067. doi: 10.1523/JNEUROSCI.2953-14.2015
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Ilg, A.-K., Enkel, T., Bartsch, D., and Bähner, F. (2018). Verhaltenseffekte von akutem systemisch niedrig dosiertem Clozapin bei Wildtyp-Ratten: Implikationen für die Verwendung von EDS in den Verhaltensneurowissenschaften. Front. Verhalten. Neurowissenschaften. 12:173. doi: 10.3389/fnbeh.2018.00173
CrossRef Volltext / Google Scholar
Isom, G. E. und Elshowihy, R. M. (1982). Wechselwirkung von akutem und chronischem Stress mit der Atmung: modifikation durch Naloxon. Pharmacol. Biochem. Verhalten. 16, 599–603. doi: 10.1016/0091-3057(82)90422-1
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Jann, MW, Lam, YW und Chang, WH (1994). Schnelle Bildung von Clozapin bei Meerschweinchen und Menschen nach Clozapin-N-Oxid-Verabreichung. Bogen. Int. Pharmacodyn. Ther. 328, 243–250.
PubMed Abstract / Google Scholar
Joober, R. (2010). Clozapin: ein ausgeprägtes, wenig verstandenes und wenig genutztes Molekül. J. Psychiatrie Neurowissenschaften. 35, 147–149. Ursprungsbezeichnung: 10.1503/jpn.100055
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Kinkead, R., Dupenloup, L., Valois, N. und Gulemetova, R. (2001). Stressinduzierte Abschwächung der hyperkapnischen Beatmungsreaktion bei wachen Ratten. In: J. Appl. In: Physiol. 90, 1729–1735. doi: 10.1152/jappl.2001.90.5.1729
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Klein, D. F. (1993). Falsche Erstickungsalarme, spontane Panik und verwandte Zustände. Eine integrative Hypothese. Bogen. Psychiatrie 50, 306-317. doi: 10.1001/archpsyc.1993.01820160076009
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Korsak, A., Sheikhbahaei, S., Machhada, A., Gourine, A. V. und Huckstepp, R. T. R. (2018). Die Rolle von parafazialen Neuronen bei der Kontrolle der Atmung während des Trainings. Sci. 8:400. ust-IDNR.: 10.1038/s41598-017-17412- z
CrossRef Volltext / Google Scholar
Lapin, I. P. (1995). Nur Kontrollen: Wirkung von Handhabung, Scheininjektion und intraperitonealer Injektion von Kochsalzlösung auf das Verhalten von Mäusen in einem erhöhten Plus-Labyrinth. In: J. Pharmacol. Toxicol. Methoden 34, 73-77. doi: 10.1016/1056-8719(95)00025-D
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Lavezzi, A. M., Alfonsi, G. und Matturri, L. (2013). Pathophysiologie des menschlichen Locus coeruleus-Komplexes bei plötzlichem unerklärlichem Tod des Fötus / Neugeborenen. Neurol. Entschließung 35, 44-53. doi: 10.1179/1743132812Y.0000000108
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
MacLaren, DAA, Browne, RW, Shaw, JK, Krishnan Radhakrishnan, S., Khare, P., España, RA, et al. (2016). Clozapin-N-Oxid-Verabreichung erzeugt Verhaltenseffekte bei Langzeit-Ratten: Implikationen für die Gestaltung von DREADD-Experimenten. eNeuro 3, 1-14. doi: 10.1523/ENEURO.0219-16.2016
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Es sind keine frei zugänglichen ergänzenden Materialien verfügbar Zitation Madisen, L., Zwingman, T. A., Sunkin, S. M., Oh, S. W., Zariwala, H. A., Gu, H., et al. (2010). Ein robustes Cre-Reporting- und Charakterisierungssystem mit hohem Durchsatz für das gesamte Mausgehirn. Nat. Neurowissenschaften. 13, 133–140. Ursprungsbezeichnung: 10.1038/nn.2467
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Mahler, S. V. und Aston-Jones, G. (2018). CNO böse? Überlegungen zur Verwendung von Dreadds in den Verhaltensneurowissenschaften. Neuropsychopharmakologie 43, 934-936. doi: 10.1038/KKW.2017.299
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Manvich, D. F., Webster, K. A., Foster, S. L., Farrell, M. S., Ritchie, J. C., Porter, J. H., et al. (2018). Der CMD-Agonist Clozapin-N-Oxid (CNO) wird zu Clozapin reverse-metabolisiert und erzeugt Clozapin-ähnliche interozeptive Stimuluseffekte bei Ratten und Mäusen. Sci. 8, 3840. ust-IDNR.: 10.1038/s41598-018-22116- z
CrossRef Volltext / Google Scholar
Misslin, R., Herzog, F., Koch, B. und Ropartz, P. (1982). Auswirkungen der Isolierung, Handhabung und Neuheit auf die Hypophysen-Nebennieren-Reaktion in der Maus. Psychoneuroendokrinologie 7, 217-221. doi: 10.1016/0306-4530(82)90015-4
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Nakamura, A., Zhang, W., Yanagisawa, M., Fukuda, Y. und Kuwaki, T. (2007). Vigilanzzustandsabhängige Abschwächung von hyperkapnischem Chemoreflex und übertriebener Schlafapnoe bei Orexin-Knockout-Mäusen. In: J. Appl. In: Physiol. 102, 241–248. doi: 10.1152/japplphysiol.00679.2006
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Obonai, T., Yasuhara, M., Nakamura, T. und Takashima, S. (1998). Veränderung der Katecholamin-Neuronen im Hirnstamm von Opfern des plötzlichen Kindstods. Pädiatrie 101, 285-288. doi: 10.1542/peds.101.2.285
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Ozawa, Y., Takashima, S. und Tada, H. (2003). Alpha2-adrenerge Rezeptor-Subtyp-Veränderungen im Hirnstamm beim plötzlichen Kindstod. Frühes Summen. Dev. 75 (Suppl.), S129–S138. doi: 10.1016/j.pathophys.2004.01.015
CrossRef Volltext / Google Scholar
Padovan-Hernandez, Y. und Knackstedt, LA (2018). Dosisabhängige Reduktion der kokaininduzierten Fortbewegung durch Clozapin-N-Oxid bei Ratten mit Kokain-Selbstverabreichung in der Vorgeschichte. Neurowissenschaften. Lett. 674, 132–135. doi: 10.1016/j.neulet.2018.03.045
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Ramanantsoa, N., Hirsch, M.-R., Thoby-Brisson, M., Dubreuil, V., Bouvier, J., Ruffault, P.-L., et al. (2011). Atmung ohne CO (2) -Chemosensitivität bei bedingten Phox2b-Mutanten. In: J. Neurosci. 31, 12880–12888. doi: 10.1523/JNEUROSCI.1721-11.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
Raper, J., Morrison, R. D., Daniels, J. S., Howell, L., Bachevalier, J., Wichmann, T., et al. (2017). Metabolism and distribution of clozapine-N-oxide: implications for nonhuman primate chemogenetics. ACS Chem. Neurosci. 8, 1570–1576. doi: 10.1021/acschemneuro.7b00079
PubMed Abstract | CrossRef Full Text | Google Scholar
Ray, R. S., Corcoran, A. E., Brust, R. D., Soriano, L. P., Nattie, E. E., and Dymecki, S. M. (2013). Egr2-Neuronen steuern die erwachsene Atmungsreaktion auf Hyperkapnie. Brain Res. 1511, 115-125. doi: 10.1016/j.brainres.2012.12.017
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Es sind keine frei zugänglichen ergänzenden Materialien verfügbar Zitation Ray, R. S., Corcoran, A. E., Brust, R. D., Kim, J. C., Richerson, G. B., Nattie, E., et al. (2011). Beeinträchtigte Atem- und Körpertemperaturkontrolle bei akuter serotonerger Neuronenhemmung. Wissenschaft 333, 637-642. doi: 10.1126/Wissenschaft.1205295
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Rjabinin, A. E., Wang, Y. M., und Finn, D. A. (1999). Unterschiedliche Fos-Immunreaktivität nach wiederholter Handhabung und Injektionsstress bei zwei Inzuchtstämmen von Mäusen. Pharmacol. Biochem. Verhalten. 63, 143–151. ust-idnr.: 10.1016/S0091-3057(98)00239-1
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Snyder, B., Shell, B., Cunningham, JT und Cunningham, RL (2017). Chronische intermittierende Hypoxie induziert oxidativen Stress und Entzündungen in Hirnregionen, die mit Neurodegeneration im Frühstadium assoziiert sind. In: Physiol. Rep. 5, 1-13. doi: 10.14814/phy2.13258
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Sun, JJ, Huang, TW, Neul, JL und Ray, RS (2017). Embryonale Hinterhirnmusterungsgene beschreiben unterschiedliche kardiorespiratorische und metabolische homöostatische Populationen im Erwachsenenalter. Sci. 7:9117. ust-IDNR.: 10.1038/s41598-017-08810-4
CrossRef Volltext / Google Scholar
Sun, JJ und Ray, RS (2017). Tg (Th-Cre) FI172Gsat (Th-Cre) definiert Neuronen, die für vollständige hyperkapnische und hypoxische Reflexe erforderlich sind. Biol. Öffnen 6, 1200-1208. Ursprungsbezeichnung: 10.1242/bio.026823
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Taugher, RJ, Lu, Y., Wang, Y., Kreple, CJ, Ghobbeh, A., Fan, R., et al. (2014). Der Bettkern der Stria terminalis ist entscheidend für angstbedingtes Verhalten, das durch CO2 und Azidose hervorgerufen wird. In: J. Neurosci. 34, 10247–10255. doi: 10.1523/JNEUROSCI.1680-14.2014
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Valentino, RJ, und Van Bockstaele, E. (2008). Konvergente Regulation der Locus coeruleus-Aktivität als adaptive Reaktion auf Stress. EUR. J. Pharmacol. 583, 194–203. geburtsdatum: 10.1016/j.ejphar.2007.11.062
CrossRef Volltext / Google Scholar
Verbraecken, J. und McNicholas, WT (2013). Atemmechanik und Beatmungskontrolle bei Überlappungssyndrom und Adipositas-Hypoventilation. Respir. 14:132. doi: 10.1186/1465-9921-14-132
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Viemari, J.-C. (2008). Noradrenerge Modulation des respiratorischen neuronalen Netzwerks. Respir. In: Physiol. Neurobiol. 164, 123–130. doi: 10.1016/j.bzw.2008.06.016
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Winter, A., Ahlbrand, R., Naik, D. und Sah, R. (2017). Differentielle Verhaltensempfindlichkeit gegenüber der Inhalation von Kohlendioxid (CO2) bei Ratten. Neurowissenschaften 346, 423-433. doi: 10.1016/j.Neurowissenschaften.2017.01.003
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Ziemann, A. E., Allen, J. E., Dahdaleh, N. S., Drebot, I. I., Coryell, M. W., Wunsch, AM, et al. (2009). Die Amygdala ist ein Chemosensor, der Kohlendioxid und Azidose erkennt, um Angstverhalten hervorzurufen. Cell 139, 1012–1021. doi: 10.1016/j.cell.2009.10.029
PubMed Abstract | CrossRef Full Text | Google Scholar