- Einleitung
- Materialien und Methoden
- Studiendesign
- Einschlusskriterien
- Diagnose
- Operationsgruppe
- Strahlentherapiegruppe
- Klassifizierung von Tumoren
- Operationsprogramm
- Statistische Analyse
- Ergebnisse
- Operationsgruppe
- Teilnehmer
- Die Art der Tumoren
- Chirurgische Ergebnisse
- Strahlentherapiegruppe
- Symptomatische Ergebnisse
- Radiologische Endpunkte
- Weitere Behandlung
- Schlussfolgerung
- Erklärung zur Datenverfügbarkeit
- Ethikerklärung
- Autorenbeiträge
- Finanzierung
- Interessenkonflikt
Einleitung
Cerebellopontine angle Meningiome machen 6-15% der Tumoren in der Cerebellopontine angle Region aus (1). Sie zeichnen sich durch die tiefe Tumorlokation, das enge Operationsfeld und die Nähe zum Hirnstamm aus, mehrere Paare von (V–XI) Hirnnerven (2). Gegenwärtig ist die chirurgische Behandlung die erste Wahl für große Kleinhirn-Winkel-Meningeome, während kleine Kleinhirn-Winkel-Meningeome immer durch stereotaktische Strahlentherapie, Pharmakotherapie und experimentelle Therapie behandelt werden (3). In den letzten Jahren haben viele Studien ergeben, dass die stereotaktische Strahlentherapie die Einschränkungen einer niedrigen Tumorkontrollrate, eines Hirnödems nach der Behandlung und einer Gewebeadhäsion aufwies, was die weiteren Behandlungen behinderte (4). Daher wenden sich immer mehr kleine Cerebellopontin-Winkel-Meningeom-Patienten einer chirurgischen Behandlung zu.
Materialien und Methoden
Studiendesign
Es wurde eine retrospektive Analyse von kleinen Cerebellopontin-Winkel-Meningeom-Patienten durchgeführt. Diese Patienten wurden zwischen Januar 2010 und Dezember 2019 in der neurochirurgischen Abteilung des Ersten angeschlossenen Krankenhauses der Soochow University operiert. Diese Patienten wurden als Operationsgruppe eingestuft. Wir haben auch die Literatur zur stereotaktischen Strahlentherapie von kleinen Cerebellopontin-Winkel-Meningeomen aus den letzten 10 Jahren überprüft. Die klinischen Daten von Patienten in der Literatur wurden gesammelt und analysiert, und diese Patienten wurden als Strahlentherapiegruppe klassifiziert. Wir analysierten die Unterschiede zwischen den beiden Gruppen, einschließlich der Art der Tumoren, Symptome vor- und Nachbehandlungen, neurologische Defizite und Prognose. Schließlich untersuchten wir die chirurgischen Ergebnisse von kleinen Cerebellopontin-Winkel-Meningeomen und fassten die chirurgischen Erfahrungen zusammen.
Einschlusskriterien
Diagnose
Um Meningeome von anderen Cerebellopontin-Winkeltumoren wie Akustikusneurinomen und Gliomen zu unterscheiden, wurden alle Patienten sowohl radiologisch als auch histopathologisch diagnostiziert Untersuchung, einschließlich MRT, CT, PET und SSTR2-Liganden. Sowohl das Duralschwanzzeichen im MRT als auch keine Ausdehnung des inneren Gehörgangs im CT sind die Hauptunterschiedspunkte zwischen Meningeomen des Kleinhirnpontinwinkels und Akustikusneurinomen. Um Cerebellopontin-Winkel-Meningeome von Gliomen und Metastasen zu unterscheiden, wurden die Patienten konventionell MR-spektroskopisch untersucht (5). In Bezug auf histologische Aspekte wurde auch die immunhistochemische Analyse konventionell getestet, wie HE-Färbung, Vimentin-Färbung, EMA-Färbung, Ki-67 und CD56.
Operationsgruppe
(1) Die Patienten mit Kleinhirnpontinwinkel-Meningeom wurden zwischen Januar 2010 und Dezember 2019 operiert, (2) Tumorvolumen ≤ 8 cm3, (3) keine verwandte Behandlung vor der Operation, (4) keine anderen Erkrankungen des Nervensystems und (5) während der Nachsorge in Kontakt gehalten.
Strahlentherapiegruppe
(1) Die Patienten mit Kleinhirn-Pontonwinkel-Meningeom wurden aus der Literatur zur stereotaktischen Strahlentherapie entnommen, die zwischen Januar 2010 und Dezember 2019 veröffentlicht wurde, (2) Die eingeschlossenen Patienten hatten vollständige Daten vor und nach der Behandlung, (3) keine anderen Erkrankungen des Nervensystems und (4) blieben während der Nachsorge in Kontakt.
Das Follow-up bestand darin, die Patienten routinemäßig zu besuchen und in den ersten 3 Jahren nach der Behandlung alle 3-6 Monate MRT- oder CT-Tests durchzuführen und dann jedes Jahr zu besuchen und zu testen.
Klassifizierung von Tumoren
Basierend auf der zentralen Stelle der duralen Anhaftung wurden Kleinhirn-Winkel-Meningeome in drei Typen eingeteilt (6): anteriore Tumoren waren solche, die aus dem Tentorium cerebelli oder dem Felsenbein Dura anterior stammten der innere Gehörgang; mittlere Tumoren waren solche, die aus der Dura mater im inneren Gehörgang stammten; posteriore Tumoren waren solche, die aus den Sigmoid- und Querhöhlen oder dem Felsenbein Dura posterior stammten der innere Gehörgang (Abbildung 1).
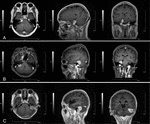
Abbildung 1. Drei Arten von kleinen Cerebellopontin-Winkel-Meningeomen. (anterior. (B) Mitte. (C) Posterior.
Basierend auf der Tumorpathologie wurden Kleinhirn-Winkel-Meningeome in drei Grade eingeteilt: WHO-Grad I (geringes Rezidiv und geringes invasives Wachstum), WHO-Grad II (hohes Rezidiv und hohes invasives Wachstum) und WHO-Grad III (starkes Rezidiv und metastasieren systemisch).
Basierend auf dem Grad der Tumorresektion wurden Patienten mit Kleinhirn-Winkel-Meningeomen in fünf Grade eingeteilt: Simpson Grad I: Totalresektion des Meningeoms, des Duralansatzes und des Schädels; Simpson Grad II: Totalresektion des Meningeoms und Elektrokoagulation oder Laserbehandlung mit Dura-Attachment; Simpson Grad III: Totalresektion von Meningeomen und keine Behandlung mit Dura-Attachment und Schädel; Simpson Grad IV: Teilresektion von Meningeomen; Simpson Grad V: Dekompression und Tumorbiopsie.
Tumorprogression und -regression wurden als Volumenänderungen von mehr als 15% bei radiologischer Untersuchung definiert.
Operationsprogramm
Alle Patienten verwendeten den suboccipitalen Retrosigmoid-Ansatz. Auf der betroffenen Seite wurde ein suboccipitaler retrosigmoidaler gerader Einschnitt von etwa 8-10 cm vorgenommen. Der lange Durchmesser des ovalen Knochenfensters betrug 5 cm und der kurze Durchmesser 3,5 cm. Das Knochenfenster bis zum Sinus transversum, lateral zur Mastoidwurzel, legt den Winkel zwischen Sigma und Sinus transversum frei. Schneiden Sie die Dura, strecken Sie das Kleinhirn, öffnen Sie die Cisterna magna und geben Sie die Liquor cerebrospinalis frei. Schließlich wurde das Meningeom des Kleinhirnpontinwinkels vollständig reseziert, wobei darauf geachtet wurde, die Vena petrosa, den Nervus trigeminus und den Nervus abducens zu schützen. Während der Operation wurde eine elektrophysiologische Überwachung verwendet, um die Gesichts- und akustischen Nerven zu überwachen.
Statistische Analyse
Alle statistischen Analysen wurden mit SPSS Version 22.0 durchgeführt. Die parametrischen kontinuierlichen Variablen wurden als Mittelwert ± Standardabweichung angegeben. Die nichtparametrischen Variablen wurden als Median mit dem Bereich angegeben. Klinische Ergebnisse und Anzeichen und Symptome wurden als Daten aus drei Kategorien berichtet (Verbesserung oder Vergrößerung, keine Veränderung, Verschlechterung oder Abnahme). Der unabhängige Stichproben-T-Test wurde für zwei Datenkategorien durchgeführt, und ANOVA wurde für Daten mit drei Kategorien durchgeführt. Der Chi-Quadrat-Test wurde durchgeführt, um nominell verteilte kategoriale Variablen zu vergleichen. Die logistische Regressionsanalyse wurde für multivariate Analysen durchgeführt. P-Werte von weniger als 0,05 wurden als statistisch signifikant angesehen.
Ergebnisse
Operationsgruppe
Teilnehmer
Insgesamt wurden 162 Patienten mit Kleinhirnpontinwinkel-Meningeom eingeschlossen, darunter 53 Männer und 109 Frauen mit einem Durchschnittsalter von 54,85 Jahren (21-89 Jahre). Die präoperativen Symptome waren Kopfschmerzen und Schwindel (96), Hörverlust und Tinnitus (48), Gesichtsgefühl und Lähmung (29), Gehinstabilität und Ataxie (28), Heiserkeit, schlechter Hustenreflex (16). Es gab 77 Patienten mit zwei oder mehr Symptomen und 64 Patienten ohne Symptome vor der Diagnose.
Die Art der Tumoren
Das Tumorvolumen reichte von 1,042 bis 8,161 cm3 mit einem Durchschnitt von 4,710 cm3; 72 Patienten hatten vordere Tumoren, 41 Patienten hatten mittlere Tumoren und 49 Patienten hatten hintere Tumoren; 148 Patienten hatten WHO-Grad-I-Tumoren und 14 Patienten hatten WHO-Grad-II-Tumoren.
Chirurgische Ergebnisse
Es gab 152 Fälle von Simpson Grad I und 10 Fälle von Simpson Grad II, 41 Fälle von postoperativer Symptomlinderung, 110 Fälle ohne signifikante Veränderung, 11 Fälle von Verschlimmerung oder neuen Symptomen.
Strahlentherapiegruppe
Insgesamt wurden 1644 Patienten mit Kleinhirnpontinwinkel-Meningeom eingeschlossen, darunter 335 Männer und 1309 Frauen (Tabelle 1).
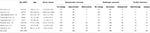
Tabelle 1. Eigenschaften von Patienten in Literaturen.
Von der Strahlentherapiegruppe hatten 971 Patienten (59, 1%) nach der Behandlung keine signifikante Veränderung der Symptome, 546 Patienten (33, 2%) zeigten eine Verbesserung der Symptome und 127 Patienten (7, 7%) zeigten eine Verschlechterung der Symptome oder entwickelten neue neurologische Symptome.
Es gab 151 Patienten (9.2%) in der Strahlentherapiegruppe mit Tumorrezidiv während der Nachsorge.
54 Patienten (3,3%) erhielten eine zweite stereotaktische Strahlentherapie und 62 Patienten (3,8%) wurden während der Nachsorge operiert.
Symptomatische Ergebnisse
Von der Operationsgruppe hatten 102 Patienten (63,0%) keine signifikante Veränderung der Symptome nach der Operation, 49 Patienten (30,2%) zeigten eine Verbesserung der Symptome und 11 Patienten (6,8%) zeigten eine Verschlechterung der Symptome oder entwickelten neue neurologische Symptome. Es gab keinen signifikanten Unterschied in der Symptomverschlechterungsrate zwischen der Operationsgruppe und der Strahlentherapiegruppe, mit Ausnahme von Andrew et al.Studie (Tabelle 2). Die Symptomverschlechterungsrate von Andrew et al. war signifikant höher als die der Operationsgruppe.
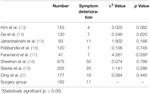
Tabelle 2. Symptomverschlechterungsrate.
Radiologische Endpunkte
Es gab 10 Patienten (6,2%) in der Operationsgruppe mit Tumorrezidiv während der Nachbeobachtung. Wir fanden keinen signifikanten Unterschied in der Tumorvergrößerungsrate zwischen der Operationsgruppe und der Strahlentherapiegruppe, mit Ausnahme von Robert et al. (Tabelle 3). Die Tumorvergrößerungsrate von Robert et al. war signifikant höher als die der Operationsgruppe.
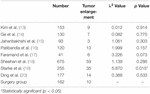
Tabelle 3. Tumorvergrößerungsrate.
Weitere Behandlung
In der Operationsgruppe gab es einen Patienten (0,6%), der sich einer zweiten Resektion unterzog, und 12 Patienten (7,4%) erhielten während der Nachsorge eine stereotaktische Strahlentherapie. Wir fanden keinen signifikanten Unterschied in der weiteren Behandlungsrate zwischen der Operationsgruppe und der Strahlentherapiegruppe, mit Ausnahme von Kyung et al. und Andrew et al. (Tabelle 4). Die weitere Behandlungsrate von Kyung et al. war signifikant niedriger als die der Operationsgruppe, während die weitere Behandlungsrate von Andrew et al. war signifikant höher als die der Operationsgruppe.
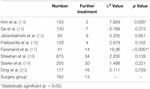
Tabelle 4. Weitere Behandlung.
In der Operationsgruppe waren WHO-Grad II und Simpson-Grad II Risikofaktoren für eine weitere Behandlung (Tabelle 5).

Tabelle 5. Risikofaktoren für weitere Behandlungen.
Die Wahl der Operation oder stereotaktischen Strahlentherapie hängt von der allgemeinen Situation der Patienten und der Art der Tumoren ab (7). Die meisten Cerebellopontin-Winkel-Meningeome gehören zu gutartigen Tumoren. Die chirurgische Wirkung von Meningeomen des Kleinhirnpontinwinkels ist immer zufriedenstellend, und die Raten sowohl der postoperativen Symptomverschlechterung als auch der Tumorvergrößerung sind niedriger als bei anderen Tumoren des Nervensystems. Die Kompression des Hirnstamms und des Kleinhirns ist jedoch ein häufiges Auftreten von Kleinhirn-Winkel-Meningeomen, insbesondere bei Patienten mit großen Kleinhirn-Winkel-Meningeomen. Eine vollständige oder teilweise Resektion kann das Risiko von Komplikationen erheblich reduzieren. Daher ist die Operation die beste Wahl für Patienten mit großen Cerebellopontin-Winkel-Meningeomen. Bei kleinen Cerebellopontin-Winkel-Meningeomen ist die stereotaktische Strahlentherapie, einschließlich Gamma Knife, Cyber Knife und anderer Arten von Linearbeschleunigern (8), allgemein als erste Wahl anerkannt. Mit der Entwicklung der medizinischen Behandlung und der Popularisierung der MRT wird die frühzeitige Diagnose eines Kleinhirn-Winkel-Meningeoms im kleinvolumigen oder asymptomatischen Stadium möglich. Eine frühzeitige Diagnose und Behandlung verbessert die Prognose des Kleinhirn-Winkel-Meningeoms erheblich und führt zu einer Verwechslung der Wahl zwischen Operation und stereotaktischer Strahlentherapie bei Kleinhirn-Winkel-Meningeomen. In Anbetracht des Ödems und der Adhäsion von Hirngewebe nach stereotaktischer Strahlentherapie, die die weitere Operation behinderten, haben immer mehr Studien frühe chirurgische Behandlungen unterstützt.
In Bezug auf die Linderung präoperativer Symptome war die Rate der Symptomverschlechterung in der Operationsgruppe ähnlich oder sogar niedriger als in der Strahlentherapiegruppe. Im Vergleich zur stereotaktischen Strahlentherapie kann eine chirurgische Behandlung manchmal zu besseren Ergebnissen bei der Linderung präoperativer Symptome führen. Ödeme des peripheren Hirngewebes sind eine häufige Nebenwirkung der stereotaktischen Strahlentherapie. Eine Schwellung des Hirngewebes verschlimmert die Spannung und Kompression der Nerven, weshalb sich die Symptome nach einer stereotaktischen Strahlentherapie verschlimmern. Um Nervenverletzungen zu reduzieren und die Verschlechterung der Symptome zu lindern, müssen die Bediener das Gehirngewebe, die Nerven und die Blutgefäße während der Operation sorgfältig schützen. Im Vergleich zu normalen Kleinhirn-Winkel-Meningeomen erfordert eine chirurgische Operation an kleinen Kleinhirn-Winkel-Meningeomen mehr Schutz für Nerven und Blutgefäße, und eine neuroelektrophysiologische Überwachung während des gesamten Operationsprozesses wird als wesentlich erachtet, was zu einer geringeren Rate der Symptomverschlechterung in der Operationsgruppe beiträgt. Die häufigste klinische Manifestation von kleinen Cerebellopontin-Winkel-Meningeomen sind funktionelle Defekte der Gesichts- und Hörnerven. Daher ist der Schutz der Gesichts- und Hörnerven ein wichtiger Punkt der Operation. Verschiedene Arten von Cerebellopontin-Winkel-Meningeomen drücken die Gesichts- und Hörnerven in verschiedene Positionen (9). So ist der erste Schritt der kleinen cerebellopontine Winkel Meningeome Chirurgie Lokalisierung der Gesichts- und Hörnerven. Anteriore Tumoren drücken im Allgemeinen die Gesichts- und Hörnerven zur lateralen oder lateralen inferioren Seite. Posteriore Tumoren drücken im Allgemeinen die Gesichts- und Hörnerven nach medial oder medial inferior. Mittlere Tumoren drücken im Allgemeinen die Gesichts- und Hörnerven vertikal (Abbildung 2). Aufgrund der Kompression des Tumors sind die Gesichts- und Hörnerven oft länglich und werden dünn und verfärbt.
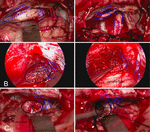
Abbildung 2. (A) Vordere Tumoren drücken den Gesichts- und Hörnerv zur lateralen Seite. (B) Mittlere Tumoren drücken den Nerv zum ventralen Aspekt. (C) Posteriore Tumoren drücken den Nerv nach medial inferior.
Während der Operation muss der Operateur auf eine scharfe Trennung bestehen, wenn der Tumor von den Gesichts- und Hörnerven getrennt wird. Die Traktion der Gesichts- und Hörnerven und des Kleinhirns sollte minimiert werden. Die Nährstoffgefäße um die Gesichts- und Hörnerven sollten so weit wie möglich erhalten bleiben. Obwohl die Gesichts- und Hörnerven nach der Operation anatomisch erhalten sind, besteht bei vielen Patienten immer noch ein Verlust der Nervenfunktion, der auf das invasive Wachstum von Tumoren, die intraoperative Traktion und die durch Elektrokoagulation verursachte Wärmeleitungsverletzung zurückzuführen sein kann (10). Eine effektive intraoperative neuroelektrophysiologische Überwachung kann die Neuronenverletzung verringern, indem die rechtzeitige Lokalisierung der Gesichts- und Hörnerven ermöglicht wird, wodurch die Rate der Nervenfunktionserhaltung erhöht wird.
In Bezug auf die Hemmung der Tumorprogression ist die Tumorrezidivrate in der Operationsgruppe ähnlich oder sogar niedriger als die Tumorvergrößerungsrate in der Strahlentherapiegruppe. Im Vergleich zur stereotaktischen Strahlentherapie kann eine chirurgische Behandlung zu besseren Ergebnissen bei der Hemmung des Tumorfortschritts führen. Die stereotaktische Strahlentherapie, die sich hauptsächlich auf Gamma Knife und Cyber Knife bezieht, unterdrückt das Fortschreiten des Tumors, indem sie Tumorzellen abtötet. Das Ziel der stereotaktischen Strahlentherapie befindet sich im Allgemeinen im Zentrum von Tumoren, und seine Dosis nimmt mit der Entfernung vom Tumorzentrum ab. Obwohl die periphere Dosiserhöhungstechnologie in den letzten Jahren aufgetaucht ist, besteht immer noch das Problem der unvollständigen Inaktivierung der Tumorgrenze, was auch zu einer Erhöhung der Tumorvergrößerungsrate in der Strahlentherapiegruppe führt (11). Für die chirurgische Behandlung von kleinen Cerebellopontin-Winkel-Meningeomen ist die totale Resektion des Tumors, der Duralbefestigung und des Schädels der Schlüssel zur Verhinderung eines erneuten Auftretens des Tumors. Nach dem chirurgischen Prinzip muss der Bediener den Duralansatz und den Schädel nach der Tumorresektion resezieren, um Simpson-Grad I zu erreichen. Wenn der Duralansatz und der Schädel unvollständig reseziert wurden, ist die Elektrokoagulation unerlässlich, um die Möglichkeit eines erneuten Auftretens des Tumors zu verringern und einen Grad II. Mit der Entwicklung von Hochfrequenzlaserskalpellen und anderen Mikroinstrumenten wird die chirurgische Behandlung des Duralansatzes und der Schädelresektion immer standardisierter. Die Gesamttumorresektionsrate kleiner Kleinhirnpontinwinkel-Meningeome nimmt zu und die Tumorrezidivrate nimmt von Jahr zu Jahr ab.
Viele Strahlentherapiestudien haben berichtet, dass das Wiederauftreten kleiner cerebellopontineraler Winkelmeningeome mit der Pathologie der Tumoren zusammenhängt. Meningeome des WHO-Grades II treten häufiger auf als Meningeome des WHO-Grades I, was mit dem Merkmal eines hohen invasiven Wachstums zusammenhängt. Die stereotaktische Strahlentherapie kann jedoch das Tumorgewebe nicht erhalten, um die Pathologie des Tumors direkt zu untersuchen. Daher wird der Grad der mit Strahlentherapie behandelten Zerebellopontinwinkel-Meningeome hauptsächlich aus der bildgebenden Untersuchung abgeleitet, die ungewiss ist. Im Gegensatz zur stereotaktischen Strahlentherapie kann die Operation Tumorgewebe direkt zur pathologischen Untersuchung gewinnen und die weitere Behandlung durch die genauen pathologischen Untersuchungsergebnisse leiten. In der vorliegenden Studie waren WHO Grad II und Simpson Grad II die Risikofaktoren für ein Wiederauftreten des Tumors nach der Operation. Daher müssen Patienten mit WHO-Grad II oder Simpson-Grad II, die sich einer Operation unterziehen, frühzeitig weitere Behandlungen erhalten, anstatt auf das Wiederauftreten von Tumoren zu warten. Dies ist auch der Grund, warum die Rezidivrate in der Operationsgruppe etwas niedriger war als die Tumorvergrößerungsrate in der Strahlentherapiegruppe.
In Bezug auf weitere Behandlungen war die weitere Behandlungsrate in der Operationsgruppe ähnlich oder sogar niedriger als in der Strahlentherapiegruppe. Daher haben Patienten mit chirurgischer Behandlung im Vergleich zur stereotaktischen Strahlentherapie möglicherweise eine geringere Wahrscheinlichkeit für weitere Behandlungen. In: Kyung et al.in der Studie waren die Probanden asymptomatische Patienten mit kleinen Cerebellopontin-Winkel-Meningeomen. Ein Fehlen von Symptomen oder relativ milde Symptome könnten das subjektive Verlangen der Patienten nach einer Behandlung signifikant reduzieren, weshalb die weitere Behandlungsrate in Kyung et al. war niedriger als in der chirurgischen Gruppe berichtet. In der Strahlentherapiegruppe gab es keinen signifikanten Unterschied zwischen der Anzahl der Patienten, die sich für eine weitere Strahlentherapie entschieden, und der Anzahl der Patienten, die sich einer Operation zuwandten. In der Operationsgruppe gab es 1 Patient (0,6%), der sich einer zweiten Resektion unterzog, und 12 Patienten (7,4%) erhielten während der Nachsorge eine stereotaktische Strahlentherapie. Der Grund für eine weitere Strahlentherapie bei Patienten in der Operationsgruppe war die hohe Invasivität des Tumors und die unvollständige Behandlung des Duralansatzes und des Schädels (12). Ähnlich wie bei anderen Meningeomen ist die stereotaktische Strahlentherapie von kleinen Cerebellopontinwinkel-Meningeomen eher eine Hilfsbehandlung zur Hemmung des Tumorfortschritts nach der Operation.
Die chirurgischen Komplikationen umfassten hauptsächlich Funktionsstörungen der Gesichts- und Hörnerven, des Nervus trigeminus und der hinteren Hirnnerven sowie des Hydrozephalus. Gesichtslähmung, Taubheitsgefühl im Gesicht und Hörverlust können die Lebensqualität von Patienten nach der Operation ernsthaft beeinträchtigen. Die Symptome einer Schädigung des hinteren Hirnnervs wie Heiserkeit, Dysarthrie und ein geschwächter Hustenreflex beeinflussen die Prognose der Patienten nach der Operation erheblich. Aufgrund der geringen Größe des Tumors sind Komplikationen wie Hydrozephalus und intrazerebrale Blutungen bei Patienten mit kleinen Cerebellopontin-Winkel-Meningeomen selten.
Schlussfolgerung
Im Vergleich zur stereotaktischen Strahlentherapie kann die chirurgische Behandlung kleiner cerebellopontinaler Winkelmeningeome manchmal zu besseren Ergebnissen bei der Linderung präoperativer Symptome und der Hemmung des Tumorfortschritts führen. In Bezug auf weitere Behandlungen kann die chirurgische Behandlung im Vergleich zur Unsicherheit der stereotaktischen Strahlentherapie genaue pathologische Untersuchungsergebnisse erhalten, um die weitere Behandlung zu leiten. Ähnlich wie bei großen Tumoren sollte die chirurgische Behandlung bei kleinen Cerebellopontinwinkel-Meningeomen die erste Wahl sein, während stereotaktische Strahlentherapie, Pharmakotherapie und experimentelle Therapie als Ergänzung zur chirurgischen Behandlung besser geeignet sind.
Erklärung zur Datenverfügbarkeit
Die Rohdaten, die die Schlussfolgerungen dieses Artikels stützen, werden von den Autoren ohne unangemessenen Vorbehalt zur Verfügung gestellt.
Ethikerklärung
Die Studien mit menschlichen Teilnehmern wurden vom Institutional Review Board und der Ethikkommission des Ersten angeschlossenen Krankenhauses der Soochow University überprüft und genehmigt. Die Patienten / Teilnehmer gaben ihre schriftliche Einverständniserklärung zur Teilnahme an dieser Studie ab.
Autorenbeiträge
JW und GC entwarfen die Studie. JB, PP, HY, WG, YL, ZY und ZW führten die Experimente durch und analysierten die Daten. JB schrieb das Manuskript. Alle Autoren haben das Manuskript gelesen und genehmigt. JB, PJ und HY haben gleichermaßen zu dieser Arbeit beigetragen. Alle Autoren haben zu dem Artikel beigetragen und die eingereichte Version genehmigt.
Finanzierung
Diese Arbeit wurde durch den Jiangsu Provincial Medical Key Talent Grant (ZDRCA2016040) und den Grant (SYS2019045) der Regierung von Suzhou unterstützt.
Interessenkonflikt
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
1. Kankane VK, Warade AC, Misra BK. Nicht-vestibuläre Schwannom-Tumoren im Kleinhirnpontinwinkel: ein einmaliges Erlebnis. Asiatische J Neurochirurgie. (2019) 14:154–61. doi: 10.4103/ajns.ajns_335_17
CrossRef Volltext / Google Scholar
2. Faramand A, Kano H, Niranjan A, Park KJ, Flickinger JC, Lunsford LD. Tumorkontrolle und Hirnnervenergebnisse nach adjuvanter Radiochirurgie bei Meningeomen mit niedriger Schädelbasis. Weltneurochirurgie. (2019) 127:e221–9. doi: 10.1016/j.wneu.2019.03.052
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
3. Sorrentino T, Altieri R, Zinis LR, Stefini R, Panciani PP, et al. Early-career chirurgische Praxis für Kleinhirn-Winkel Tumoren in der Ära der Radiochirurgie. J Neurol Surg B Schädelbasis. (2018) 79:269–81. doi: 10,1055/s-0037-1606826
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
4. Magill ST, Lee DS, Yen AJ, Lucas CG, Raleigh DR, Aghi MK, et al. Chirurgische Ergebnisse nach Reoperation bei rezidivierenden Schädelbasismeningeomen. J Neurochirurg. (2018) 130:876–83. doi: 10.3171/2017.11.jns172278
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
5. Es sind keine frei zugänglichen ergänzenden Materialien verfügbar in: Nowosielski M, Galldiks N, Iglseder S, Kickingereder P, Deimling A, Bendszus M, et al. Diagnostische Herausforderungen beim Meningeom. In: J Neuro Oncol. (2017) 19:1588–98.
Google Scholar
6. Dr. Haase, Magill ST, Rick JW, Aghl MK, et al. Petrous Face Meningeome: Klassifikation, klinische Syndrome und chirurgische Ergebnisse. Weltneurochirurgie. (2018) 114:e1266–74. doi: 10.1016/j.wneu.2018.03.194
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
7. Tomasello F, Angileri FF, Conti A, Scibilia A, Cardali S, Torre DL, et al. Petrosale Meningeome: Einflussfaktoren auf das Ergebnis und die Rolle der intraoperativen multimodalen Unterstützung der Mikrochirurgie. Neurochirurgie. (2019) 84:1313–24. doi: 10.1093/neuros/nyy188
Querverweis Volltext / Google Scholar
8. Goldbrunner R, Minniti G, Preusser M, Jenkinson MD, Sallabanda K, Houdart E, et al. EANO-Richtlinien für die Diagnose und Behandlung von Meningeomen. Lancet Oncol. (2016) 17:e383–91. doi: 10.1016/S1470-2045(16)30321-7
CrossRef Volltext / Google Scholar
9. Ehresman JS, Garzon-Muvdi T, Rogers D, Lim M, Gallia GL, Weingart J, et al. Risiko der Entwicklung postoperativer Defizite aufgrund der Tumorlokalisation nach chirurgischer Resektion eines intrakraniellen Meningeoms. J Neurol Surg B Schädelbasis. (2019) 80:59–66. doi: 10,1055/s-0038-1667066
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
10. D’Amico RS, Banu MA, Petridis P, Bercow AS, Malone H, Praver M, et al. Wirksamkeit und Ergebnisse eines gesichtsnervenschonenden Behandlungsansatzes bei Meningeomen des Kleinhirnpontinwinkels. J Neurochirurg. (2017) 127:1231–41. doi: 10.3171/2016.10.JNS161982
Querverweis Volltext / Google Scholar
11. Iwai Y., Yamanaka K., Shimohonji W., Ishibashi K. Inszenierte Gamma-Knife-Radiochirurgie bei Meningeomen mit großer Schädelbasis. Cureus. (2019) 11:e6001. doi: 10.7759/cureus.6001
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
12. Magill ST, Dalle Ore CL, Diaz MA, Jalili DD, Raleigh DR, Aghi MK, et al. Chirurgische Ergebnisse nach Reoperation bei rezidivierenden Meningeomen ohne Schädelbasis. J Neurochirurg. (2018) 1:1–9. doi: 10.3171/2018.6JNS18118
Querverweis Volltext / Google Scholar
13. Kim KH, Kang SJ, Choi JW, Kong DS, Seol HJ, Nam DH, et al. Klinische und radiologische Ergebnisse der proaktiven Gamma-Knife-Operation bei asymptomatischen Meningeomen im Vergleich zum natürlichen Verlauf ohne Intervention. J Neurochirurg. (2018) 1:1–10. doi: 10.3171/2017.12JNS171943
Querverweis Volltext / Google Scholar
14. Zhang Z, Li Y, Li Y, Wang G, Zhang J, Zhang Y, Zhang J, Zhang J, Zhang J, Zhang J, Zhang J, Zhang J. Gamma-Knife-Radiochirurgie bei intrakraniellen benignen Meningeomen: Follow-up-Ergebnis bei 130 Patienten. Schwerpunkt Neurochirurgie. (2019) 46:E7. doi: 10.3171/2019.3.FOCUS1956
CrossRef Volltext / Google Scholar
15. Jahanbakhshi A, Azar M, Kazemi F, Jalessi M, Chanideh I, Amini E. Gamma Knife stereotaktische Radiochirurgie für cerebellopontine Winkel Meningiom. In: Clin Neurol Neurosurg. (2019) 187:105557. doi: 10.1016/j.clineuro.2019.105557
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
16. Er ist Mitglied des Vorstands der Deutschen Bahn AG. Stereotaktische Radiochirurgie bei Meningeomen der hinteren Fossa WHO Grad I: Langzeitergebnisse mit volumetrischer Bewertung. J Neurochirurg. (2018) 129:1249–59. doi: 10.3171/2017.6JNS17993
Querverweis Volltext / Google Scholar
17. Faramand A., Kano H., Niranjan A., Johnson Sa., Hassib M., Park KJ, et al. Hirnnervenergebnisse nach primärer stereotaktischer Radiochirurgie bei symptomatischen Schädelbasismeningeomen. J Neurooncol. (2018) 139:341–8. doi: 10.1007/s11060-018-2866-9
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
18. Sheehan JP, Starke RM, Kano H, Barnett GH, Mathieu D, Chiang V, et al. Gamma Knife Radiochirurgie für hintere Fossa Meningeome: eine multizentrische Studie. J Neurochirurg. (2015) 122:1479–89. doi: 10.3171/2014.10JNS14139
Querverweis Volltext / Google Scholar
19. Starke RM, Williams BJ, Hiles C, Nguyen JH, Elsharkawy MEINE, Sheehan JP. Gamma Knife Chirurgie für Schädelbasis Meningeome. J Neurochirurg. (2012) 116:588–97.
Google Scholar
20. Ding D, Starke RM, Kano H, Nakaji P, Barnett GH, Mathieu D, et al. Gamma Knife Radiochirurgie für cerebellopontine Winkel Meningeome: eine multizentrische Studie. Neurochirurgie. (2014) 75: 398-408; Seite 408. doi: 10.1227/NEU.0000000000000480
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar