Die chromosomale DNA-Replikation erfordert, dass DNA-Polymerasen an ringförmige Gleitklemmen gebunden werden, die die DNA umgeben und eine schnelle, prozessive Replikation ermöglichen. Gleitklemmen werden durch den Clamp Loader Complex, eine pentamere Anordnung von Proteinen der AAA + -Familie von ATPasen, auf DNA geladen.
Wir wollen die Funktion und den Mechanismus von Klemmladern genauer verstehen. Neuere Strukturen des T4-Bakteriophagen-Clamp-Loaders im Komplex mit Primer-Template-DNA und der Gleitklemme haben ein Arbeitsmodell für den Clamp-Loader-Mechanismus vorgeschlagen, wie unten gezeigt (siehe Kelch et al. 2011):
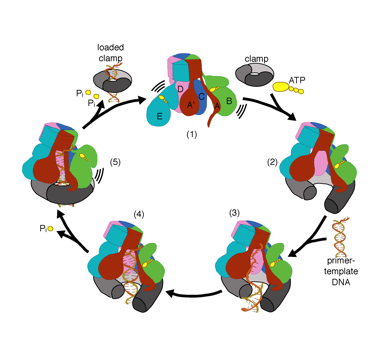
Unser Modell sagt voraus, dass die ATP-Hydrolyse am Ende der AAA + -Spirale beginnt und sequentiell die Spirale hinauf verläuft, was zum Ausstoßen des Klemmladers aus der DNA und der geschlossenen Klemme führt. Unsere Hypothese wird in dieser Animation von drei aufeinanderfolgenden ATP-Hydrolyseereignissen veranschaulicht:
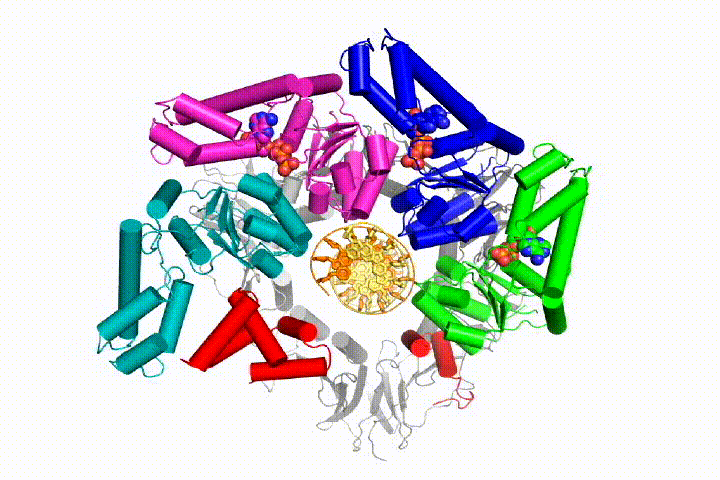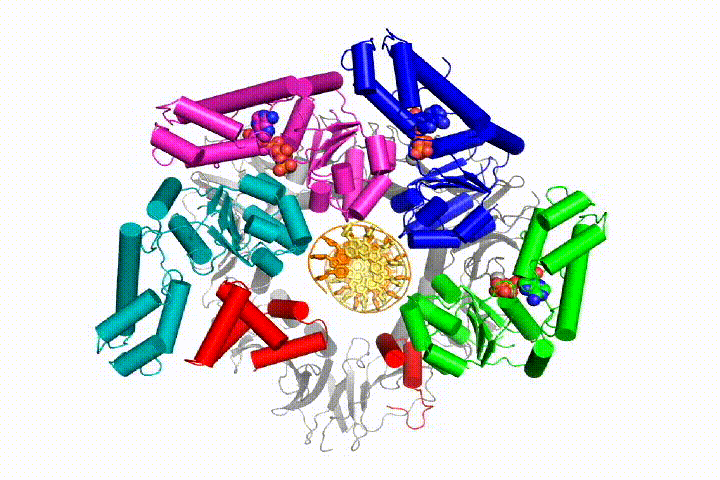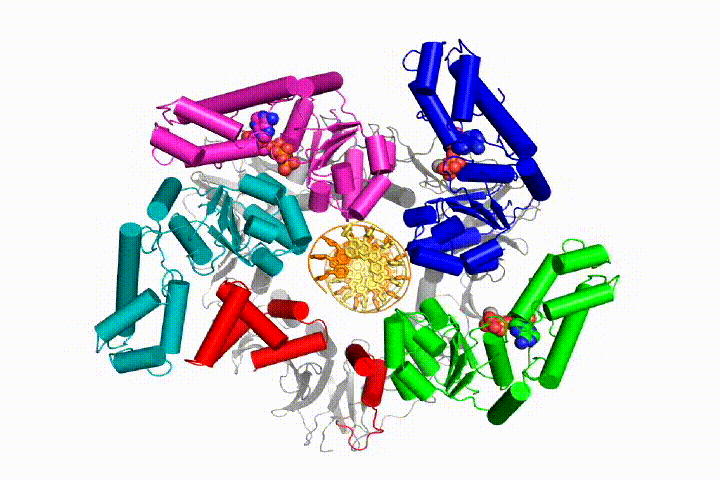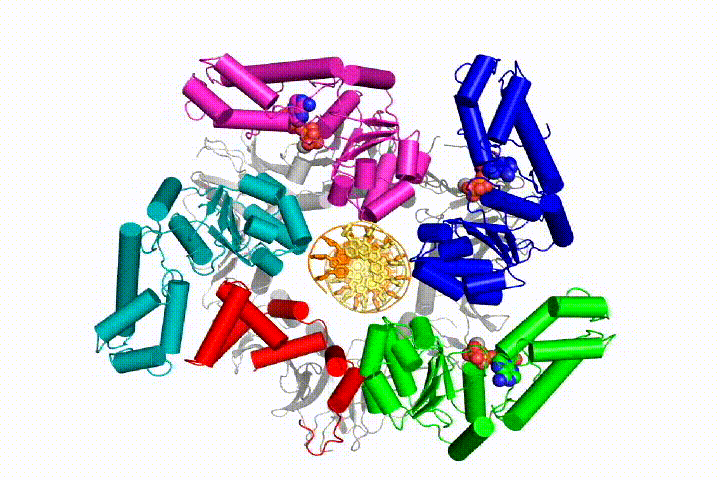
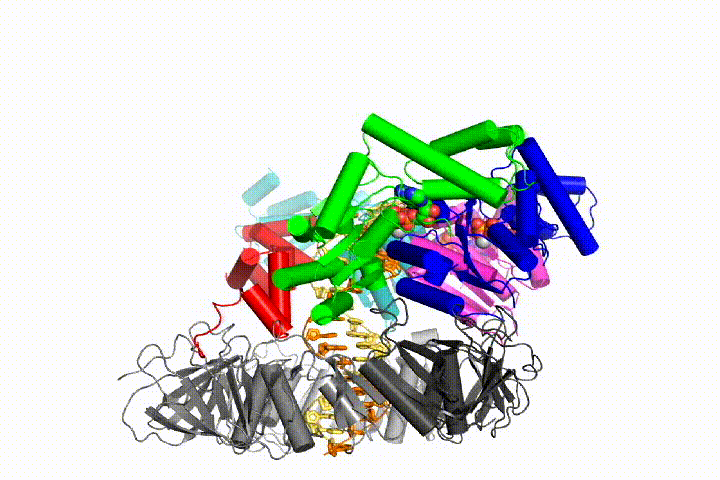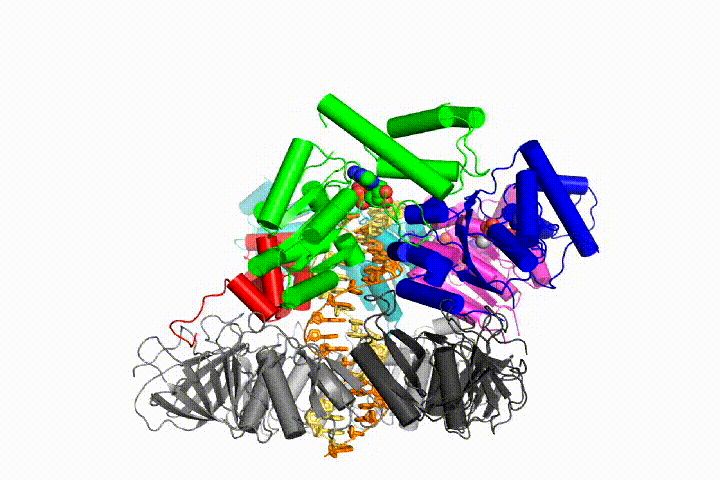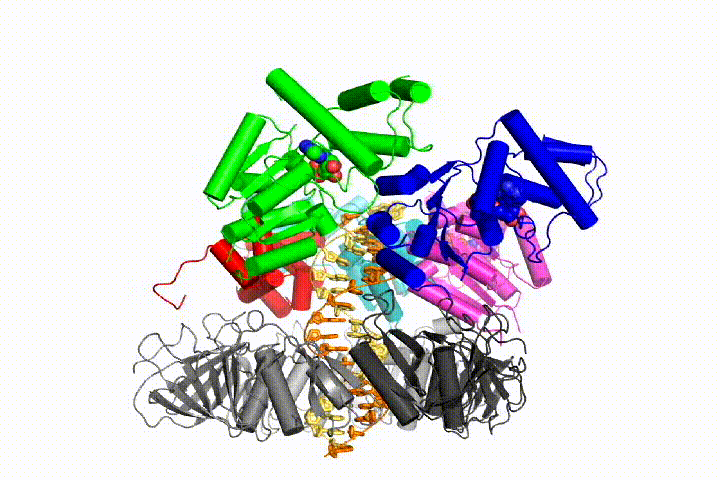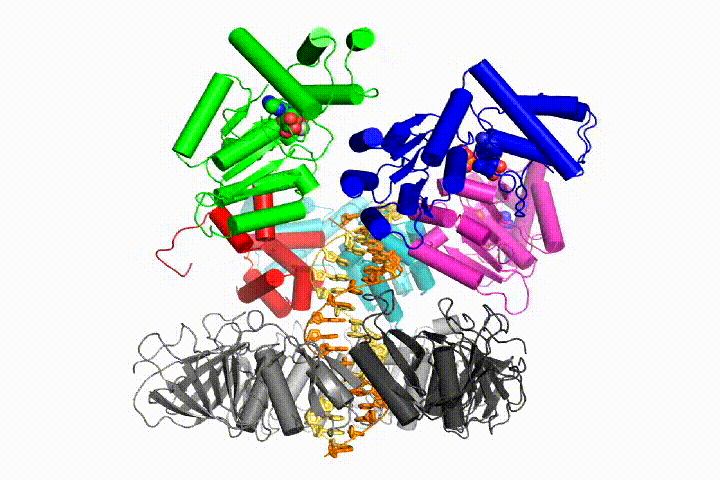
Wir werden diese Modelle mit einer Vielzahl biochemischer, biophysikalischer und struktureller Methoden auf den Klammerladermechanismus testen. Das Verständnis des Clamp-Loader-Mechanismus im atomaren Detail wird wichtige Implikationen für das Verständnis der DNA-Replikation sowie des Mechanismus verwandter AAA + -Proteinanordnungen haben. Schließlich verwenden wir unser mechanistisches Verständnis, um neue nanodevices und Effektoren des kleinen Moleküls von AAA+-Funktion zu entwickeln.