Generischer Name: Clonidinhydrochlorid
Darreichungsform: Tablette
Medizinisch überprüft von Drugs.com . Zuletzt aktualisiert am 1. Juli 2020.
- Übersicht
- Nebenwirkungen
- Dosierung
- Fachmann
- Tipps
- Wechselwirkungen
- Mehr
- Clonidinhydrochlorid Tabletten, USP
- Clonidin Beschreibung
- Clonidin – Klinische Pharmakologie
- Pharmakokinetik
- Indikationen und Verwendung für Clonidin
- Kontraindikationen
- Warnhinweise
- Entzug
- Vorsichtsmaßnahmen
- Allgemein
- Perioperative Anwendung
- Informationen für Patienten
- Wechselwirkungen mit anderen Arzneimitteln
- Toxikologie
- Karzinogenese, Mutagenese, Beeinträchtigung der Fertilität
- Trächtigkeit
- Stillende Mütter
- Pädiatrische Anwendung
- Nebenwirkungen
- Überdosierung
- Clonidin Dosierung und Verabreichung
- Wie wird Clonidin geliefert
- HAUPTANZEIGEFELD
- HAUPTANZEIGEFELD
- PRINCIPAL DISPLAY PANEL
- Mehr über Clonidin
- Verbraucherressourcen
- Professionelle Ressourcen
- Verwandte behandlung guides
Clonidinhydrochlorid Tabletten, USP
Orales Antihypertensivum
Tabletten von 0,1 mg, 0,2 mg und 0.3 mg
Rx Only
Prescribing Information
Clonidin Beschreibung
Clonidinhydrochlorid, USP ist ein zentral wirkendes Alpha-Agonist hypotensive Mittel als Tabletten zur oralen Verabreichung in drei Dosierungsstärken: 0,1 mg, 0,2 mg und 0,3 mg. Die 0,1 mg Tablette entspricht 0,087 mg der freien Base.
Die inaktiven Bestandteile sind kolloidales Siliciumdioxid, Maisstärke, zweibasisches Calciumphosphat, Hydroxypropylcellulose, mikrokristalline Cellulose, Lactose-Monohydrat und Magnesiumstearat. Darüber hinaus ist die 0.1 mg Tabletten enthalten FD& C Rot Nr. 40 und die 0,2 mg und 0,3 mg Tabletten enthalten FD& C Gelb Nr. 6 als Farbzusätze.
Clonidinhydrochlorid ist ein Imidazolinderivat und existiert als mesomere Verbindung. Der chemische Name ist 2- (2,6-dichlorphenylamino) -2-imidazolinhydrochlorid. Das Folgende ist die Strukturformel:
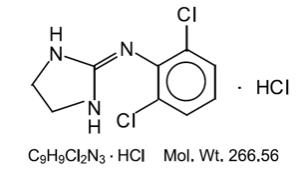
Clonidinhydrochlorid ist eine geruchlose, bittere, weiße, kristalline Substanz, die in Wasser und Alkohol löslich ist.
Clonidin – Klinische Pharmakologie
Clonidin stimuliert Alpha-Adrenorezeptoren im Hirnstamm. Diese Aktion führt zu einem verringerten sympathischen Abfluss aus dem Zentralnervensystem und zu einer Abnahme des peripheren Widerstands, des Nierengefäßwiderstands, der Herzfrequenz und des Blutdrucks. Clonidinhydrochlorid-Tabletten wirken relativ schnell. Der Blutdruck des Patienten sinkt innerhalb von 30 bis 60 Minuten nach einer oralen Dosis, wobei die maximale Abnahme innerhalb von 2 bis 4 Stunden auftritt. Der renale Blutfluss und die glomeruläre Filtrationsrate bleiben im Wesentlichen unverändert. Normale Haltungsreflexe sind intakt, daher sind orthostatische Symptome mild und selten.
Akutstudien mit Clonidinhydrochlorid am Menschen haben eine mäßige Verringerung (15% bis 20%) des Herzzeitvolumens in Rückenlage ohne Änderung des peripheren Widerstands gezeigt: Bei einer Neigung von 45′ kommt es zu einer geringeren Verringerung des Herzzeitvolumens und einer Abnahme des peripheren Widerstands. Während der Langzeittherapie kehrt das Herzzeitvolumen tendenziell zu den Kontrollwerten zurück, während der periphere Widerstand verringert bleibt. Eine Verlangsamung der Pulsfrequenz wurde bei den meisten Patienten beobachtet, die Clonidin erhielten, aber das Medikament verändert die normale hämodynamische Reaktion auf Bewegung nicht.
Bei einigen Patienten kann sich eine Toleranz gegenüber der blutdrucksenkenden Wirkung entwickeln, die eine Neubewertung der Therapie erforderlich macht.
Andere Studien an Patienten haben Hinweise auf eine Verringerung der Plasma-Renin-Aktivität und der Ausscheidung von Aldosteron und Katecholaminen geliefert. Der genaue Zusammenhang dieser pharmakologischen Wirkungen mit der blutdrucksenkenden Wirkung von Clonidin ist nicht vollständig geklärt.
Clonidin stimuliert akut die Wachstumshormonfreisetzung bei Kindern und Erwachsenen, führt jedoch bei Langzeitanwendung nicht zu einer chronischen Erhöhung des Wachstumshormons.
Pharmakokinetik
Die Pharmakokinetik von Clonidin ist dosisproportional im Bereich von 100 bis 600 mcg. Die absolute Bioverfügbarkeit von Clonidin bei oraler Verabreichung beträgt 70% bis 80%. Die maximalen Clonidin-Plasmaspiegel werden in etwa 1 bis 3 Stunden erreicht.
Nach intravenöser Verabreichung zeigt Clonidin eine biphasische Disposition mit einer Verteilungshalbwertszeit von etwa 20 Minuten und einer Eliminationshalbwertszeit von 12 bis 16 Stunden. Die Halbwertszeit erhöht sich bei Patienten mit schwerer Nierenfunktionsstörung auf bis zu 41 Stunden. Clonidin passiert die Plazentaschranke. Es wurde gezeigt, dass es die Blut-Hirn-Schranke bei Ratten überschreitet.
Nach oraler Verabreichung werden etwa 40% bis 60% der absorbierten Dosis innerhalb von 24 Stunden als unverändertes Arzneimittel im Urin zurückgewonnen. Etwa 50% der absorbierten Dosis werden in der Leber metabolisiert. Weder die Nahrung noch die Rasse des Patienten beeinflussen die Pharmakokinetik von Clonidin.
Die blutdrucksenkende Wirkung wird bei Plasmakonzentrationen zwischen etwa 0, 2 und 2, 0 ng/ ml bei Patienten mit normaler Ausscheidungsfunktion erreicht. Ein weiterer Anstieg der Plasmaspiegel wird die blutdrucksenkende Wirkung nicht verstärken.
Indikationen und Verwendung für Clonidin
Clonidinhydrochlorid-Tabletten, USP sind bei der Behandlung von Bluthochdruck indiziert. Clonidinhydrochlorid-Tabletten, USP kann allein oder gleichzeitig mit anderen blutdrucksenkenden Mitteln eingesetzt werden.
Kontraindikationen
Clonidinhydrochlorid-Tabletten sollten nicht bei Patienten mit bekannter Überempfindlichkeit gegen Clonidin angewendet werden (siehe VORSICHTSMAßNAHMEN).
Warnhinweise
Entzug
Die Patienten sollten angewiesen werden, die Therapie nicht ohne Rücksprache mit ihrem Arzt abzubrechen. Ein plötzliches Absetzen der Clonidin-Behandlung führte in einigen Fällen zu Symptomen wie Nervosität, Unruhe, Kopfschmerzen und Zittern, begleitet oder gefolgt von einem raschen Anstieg des Blutdrucks und erhöhten Katecholaminkonzentrationen im Plasma. Die Wahrscheinlichkeit solcher Reaktionen auf das Absetzen der Clonidin-Therapie scheint nach Verabreichung höherer Dosen oder Fortsetzung der gleichzeitigen Betablockerbehandlung größer zu sein, und in diesen Situationen ist daher besondere Vorsicht geboten. Seltene Fälle von hypertensiver Enzephalopathie, zerebrovaskulären Unfällen und Tod wurden nach Clonidin-Entzug berichtet. Beim Absetzen der Therapie mit Clonidin sollte der Arzt die Dosis schrittweise über 2 bis 4 Tage reduzieren, um Entzugssymptome zu vermeiden.
Ein übermäßiger Anstieg des Blutdrucks nach Absetzen der Clonidin-Therapie kann durch Verabreichung von oralem Clonidinhydrochlorid oder durch intravenöses Phentolamin rückgängig gemacht werden. Wenn die Therapie bei Patienten, die gleichzeitig einen Betablocker und Clonidin erhalten, abgebrochen werden soll, sollte der Betablocker einige Tage vor dem schrittweisen Absetzen von Clonidin abgesetzt werden.
Da Kinder häufig Magen-Darm-Erkrankungen haben, die zu Erbrechen führen, können sie besonders anfällig für hypertensive Episoden sein, die auf eine plötzliche Unfähigkeit zur Einnahme von Medikamenten zurückzuführen sind.
Vorsichtsmaßnahmen
Allgemein
Bei Patienten, die eine lokalisierte Kontaktsensibilisierung gegen transdermales Clonidin entwickelt haben, kann die Fortsetzung der transdermalen Clonidin- oder Substitution der oralen Clonidinhydrochlorid-Therapie mit der Entwicklung eines generalisierten Hautausschlags verbunden sein.
Bei Patienten, die eine allergische Reaktion auf transdermales Clonidin entwickeln, kann die Substitution von oralem Clonidinhydrochlorid auch eine allergische Reaktion hervorrufen (einschließlich generalisiertem Hautausschlag, Urtikaria oder Angioödem).)
Die sympatholytische Wirkung von Clonidin kann die Sinusknotenfunktionsstörung und den atrioventrikulären (AV) Block verschlimmern, insbesondere bei Patienten, die andere Sympatholytika einnehmen. Es gibt Berichte nach Markteinführung von Patienten mit Leitungsstörungen und / oder Einnahme anderer Sympatholytika, die eine schwere Bradykardie entwickelten, die IV Atropin, IV Isoproterenol und vorübergehende Herzschrittmacher während der Einnahme von Clonidin erforderte.
Bei Hypertonie durch Phäochromozytom ist keine therapeutische Wirkung von Clonidinhydrochlorid-Tabletten zu erwarten.
Perioperative Anwendung
Die Verabreichung von Clonidinhydrochlorid-Tabletten sollte innerhalb von vier Stunden nach der Operation fortgesetzt und so bald wie möglich danach wieder aufgenommen werden. Der Blutdruck sollte während der Operation sorgfältig überwacht werden, und bei Bedarf sollten zusätzliche Maßnahmen zur Kontrolle des Blutdrucks verfügbar sein.
Informationen für Patienten
Patienten sollten vor einer Unterbrechung der Therapie mit Clonidinhydrochlorid-Tabletten ohne ärztlichen Rat gewarnt werden.
Da Patienten bei der Anwendung von Clonidin eine mögliche beruhigende Wirkung, Schwindel oder Akkommodationsstörung verspüren können, sollten Sie die Patienten vor Aktivitäten wie dem Führen eines Fahrzeugs oder dem Bedienen von Geräten oder Maschinen warnen. Informieren Sie die Patienten auch darüber, dass diese beruhigende Wirkung durch die gleichzeitige Anwendung von Alkohol, Barbituraten oder anderen Beruhigungsmitteln verstärkt werden kann.
Patienten, die Kontaktlinsen tragen, sollten darauf hingewiesen werden, dass die Behandlung mit Clonidinhydrochlorid-Tabletten trockene Augen verursachen kann.
Wechselwirkungen mit anderen Arzneimitteln
Clonidin kann die ZNS-depressive Wirkung von Alkohol, Barbituraten oder anderen sedierenden Arzneimitteln verstärken. Wenn ein Patient, der Clonidinhydrochlorid erhält, auch trizyklische Antidepressiva einnimmt, kann die blutdrucksenkende Wirkung von Clonidin verringert sein, was eine Erhöhung der Clonidin-Dosis erforderlich macht. Wenn ein Patient, der Clonidin erhält, auch Neuroleptika einnimmt, können orthostatische Regulationsstörungen (z. B. orthostatische Hypotonie, Schwindel, Müdigkeit) induziert oder verschlimmert werden.
Überwachung der Herzfrequenz bei Patienten, die Clonidin gleichzeitig mit Wirkstoffen erhalten, von denen bekannt ist, dass sie die Sinusknotenfunktion oder die AV-Knotenleitung beeinflussen, z. B. Digitalis, Kalziumkanalblocker und Betablocker. Im Zusammenhang mit der gleichzeitigen Anwendung von Clonidin mit Diltiazem oder Verapamil wurde über Sinusbradykardie berichtet, die zu Krankenhausaufenthalten und Schrittmacherinsertion führte.
Amitriptylin in Kombination mit Clonidin verstärkt die Manifestation von Hornhautläsionen bei Ratten (siehe Toxikologie).
Basierend auf Beobachtungen bei Patienten im alkoholischen Delirium wurde vorgeschlagen, dass hohe intravenöse Dosen von Clonidin das arrhythmogene Potenzial (QT-Verlängerung, Kammerflimmern) hoher intravenöser Dosen von Haloperidol erhöhen können. Kausaler Zusammenhang und Relevanz für orale Clonidin-Tabletten wurden nicht nachgewiesen.
Toxikologie
In mehreren Studien mit oralem Clonidinhydrochlorid wurde bei Albinoratten, die sechs Monate oder länger behandelt wurden, ein dosisabhängiger Anstieg der Inzidenz und des Schweregrads der spontanen Netzhautdegeneration beobachtet. Gewebeverteilungsstudien an Hunden und Affen zeigten eine Konzentration von Clonidin in der Aderhaut.
Angesichts der bei Ratten beobachteten Netzhautdegeneration wurden in klinischen Studien bei 908 Patienten vor und periodisch nach Beginn der Clonidintherapie Augenuntersuchungen durchgeführt. Bei 353 dieser 908 Patienten wurden die Augenuntersuchungen über einen Zeitraum von 24 Monaten oder länger durchgeführt. Bis auf eine gewisse Trockenheit der Augen wurden keine arzneimittelbedingten abnormalen ophthalmologischen Befunde festgestellt, und nach spezialisierten Tests wie Elektroretinographie und Makulablendung war die Netzhautfunktion unverändert.
In Kombination mit Amitriptylin führte die Verabreichung von Clonidinhydrochlorid bei Ratten innerhalb von 5 Tagen zur Entwicklung von Hornhautläsionen.
Karzinogenese, Mutagenese, Beeinträchtigung der Fertilität
Die chronische Verabreichung von Clonidin über die Nahrung war bei Ratten (132 Wochen) bzw. Mäusen (78 Wochen), die mit dem bis zu 46-fachen bzw. 70-fachen der maximal empfohlenen Tagesdosis für den Menschen in mg / kg (9-fache bzw. 6-fache der MRDHD auf mg / m2-Basis) dosiert wurden, nicht karzinogen. Es gab keine Hinweise auf Genotoxizität im Ames-Test auf Mutagenität oder im Maus-Mikronukleustest auf Klastogenität.
Die Fertilität männlicher oder weiblicher Ratten wurde durch Clonidin-Dosen von bis zu 150 mcg / kg (etwa das 3-fache der MRDHD) nicht beeinflusst. In einem separaten Experiment schien die Fertilität weiblicher Ratten bei Dosierungen von 500 bis 2000 mcg / kg (10- bis 40-fache der oralen MRDHD auf mg / kg-Basis; 2- bis 8-fache der MRDHD auf mg / m ‚-Basis) beeinträchtigt zu sein.)
Trächtigkeit
Teratogene Wirkungen: Trächtigkeitskategorie C. Reproduktionsstudien an Kaninchen in Dosen von bis zu etwa dem 3-fachen der oralen empfohlenen Tageshöchstdosis (MRDHD) von Clonidinhydrochlorid-Tabletten ergaben keine Hinweise auf ein teratogenes oder embryotoxisches Potenzial bei Kaninchen. Bei Ratten waren jedoch Dosen von Clonidin von nur 1/3 der oralen MRDHD (1/15 der MRDHD auf mg / m2-Basis) in einer Studie, in der Muttertiere ab 2 Monaten kontinuierlich behandelt wurden, mit erhöhten Resorptionen assoziiert vor der Paarung. Erhöhte Resorptionen waren weder mit einer gleichzeitigen Behandlung noch mit höheren Dosierungen (bis zum 3-fachen der oralen MRDHD) verbunden, wenn die Dams an den Tagen 6 bis 15 der Trächtigkeit behandelt wurden. Ein Anstieg der Resorption wurde bei viel höheren Dosierungen beobachtet (40-fache orale MRDHD auf mg / kg-Basis; 4- bis 8-fache der MRDHD auf mg / m2-Basis) bei Mäusen und Ratten, die an den Trächtigkeitstagen 1 bis 14 behandelt wurden (die niedrigste in der Studie verwendete Dosis betrug 500 mcg / kg).
Es wurden keine adäquaten, gut kontrollierten Studien an schwangeren Frauen durchgeführt. Clonidin passiert die Plazentaschranke (siehe KLINISCHE PHARMAKOLOGIE, Pharmakokinetik). Da Reproduktionsstudien an Tieren nicht immer die Reaktion des Menschen vorhersagen, sollte dieses Medikament während der Schwangerschaft nur angewendet werden, wenn dies eindeutig erforderlich ist.
Stillende Mütter
Da Clonidinhydrochlorid in die Muttermilch übergeht, ist Vorsicht geboten, wenn Clonidinhydrochlorid-Tabletten einer stillenden Frau verabreicht werden.
Pädiatrische Anwendung
Sicherheit und Wirksamkeit bei pädiatrischen Patienten wurden in adäquaten und gut kontrollierten Studien nicht nachgewiesen (siehe WARNHINWEISE, Entzug).
Nebenwirkungen
Die meisten Nebenwirkungen sind mild und nehmen mit fortgesetzter Therapie tendenziell ab. Die häufigsten (die dosisabhängig zu sein scheinen) sind trockener Mund, der bei etwa 40 von 100 Patienten auftritt; schläfrigkeit, etwa 33 von 100; Schwindel, etwa 16 von 100; Verstopfung und Sedierung, jeweils etwa 10 von 100.
Die folgenden weniger häufigen Nebenwirkungen wurden auch bei Patienten berichtet, die Clonidinhydrochlorid-Tabletten erhielten, aber in vielen Fällen erhielten die Patienten gleichzeitig Medikamente und ein kausaler Zusammenhang wurde nicht hergestellt.
Körper als Ganzes: Müdigkeit, Fieber, Kopfschmerzen, Blässe, Schwäche und Entzugssyndrom. Ebenfalls berichtet wurden ein schwach positiver Coombs-Test und eine erhöhte Empfindlichkeit gegenüber Alkohol.
Kardiovaskulär: Bradykardie, Herzinsuffizienz, elektrokardiographische Anomalien (d. H. Sinusknotenstillstand, Übergangsbradykardie, hochgradiger AV-Block und Arrhythmien), orthostatische Symptome, Herzklopfen, Raynaud-Phänomen, Synkope und Tachykardie.
Fälle von Sinusbradykardie und atrioventrikulärer Blockade wurden sowohl mit als auch ohne gleichzeitige Anwendung von Digitalis berichtet.
Zentrales Nervensystem: Unruhe, Angstzustände, Delirium, wahnhafte Wahrnehmung, Halluzinationen (einschließlich visueller und auditiver), Schlaflosigkeit, psychische Depression, Nervosität, andere Verhaltensänderungen, Parästhesien, Unruhe, Schlafstörungen und lebhafte Träume oder Albträume.
Dermatologisch: Alopezie, angioneurotisches Ödem, Nesselsucht, Pruritus, Hautausschlag und Urtikaria.
Gastrointestinal: Bauchschmerzen, Anorexie, Verstopfung, Hepatitis, Unwohlsein, leichte vorübergehende Anomalien bei Leberfunktionstests, Übelkeit, Parotitis, Pseudoobstruktion (einschließlich Kolonpseudoobstruktion), Speicheldrüsenschmerzen und Erbrechen.
Urogenital: Verminderte sexuelle Aktivität, Schwierigkeiten bei der Miktion, erektile Dysfunktion, Libidoverlust, Nykturie und Harnverhalt.
Hämatologisch: Thrombozytopenie.
Metabolisch: Gynäkomastie, vorübergehende Erhöhung des Blutzuckers oder der Serumkreatinphosphokinase und Gewichtszunahme.
Muskuloskelettal: Beinkrämpfe und Muskel- oder Gelenkschmerzen.
Oro-otolaryngeal: Trockenheit der Nasenschleimhaut.
Ophthalmologisch: Akkommodationsstörung, verschwommenes Sehen, Brennen der Augen, verminderter Tränenfluss und Trockenheit der Augen.
Überdosierung
Hypertonie kann sich früh entwickeln und kann von Hypotonie, Bradykardie, Atemdepression, Hypothermie, Schläfrigkeit, verminderten oder fehlenden Reflexen, Schwäche, Reizbarkeit und Miosis begleitet werden. Die Häufigkeit einer ZNS-Depression kann bei Kindern höher sein als bei Erwachsenen. Große Überdosierungen können zu reversiblen Herzleitungsfehlern oder Herzrhythmusstörungen, Apnoe, Koma und Krampfanfällen führen. Anzeichen und Symptome einer Überdosierung treten im Allgemeinen innerhalb von 30 Minuten bis zwei Stunden nach der Exposition auf. Bereits 0,1 mg Clonidin haben bei Kindern Anzeichen einer Toxizität hervorgerufen.
Es gibt kein spezifisches Antidot für eine Clonidin-Überdosierung. Eine Überdosierung von Clonidin kann zur raschen Entwicklung einer ZNS-Depression führen; Daher wird die Induktion von Erbrechen mit Ipecac-Sirup nicht empfohlen. Eine Magenspülung kann nach kürzlicher und / oder großer Einnahme angezeigt sein. Die Verabreichung von Aktivkohle und / oder eines Kathartikums kann vorteilhaft sein. Unterstützende Maßnahmen können Atropinsulfat bei Bradykardie, intravenöse Flüssigkeiten und / oder Vasopressoren bei Hypotonie und Vasodilatatoren bei Hypertonie umfassen. Naloxon kann eine nützliche Ergänzung zur Behandlung von Clonidin-induzierter Atemdepression, Hypotonie und / oder Koma sein; Der Blutdruck sollte überwacht werden, da die Verabreichung von Naloxon gelegentlich zu paradoxer Hypertonie geführt hat. Die Verabreichung von Tolazolin hat zu inkonsistenten Ergebnissen geführt und wird nicht als Erstlinientherapie empfohlen. Es ist unwahrscheinlich, dass die Dialyse die Elimination von Clonidin signifikant verbessert.
Die größte bisher gemeldete Überdosierung betraf einen 28-jährigen Mann, der 100 mg Clonidinhydrochlorid-Pulver einnahm. Dieser Patient entwickelte Bluthochdruck, gefolgt von Hypotonie, Bradykardie, Apnoe, Halluzinationen, Glaukom und vorzeitigen ventrikulären Kontraktionen. Der Patient erholte sich nach intensiver Behandlung vollständig. Die Clonidin-Plasmaspiegel betrugen 60 ng / ml nach 1 Stunde, 190 ng / ml nach 1,5 Stunden, 370 ng / ml nach 2 Stunden und 120 ng / ml nach 5,5 und 6,5 Stunden. Bei Mäusen und Ratten beträgt die orale LD50 von Clonidin 206 bzw. 465 mg / kg.
Clonidin Dosierung und Verabreichung
Erwachsene
Die Dosis der Clonidinhydrochlorid-Tabletten muss entsprechend der individuellen Blutdruckreaktion des Patienten angepasst werden. Im Folgenden finden Sie eine allgemeine Anleitung zur Verwaltung.
Anfangsdosis
0,1 mg Tablette zweimal täglich (morgens und vor dem Schlafengehen). Ältere Patienten können von einer niedrigeren Anfangsdosis profitieren.
Erhaltungsdosis
Bei Bedarf können in wöchentlichen Abständen weitere Inkremente von 0,1 mg pro Tag vorgenommen werden, bis das gewünschte Ansprechen erreicht ist. Die Einnahme des größeren Teils der oralen Tagesdosis vor dem Schlafengehen kann die vorübergehenden Nebenwirkungen von Mundtrockenheit und Schläfrigkeit minimieren. Die am häufigsten verwendeten therapeutischen Dosen reichten von 0,2 mg bis 0,6 mg pro Tag in aufgeteilten Dosen.
Studien haben gezeigt, dass 2,4 mg die maximal wirksame Tagesdosis ist, aber so hohe Dosen wurden selten angewendet.
Eingeschränkte Nierenfunktion
Patienten mit eingeschränkter Nierenfunktion können von einer niedrigeren Anfangsdosis profitieren. Patienten sollten sorgfältig überwacht werden. Da während der routinemäßigen Hämodialyse nur eine minimale Menge Clonidin entfernt wird, ist es nicht erforderlich, nach der Dialyse zusätzliches Clonidin zu verabreichen.
Wie wird Clonidin geliefert
Clonidin-Hydrochlorid-Tabletten, USP werden wie folgt geliefert:
0,1 mg: Eine rosa Tablette in Form von „ „.
„.
NDC 58657-647-01 (Flasche mit 100)
NDC 58657-647-50 (Flasche mit 500)
NDC 58657-647-10 (Flasche mit 1000)
0, 2 mg: Eine orangefarbene Tablette in Form von “  „.
„.
NDC 58657-648-01 (Flasche mit 100)
NDC 58657-648-50 (Flasche mit 500)
NDC 58657-648-10 (Flasche mit 1000)
0, 3 mg: Eine hellorange Tablette in Form von “  „.
„.
NDC 58657-649-01 (Flasche mit 100 Stück)
NDC 58657-649-50 (Flasche mit 500 Stück)
NDC 58657-649-10 (Flasche mit 1000 Stück)
Bei 25°C (77°F) lagern; Exkursionen auf 15°C-30°C (59°F- 86°F) . In einem dichten, lichtbeständigen Behälter abgeben.
Hergestellt von:
Yung Shin Pharmaceutical Ind. Co., Ltd.
Tachia, Taichung 43769
TAIWAN
Vertrieben von:
Methode Pharmaceuticals, LLC
7333 Jack Newell Blvd. North, Suite 300
Fort Worth, Texas 76118
Um UNERWÜNSCHTE ARZNEIMITTELWIRKUNGEN zu melden, rufen Sie bitte Method Pharmaceuticals unter 1-877-250-3427
Überarbeitet: 06/20
HAUPTANZEIGEFELD
NDC 58657-647-10
Clonidin
HYDROCHLORID
TABLETTEN, USP
0,1 mg
Rx Nur
1000 Tabletten

HAUPTANZEIGEFELD
NDC 58657-648-10
Clonidin
HYDROCHLORID
TABLETTEN, USP
0.2 mg
Rx Only
1000 Tablets

PRINCIPAL DISPLAY PANEL
NDC 58657-649-10
Clonidine
HYDROCHLORIDE
TABLETS, USP
0.3 mg
Rx Only
1000 Tablets

| Clonidine HYDROCHLORIDE Clonidine hydrochloride tablet |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
| Clonidinhydrochlorid Clonidinhydrochlorid Tablette |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
| Clonidinhydrochlorid Clonidinhydrochlorid Tablette |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Etikettierer – Method Pharmaceuticals, LLC (060216698)
Mehr über Clonidin
- Nebenwirkungen
- Während der Schwangerschaft oder Stillzeit
- Dosierungsinformationen
- Patiententipps
- Arzneimittelbilder
- Wechselwirkungen mit anderen Arzneimitteln
- Alternativen vergleichen
- Selbsthilfegruppe
- Preise & Gutscheine
- 619 Bewertungen
- Arzneimittelklasse: Antiadrenergika, zentral wirkend
- FDA-Warnungen (1)
Verbraucherressourcen
- Patienteninformationen
- … +5 mehr
Professionelle Ressourcen
- Verschreibungsinformationen
- Clonidin (Professionelle Patientenberatung)
- Clonidin-Retardtabletten (FDA)
- Clonidin-Injektion (FDA)
- Clonidin-Pflaster (FDA)
- Clonidin Tabletten (FDA)
Andere marken Catapres, Kapvay, Catapres-TTS, Duraclon, Nexiclon XR
Verwandte behandlung guides
- Angst
- ADHS
- Alkohol Rückzug
- Vorhofflimmern
- … +19 mehr
Medizinischer Haftungsausschluss