Generischer Name: Clindamycinphosphat
Darreichungsform: Vaginalcreme
Medizinisch überprüft von Drugs.com . Zuletzt aktualisiert am 1. März 2020.
- Übersicht
- Nebenwirkungen
- Dosierung
- Professional
- Wechselwirkungen
- Mehr
- NUR ZUR INTRAVAGINALEN ANWENDUNGNICHT ZUR OPHTHALMISCHEN, DERMALEN ODER ORALEN ANWENDUNG
- Cleocin Vaginalcreme – Klinische Pharmakologie
- Wirkmechanismus
- Pharmakokinetik
- MIKROBIOLOGIE
- Wirkmechanismus
- Resistenz
- Antibakterielle Aktivität
- Indikationen und Verwendung für Cleocin Vaginal Creme
- Kontraindikationen
- Warnhinweise
- Vorsichtsmaßnahmen
- Allgemeines
- Informationen für den Patienten
- Arzneimittelwechselwirkungen
- Karzinogenese, Mutagenese, Beeinträchtigung der Fertilität
- Schwangerschaft
- Stillende Mütter
- Pädiatrische Anwendung
- Geriatrische Anwendung
- Nebenwirkungen
- Klinische Studien
- Überdosierung
- Cleocin Vaginalcreme Dosierung und Verabreichung
- Wie wird Cleocin Vaginalcreme geliefert
- Klinische Studien
- GEBRAUCHSANWEISUNG
- PRINCIPAL DISPLAY PANEL – 40 g Tube Label
- PRINCIPAL DISPLAY PANEL – 40 g Tube Karton
- Mehr über Cleocin Vaginal (clindamycin topical)
- Verbraucherressourcen
- Professionelle Ressourcen
- Andere Formulierungen
- Verwandte Behandlungsleitfäden
NUR ZUR INTRAVAGINALEN ANWENDUNGNICHT ZUR OPHTHALMISCHEN, DERMALEN ODER ORALEN ANWENDUNG
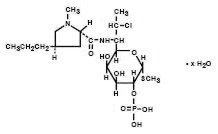
Clindamycinphosphat ist ein wasserlöslicher Ester des halbsynthetischen Antibiotikums, das durch eine 7 (S) -Chlorsubstitution der 7 (R) -Hydroxylgruppe des Mutterantibiotikums Lincomycin hergestellt wird. Der chemische Name für Clindamycinphosphat ist Methyl 7-chloro-6,7,8-trideoxy-6-(1-methyl-trans-4-propyl-L-2-pyrrolidinecarboxamido)-1-thio-L-threo-α–D-galacto- octopyranosid 2-(Dihydrogenphosphat). Es hat ein Molekulargewicht von 504,96 und die Summenformel ist C18H34ClN2O8PS. Die Strukturformel ist unten dargestellt:
Cleocin Vaginalcreme 2% ist eine halbfeste, weiße Creme, die 2% Clindamycinphosphat, USP, in einer Konzentration enthält, die 20 mg Clindamycin pro Gramm entspricht. Der pH-Wert der Creme liegt zwischen 3,0 und 6,0. Die Creme enthält auch Benzylalkohol, Cetostearylalkohol, gemischte Fettsäureester, Mineralöl, Polysorbat 60, Propylenglykol, gereinigtes Wasser, Sorbitanmonostearat und Stearinsäure.
Jeder Applikator mit 5 Gramm Vaginalcreme enthält ungefähr 100 mg Clindamycinphosphat.
Cleocin Vaginalcreme – Klinische Pharmakologie
Wirkmechanismus
Clindamycin ist ein antibakterielles Medikament (siehe MIKROBIOLOGIE).
Pharmakokinetik
Nach einer einmal täglichen intravaginalen Dosis von 100 mg Clindamycinphosphat-Vaginalcreme 2%, die 6 gesunden weiblichen Freiwilligen über 7 Tage verabreicht wurde, wurden ungefähr 5% (Bereich 0, 6% bis 11%) der verabreichten Dosis systemisch resorbiert. Die am ersten Tag beobachtete maximale Clindamycin-Serumkonzentration betrug durchschnittlich 18 ng / ml (Bereich 4 bis 47 ng / ml) und am 7. Tag durchschnittlich 25 ng / ml (Bereich 6 bis 61 ng / ml). Diese Spitzenkonzentrationen wurden ungefähr 10 Stunden nach der Dosierung (Bereich 4-24 Stunden) erreicht.
Nach einer einmal täglichen intravaginalen Dosis von 100 mg Clindamycinphosphat-Vaginalcreme 2%, die an 7 aufeinanderfolgenden Tagen an 5 Frauen mit bakterieller Vaginose verabreicht wurde, war die Resorption langsamer und weniger variabel als bei gesunden Frauen. Ungefähr 5% (Bereich 2% bis 8%) der Dosis wurden systemisch resorbiert. Die am ersten Tag beobachtete maximale Clindamycin-Serumkonzentration betrug durchschnittlich 13 ng / ml (Bereich 6 bis 34 ng / ml) und am 7. Tag durchschnittlich 16 ng / ml (Bereich 7 bis 26 ng / ml). Diese Spitzenkonzentrationen wurden ungefähr 14 Stunden nach der Anwendung erreicht (Bereich 4-24 Stunden).
Nach wiederholter vaginaler Dosierung von Clindamycinphosphat-Vaginalcreme 2% kam es zu einer geringen oder keiner systemischen Akkumulation von Clindamycin. Die systemische Halbwertszeit betrug 1,5 bis 2,6 Stunden.
MIKROBIOLOGIE
Wirkmechanismus
Clindamycin hemmt die bakterielle Proteinsynthese durch Bindung an die 23S-RNA der 50S-Untereinheit des Ribosoms. Clindamycin ist überwiegend bakteriostatisch. Obwohl Clindamycinphosphat in vitro inaktiv ist, wandelt es eine schnelle In-vivo-Hydrolyse in aktives Clindamycin um.
Resistenz
Resistenz gegen Clindamycin wird am häufigsten durch Modifikation der Zielstelle auf dem Ribosom verursacht, üblicherweise durch chemische Modifikation von RNA-Basen durch Punktmutationen in RNA oder gelegentlich in Proteinen. In einigen Organismen wurde eine Kreuzresistenz zwischen Lincosamiden, Makroliden und Streptograminen B nachgewiesen. Kreuzresistenz wurde zwischen Clindamycin und Lincomycin nachgewiesen.
Antibakterielle Aktivität
Kultur- und Empfindlichkeitstests von Bakterien werden nicht routinemäßig durchgeführt, um die Diagnose einer bakteriellen Vaginose zu stellen (siehe INDIKATIONEN UND VERWENDUNG); Standardmethode für die Empfindlichkeitsprüfung der potenziellen bakteriellen Erreger, Gardnerella vaginalis, Mobiluncus spp., oder Mycoplasma hominis, wurde nicht definiert.
Die folgenden In-vitro-Daten sind verfügbar, ihre klinische Signifikanz ist jedoch unbekannt. Clindamycin ist in vitro gegen die meisten Isolate der folgenden Organismen wirksam, von denen berichtet wird, dass sie mit bakterieller Vaginose assoziiert sind:
- Bacteroides spp.
- Gardnerella vaginalis
- Mobiluncus spp.
- Mycoplasma hominis
- Peptostreptococcus spp.
Indikationen und Verwendung für Cleocin Vaginal Creme
Cleocin Vaginal Creme 2%, ist angezeigt in die behandlung von bakterielle vaginose (früher bezeichnet als Haemophilus vaginitis, Gardnerella vaginitis, unspezifische vaginitis, Corynebacterium vaginitis, oder anaerobe vaginose). Cleocin Vaginalcreme 2%, kann verwendet werden, um nicht schwangere Frauen und schwangere Frauen während des zweiten und dritten Trimesters zu behandeln. (Siehe KLINISCHE STUDIEN.)
HINWEIS: Für die Zwecke dieser Indikation wird eine klinische Diagnose einer bakteriellen Vaginose üblicherweise durch das Vorhandensein eines homogenen Vaginalausflusses definiert, der (a) einen pH-Wert von mehr als 4,5 aufweist, (b) einen „fischigen“ Amingeruch abgibt, wenn er mit einer 10% igen KOH-Lösung gemischt wird, und (c) bei mikroskopischer Untersuchung Clue-Zellen enthält. Zu den Gram-Färbungsergebnissen, die mit der Diagnose einer bakteriellen Vaginose übereinstimmen, gehören (a) eine deutlich reduzierte oder fehlende Lactobacillus-Morphologie, (b) das Vorherrschen des Gardnerella-Morphotyps und (c) fehlende oder wenige weiße Blutkörperchen.
Andere Erreger, die häufig mit Vulvovaginitis in Verbindung gebracht werden, z. B. Trichomonas vaginalis, Chlamydia trachomatis, N. gonorrhoeae, Candida albicans und Herpes-simplex-Virus, sollten ausgeschlossen werden.
Kontraindikationen
Cleocin Vaginalcreme 2% ist bei Personen mit Überempfindlichkeit gegen Clindamycin, Lincomycin oder einen der Bestandteile dieser Vaginalcreme in der Vorgeschichte kontraindiziert. Cleocin Vaginalcreme 2% ist auch bei Personen mit regionaler Enteritis, Colitis ulcerosa oder „Antibiotika-assoziierter“ Colitis in der Vorgeschichte kontraindiziert.
Warnhinweise
Pseudomembranöse Kolitis wurde mit fast allen antibakteriellen Wirkstoffen, einschließlich Clindamycin, berichtet und kann im Schweregrad von leicht bis lebensbedrohlich reichen. Oral und parenteral verabreichtes Clindamycin wurde mit schwerer Kolitis in Verbindung gebracht, die tödlich enden kann. Durchfall, blutiger Durchfall und Kolitis (einschließlich pseudomembranöser Kolitis) wurden bei der Verwendung von oral und parenteral verabreichtem Clindamycin sowie bei topischen (dermalen und vaginalen) Formulierungen von Clindamycin berichtet. Daher ist es wichtig, diese Diagnose bei Patienten zu berücksichtigen, die nach der Verabreichung von Clindamycin Durchfall haben, auch wenn sie vaginal verabreicht werden, da ungefähr 5% der Clindamycindosis systemisch aus der Vagina resorbiert werden.
Die Behandlung mit antibakteriellen Mitteln verändert die normale Flora des Dickdarms und kann das Überwachsen von Clostridien ermöglichen.Studien zeigen, dass ein von Clostridium difficile produziertes Toxin eine Hauptursache für „Antibiotika-assoziierte“ Kolitis ist.
Nachdem die Diagnose einer pseudomembranösen Kolitis gestellt wurde, sollten therapeutische Maßnahmen eingeleitet werden. Leichte Fälle von pseudomembranöser Kolitis sprechen normalerweise auf das Absetzen des Arzneimittels allein an. In mittelschweren bis schweren Fällen sollte die Behandlung mit Flüssigkeiten und Elektrolyten, die Proteinergänzung und die Behandlung mit einem antibakteriellen Arzneimittel, das klinisch gegen Clostridium difficile Colitis wirksam ist, in Betracht gezogen werden.
Während oder nach einer antimikrobiellen Behandlung können Symptome einer pseudomembranösen Kolitis auftreten.
Vorsichtsmaßnahmen
Allgemeines
Cleocin Vaginalcreme 2% enthält Inhaltsstoffe, die Brennen und Reizungen des Auges verursachen. Bei versehentlichem Kontakt mit dem Auge das Auge mit reichlich kaltem Leitungswasser ausspülen.
Die Verwendung von Cleocin Vaginalcreme 2% kann zum Überwachsen nicht empfänglicher Organismen in der Vagina führen. In klinischen Studien mit 600 nicht schwangeren Frauen, die 3 Tage lang behandelt wurden, wurde Candida albicans bei 8, 8% der Patienten entweder symptomatisch oder kulturell nachgewiesen. Bei 9% der Patienten wurde Vaginitis registriert. In klinischen Studien mit 1325 nicht schwangeren Frauen, die 7 Tage lang behandelt wurden, wurde Candida albicans bei 10, 5% der Patienten entweder symptomatisch oder kulturell nachgewiesen. Vaginitis wurde bei 10,7% der Patienten registriert. Bei 180 schwangeren Frauen, die 7 Tage lang behandelt wurden, wurde Candida albicans bei 13, 3% der Patienten entweder symptomatisch oder kulturell nachgewiesen. Bei 7,2% der Patienten wurde eine Vaginitis festgestellt. Candida albicans, wie hier berichtet, umfasst die Begriffe: vaginale Moniliasis und Moniliasis (Körper als Ganzes). Vaginitis umfasst die Begriffe: vulvovaginale Störung, Vulvovaginitis, vaginaler Ausfluss, trichomonale Vaginitis und Vaginitis.
Informationen für den Patienten
Der Patient sollte angewiesen werden, während der Behandlung mit diesem Produkt keinen Vaginalverkehr zu führen oder andere Vaginalprodukte (wie Tampons oder Duschen) zu verwenden.
Der Patient sollte auch darauf hingewiesen werden, dass diese Creme Mineralöl enthält, das Latex- oder Gummiprodukte wie Kondome oder vaginale Verhütungsmembranen schwächen kann. Daher wird die Verwendung solcher Produkte innerhalb von 72 Stunden nach der Behandlung mit Cleocin Vaginalcreme 2% nicht empfohlen.
Arzneimittelwechselwirkungen
Es wurde gezeigt, dass systemisches Clindamycin neuromuskuläre Blockierungseigenschaften aufweist, die die Wirkung anderer neuromuskulärer Blockierungsmittel verstärken können. Daher sollte es bei Patienten, die solche Mittel erhalten, mit Vorsicht angewendet werden.
Karzinogenese, Mutagenese, Beeinträchtigung der Fertilität
Es wurden keine Langzeitstudien an Tieren mit Clindamycin durchgeführt, um das karzinogene Potenzial zu bewerten.
Die durchgeführten Genotoxizitätstests umfassten einen Mikronukleustest an Ratten und einen Ames-Test. Beide Tests waren negativ. Fertilitätsstudien an Ratten, die oral mit bis zu 300 mg/kg/Tag (dem 31-fachen der Exposition beim Menschen, bezogen auf mg/m2) behandelt wurden, zeigten keine Auswirkungen auf die Fertilität oder die Paarungsfähigkeit.
Schwangerschaft
Teratogene Wirkungen
In klinischen Studien mit schwangeren Frauen wurde die systemische Verabreichung von Clindamycin während des zweiten und dritten Trimesters nicht mit einer erhöhten Häufigkeit angeborener Anomalien in Verbindung gebracht.
Clindamycin Vaginalcreme sollte während des ersten Schwangerschaftstrimesters nur angewendet werden, wenn dies eindeutig erforderlich ist und der Nutzen die Risiken überwiegt. Es gibt keine adäquaten und gut kontrollierten Studien bei schwangeren Frauen während des ersten Schwangerschaftstrimesters.
Cleocin Vaginalcreme 2% wurde bei schwangeren Frauen während des zweiten Trimesters untersucht. Bei Frauen, die sieben Tage lang behandelt wurden, wurde bei 1, 1% der Patienten, die Clindamycin Vaginalcreme erhielten, über abnormale Wehen berichtet 2% im Vergleich zu 0, 5% der Patienten, die Placebo erhielten.
Reproduktionsstudien wurden an Ratten und Mäusen mit oralen und parenteralen Dosen von Clindamycin bis zu 600 mg / kg/ Tag (62- bzw. 25-fache der maximalen Exposition des Menschen bezogen auf die Körperoberfläche) durchgeführt und haben keine Hinweise auf eine Schädigung des Fötus durch Clindamycin ergeben. Gaumenspalten wurden bei Feten eines Mausstamms beobachtet, der intraperitoneal mit Clindamycin in einer Dosis von 200 mg / kg/ Tag behandelt wurde (etwa das 10-fache der empfohlenen Dosis basierend auf Körperoberflächenumrechnungen). Da dieser Effekt bei anderen Mausstämmen oder bei anderen Spezies nicht beobachtet wurde, kann der Effekt stammspezifisch sein.
Stillende Mütter
Begrenzte veröffentlichte Daten basierend auf Brustmilchproben berichten, dass Clindamycin in der menschlichen Muttermilch im Bereich von weniger als 0,5 bis 3,8 mcg / ml in Dosierungen von 150 mg oral bis 600 mg intravenös auftritt. Es ist nicht bekannt, ob Clindamycin nach Anwendung von vaginal verabreichtem Clindamycinphosphat in die Muttermilch übergeht.
Clindamycin kann negative Auswirkungen auf die Magen-Darm-Flora des gestillten Säuglings haben. Wenn Clindamycin von einer stillenden Mutter benötigt wird, ist dies kein Grund, das Stillen abzubrechen, aber ein alternatives Medikament kann bevorzugt werden. Überwachen Sie das gestillte Kind auf mögliche Nebenwirkungen auf die Magen-Darm-Flora, wie Durchfall, Candidiasis (Soor, Windeldermatitis) oder selten Blut im Stuhl, was auf eine mögliche Antibiotika-assoziierte Kolitis hinweist.
Die entwicklungs- und gesundheitlichen Vorteile des Stillens sollten zusammen mit dem klinischen Bedarf der Mutter an Clindamycin und möglichen nachteiligen Auswirkungen von Clindamycin oder der zugrunde liegenden Erkrankung der Mutter auf das gestillte Kind berücksichtigt werden.
Pädiatrische Anwendung
Sicherheit und Wirksamkeit bei pädiatrischen Patienten wurden nicht nachgewiesen.
Geriatrische Anwendung
Klinische Studien für Cleocin Vaginalcreme 2% umfassten keine ausreichende Anzahl von Probanden ab 65 Jahren, um festzustellen, ob sie anders reagieren als jüngere Probanden. Andere berichtete klinische Erfahrungen haben keine Unterschiede in den Reaktionen zwischen älteren und jüngeren Patienten festgestellt.
Nebenwirkungen
Klinische Studien
Nicht schwangere Frauen
In klinischen Studien mit nicht schwangeren Frauen brachen 1, 8% von 600 Patienten, die 3 Tage lang mit Cleocin Vaginalcreme behandelt wurden, 2% und 2, 7% von 1325 Patienten, die 7 Tage lang behandelt wurden, die Therapie aufgrund arzneimittelbedingter unerwünschter Ereignisse ab. Medizinische Ereignisse, die als verwandt, wahrscheinlich verwandt, möglicherweise verwandt oder in unbekanntem Zusammenhang mit vaginal verabreichter Clindamycinphosphat-Vaginalcreme 2% beurteilt wurden, wurden bei 20, 7% der Patienten berichtet, die 3 Tage lang behandelt wurden, und bei 21, 3% der Patienten, die 7 Tage lang behandelt wurden. Ereignisse, die bei ≥1% der Patienten auftraten, die Clindamycinphosphat-Vaginalcreme 2% erhielten, sind in Tabelle 1 aufgeführt.
| Ereignis | Cleocin Vaginalcreme | |
|---|---|---|
| 3 Tag n=600 |
7 Tag n=1325 |
|
| Urogenitalen | ||
| Vaginale Moniliasis | 7.7 | 10.4 |
| Vulvovaginitis | 6.0 | 4.4 |
| Vulvovaginale Störung | 3.2 | 5.3 |
| Trichomonale Vaginitis | 0 | 1.3 |
| Körper als Ganzes | ||
| Moniliasis (Körper) | 1.3 | 0.2 |
Andere Ereignisse, die in < 1% der Clindamycin-Vaginalcreme-2% -Gruppen auftraten, umfassen:
Urogenitalsystem: vaginaler Ausfluss, Metrorrhagie, Harnwegsinfektion, Endometriose, Menstruationsstörung, Vaginitis / vaginale Infektion und vaginale Schmerzen.
Körper als Ganzes: lokalisierte Bauchschmerzen, generalisierte Bauchschmerzen, Bauchkrämpfe, Mundgeruch, Kopfschmerzen, bakterielle Infektionen, entzündliche Schwellungen, allergische Reaktionen und Pilzinfektionen.
Verdauungssystem: Übelkeit, Erbrechen, Verstopfung, Dyspepsie, Blähungen, Durchfall und Magen-Darm-Störungen.
Endokrines System: Hyperthyreose.
Zentralnervensystem: Schwindel und Schwindel.
Atmungssystem: Epistaxis.
Haut: Pruritus (Nicht-Applikationsstelle), Moniliasis, Hautausschlag, makulopapulöser Hautausschlag, Erythem und Urtikaria.
Besondere Sinne: geschmack Perversion.
Schwangere Frauen
In einer klinischen Studie mit schwangeren Frauen im zweiten Trimester brachen 1, 7% der 180 Patienten, die 7 Tage lang behandelt wurden, die Therapie aufgrund arzneimittelbedingter unerwünschter Ereignisse ab. Medizinische Ereignisse, die als verwandt, wahrscheinlich verwandt, möglicherweise verwandt oder in unbekanntem Zusammenhang mit vaginal verabreichter Clindamycinphosphat-Vaginalcreme 2% beurteilt wurden, wurden bei 22, 8% der schwangeren Patienten berichtet. Ereignisse, die bei ≥1% der Patienten auftraten, die entweder Clindamycinphosphat-Vaginalcreme 2% oder Placebo erhielten, sind in Tabelle 2 aufgeführt.
| Ereignis | CLEOCIN Vaginalcreme |
Placebo |
|---|---|---|
| 7 TAG n=180 |
7 TAG n=184 |
|
| Urogenitalen | ||
| Vaginale Moniliasis | 13.3 | 7.1 |
| Vulvovaginale Störung | 6.7 | 7.1 |
| Abnormale Arbeit | 1.1 | 0.5 |
| Körper als Ganzes | ||
| Pilzinfektion | 1.7 | 0 |
| Haut | ||
| Pruritus, Nicht-Applikationsstelle | 1.1 | 0 |
Andere Ereignisse, die in < 1% der Clindamycin-Vaginalcreme-2% -Gruppe auftraten, umfassen:
Urogenitalsystem: Dysurie, Metrorrhagie, Vaginalschmerzen und trichomonale Vaginitis.
Körper als Ganzes: Infektion der oberen Atemwege.
Haut: Pruritus (topische Applikationsstelle) und Erythem.
Erfahrungen nach Markteinführung
Da diese Reaktionen freiwillig aus einer Population unsicherer Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Im Zeitraum nach Markteinführung gab es Fallberichte über pseudomembranöse Kolitis unter Verwendung von Clindamycinphosphat-Vaginalcreme.
Andere Clindamycin-Formulierungen
Clindamycin Vaginal Cream bietet minimale Spitzenserumspiegel und systemische Exposition (AUCs) von Clindamycin im Vergleich zu 100 mg oraler Clindamycin-Dosierung. Obwohl diese niedrigeren Expositionsniveaus weniger wahrscheinlich die üblichen Reaktionen hervorrufen, die bei oralem Clindamycin beobachtet werden, kann die Möglichkeit dieser und anderer Reaktionen derzeit nicht ausgeschlossen werden. Daten aus gut kontrollierten Studien, in denen oral verabreichtes Clindamycin direkt mit vaginal verabreichtem Clindamycin verglichen wurde, liegen nicht vor.
Die folgenden Nebenwirkungen und veränderten Labortests wurden bei oraler oder parenteraler Anwendung von Clindamycin berichtet:
Gastrointestinal: Bauchschmerzen, Ösophagitis, Übelkeit, Erbrechen, Durchfall und pseudomembranöse Kolitis. (Siehe WARNUNGEN.)
Hämatopoetisch: Vorübergehende Neutropenie (Leukopenie), Eosinophilie, Agranulozytose und Thrombozytopenie wurden berichtet. In keinem dieser Berichte konnte eine direkte ätiologische Beziehung zur gleichzeitigen Clindamycin-Therapie hergestellt werden.
Überempfindlichkeitsreaktionen: Makulopapulöser Hautausschlag und Urtikaria wurden während der medikamentösen Therapie beobachtet. Generalisierte leichte bis mittelschwere morbilliforme Hautausschläge sind die am häufigsten berichteten Nebenwirkungen. Seltene Fälle von Erythema multiforme, von denen einige dem Stevens-Johnson-Syndrom ähneln, wurden mit Clindamycin in Verbindung gebracht. Einige Fälle von anaphylaktoiden Reaktionen wurden berichtet. Wenn eine Überempfindlichkeitsreaktion auftritt, sollte das Arzneimittel abgesetzt werden.
Leber: Während der Clindamycin-Therapie wurden Gelbsucht und Anomalien bei Leberfunktionstests beobachtet.
Bewegungsapparat: Seltene Fälle von Polyarthritis wurden berichtet.
Nieren: Obwohl kein direkter Zusammenhang von Clindamycin mit Nierenschäden festgestellt wurde, wurde in seltenen Fällen eine Nierenfunktionsstörung beobachtet, die durch Azotämie, Oligurie und / oder Proteinurie nachgewiesen wurde.
Überdosierung
Vaginal applizierte Clindamycinphosphat-Vaginalcreme 2% konnte in ausreichenden Mengen absorbiert werden, um systemische Wirkungen zu erzielen. (Siehe WARNUNGEN.)
Cleocin Vaginalcreme Dosierung und Verabreichung
Die empfohlene Dosis beträgt einen Applikator Clindamycinphosphat Vaginalcreme 2% (5 Gramm mit ungefähr 100 mg Clindamycinphosphat) intravaginal, vorzugsweise vor dem Schlafengehen, an 3 oder 7 aufeinanderfolgenden Tagen bei nicht schwangeren Patienten und an 7 aufeinanderfolgenden Tagen bei schwangeren Patienten. (Siehe KLINISCHE STUDIEN.)
Wie wird Cleocin Vaginalcreme geliefert
Cleocin Vaginalcreme 2% (Clindamycinphosphat Vaginalcreme) wird wie folgt geliefert:
40 g Tube (mit 7 Einwegapplikatoren) NDC 0009-3448-01
Bei kontrollierter Raumtemperatur von 20 ° bis 25 ° C (68 ° bis 77 ° F) lagern. Vor dem Einfrieren schützen.
Klinische Studien
In zwei klinischen Studien mit 674 auswertbaren nicht schwangeren Frauen mit bakterieller Vaginose, die Cleocin Vaginalcreme 2% für 3 oder 7 Tage verglichen, lagen die klinischen Heilungsraten, die 1 Monat nach der Therapie bestimmt wurden, zwischen 72% und 81% für die 3-tägige Behandlung und 84% bis 86% für die 7-tägige Behandlung.
| CLEOCIN 3 Tage | CLEOCIN 7 Tage | |||
|---|---|---|---|---|
| US-Studie | 94/131 | 72% | 110/128 | 86% |
| Europäische Studie | 161/199 | 81% | 181/216 | 84% |
In einer klinischen Studie mit 249 auswertbaren schwangeren Patienten im zweiten und dritten Trimester, die 7 Tage lang behandelt wurden, betrug die klinische Heilungsrate, bestimmt 1 Monat nach der Therapie, 60% (77/129) im Clindamycin-Arm und 9% (11/120) für die fahrzeug arm. Die Bestimmung der klinischen Heilung basierte auf dem Fehlen eines „fischigen“ Amingeruchs, wenn der vaginale Ausfluss mit einer 10% igen KOH-Lösung gemischt wurde, und dem Fehlen von Clue-Zellen bei mikroskopischer Untersuchung.
Nur Rx
Das Etikett dieses Produkts wurde möglicherweise aktualisiert. Für aktuelle vollständige Verschreibungsinformationen, besuchen Sie bitte www.pfizer.com.

LAB-0043-12.0
Überarbeitet 03/2020
GEBRAUCHSANWEISUNG
Einweg-Kunststoffapplikatoren werden mit diesem Paket geliefert. Sie wurden entwickelt, um eine ordnungsgemäße vaginale Verabreichung der Creme zu ermöglichen.
Entfernen Sie die Kappe vom Cremetubus. Schrauben Sie einen Kunststoffapplikator auf das Gewindeende des Rohrs.
Rohr von unten rollen, vorsichtig zusammendrücken und das Medikament in den Applikator drücken. Der Applikator wird gefüllt, wenn der Kolben seinen vorbestimmten Haltepunkt erreicht.
Schrauben Sie den Applikator vom Röhrchen ab und setzen Sie die Kappe wieder auf.
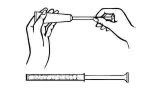
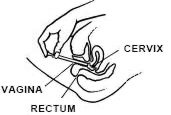
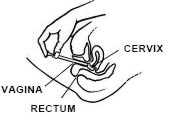
Fassen Sie den Applikatorzylinder auf dem Rücken fest und führen Sie ihn so weit wie möglich in die Vagina ein, ohne Beschwerden zu verursachen.
Drücken Sie den Kolben langsam bis zum Anschlag.
Applikator vorsichtig aus der Scheide nehmen und Applikator entsorgen.
DENKEN SIE DARAN, EINEN APPLICATORFUL JEDE NACHT VOR DEM SCHLAFENGEHEN ODER WIE VON IHREM ARZT VERSCHRIEBEN ANZUWENDEN.
GEBRAUCHSANWEISUNG FÜR PATIENTEN
Diese Packung enthält Einweg-Applikatoren aus Kunststoff. Die Applikatoren sind für die ordnungsgemäße Verabreichung der Creme in die Vagina ausgelegt.
Entfernen Sie die Kappe vom Cremetubus und schrauben Sie den Kunststoffapplikator auf den Tubus.
Drücken Sie das Röhrchen vorsichtig vom unteren Ende und drücken Sie das Medikament in den Applikator. Der Applikator ist voll, wenn der Kolben seine maximale Länge erreicht.
Schrauben Sie den Applikator vom Röhrchen ab und setzen Sie die Kappe wieder auf.
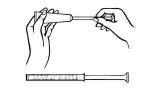
Legen Sie sich auf den Rücken und halten Sie den Applikator fest, führen Sie ihn so weit wie möglich in die Vagina ein, ohne Beschwerden zu verursachen.
Drücken Sie den Kolben langsam bis zum Anschlag.
Entfernen Sie den Applikator vorsichtig aus der Scheide und entsorgen Sie ihn.
DENKEN SIE DARAN, JEDEN ABEND VOR DEM SCHLAFENGEHEN ODER NACH ANWEISUNG IHRES ARZTES EINEN VOLLEN APPLIKATOR AUFZUTRAGEN.
LAB-1058-1.0
PRINCIPAL DISPLAY PANEL – 40 g Tube Label
NDC 0009-3448-01
40 Gramm
Nur Rx
Cleocin®
Clindamycinphosphat
Vaginalcreme, USP
Zur intravaginalen Anwendung Nur
2%*
PRINCIPAL DISPLAY PANEL – 40 g Tube Karton
NDC 0009-3448-01
40 Gramm mit 7 Applikatoren
Nur Rx
Cleocin®
Clindamycinphosphat
Vaginalcreme, USP
Nur zur intravaginalen Anwendung
2%*
Pfizer
Vertrieben von
Pharmacia & Upjohn Co
Abteilung von Pfizer Inc, NY, NY 10017
| CLEOCIN Clindamycin Phosphat Creme |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Etikettierer – Pharmacia und Upjohn Company LLC (618054084)
| Niederlassung | |||
| Name | Adresse | ID/FEI | Vorgänge |
| Pharmacia und Upjohn Company LLC | 618054084 | ANALYSE (0009-3448), API-HERSTELLUNG (0009-3448), ETIKETT (0009-3448), HERSTELLUNG (0009-3448), PACKUNG(0009-3448) | |
Mehr über Cleocin Vaginal (clindamycin topical)
- Nebenwirkungen
- Während der Schwangerschaft oder Stillzeit
- Dosierungsinformationen
- Wechselwirkungen mit anderen Arzneimitteln
- Preise & Gutscheine
- Generische Verfügbarkeit
- Arzneimittelklasse: vaginale Antiinfektiva
Verbraucherressourcen
- Weiterführende Literatur
Professionelle Ressourcen
- Verschreibungsinformationen
- Clindamycin Vaginalcreme (FDA)
Andere Marken Clindamax, Clindagel, Clindesse, Clindacin ETZ, … +4 mehr
Andere Formulierungen
- Cleocin
- … +4 mehr
Verwandte Behandlungsleitfäden
- Bakterielle Vaginitis
Medizinischer Haftungsausschluss