Einleitung
Healthcare-assoziierte Infektionen (HAIs) wie Bakteriämie, die durch multiresistente Pseudomonas aeruginosa-Stämme verursacht werden, führen zu einer erhöhten Morbidität und Mortalität, verlängern den Krankenhausaufenthalt und höhere Kosten im Vergleich zu Infektionen, die durch anfällige Stämme verursacht werden.1-3 Infektionen, die durch diese resistenten Mikroorganismen verursacht werden, sind häufig mit Alter, Krebs, Herzerkrankungen, Diabetes, intensivem Einsatz von Antibiotika und invasiven Verfahren wie Hämodialyse, mechanischem Beatmungskatheter, Tracheotomie und anderen verbunden.4
Die zunehmende Inzidenz von multiresistentem P. aeruginosa als Ursache einer nosokomialen Infektion ist ein globales Problem, eine Folge der Fähigkeit dieses Mikroorganismus, während einer antimikrobiellen Chemotherapie Resistenzen gegen fast alle anderen antimikrobiellen Wirkstoffe zu entwickeln, entweder durch Selektion von Mutationen in chromosomalen Genen oder durch horizontalen Gentransfer.5,6 In Brasilien ist dieses Problem noch schwerwiegender, da der Einsatz von Antibiotika, insbesondere β-Lactamen, Carbapenemen und Fluorchinolonen, sehr hoch ist.7,8 Der Widerstand in P. aeruginosa zu Carbapenems ist bis zu 60% in einigen brasilianischen Krankenhausen9,10 und tritt hauptsächlich durch die Produktion von Metallo-β-Lactamasen (MBL) auf.
Es sind zehn Unterklassen der MBL-Enzyme bekannt: IMP (Imipenemase), VIM (Verona Imipenemase), SPM-1 (São Paulo MBL), GIM (deutsche Imipenemase), SIM-1 (Seul Imipenemase), 11 AIM-1 (australische Imipenemase), 12 KHM (Kyorin University Hospital), 13 NDM-1 (New Delhi MBL),14 DIM-1 (niederländische Imipenemase), 15 und TMB (Tripoli MBL).16 In Brasilien sind die am weitesten verbreiteten Unterklassen IMP-1 und SPM-1.11
Mehrere andere Virulenzgene sowie die Biofilmbildung können zur Pathogenität schwerer Infektionen beitragen, insbesondere auch bei invasiven Eingriffen.17 Unter den wichtigsten Virulenzfaktoren, die in der Literatur beschrieben werden, heben wir diejenigen hervor, die mit der Adhäsion von Mikroorganismen an Wirtszellen durch Flagellen, Fimbrien und Alginat in Zusammenhang stehen18 und diejenigen, die die Störung der epithelialen Integrität erleichtern und das Immunsystem stören, wie Elastase, Phospholipase C und Protease A, weiter Exotoxin A, Pyocyanin und Pyoverdin.19 Die Biofilmproduktion ist insbesondere mit der Schwierigkeit von Antibiotika verbunden, in die Zellen einzudringen, da sie eine polymere Matrix aus Polysacchariden, Proteinen und DNA absondern.20,21
Ziel dieser Studie war es, die Risikofaktoren für eine durch Carbapenem-resistente P. aeruginosa verursachte Bakteriämie sowie die Produktion von MBL zu identifizieren. Darüber hinaus untersuchten wir die Häufigkeit von Virulenzgenen und ihre Fähigkeit, Biofilme zu bilden.
Materialien und Methodenpatienten und Krankenhaus
Die P. Aeruginosa-Stämme wurden von Patienten gewonnen, die in das Universitätsklinikum Uberlandia (Brasilien) der Bundesuniversität von Uberlândia (HC-UFU) eingeliefert und im Zeitraum von Mai 2009 bis Dezember 2012 aus dem Mikrobiologielabor des HC-UFU gewonnen wurden, wobei nur die erste Infektionsepisode berücksichtigt wurde.
Studiendesign
Wir führten eine Fallstudie (Patienten mit Bakteriämie aufgrund von P. aeruginosa resistent gegen Carbapeneme) versus Kontrolle (Patienten mit Bakteriämie verursacht durch P. aeruginosa anfällig für Carbapeneme) durch, um Risikofaktoren bei Patienten zu identifizieren, die mit P infiziert sind. aeruginosa resistent gegen Carbapeneme. Darüber hinaus bewerteten wir sekundäre Ergebnisse, einschließlich Krankenhausaufenthalte, Aufnahme auf die Intensivstation (ICU) und Verwendung von invasiven Verfahren. Demografische, klinische und epidemiologische Merkmale jedes in die Studie einbezogenen Patienten wurden aus den klinischen Aufzeichnungen gewonnen.
Definitionen
Healthcare-assoziierte Infektionen (HAIs) sind definiert als jede Infektion, die nach der Aufnahme eines Patienten in ein Krankenhaus erworben wurde. HAIs können sich während des Krankenhausaufenthalts oder nach der Entlassung manifestieren, da sie mit dem Krankenhausaufenthalt oder den während des Krankenhausaufenthalts durchgeführten Eingriffen zusammenhängen.22 Bakteriämie kann nach Angaben der Zentren für die Kontrolle und Prävention von Krankheiten 23 als das Vorhandensein lebensfähiger Bakterien im Blut definiert werden, die durch ein positives Blutkulturergebnis dokumentiert sind. Die Bakteriämie wurde als primär eingestuft, wenn sie nicht mit einem anderen Infektionsherd oder mit einem intravenösen Katheter zusammenhing, und als sekundär, wenn sie klinisch mit einer Infektion an einer anderen anatomischen Stelle zusammenhing.9 Multiresistenz ist definiert als erworbene Nichtanfälligkeit gegenüber mindestens einem Wirkstoff in drei oder mehr antimikrobiellen Kategorien.24 Die antimikrobielle Therapie wurde als ungeeignet erachtet, wenn ein isolierter Mikroorganismus in vitro eine Resistenz gegen antimikrobielle Mittel zeigte, die zur Behandlung des Patienten verwendet wurden, und / oder 24 Stunden nach der Diagnose mikrobieller Infektionen keine Behandlung erfolgte.25
Klinisch mikrobiologische und molekulare Tests
Kulturen wurden nach dem vom Mikrobiologielabor des HC-UFU verwendeten Protokoll gesammelt und mit dem automatisierten System BACT/Alert® (bioMérieux, Durham, USA) verarbeitet. Die Identifizierungs- und antimikrobiellen Empfindlichkeitstests wurden automatisiert unter Verwendung des VITEK II-Systems durchgeführt, und die Stämme, die eine mittlere Empfindlichkeit aufwiesen, wurden als resistent angesehen. Qualitätskontrollprotokolle wurden nach den Standards des Clinical and Laboratory Standard Institute verwendet.26-28 Das Carbapenem-resistente P. aeruginosa-Isolate wurden phänotypisch auf MBL-Produktion unter Verwendung von Doppelscheiben-Synergie-Tests gescreent, wie zuvor beschrieben.29,30 Zusätzlich wurde zur Beurteilung des Vorhandenseins von MBL-Genen in P. aeruginosa-Stämmen eine Multiplex-PCR durchgeführt, wie zuvor beschrieben.31 Die Zyklusbedingungen waren: 94 °C für 5min, gefolgt von 30 Denaturierungszyklen bei 94 °C für 30s, Tempern bei 53°C für 45s und Extension bei 72°C für 30s, gefolgt von Endextension bei 72°C bei 10min, alles in einem MasterCycler personal (Eppendorf). Der Nachweis von Virulenzgenen, die alkalische Protease (aprA), Elastase A (lasA), Elastase (lasB), 32 hämolytische Phospholipase C (plcH), nicht hämolytische Phospholipase C (plcN), Exotoxin A (toxA) und Alginat (algD) kodieren, 33 wurden durch Uniplex-PCR unter Verwendung des folgenden Protokolls bestimmt: 94 ° C für 3min, 30 Zyklen bei 94 ° C für 30s, 55 ° C für 1min und 72 für 1min und 30s und 72°C für 5min.
Initial Adhäsion assay34
Um die Initialadhäsion zu bewerten, wurden 200µL einer Zellsuspension mit 1×107 Zellen/ml, hergestellt in TSB, zu 96-well Polystyrolplatten gegeben. Die anfängliche Haftung wurde für 2h bei 37 ° C mit Rotation bei 120 U / min zugelassen. Bakterien, die in 96-Well-Polystyrolplatten anhafteten, wurden zweimal mit einer 0,9% igen NaCl-Lösung gewaschen und durch Abkratzen der Vertiefungen für 90s geerntet. Die erhaltene Zellsuspension wurde zur koloniebildenden Einheit (CFU) -Enumeration auf TSA plattiert. Alle Experimente wurden in dreifacher Ausfertigung in drei unabhängigen Experimenten durchgeführt. Als Positivkontrolle wurde der Stamm ATCC15692 (PAO1) und als Negativkontrolle TSB ohne Bakterien verwendet.
Biofilmbildungs-Assay35
200 µl einer Zellsuspension mit 1 × 107 Zellen / ml, hergestellt in TSB, wurden zu 96-Well-Polystyrolplatten gegeben. Biofilmbildung wurde für 24h bei 37°C mit Rotation bei 120rpm auftreten gelassen. In 96-Well-Polystyrolplatten gewachsene Bakterien wurden zweimal mit einer 0,9%igen NaCl-Lösung gewaschen und in umgekehrter Position trocknen gelassen. Die Gesamtbiomasse wurde wie zuvor beschrieben durch Methanolfixierung (Merck), Kristallviolettfärbung (Merck) und Essigsäureelution (Merck) gemessen. Der eluierte Farbstoff wurde aus jeder Vertiefung entfernt und in eine neue 96-Well-Mikrotiterplatte gegeben, und seine Absorption wurde auf einem ELISA-Plattenleser (BioTek Instruments Inc., Vermont, USA) bei 570 nm. Die Experimente wurden mit acht Replikaten für jeden Stamm in drei unabhängigen Experimenten durchgeführt. TSB ohne Bakterien wurde als Negativkontrolle verwendet. Der Grenzwert für die optische Dichte (ODc) wurde als drei Standardabweichungen (SD) über dem Mittelwert der optischen Dichte (OD) der Negativkontrolle ermittelt: ODc = durchschnittliche OD der Negativkontrolle + 3x SD der Negativkontrolle. Zur leichteren Interpretation der Ergebnisse wurden Stämme nach optischer Dichte in folgende Kategorien eingeteilt: (ODi): ODi≤ODc oder ODc
ODi2x ODc =Nicht-Biofilmproduzent /schwacher Biofilmproduzent; 2x ODcODi4x ODc=moderater Biofilmproduzent; 4x ODcODi=starker Biofilmproduzent.Biofilmzellkonzentration36
Die Biofilmzellkonzentration wurde durch KBE-Enumeration bestimmt. Nach Biofilmbildung wurden die Biofilme zweimal mit einer 0,9%igen NaCl-Lösung gewaschen und nach 90s Abkratzen der Wells geerntet. Die erhaltene Zellsuspension wurde auf TSA-Platten plattiert. Alle Experimente wurden in dreifacher Ausfertigung durchgeführt, bei drei unabhängigen Gelegenheiten.
Statistische Analyse
Die statistische Analyse wurde mit GraphPad Prism v.5 (GraphPad Software, San Diego, CA) durchgeführt. Quantitative Assays wurden unter Verwendung des Kruskal–Wallis unter Anwendung des Dunn’s multiple comparison Test verglichen. Alle Tests wurden mit einem Konfidenzniveau von 95% durchgeführt und die statistische Signifikanz wurde als p
0,05 definiert.Ethische Zulassung
Die Forschungsethikkommission der Federal University Uberlandia hat unser Studiendesign bewertet und genehmigt.
Ergebnisse
Vom 1. Mai 2009 bis zum 31. Dezember 2012 wurde im mikrobiologischen Labor des Universitätsklinikums eine Krankenhausüberwachung der Inzidenz von P. aeruginosa-Bakteriämie durchgeführt. In diesem Zeitraum wurden 157 nicht-repetitive Patienten mit P. aeruginosa-Bakteriämie in die Studie aufgenommen. Die detaillierten Informationen zu Faktoren, die mit der Entwicklung von Bakteriämie und den klinischen und demografischen Merkmalen sowie der Verteilung der Patienten auf die Stationen verbunden sind, sind in den Tabellen 1 und 2 dargestellt. Die primäre Bakteriämie trat bei 75,8% auf, und diejenigen mit unbekanntem Fokus entfielen auf 62%.4% der Fälle. Sekundäre Bakteriämie entfielen 24,2% der Patienten, wo die Atemwege war der Schwerpunkt der Infektion (17,2%). Darüber hinaus hatten 43,9% der Patienten eine Bakteriämie mit Carbapenem-resistentem P. aeruginosa, und die meisten dieser Patienten wurden auf die Intensivstation aufgenommen. Die meisten Patienten waren männlich (66,8%), mit einem durchschnittlichen Krankenhausaufenthalt von 63,2 ± 80,17 Tagen und einem Durchschnittsalter von 52,01 ± 20,24 Jahren.
Verteilung der mit Pseudomonas aeruginosa infizierten Patienten in verschiedenen Einheiten des Klinischen Krankenhauses der Bundesuniversität von Uberlândia von Mai / 2009 bis Dezember / 2012.
| Kliniken | Gesamt | Carbapenem-resistente Pseudomonas aeruginosa |
|---|---|---|
| N=157 (%) | N=69 (%) | |
| Chirurgie | 35 (22.3) | 16 (23.2) |
| Medizinische Klinik | 24 (15.3) | 10 (14.5) |
| Onkologie | 14 (8.9) | 2 (2.9) |
| Notaufnahme | 9 (5.7) | 5 (7.3) |
| ICUa | 50 (31.9) | 31 (44.9) |
| Neonatale Intensivstation | 2 (1.3) | 0 |
| Pädiatrische Intensivstation | 2 (1.3) | 1 (1.5) |
| Transplantation | 2 (1.3) | 0 |
| Sonstigeb | 3 (1.9) | 0 |
Intensivstation.
Burneds, Thoraxschmerzeinheit.
Risikofaktoren im Zusammenhang mit Carbapenem-Resistenz bei Patienten mit Bakteriämie durch Pseudomonas aeruginosa.
| Risikofaktoren | Gesamt | Carbapenem-resistent | Multisensitiv | Univariat | Multivariat | ||
|---|---|---|---|---|---|---|---|
| N=157 (%) | N=69 (%) | N=65 (%) | ORb (CIc 95%) | pd | ODER (CI 95%) | p | |
| Alter-Mittelwert (Jahre) | 52.01±24.49 | 59.01±20.24 | 43.18±27.56 | – | 0.0009* | – | – |
| Männlich / weiblich | 105/52 (66.88/33.12) | 45 (65.22)/24 (34.78) | 43 (66.15)/22 (33.85) | 0.9593 (0.4698–1.959) | 0.9092 | – | – |
| Zeit des Krankenhausaufenthaltes, Mittelwert (Tage) | 63.2±80.17 | 60.01±48.97 | 68.86±110.4 | – | 0.3477 | – | – |
| Intensivstation | 74 (47.13) | 38 (55.07) | 22 (33.85) | 2.396 (1.190–4.822) | 0.0135 | – | – |
| Chirurgie | 69 (43.95) | 37 (53.62) | 20 (30.77) | 2.602 (1.281–5.282) | 0.0075* | – | – |
| Invasive Eingriffe (72h) | 139 (88.53) | 64 (92.75) | 54 (83.08) | 2.607 (0.8527–7.973) | 0.0843 | – | – |
| Mechanical ventilation | 89 (56.69) | 48 (69.56) | 28 (43.08) | 3.020 (1.485–6.144) | 0.002* | 3.0674 (1.22–7.73) | 0.0175 |
| Tracheostomy | 70 (44.58) | 43 (62.32) | 17 (26.15) | 4.670 (2.234–9.759) | * | – | – |
| Urinary catheter | 101 (64.33) | 52 (75.36) | 34 (52.31) | 2.789 (1.340–5.804) | 0.0054* | – | – |
| Venöser Zentralkatheter | 125 (79.62) | 59 (85.51) | 48 (73.85) | 2.090 (0.8761–4.984) | 0.0926 | – | – |
| Chirurgische Drainage | 24 (15.29) | 14 (20.29) | 7 (10.77) | 2.109 (0.7918–5.618) | 0.1297 | – | – |
| Sonden enterale/gastrische Ernährung | 109 (69.43) | 54 (78.26) | 40 (61.54) | 2.250 (1.053–4.810) | 0.0345* | 3.8347 (1.43–10.26) | 0.0074 |
| Hämodialyse | 39 (24.84) | 27 (39.13) | 8 (12.31) | 4.580 (1.892–11.09) | 0.0004* | ||
| Parenterale Ernährung | 25 (1.92) | 14 (20.29) | 8 (12.31) | 1.814 (0.7052–4.664) | 0.2125 | – | – |
| Komorbiditätsbedingungen | 122 (77.70) | 53 (76.81) | 49 (75.38) | 1.082 (0.4886–2.394) | 0.8465 | – | – |
| Herzinsuffizienz | 35 (22.29) | 21 (30.43) | 12 (18.46) | 1.932 (0.8597–4.343) | 0.1079 | – | – |
| Krebs | 32 (20.38) | 8 (11.59) | 17 (26.15) | 0.3703 (0.1473–0.9308) | 0.0306 | – | – |
| Diabetes mellitus | 21 (13.37) | 9 (13.04) | 7 (10.75) | 1.243 (0.4341–3.558) | 0.6849 | – | – |
| Chronisches Nierenversagen | 40 (25.48) | 21 (30.43) | 16 (24.61) | 1.340 (0.6249–2.873) | 0.4514 | – | – |
| Humanes Immundefizienzvirus | 10 (6.37) | 5 (7.25) | 3 (4.61) | 1.615 (0.3699–7.048) | 0.7191 | – | – |
| ASISescore≥4 | 81 (51.59) | 35 (50.72) | 33 (50.77) | 0.9982 (0.5068–1.966) | 0.9959 | – | – |
| Primäre Bakteriämie | 119 (75.79) | 45 (65.22) | 57 (87.69) | 0.2632 (0.1080–0.6413) | 0.0023* | – | – |
| Zentrale Linie Katheter verwandte | 21 (13.37) | 11 (15.94) | 7 (10.75) | 1.571 (0.5693–4.338) | 0.3802 | – | – |
| Unbekannt | 98 (62.42) | 34 (49.27) | 50 (76.9) | 0.2914 (0.1383–0.6143) | 0.0009 | 0.2363 (0.08–0.73) | 0.0127 |
| Sekundäre Bakteriämie | 38 (24.20) | 24 (34.78) | 8 (12.31) | 3.800 (1.559–9.260) | 0.0023* | – | – |
| Atemwege | 27 (17.19) | 17 (24.64) | 5 (7.69) | 3.923 (1.353–11.37) | 0.0081* | – | – |
| Harnwege | 6 (3.82) | 4 (5.79) | 1 (1.54) | 3.938 (0.4282–36.22) | 0.3666 | – | – |
| Unangemessene Therapie | 49 (31.21) | 32 (46.37) | 8 (12.31) | 6.162 (2.560–14.83) | * | 8.5534 (3.28–22.32) | |
| Vorheriger Einsatz von Antibiotika | 123 (78.34) | 59 (85.51) | 43 (66.15) | 3.019 (1.297–7.025) | 0.0086* | – | – |
| Sterblichkeit | 92 (58.59) | 48 (69.56) | 32 (49.23) | 2.357 (1.163–4.779) | 0.0165* | 2.3660 (1.15–4.85) | 0.0186 |
Multisensitive Stämme wurden als solche betrachtet, die eine Empfindlichkeit gegenüber allen getesteten antimikrobiellen Mitteln zeigten.
Odds ratio.
Konfidenzintervall.
p-Wert.
Durchschnittlicher Schweregrad der Erkrankung.
Statistisch signifikant (P≤0,05).
Der vorherige Einsatz von Antibiotika (78,3%), invasive Eingriffe (88,5%), Komorbiditäten (77,7%) und vorherige Operationen (43,9%) waren häufig. Es wurde festgestellt, dass 31,2% der Patienten unzureichend behandelt wurden und die Sterblichkeitsrate 58,6% betrug. Mehrere intrinsische und extrinsische Faktoren für die Entwicklung von Bakteriämie durch Stämme von P. gegen Carbapeneme resistente Aeruginosen wurden durch univariate Analyse nachgewiesen. Jedoch waren nur mechanische Beatmung, enterale / nasogastrische Sonden, primäre Bakteriämie mit unbekanntem Fokus und unangemessene Therapie Risikofaktoren, die unabhängig mit der Entwicklung einer Carbapenem-resistenten P. aeruginosa-Bakteriämie assoziiert waren.
Die MBL-Produktion wurde auf 56 carbapenem-resistente P. aeruginosa-Isolate analysiert. Neun (25,0%) Isolate waren phänotypisch positiv und insgesamt 16,1% (n = 9/56) stimmten mit den amplicons MBL-Genen überein, wobei es sich um 10,71% BPM-1 und 5 handelte.3% blaVIM-Gene Im Allgemeinen zeigten die Stämme ein Multiresistenzprofil. Bei anderen untersuchten Virulenzgenen (aprA, plcH, plcN, lasA, lasB, toxA und algD) zeigten alle Stämme eine hohe Häufigkeit (88%).
Von den 88 Carbapenem-empfindlichen P. aeruginosa-Stämmen waren 21 (23,9%) resistent gegen andere β-Lactame. Bei 69 gegen Carbapeneme resistenten Stämmen war das Resistenzprofil hoch: β-Lactam 50/69 (72,5%), Fluorchinolone 48/69 (69,6%) und Aminoglykoside 50/69 (72,5%) (Tabelle 3).
Antimicrobial resistance profiles in samples of Pseudomonas aeruginosa isolated from blood.
| Antimicrobial | Carbapenems | p (OR) | |
|---|---|---|---|
| Resistant group N=69 (%) |
Susceptible group N=88 (%) |
||
| Ceftazidime | 51 (73.9) | 10 (11.4) | |
| Cefepime | 45 (65.2) | 17 (19.3) | |
| Piperacillin/tazobactam | 37 (53.6) | 12 (13.6) | |
| Fluorquinolones (ciprofloxacin and levofloxacin) | 48 (69.6) | 17 (19.3) | |
| Aminoglicosides (amikacin and gentamicin) | 50 (72.5) | 12 (13.6) | |
Zusätzlich zur MBL-Forschung wurden fünf Stämme ausgewählt (zwei mit SPM-1, einer mit VIM und zwei phänotypisch positiv für MBL) zur Bewertung der Biofilmbildung unter Verwendung quantitativer Assays der Gesamtbiomasse durch Färbung mit Kristallviolett. In Anbetracht des Vorhandenseins von MBL-Genen wurden alle Stämme als starke Biofilmproduzenten mit einem Durchschnitt von 0,90 ± 0,61 Biomasse identifiziert. Unterschiede in der anfänglichen Adhäsion einzelner Stämme wurden nicht beobachtet. Es gab jedoch eine niedrigere OD für den Stamm, der das blaVIM-Gen enthielt (Abb. 1).
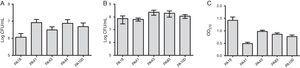
(A) Anzahl der Zellen, die nach 2 h an einer Polystyroloberfläche hafteten, ausgedrückt als log CFU / ml für 5 aus Blut isolierte Proben von Pseudomonas aeruginosa. (B) Anzahl der lebensfähigen Zellen im Biofilm (log CFU/ml). (C) Biomasse von Biofilm, ausgedrückt als optische Dichte von Kristallviolett (OD570nm).
Diskussion
Krankenhausbakteriämie durch multiresistente Mikroorganismen, ob grampositiv oder gramnegativ, wurde oft als signifikantes Gesundheitsproblem beschrieben, das die Krankenhauskosten erhöht und die Etablierung einer geeigneten antimikrobiellen Therapie erschwert, was zu einer schlechteren Prognose führt.37 Der hohe Anteil an Krankenhausbakterien, die durch carbapenemresistente P. aeruginosa verursacht werden, weist auf die Bedeutung dieses Organismus als wesentliche Ursache dieser Infektion in unserem Krankenhaus hin. Der hohe Anteil an Krankenhausbakterien, die durch carbapenemresistente P. aeruginosa verursacht werden, weist auf die Bedeutung dieses Organismus als wesentliche Ursache dieser Infektion in unserem Krankenhaus hin. Die Ergebnisse verschiedener Studien haben gezeigt, dass intrinsische Risikofaktoren wie mechanische Beatmung, Verwendung einer Magensonde und vorherige Verwendung von Antibiotika das Risiko einer Bakteriämieentwicklung erhöhen, die durch carbapenemresistente P. aeruginosa verursacht wird, sowie das Risiko von Morbidität und Mortalität.38
In dieser Studie waren laut univariater Analyse mehr als 50% der Risikofaktoren mit einer Infektion durch diesen Mikroorganismus assoziiert. Jedoch wurden nur mechanische Beatmung, enterale / gastrische Ernährungssonden, primäre Bakteriämie unbekannter Herkunft und unangemessene Behandlung durch multivariate Analyse als unabhängige Risikofaktoren betrachtet.
Ein zentralvenöser Katheter ist einer der wichtigsten Risikofaktoren für erworbene Bakteriämie im Krankenhaus, da er mit mehr als 90% dieser Infektionen assoziiert war.39 Obwohl es in dieser Studie kein signifikanter Risikofaktor war, hatten 85, 5% der Patienten mit Bakteriämie mit Carbapenem-resistentem P. aeruginosa dieses invasive Verfahren.
Bakteriämie, die durch antibiotikaresistente P. aeruginosa verursacht wird, weist häufig eine höhere Mortalitätsrate auf, insbesondere aufgrund der Verabreichung einer unangemessenen Antibiotikatherapie.40 In dieser Studie untersuchten wir eine Kohorte von 157 Patienten mit Bakteriämie, die durch P. aeruginosa-Stämme verursacht wurde, von denen 69 mit carbapenem-resistenten P. aeruginosa-Isolaten infiziert waren. Die Gesamtmortalität war in der Carbapenem-resistenten Gruppe höher; das Vorhandensein resistenter Stämme war jedoch signifikant mit einer unangemessenen antimikrobiellen Therapie verbunden, was beweist, dass diese Gruppe normalerweise eine schlechtere Prognose hat. Ähnlich wie unsere Ergebnisse zeigten frühere Studien, dass P. aeruginosa, isoliert von Patienten, die eine unangemessene Therapie erhielten, eine schlechtere Prognose mit Raten von 46,1%41 und 53,8% hatte.42
Neben der Assoziation mit schweren Infektionen führt die Resistenz gegen Carbapeneme bei P. aeruginosa häufig zur Produktion von MBL.43 Unsere Ergebnisse zeigten, dass das Carbapenem-resistente P. aeruginosa waren im gesamten Krankenhaus mit Genen vorherrschend, die diese Enzyme in 16,1% der Stämme kodierten, wobei 10,7% des Genotyps blaSPM-1 und 5,4% des Genotyps blaVIM waren. Da die Häufigkeit von multiresistenten Stämmen hoch war, deuten diese Ergebnisse darauf hin, dass andere Resistenzmechanismen in diesen Stämmen koexistieren, wie Effluxpumpen und Undurchlässigkeit der Membran.44
Die Prävalenz von MBL als Resistenzmechanismus hat insbesondere in Lateinamerika zugenommen.45 In Brasilien ist die Prävalenz von MBL-produzierendem P. aeruginosa variiert zwischen verschiedenen Regionen und zwischen Krankenhäusern, mit Raten von 7,5% bis 44%.11
Das SPM-1-Enzym gilt in Brasilien als das häufigste, gefolgt von IMP-1,11,46 Es hat jedoch auch eine Zunahme der Häufigkeit von P. aeruginosa-Isolaten gegeben, die das VIM-Enzym enthalten.45,47 In unserer Studie wurde das SPM-1-Enzym in 16,7% der phänotypisch produzierenden MBL-Proben nachgewiesen, gefolgt vom VIM-Enzym, das in 8,3% der Fälle nachgewiesen wurde. Diese Ergebnisse weisen auf eine signifikante Verbreitung von MBL-kodierenden Genen in unserer Region hin.
In Anbetracht des Vorhandenseins von MBL und Biofilmproduktion wurden 100% der Stämme als starke Produzenten eingestuft. Eine weitere Studie in Brasilien ergab, dass 40% der als stark biofilmproduzierend eingestuften P. aeruginosa auch MBL-Produzenten waren.35 Wir glauben, dass diese Ergebnisse wichtig sind, wenn sich diese Eigenschaften (Biofilmproduktion und MBL) überschneiden und Infektionen, die durch diese Bakterien verursacht werden, schwer zu behandeln sind. Dies ist zum Teil gerechtfertigt, weil das Wachstum von Bakterien im Biofilm etwa 64-mal resistenter gegen antimikrobielle Mittel ist.48
P. aeruginosa weist eine große Anzahl extrazellulärer Virulenzfaktoren auf, die ebenfalls zur Pathogenität und Schwere dieser Infektionen beitragen, z. B. die von aprA-, plcH-, plcN-, lasA-, lasB-, toxA- und algD-Genen kodierten.32,33 Unsere Daten zeigten, dass das Vorhandensein eines multiresistenten Profils in den meisten Stämmen (88%) positiv für die Virulenzgene aprA, plcH, plcN, lasA, lasB, toxA und algD war, mit Ausnahme eines Stammes, der die toxA- und plcH-Gene nicht zeigte, was zu einer schlechteren Prognose bei schweren Infektionen beitragen kann.
Unsere Ergebnisse bestätigen bisherige Befunde hinsichtlich Risikofaktoren für die Entwicklung einer P. aeruginosa carbapenem-resistenten Bakteriämie sowie der Verbreitung MBL-produzierender Stämme vom Typ SPM-1. Diese Studie trägt jedoch zu einem weiteren Nachweis der Ausbreitung von MBL-produzierenden Stämmen bei, insbesondere der VIM-Typ, in hochvirulenten Stämmen und stark Biofilmproduzenten.
Interessenkonflikte
Die Autoren erklären keine Interessenkonflikte.