Einleitung
Venöse Thromboembolien (VTE), einschließlich tiefer Venenthrombosen (DVT), Lungenembolien (PE) und splanchnische Venenthrombosen, sind eine häufige Komplikation von Krebs.1 Die Entwicklung einer krebsassoziierten VTE ist mit einer verminderten Lebensqualität verbunden und stellt sowohl für den Patienten als auch für das Gesundheitssystem eine erhebliche wirtschaftliche Belastung dar.2 VTE ist die zweithäufigste Todesursache bei ambulanten Krebspatienten, die eine Chemotherapie erhalten, und hat sich als unabhängiger Prädiktor für die Mortalität in der Bevölkerung von Krebspatienten erwiesen.3,4 Das Management der krebsassoziierten VTE-Behandlung kann eine Herausforderung darstellen, da das Risiko für wiederkehrende VTE und gerinnungshemmende Blutungen trotz angemessener Behandlung hoch ist.5 Darüber hinaus erhöhen Arzneimittelwechselwirkungen und krebsbedingte Begleiterkrankungen wie Nieren- und / oder Leberfunktionsstörungen, verminderte orale Aufnahme, durch Chemotherapie verursachte Übelkeit und Erbrechen sowie Thrombozytopenie die Komplexität der Behandlung, indem sie die Wahl des Antikoagulans einschränken.
Klinische Studien zur Bewertung von niedermolekularem Heparin zur Behandlung von krebsassoziierter VTE
Die Langzeitanwendung von niedermolekularem Heparin (LMWH) zur Behandlung von VTE bei Patienten mit aktivem Krebs wird als Erstlinientherapie auf der Grundlage der Ergebnisse mehrerer offener randomisierter kontrollierter Studien (RCTs) empfohlen.6,7 Die beiden größten bisher veröffentlichten Studien, die Studien CLOT (Comparison of Low molecular-weight heparin versus Oral anticoagulant Therapy for the Prevention of Recurrent Venous Thromboembolism in Patients with Cancer) und CATCH (Comparison of Acute Treatments in Cancer Haemostasis), verglichen eine LMWH mit einer Vitamin-K-Antagonisten-Therapie bei Patienten mit aktivem Krebs und akuter symptomatischer proximaler TVT oder PE. Siehe Tabelle 1 für Baseline-Merkmale und Tabelle 2 für Studienergebnisse.8,9 Beide Studien verwendeten ein offenes Studiendesign, das gleiche International Normalized Target Ratio (INR) im Vitamin-K-Antagonisten-Kontrollarm, die gleiche aktive Krebsdefinition und die gleiche Behandlungsdauer und hatten vergleichbare Zulassungskriterien für Patienten.
Tabelle 1: Studiendesign und Basismerkmale der CATCH- und CLOT-Studien
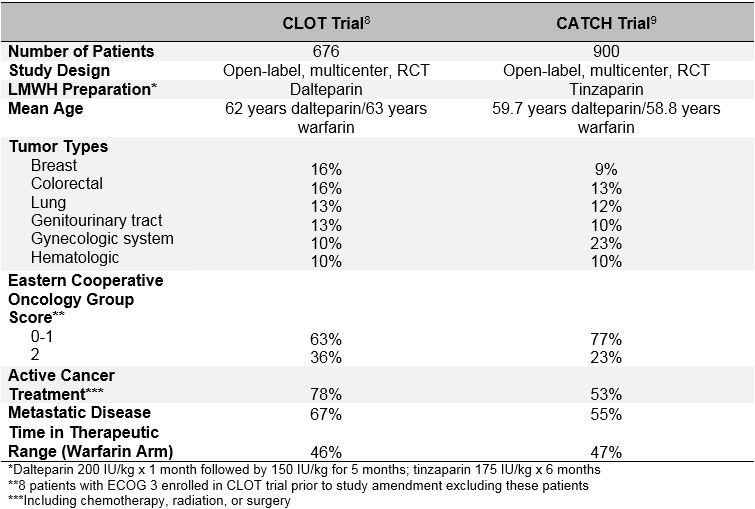
Tabelle 2: Ergebnisse der CLOT- und CATCH-Studien

In der 2003 veröffentlichten CLOT-Studie wurden 676 Patienten randomisiert, um Dalteparin (200 IE / kg täglich für 1 Monat, gefolgt von 150 IE / kg täglich für 5 Monate) oder Vitamin-K-Antagonisten (Warfarin oder Acenocoumarol) zu erhalten mit einer Ziel-INR von 2, 5 für insgesamt 6 Monate mit einer anfänglichen Überlappung von 5-7 Tagen mit Dalteparin 200 IE / kg).8 Symptomatische rezidivierende TVT oder PE, einschließlich Tod im Zusammenhang mit PE, wurde bei 27 Patienten (7, 0%) beobachtet, die randomisiert auf Dalteparin und bei 53 Patienten (15%) randomisiert auf Vitamin-K-Antagonisten (Hazard Ratio 0, 48; 95% Konfidenzintervall , 0,30-0,77; p = 0,002). Zwischen den 2 Gruppen wurde kein Unterschied in den Raten schwerer Blutungen (6 vs. 4%; p = 0, 27), Blutungen (15 vs. 19%; p = 0, 09) oder Todesfälle (39 vs. 41%; p = 0, 53) beobachtet.
In der CATCH-Studie, die über 10 Jahre später im Jahr 2015 veröffentlicht wurde, wurden 900 Patienten für insgesamt 6 Monate randomisiert auf Tinzaparin (175 IE / kg täglich ohne Dosisreduktion) oder Warfarin (Ziel-INR 2,0-3,0 mit anfänglicher Tinzaparin 175 IE / kg Überlappung für 5-10 Tage) randomisiert.9 Der primäre zusammengesetzte Endpunkt einer rezidivierenden VTE einschließlich zufälliger proximaler TVT und PE trat bei 31 Patienten (6,9%) im Tinzaparin-Arm und bei 45 Patienten (10%) im Warfarin-Arm auf (HR 0,65; 95% -KI, 0,41-1,03; p = 0,07). Eine symptomatische TVT trat bei signifikant weniger mit Tinzaparin behandelten Patienten auf (2,7 vs. 5,3%; HR 0,48; 95% -KI, 0,24-0,96; p = 0,04). Obwohl die Raten schwerer Blutungen in beiden Armen ähnlich waren, wurde unter Tinzaparin eine signifikante Reduktion klinisch relevanter, nicht schwerwiegender Blutungen beobachtet (10,9 vs. 15,3%; HR 0,58; 95% -KI, 0,40-0,84; p = 0,004). Die Mortalität war in beiden Gruppen ähnlich, wobei etwa ein Drittel der Patienten während des Studienzeitraums starb (33,4 vs. 30,6%; p = 0,54). Obwohl Tinzaparin den primären zusammengesetzten Endpunkt der rezidivierenden VTE nicht signifikant reduzierte, unterstützen die Ergebnisse der CATCH-Studie die Verwendung von Langzeit-LMWH als bevorzugte Behandlung für krebsassoziierte VTE aufgrund eines geringeren Risikos für klinisch relevante schwere Blutungen und einer signifikanten Verringerung der rezidivierenden TVT.
Das Versäumnis der CATCH-Studie, die statistische Signifikanz für den primären Endpunkt zu erreichen, kann auf die im Warfarin-Arm beobachtete niedrigere als erwartete rezidivierende VTE-Rate zurückzuführen sein. Eine mögliche Erklärung für diese Beobachtung könnte eine Verbesserung des Warfarin-Managements in der CATCH-Studie sein. Ähnliche Werte der INR-Kontrolle in beiden Studien sprechen jedoch dagegen (Zeit im therapeutischen Bereich betrug 46% bei GERINNSEL vs. 47% bei FANG; Zeit über dem therapeutischen Bereich betrug 24% bei GERINNSEL vs. 27% bei FANG). Eine wahrscheinlichere Erklärung ist eine Voreingenommenheit bei der Auswahl von „weniger kranken“ Patienten für die Aufnahme in die CATCH-Studie. Obwohl die CATCH- und CLOT-Studien ähnliche Einschluss- und Ausschlusskriterien verwendeten, bestehen zwischen den beiden Patientenpopulationen wesentliche Unterschiede in den Baseline-Merkmalen, insbesondere in Bezug auf thrombotische und prognostische Risikofaktoren. Ein höherer Anteil der Patienten in der CLOT-Studie erhielt eine aktive Krebsbehandlung (72% CLOT vs. 53% CATCH), hatte eine Vorgeschichte von VTE (11% CLOT vs. 6% CATCH), hatte Anzeichen einer metastasierten Erkrankung (67% CLOT vs. 55% CATCH) und hatte einen schlechteren Leistungsstatus (Eastern Cooperative Oncology Group Score von 2 in 36% CLOT vs. 23% CATCH). Darüber hinaus war die Mortalität während des 6-monatigen Behandlungszeitraums auch in der Gerinnselpopulation höher (39% GERINNSEL gegenüber 32% FANG). Daher hatte die CATCH-Patientenpopulation wahrscheinlich ein geringeres inhärentes Risiko für rezidivierende VTE im Vergleich zu GERINNSEL-Studienpatienten. Es ist sehr wahrscheinlich, dass die Ermittler Patienten nicht in CATCH einschrieben, wenn sie der Meinung waren, dass LMWH vorteilhafter wäre als Warfarin, was zur selektiven Einschreibung von Patienten führte, bei denen die Wahrscheinlichkeit einer rezidivierenden VTE geringer war.
Studien zur Bewertung direkter oraler Antikoagulanzien bei krebsassoziierter VTE
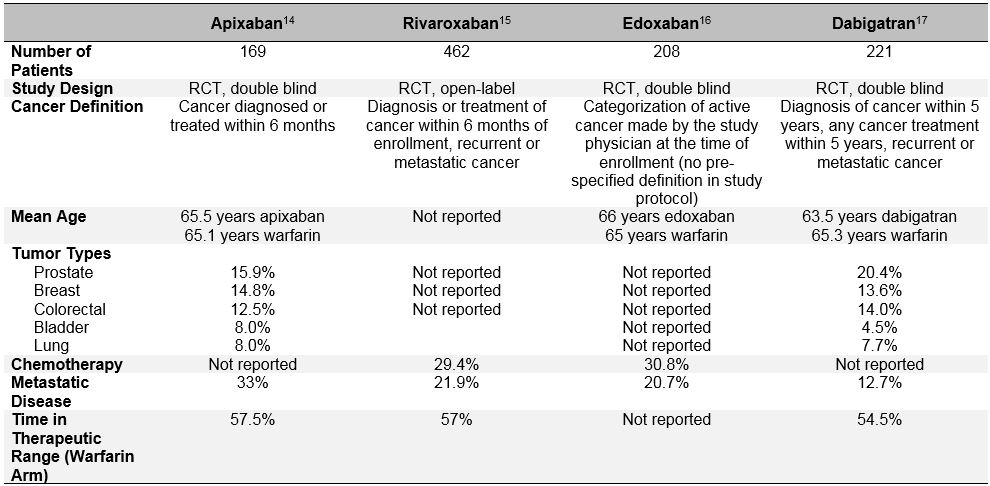
Die Verzerrung der Patientenauswahl ist in den jüngsten randomisierten Studien zur Bewertung der Wirksamkeit und Sicherheit direkter oraler Antikoagulanzien (DOACs) zur Behandlung der akuten VTE noch deutlicher.10 Diese oralen Antikoagulanzien wurden in den letzten zehn Jahren ausführlich untersucht Vorhofflimmern, VTE-Behandlung und VTE-Prävention. In den wegweisenden klinischen Phase-III-Studien zur akuten VTE-Behandlung wurde durchweg gezeigt, dass DOACs Warfarin nicht unterlegen sind (gepooltes relatives Risiko 0,90; 95% CI, 0,77-1.06) bei der Verhinderung rezidivierender VTE, und sie haben ein ähnliches oder reduziertes Risiko für schwere Blutungen (gepoolte RR 0,40; 95% CI, 0,45-0,83).11 Unter den Patienten, die in diesen Studien als „Krebs“ oder „aktiver Krebs“ eingestuft wurden, scheinen DOACs auch eine ähnliche Leistung wie Warfarin zu erbringen.12 Eine eingehendere Untersuchung dieser Post-hoc-Daten zeigt jedoch eine wichtige Voreingenommenheit bei der Patientenauswahl und stellt die Verallgemeinerbarkeit der Ergebnisse der DOAC-Studie auf „reale“ Krebspatienten mit VTE in Frage. Zusätzlich zu den heterogenen Definitionen von „aktivem Krebs“, die in diesen Studien verwendet wurden und sich von den GERINNSEL- und Fangstudien unterschieden, waren wichtige Determinanten für wiederkehrende VTE und Blutungen auch bei den DOAC-Patienten mit Krebs sehr unterschiedlich von den LMWH-krebsspezifischen Studien (Tabelle 3). Dazu gehören das Vorhandensein von Metastasen und die gleichzeitige Anwendung einer Krebstherapie. Die großen Unterschiede in der Mortalität während des Studienzeitraums sprechen auch dafür, dass sehr unterschiedliche Gruppen von Patienten mit „Krebs“ in die DOAC-versus LMWH-Studien einbezogen wurden. Darüber hinaus im Gegensatz zu LMWH, die mit einer signifikanten Verringerung des Risikos für rezidivierende VTE im Vergleich zu Vitamin-K-Antagonisten verbunden ist (RR 0,52; 95% CI, 0,36-0.74), reduzierte DOACs dieses Risiko in einer Metaanalyse von 1.132 Krebspatienten, die in das klinische Studienprogramm EINSTEIN, HOKUSAI-VTE (Edoxaban Versus Warfarin zur Behandlung symptomatischer venöser Thromboembolien), RECOVER (Wirksamkeit und Sicherheit von Dabigatran im Vergleich zu Warfarin zur 6-monatigen Behandlung akuter symptomatischer venöser Thromboembolien) und AMPLIFY (Apixaban zur Erstbehandlung von Lungenembolien und tiefer Venenthrombose als Erstlinientherapie) aufgenommen wurden, nicht signifikant RCTs (RR 0,66; 95%-KI, 0,39-1,11).10 Alle diese Überlegungen sollten die nicht ausgewählte Anwendung von DOACs bei Patienten mit aktivem Krebs und akuter, symptomatischer VTE warnen.13
Tabelle 3: Studiendesign und Baseline-Merkmale der Subgruppen von Krebspatienten aus den Phase-III-DOAC-Studien
Schlussfolgerungen
Alle wichtigen evidenzbasierten Konsensrichtlinien empfehlen LMWH für die Erst- und Langzeitbehandlung von krebsassoziierter VTE.6,7,13 Diese Empfehlung basiert auf der Beobachtung, dass LMWH nicht nur wirksamer als Warfarin zur Vorbeugung von rezidivierender VTE ist, sondern auch zusätzliche Vorteile gegenüber oralen Wirkstoffen bietet, einschließlich einer stabilen Antikoagulation bei Patienten mit schlechter oraler Einnahme, einem Mangel an Arzneimittelwechselwirkungen und klinischer Erfahrung in der Behandlung der Antikoagulation im Zusammenhang mit invasiven Verfahren und Thrombozytopenie. Obwohl DOACs derzeit nicht für die VTE-Behandlung bei Krebspatienten empfohlen werden, sind RCTs, die Rivaroxaban und Edoxaban mit LMWH vergleichen, derzeit im Gange und werden dazu beitragen, ihre Rolle bei der krebsassoziierten VTE zu klären.6,13
- Khorana AA, Dalal M, Lin J, Connolly GC. Inzidenz und Prädiktoren für venöse Thromboembolien (VTE) bei ambulanten Hochrisiko-Krebspatienten, die sich in den USA einer Chemotherapie unterziehen. Krebs 2013;119: 648-55.
- Kourlaba G, Relakis J, Mylonas C, et al. Die humanistische und wirtschaftliche Belastung venöser Thromboembolien bei Krebspatienten: eine systematische Überprüfung. Blutkoagulationsfibrinolyse 2015;26: 13-31.
- Kuderer NM, Ortel TL, Francis CW. Auswirkungen von venösen Thromboembolien und Antikoagulation auf Krebs und Krebsüberleben. J Clin Oncol 2009;27:4902-11.
- Khorana AA, Francis CW, Culakova E, Kuderer NM, Lyman GH. Thromboembolien sind eine der häufigsten Todesursachen bei Krebspatienten, die eine ambulante Chemotherapie erhalten. J Thromb Haemost 2007;5:632-4.
- Prandoni P, Lensing AW, Piccioli A, et al. Rezidivierende venöse Thromboembolien und Blutungskomplikationen während der Behandlung mit Antikoagulanzien bei Patienten mit Krebs und Venenthrombose. Blut 2002;100: 3484-8.
- Lyman GH, Bohlke K, Khorana AA, et al. Prophylaxe und Behandlung venöser Thromboembolien bei Krebspatienten: American Society of Clinical Oncology Clinical Practice Guideline Update 2014. J Clin Oncol 2015;33:654-6.
- Streiff MB, Holmstrom B, Ashrani A, et al. Krebsassoziierte venöse thromboembolische Erkrankung, Version 1.2015. J Natl Kompr. Netw 2015;13:1079-95.
- Lee AY, Levine MN, Baker RI, et al. Niedermolekulares Heparin versus Cumarin zur Prävention rezidivierender venöser Thromboembolien bei Krebspatienten. N Engl J Med 2003;349:146-53.
- Lee AY, Kamphuisen PW, Meyer G, et al. Tinzaparin vs Warfarin zur Behandlung von akuten venösen Thromboembolien bei Patienten mit aktivem Krebs: Eine randomisierte klinische Studie. JAMA 2015;314:677-86.
- Träger M, Cameron C, Delluc A, Castellucci L, Khorana AA, Lee AY. Wirksamkeit und Sicherheit der Antikoagulanzientherapie zur Behandlung akuter krebsassoziierter Thrombosen: eine systematische Überprüfung und Meta-Analyse. Thromb Res 2014;134:1214-9.
- van Es N, Coppens M, Schulman S, Middeldorp S, Büller HR. Direkte orale Antikoagulanzien im Vergleich zu Vitamin-K-Antagonisten bei akuten venösen Thromboembolien: Evidenz aus Phase-3-Studien. Blut 2014;124: 1968-75.
- Vedovati MC, Germini F, Agnelli G, Becattini C. Direkte orale Antikoagulanzien bei Patienten mit VTE und Krebs: eine systematische Überprüfung und Metaanalyse. Brust 2015;147:475-83.
- Kearon C, Akl EA, Ornelas J, et al. Antithrombotische Therapie bei VTE-Erkrankungen: Leitfaden für die BRUST und Bericht des Expertengremiums. Brust 2016;149:315-52.
- Agnelli G, Büller HR, Cohen A, et al. Orales Apixaban zur Behandlung venöser Thromboembolien bei Krebspatienten: Ergebnisse der AMPLIFY-Studie. J Thromb Haemost 2015;13:2187-91.
- Prins MH, Lensing AW, Brighton TA, et al. Orales Rivaroxaban versus Enoxaparin mit Vitamin-K-Antagonisten zur Behandlung symptomatischer venöser Thromboembolien bei Krebspatienten (EINSTEIN-DVT und EINSTEIN-PE): eine gepoolte Subgruppenanalyse von zwei randomisierten kontrollierten Studien. Lancet Haematol 2014;1:e37-46.
- Raskob GE, van Es N, Segers A, et al. Edoxaban bei venösen Thromboembolien bei Krebspatienten: Ergebnisse einer Nichtunterlegenheits-Subgruppenanalyse der randomisierten, doppelblinden Doppel-Dummy-Studie Hokusai-VTE. Lanzette Hämatol 2016;3:e379-87.
- Schulman S, Goldhaber SZ, Kearon C, et al. Behandlung mit Dabigatran oder Warfarin bei Patienten mit venösen Thromboembolien und Krebs. Thromb Haemost 2015;114:150-7.
Klinische Themen: Anticoagulation Management, Arrhythmias and Clinical EP, Cardio-Oncology, Pulmonary Hypertension and Venous Thromboembolism, Anticoagulation Management and Atrial Fibrillation, Anticoagulation Management and Venothromboembolism, Atrial Fibrillation/Supraventricular Arrhythmias
Keywords: Kardiotoxine, Kardiotoxizität, Heparin, Niedermolekular, Warfarin, Antikoagulanzien, International normalisiertes Verhältnis, Acenocoumarol, Dalteparin, Antithrombine, Venöse Thromboembolie, Risikofaktoren, Vorhofflimmern, Ambulante Patienten, Forschungspersonal, Lebensqualität, Pyridone, Pyrazole, Pyridine, Thiazole, Venenthrombose, Lungenembolie, Thrombose, Thrombozytopenie, Komorbidität, Hämostase, Neoplasmen
< Zurück zur Liste