nøgleord
Cytomegalovirus lungebetændelse; Bronchiolitisobliterans organisering af lungebetændelse; Immunkompetent
introduktion
de kliniske manifestationer af cytomegalovirus (cytomegalovirus pneumonia)CMV) infektion kan opdeles i akut primær infektion Ogaktivering. Primær CMV-infektion forekommer hyppigstunder amning og barndom og er asymptomatisk eller til stede som et mildt mononukleoselignende syndrom iimmunokompetente voksne . Derefter fortsætter viruset for livet iværten, generelt i latent stadium. Reaktivering af Cmvfra latenstid er velkendt hos immunkompromitterede patienter, og det kan påvirke næsten ethvert organ. Imidlertid er alvorlig CMV lungebetændelse sjælden hos immunkompetente værter . I øjeblikket er de præcise molekylære og immunologiske mekanismerinvolveret er stadig ukendt.
Bronchiolitis obliterans organiserende lungebetændelse (BOOP) er enklinisk tilstand karakteriseret ved hoste, utilpashed, feber ogdyspnø og intet svar på antibiotika . Dens chestradiograph beskrevet som lokal, flere og diffunderer ændringer. Det kan findes med allergisk alveolitis, bestråling pneumonitis, lægemiddelreaktioner og andre organiserende infektioner. Tilfælde involveret i viral etiologi kompliceret med Boophar sporadisk været rapporteret. Her præsenterer vi et tilfælde afcmv lungebetændelse forbundet med BOOP i en immunkompetent patient ved behandling af ganciclovir, hvilket erDet første tilfælde, der nogensinde er rapporteret så vidt vi vidste.
sagsrapport
en 63-årig mand blev henvist til vores hospital på grund af en 10-dages historie med hoste og feber. Han havde en paroksysmal hostemed gul sputum. Feber, med hvæsen optrådte hovedsageligt ieftermiddag og nat, og den højeste temperatur var39, 3(102.74). Hans tidligere medicinske historie omfattede hypertension, diabetes og gigt. Hans tidligere familiehistorievar unremarkable. Hans vitale tegn var som følger: bodytemperatur: 36,5(97,7), puls: 98 slag per minut (BPM), blodtryk: 98/61 mmHg.
ved fysisk undersøgelse blev sene inspiratoriske knitrenoteret i de bilaterale nedre lungefelter. Antallet af hvide blodlegemer var 14,2 liter 109/L med 81,9% neutrofiler(NEUTR), 12,8% lymfocytter (LYR) og 0,53 liter 109/Lmonocytter (MONOR) (Figur 1). Serum C-reaktivt protein(CRP) niveau var 110,67 mg / L.
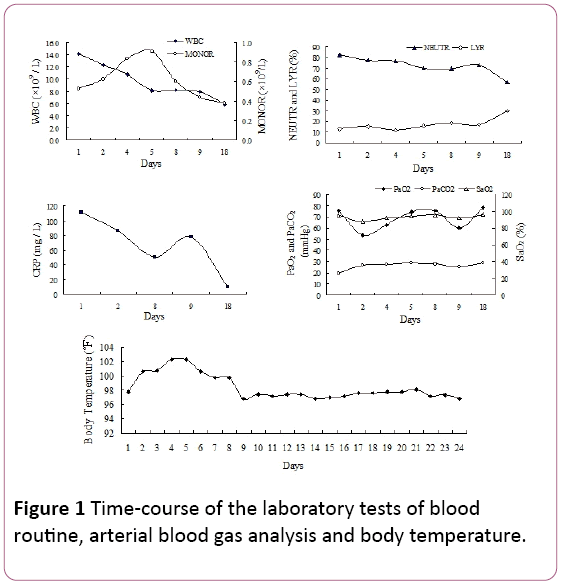
Figur 1: Time – løbet af laboratorieundersøgelser af bloodroutine, arteriel blod gas analyse og kropstemperatur.
arterielt partialtryk af ilt (PaO2) var 75,5 mmHg,med 25,8 mmHg arterielt partialtryk af CO2 (PaCO2) og94, 7% iltmætning (SaO2, 2 L/min iltforsyning vianasal kanyle). På grund af feber og tegn pååndedrætsinfektioner startede vi erfaringsmæssigt antibiotikabehandling med piperacillin tassobactam. Imidlertid reducerede patientens temperatur ikke Og stakåndetudviklet i vedvarende 4 dages hospitalsindlæggelse.
målinger af arteriel blodgas afslørede svigt iåndedræt (PaO2: 53,5 mmHg, PaCO2: 35,6 mmHg, SaO2: 87,7%) med modbalanceret metabolisk acidose (HCO3 -: 21mmol/l, pH 7,39) ved brug af 2 L/min ilt ved nasal kanyle.Laboratorieundersøgelsesresultater var som følger: mycoplasmapneumoni antistof: 1: 40 (positiv), bakteriel endotoksin (det samlede indhold af lipopolysaccharid af gramnegative bakterier): 49,14 pg/ mL, plasmafibrinogen (Fg): 7,51 g/L, aktiveretpartiel tromboplastintid (APTT): 45,9 sekund.
elektrokardiogrammet viste sinustakykardi med Tovskift. Bryst røntgen fandt to lungeinfektioner, ikkebortset fra pulmonale interstitielle læsioner (figur 2a). En thoraciccomputered tomography (CT) scan afslørede pulmonaryinterstitial læsioner (skygge af gitter i begge lunger) ogmediastinal lymfeknudeforstørrelse (figur 2D). Derefter blev 3,5 L/min ilt forsynet med ansigtsmaske, og antibiotikabehandlingen blev skiftet til Cefoperasonnatrium og sulbactamnatrium plus Levofloksacin.
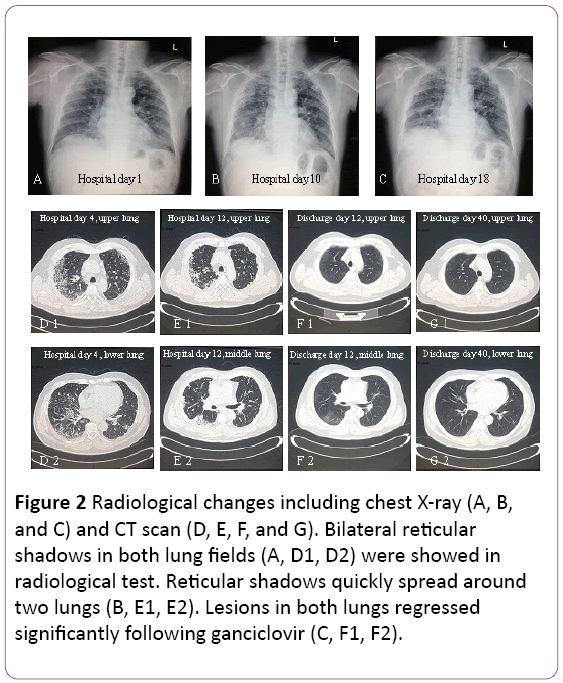
figur 2: Radiologiske ændringer inklusive røntgenbillede af brystet (A, B og C) og CT-scanning (D,E, F og G). Bilaterale retikulære skygger i begge lungefelter (a, D1, D2) blev vist iradiologisk test. Retikulære skygger spredes hurtigt rundtto lunger (B, E1, E2). Læsioner i begge lunger regresseretvæsentligt efter ganciclovir (C, F1, F2).
i betragtning af diagnosen interstitiel lungebetændelse, relevantlaboratorietest og fiberoptisk bronkoskopi blev udførtpå dag 5. Laboratorietestresultater var som følger: CMV PCR: negativ, CMV IgM: negativ, immunoglobulin IgG: positiv, HIV: negativ, leukocyttal: 7,96 liter 109 / L, NEUTR: 72,4%, LYR: 17%,CRP:77,51 mg/L, immunologisk funktion (T, B, NK-celler): normal, t-lymfocytundersæt: normal. Markører forautoimmune sygdomme, herunder perinuclear-ANCA (p-ANCA),cytoplasmatisk-ANCA (c-ANCA), ANA og anti-dsDNA var allenegative.
lungefunktion foreslog moderat begrænsendeventilatorisk dysfunktion. Røntgen-og CT-scanning afslørede læsioner påøverste lunge blev absorberet, men det blev forværret i højre nedre lunge (figur 2b og 2e).
en bronkoskopi viste bilateral bronkitis (figur 3a).Bronchoalveolær skyllevæske (BAL) var negativ formycobacteria og PAS-plet. Differentialcelletallet viste 11% neutrofiler, 19% lymfocytter og 70% makrofager.Intranukleære og intracytoplasmatiske inklusionslegemer blev fundeti lateral basal segment af lungevæv transbronchialbiopsy (TBLB) af højre nedre (figur 3b). Baseret pådiagnose af cytomegalovirus lungebetændelse med organisation, behandling med ganciclovir (5 mg/kg) via intravenøs infusionhver 12.time blev påbegyndt på dag 8. I henhold til ovenstående fund kombineret med kliniske symptomer (feber forsvinder) blev antibiotikabehandlingen ændret til Moksifloksacin på dag8. Efter 1 uges antivirusbehandling, hoste vedvarende. Han gennemgik lungebiopsi via CT-styret. En lungebiopsi afsløretboop (figur 3C). Derefter behandles patienten med oral steroidhormon. Ikke desto mindre blev hans symptomer gradvist forbedret iden følgende 1 uge. Bryst røntgen afslørede, at to lungelesioner var bedre end før (figur 2C).
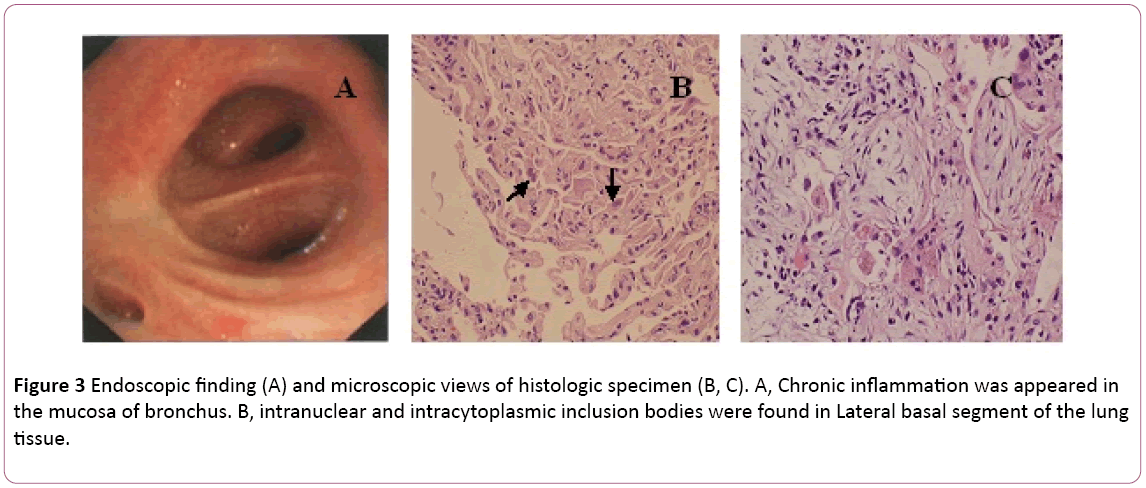
figur 3: Endoskopisk Fund (A) og mikroskopiske visninger af histologisk prøve (B, C). A, kronisk inflammation blev vist islimhinden af bronchus. B, intranukleære og intracytoplasmatiske inklusionslegemer blev fundet i Lateral basal segment af lungevæv.
behandlingen blev ændret til oral ganciclovir, 0,6 g/d (12 timer)i 7 dage, udledning. I sin opfølgning, skygge af gitter i beggelunger regresseret betydeligt (figur 2F og 2G). Han er stadig under opfølgning på poliklinikken.
Diskussion
CMV er en DNA-virus i familien Herpesviridae, og densinfektion er almindelig. Faktisk er 40% til 100% af voksneinficeret med CMV over hele verden . CMV-infektioneri den generelle befolkning er normalt subkliniske. Densymptomatisk CMV-infektion forekom hovedsageligt iimmunokompromitterede patienter med immundysfunktion,herunder patienter med AIDS, malignitet, transplantationsmodtagere og nyfødte . I tilfælde med immundefekt kan CMV-infektion forårsage lungebetændelse, retinitis,hepatitis, encephalitis, demyeliniserende polyneuropati,myocarditis, pancreatitis,gastrointestinale sygdomme og binyresygdomme osv . Tværtimod er alvorlig livstruende infektion induceret af CMV, herunder CMV lungebetændelse, erhåndfuld hos immunkompetente individer . I dette papir beskriver vi et tilfælde af CMV lungebetændelse, forbundet med BOOPin en immunokompetent vært og effektivt behandlet medganciclovir.
CMV lungebetændelse præsenterer ofte som alvorlig viral lungebetændelse med diffuse interstitielle infiltrater på røntgenbillede af brystet ogrespiratorisk svigt . Laboratoriediagnosen kan værevanskeligt og er lavet serologisk eller patologisk.Generelt er de serologiske analyser til påvisning af human CMV-infektion inklusive CMV-antistoffer (IgM,IgG) titer, CMV-proteinpp65 og CMV PCR . Det er vigtigt, histopatologiskpåvisning af CMV-inklusionslegemer på transbronchial eller openlung biopsi er patognomonisk, da CMV lungebetændelse iimmunokompetente patienter repræsenterer en sjælden begivenhed .
vores patient præsenterede ikke-specifikke symptomer (hosteog feber), som havde udviklet sig i løbet af 10 dage.Symptomerne blev forværret efter 2 dage på hospitalet (alvorlig hypoksæmi) på trods af empirisk antibiotikabehandling. Diagnosen af CMV lungebetændelse var baseret på TBLB, som blev fundet intranukleære og intracytoplasmatiske inklusionslegemer ikæmpeceller som guldstandard. Desuden var serum CMV IgG antistof Positiv et andet diagnostisk indeks. Detradiologisk billede inklusive røntgenbillede af brystet og CT-scanning viser bilaterale retikulære skygger i begge lungefelter understøttede diagnosen viral lungebetændelse. I vores tilfælde mononukleose afblodrutine blev også observeret (Figur 1). SerumIgM CMV var imidlertid negativ i dette tilfælde, hvilket var i overensstemmelse med Eddleston-rapporten . CMV PCR var også negativ. Det kan måske forklare ved falske negative resultater induceret af forbigående naturaf viremien .
under indlæggelsen faldt hans lymfocytfrekvensbetydeligt. Lymfopeni var forårsaget af CMV-infektion for både direkte hæmning af progenitorcellevækst og svigt af stamcellefornyelse . Det kan bemærkes, atimmunfunktionsanalyse såsom T-celle-delmængde, B-celle og NKcell, analyse var normal. Transient eller subklinisk t-celleabnormalitet og en inversion af CD4/CD8 T-celleforholdet blev ikke observeret i dette tilfælde. Ved HIV-sygdom er et fald i CD4+celler <100 til 10 6/L, der repræsenterer en høj risiko for CMV-sygdom. Desuden udviste vores patient ingen tegn på andenimmundefekt (HIV: negative) og autoimmune sygdomme (autoimmun antistof: negativ).
BOOP blev først beskrevet af Epler et al. og siden da er blevet grundigt undersøgt og rapporteret i hele verden . Der er mange smitstoffer kan væreforbundet med BOOP, såsom cytomegalovirus (CMV), herpessimpleks virus (HSV) . Parasitære og pneumocystis cariniiinfektioner er også blevet rapporteret . Fordi Boopræsentant måde, hvorpå lungen kan reagere på en inflammatorisk stimulus, er de vigtigste patofysiologiske fund relateret til den inflammatoriske vej. Histologiske trækomfatter granulationsvæv i væggene i alveolerne ogbronchioler er signifikante, forbundet med infiltration iinterstitial og trakeal hulrum ved forskellige grader afmononukleære celler og skumceller. Type II alveolær epitelcellehyperplasi kan også ses . I den nuværende patient blev BOOP diagnosticeret i lungebiopsi en uge senere end TBLB, hvilket tyder på, at CMV kan være det mest sandsynligepatogen.
selvom der ikke er nogen anbefalet standardvarighed forganciclovirbehandling til patienter med CMV lungebetændelse, kunne medicinen kun startes efter den endelige diagnose og administreres almindeligvis i to til tre uger. Så snart sombehandling med ganciclovir, vores patients kliniske tilstand blev forbedret med fuldstændig opløsning af det kliniske ogradiologiske billede under en måneds opfølgning.
konklusion
vi rapporterer en akut CMV-infektionssag, som præsenteredemed feber, hoste, sputum og tachypnea. Sidstnævnte forværredes hurtigt og er forbundet med respirationssvigt.CT-scanning afslørede en lille ændring af malet glas ved starten, menændringen spredte sig hurtigt omkring to lunger. Efter patologisk undersøgelse (TBLB) blev diagnosen Cmvpneumoni bekræftet. For patienter med noimmundefektforstyrrelser er det meget let at fejldiagnosticere.Den nuværende rapport tyder på, at når brystet CT viserinterstitielle læsioner,ud over at overveje tuberkulose, bakteriel lungebetændelse og andre virussygdomme, bør Cmvpneumoni inkluderes hos ældre patienter med en række grundlæggende sygdomme. Det er vigtigt, at denne sag demonstreredeat cytomegalovirus lungebetændelse kan associeres med BOOP inen immunkompetent patient. Ganciclovir behandling ereffektiv. Yderligere undersøgelser er nødvendige for at analyserelationer og dens underliggende mekanisme mellem Cmvpneumoni og BOOP.
forfatterens bidrag
cek udarbejdet og skrev manuskriptet. Tock, LL og LYH tog sig af patienten og bidrog til at koordinere manuskriptet. HL udførte de mikrobiologiske analyser. Lyhbidrog til udkastet til manuskriptet og reviderede manuskriptet. Alle forfattere har læst manuskriptet oggodkendt sin endelige version.
anerkendelser
vi er taknemmelige for Prof.
- Hamprecht K, Maschmann J, Vochem M, Diet K, Speer CP, et al. (2001) Epidemiologi for overførsel af cytomegalovirus fra mor til for tidligt spædbarn ved amning. Lancet 357: 513-518.
- Carter D, Olchovsky D, Pokroy R, Esra D (2006) Cytomegalovirus-associeret colitis, der forårsager diarre hos en immunkompetent patient. Verden J Gastroenterol12: 6898-6899.
- Kralickova P, Mala E, Vokurkova D, Krcmova I, Pliskova L, et al. (2014) Cytomegalovirus sygdom hos patienter med almindelig variabel immundefekt: tre Sagsrapporter. Internationale arkiver for allergi og Immunologi 163: 69-74.
- Eddleston M, Peacock S, Juniper M, Krigrell DA (1997) alvorlig cytomegalovirusinfektion hos immunkompetente patienter. Clin Inficere Dis 24: 52-56.
- Cunha BA (2010) Cytomegalovirus lungebetændelse: samfundserhvervet lungebetændelse hos immunkompetente værter. Inficere Dis Clin Nord Am 24: 147-158.
- Cohen JI, Corey GR(1991) Cytomegalovirus infection in the normal host. Medicine 1985; 64:100-114.
- Geddes DM. BOOP and COP. Thorax46:545-547.
- Hansell DM (1992) What are bronchiolitis obliterans organizing pneumonia (BOOP) and cryptogenic organizing pneumonia (COP)? ClinRadiol45:369-70.
- Cunha BA, Syed U, Mickail N(2012) Renal transplant with bronchiolitis obliterans organizing pneumonia (BOOP) attributable to tacrolimus and herpes simplex virus (HSV) pneumonia. Heart & Lung 41:310-315
- Bitsan M, Ouahed JD, Carpineta L, Bernard C, Bell LE(2010) kryptogen organiserende lungebetændelse efter rituksimab terapi for formodet lymfoproliferativ sygdom efter nyretransplantation. Pædiatrisk Nefrologi 25: 1163-1167.
- De La Hose RE, Stephens G, Sherlock C (2002) diagnose og behandlingsmetoder for CMV-infektioner hos voksne patienter. J ClinVirol 25: 1-12.
- Sanadgol N, Ramroodi N, Ahmadi GA, Komijani M, Moghtaderi A, et al.(2011) prævalens af cytomegalovirusinfektion og dens rolle i total immunoglobulinmønster hos Iranske patienter med forskellige undertyper af multipel sklerose. Nye Microbiologica 34: 263-274.
- Chiotan C, Radu L, Serban R, Cornacel C, Cioboata M, et al. (2014) Cytomegalovirus retinitis hos HIV/AIDS-patienter. Tidsskrift for medicin og liv 7: 237-240.
- Liu, Lai CC, Ko toilet, Chen YH, Tang HJ, et al. (2011) kliniske og mikrobiologiske egenskaber ved infektioner forårsaget af forskellige Nocardia-arter: en multicenterundersøgelse fra 1998 til 2010. Eur J ClinMicrobiol Inficere Dis30: 1341-1347.
- Beam E, RR(2012)Cytomegalovirus i fast organtransplantation: epidemiologi, forebyggelse og behandling. Curr Inficere Dis Rep14: 633-641.
- Vestman G, Berglund D, udvide J, Ingelsson M, Korsgren O, et al. (2014) øget inflammatorisk respons hos Cytomegalovirus Seropositive patienter. PloS one9: 96779.
- Carney, Rubin RH, Hoffman RA, Hansen, Healey K, et al. (1981) analyse af T-lymfocytundersæt i cytomegalovirusmononukleose. J Immunol126: 2114-2116.
- Boeckh M, Leisenring m, Riddell SR, Huang ML, et al. (2003) sen cytomegalovirus sygdom og dødelighed hos modtagere af allogene hæmatopoietiske stamcelletransplantationer: betydningen af viral belastning og T-celleimmunitet. Blod 101: 407-414.
- Gunthard HF, Aberg JA, Eron JJ, Hoy JF, Telenti A,et al. (2014) Antiretroviral behandling af voksen HIV-infektion: 2014 anbefalinger fra International Antiviral Society-USA Panel. JAMA 312: 410-425.
- Epler GR, Colby TV, McLoud TC, Carrington CB, Gaensler EA(1985) Bronchiolitis obliterans organiserer lungebetændelse. N Engl J Med 312:152-158.
- Kute VB, Patel MP, Patil SB, Shah PR, Vanikar AV,et al. (2013) Bronchiolitis obliterans organizing pneumonia (BOOP) after renal transplantation. IntUrolNephrol 45:1517-1521.
- White KA, Ruth-Sahd LA (2007) Bronchiolitis obliterans organizing pneumonia. Crit Care Nurse27:53-66.
- Yale SH, Adlakha A, Sebo TJ, Ryu JH(1993)Bronchiolitis obliterans organizing pneumonia caused by Plasmodium vivax malaria. Chest 104:1294-1296.
- Kleindienst R, Fend F, Prior C, Margreiter R, Vogel W(1999)Bronchiolitis obliterans organizing pneumonia associated with Pneumocystis carinii infection in a liver transplant patient receiving tacrolimus. Clin Transplant13:65-67.
- Moore SL (2003)Bronchiolitis obliterans organizing pneumonia: a late complication of stem cell transplantation. Clin J OncolNurs 7:659-662.