Generieke naam: Clonidinehydrochloride
doseringsvorm: tablet
medisch beoordeeld door Drugs.com. laatst bijgewerkt op 1 juli 2020.
- Overzicht
- bijwerkingen
- Dosering
- Professionele
- Tips
- Interactions
- Meer
- Clonidine Hydrochloride Tabletten, USP
- clonidine beschrijving
- Clonidine-Klinische Farmacologie
- farmacokinetiek
- indicaties en gebruik voor Clonidine
- contra-indicaties
- waarschuwingen
- terugtrekking
- voorzorgsmaatregelen
- Algemeen
- Perioperatief gebruik
- informatie voor patiënten
- geneesmiddelinteracties
- Toxicologie
- carcinogenese, mutagenese,verminderde vruchtbaarheid
- zwangerschap
- moeders die borstvoeding geven
- gebruik bij kinderen
- bijwerkingen
- clonidine dosering en toediening
- Hoe wordt Clonidine geleverd
- PRINCIPAL DISPLAY van het BEDIENINGSPANEEL
- OPDRACHTGEVER DISPLAY van het BEDIENINGSPANEEL
- PRINCIPAL DISPLAY PANEL
- Meer over clonidine
- Consument resources
- Professional resources
- behandeling in Verband met gidsen
Clonidine Hydrochloride Tabletten, USP
Mondelinge Bloeddrukverlagende
Tabletten van 0.1 mg 0.2 mg en 0.3 mg
Rx alleen
voorschrijfinformatie
clonidine beschrijving
Clonidinehydrochloride, USP is een centraal werkend Alfa-agonist hypotensief middel dat verkrijgbaar is als tabletten voor orale toediening in drie doseringssterktes: 0,1 mg, 0,2 mg en 0,3 mg. De 0,1 mg tablet komt overeen met 0,087 mg van de vrije base.
de inactieve bestanddelen zijn colloïdaal siliciumdioxide, maïszetmeel, dibasisch calciumfosfaat, hydroxypropylcellulose, microkristallijne cellulose, lactosemonohydraat en magnesiumstearaat. Daarnaast is de 0.1 mg tabletten bevatten FD&C rood Nr. 40, en de 0,2 mg en 0,3 mg tabletten bevatten respectievelijk FD&C geel Nr. 6 als kleurstoffen.
Clonidinehydrochloride is een imidazolinederivaat en bestaat als een mesomere verbinding. De chemische naam is 2-(2,6-dichlorophenylamino) – 2-imidazolinewaterstofchloride. Het volgende is de structurele formule:
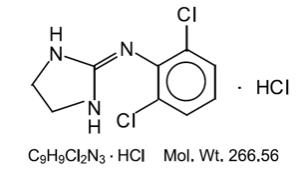
Clonidinewaterstofchloride is een geurloze, bittere, witte, kristallijne oplosbare stof in water en alcohol.
Clonidine-Klinische Farmacologie
Clonidine stimuleert alfa-adrenoreceptoren in de hersenstam. Deze actie resulteert in een verminderde sympathische uitstroom uit het centrale zenuwstelsel en in een afname van perifere weerstand, renale vasculaire weerstand, hartslag en bloeddruk. Clonidine hydrochloride tabletten werken relatief snel. De bloeddruk van de patiënt daalt binnen 30 tot 60 minuten na een orale dosis, waarbij de maximale daling binnen 2 tot 4 uur optreedt. De renale bloedstroom en de glomerulaire filtratiesnelheid blijven in wezen onveranderd. Normale houdingsreflexen zijn intact; daarom zijn orthostatische symptomen mild en zeldzaam.
Acute studies met Clonidinehydrochloride bij mensen hebben een matige vermindering (15% tot 20%) van het hartminuutvolume in liggende positie aangetoond zonder verandering in de perifere weerstand: bij een helling van 45′ is er een kleinere afname van het hartminuutvolume en een afname van de perifere weerstand. Tijdens langdurige therapie heeft het hartminuutvolume de neiging om terug te keren naar de controlewaarden, terwijl de perifere weerstand verminderd blijft. Vertraging van de polsslag is waargenomen bij de meeste patiënten die Clonidine kregen, maar het medicijn verandert de normale hemodynamische respons op lichaamsbeweging niet.
tolerantie voor het antihypertensieve effect kan bij sommige patiënten optreden, waardoor een herbeoordeling van de behandeling noodzakelijk is.
andere studies bij patiënten hebben bewijs geleverd van een vermindering van de plasmarenineactiviteit en van de excretie van aldosteron en catecholamines. Het exacte verband tussen deze farmacologische effecten en het antihypertensieve effect van Clonidine is niet volledig opgehelderd.
Clonidine stimuleert acuut de afgifte van groeihormoon bij zowel kinderen als volwassenen, maar veroorzaakt geen chronische verhoging van groeihormoon bij langdurig gebruik.
farmacokinetiek
de farmacokinetiek van Clonidine is dosisproportioneel in het bereik van 100 tot 600 mcg. De absolute biologische beschikbaarheid van Clonidine bij orale toediening is 70% tot 80%. Piekplasmaclonidinespiegels worden binnen ongeveer 1 tot 3 uur bereikt.
na intraveneuze toediening vertoont Clonidine een bifasische dispositie met een distributiehalfwaardetijd van ongeveer 20 minuten en een eliminatiehalfwaardetijd variërend van 12 tot 16 uur. De halfwaardetijd neemt tot 41 uur toe bij patiënten met een ernstige nierfunctiestoornis. Clonidine passeert de placentabarrière. Het is aangetoond dat het de bloed-hersenbarrière passeert bij ratten.
na orale toediening wordt ongeveer 40% tot 60% van de geabsorbeerde dosis binnen 24 uur als onveranderd geneesmiddel in de urine teruggevonden. Ongeveer 50% van de geabsorbeerde dosis wordt gemetaboliseerd in de lever. Noch voedsel, noch het ras van de patiënt beïnvloedt de farmacokinetiek van Clonidine.
het antihypertensieve effect wordt bereikt bij plasmaconcentraties tussen ongeveer 0,2 en 2,0 ng/mL bij patiënten met een normale excretiefunctie. Een verdere stijging van de plasmaspiegels zal het antihypertensieve effect niet versterken.
indicaties en gebruik voor Clonidine
clonidine hydrochloride tabletten zijn USP geïndiceerd voor de behandeling van hypertensie. Clonidine hydrochloride tabletten, USP kan alleen of gelijktijdig met andere antihypertensiva worden gebruikt.
contra-indicaties
Clonidinehydrochloride-tabletten mogen niet worden gebruikt bij patiënten met een bekende overgevoeligheid voor Clonidine (zie voorzorgsmaatregelen).
waarschuwingen
terugtrekking
patiënten dienen geïnstrueerd te worden de behandeling niet te staken zonder hun arts te raadplegen. Plotselinge stopzetting van de behandeling met Clonidine heeft in sommige gevallen geleid tot symptomen zoals nervositeit, agitatie, hoofdpijn en tremor, vergezeld of gevolgd door een snelle stijging van de bloeddruk en verhoogde catecholamineconcentraties in het plasma. De kans op dergelijke reacties op het staken van de behandeling met Clonidine lijkt groter te zijn na toediening van hogere doses of voortzetting van de gelijktijdige behandeling met bètablokkers en speciale voorzichtigheid is daarom aanbevolen in deze situaties. Zeldzame gevallen van hypertensieve encefalopathie, cerebrovasculaire accidenten en overlijden zijn gemeld na stopzetting van Clonidine. Wanneer de behandeling met Clonidine wordt gestaakt, moet de arts de dosis geleidelijk verlagen gedurende 2 tot 4 dagen om ontwenningsverschijnselen te voorkomen.
een excessieve stijging van de bloeddruk na stopzetting van de behandeling met Clonidine kan worden tegengegaan door toediening van oraal Clonidinehydrochloride of door intraveneuze fentolamine. Als de behandeling moet worden gestaakt bij patiënten die gelijktijdig een bètablokker en Clonidine krijgen, dient de bètablokker enkele dagen vóór de geleidelijke stopzetting van Clonidine te worden gestaakt.
omdat kinderen vaak gastro-intestinale aandoeningen hebben die tot braken leiden, kunnen zij bijzonder gevoelig zijn voor hypertensieve episodes als gevolg van abrupt onvermogen om medicatie te nemen.
voorzorgsmaatregelen
Algemeen
bij patiënten die een plaatselijke contactsensibilisatie voor transdermaal Clonidine hebben ontwikkeld, kan voortzetting van transdermaal Clonidine of vervanging van orale clonidinehydrochloride-therapie geassocieerd zijn met de ontwikkeling van een gegeneraliseerde huiduitslag.
bij patiënten die een allergische reactie ontwikkelen op transdermaal Clonidine, kan substitutie van oraal Clonidinehydrochloride ook een allergische reactie veroorzaken (waaronder gegeneraliseerde rash, urticaria of angio-oedeem).)
de sympathicolytische werking van Clonidine kan sinusknoopdisfunctie en atrioventriculair (AV) blok verergeren, vooral bij patiënten die andere sympathicolytische geneesmiddelen gebruiken. Er zijn postmarketing meldingen van patiënten met geleidingsstoornissen en/of die andere sympathicolytische geneesmiddelen gebruikten, die ernstige bradycardie ontwikkelden waarbij i.v. atropine, i. v. isoproterenol en tijdelijke cardiale pacing nodig waren tijdens het gebruik van Clonidine.
bij hypertensie veroorzaakt door feochromocytoom kan geen therapeutisch effect van Clonidinehydrochloride-tabletten worden verwacht.
Perioperatief gebruik
toediening van Clonidinehydrochloride-tabletten moet worden voortgezet tot binnen vier uur na de operatie en daarna zo snel mogelijk worden hervat. De bloeddruk moet tijdens de operatie zorgvuldig worden gecontroleerd en indien nodig moeten aanvullende maatregelen ter controle van de bloeddruk beschikbaar zijn.
informatie voor patiënten
patiënten dienen gewaarschuwd te worden tegen onderbreking van de behandeling met Clonidinehydrochloride-tabletten zonder advies van hun arts.
aangezien patiënten een mogelijk sedatief effect, duizeligheid of accommodatiestoornis kunnen ervaren bij het gebruik van Clonidine, moet patiënten worden gewaarschuwd voor activiteiten zoals het besturen van een voertuig of het bedienen van apparaten of machines. Informeer patiënten ook dat dit kalmerende effect kan worden verhoogd door gelijktijdig gebruik van alcohol, barbituraten of andere sederende geneesmiddelen.
patiënten die contactlenzen dragen, dienen gewaarschuwd te worden dat behandeling met Clonidinehydrochloride-tabletten droogte in de ogen kan veroorzaken.
geneesmiddelinteracties
Clonidine kan de CZS-depressieve effecten van alcohol, barbituraten of andere sederende geneesmiddelen versterken. Als een patiënt die Clonidinehydrochloride ontvangt ook tricyclische antidepressiva gebruikt, kan het hypotensieve effect van Clonidine worden verminderd, waardoor een verhoging van de dosis Clonidine noodzakelijk is. Als een patiënt die Clonidine krijgt ook neuroleptica gebruikt, kunnen verstoringen van de orthostatische Regulatie (bijv. orthostatische hypotensie, duizeligheid, vermoeidheid) worden geïnduceerd of verergerd.
controleer de hartslag bij patiënten die Clonidine gelijktijdig krijgen met middelen waarvan bekend is dat ze de sinusknoopfunctie of de AV-nodaalgeleiding beïnvloeden, zoals digitalis, calciumantagonisten en bètablokkers. Sinusbradycardie resulterend in ziekenhuisopname en pacemaker insertie is gemeld in samenhang met het gebruik van Clonidine gelijktijdig met diltiazem of verapamil.
Amitriptyline in combinatie met Clonidine versterkt de manifestatie van corneale laesies bij ratten (zie Toxicologie).
op basis van waarnemingen bij patiënten in een toestand van alcoholisch delirium is gesuggereerd dat hoge intraveneuze doses Clonidine het aritmogene potentieel (QT-verlenging, ventriculaire fibrillatie) van hoge intraveneuze doses haloperidol kunnen verhogen. Causaal verband en relevantie voor clonidine orale tabletten zijn niet vastgesteld.
Toxicologie
in verscheidene onderzoeken met oraal Clonidinehydrochloride werd een dosisafhankelijke toename van de incidentie en ernst van spontane retinale degeneratie gezien bij albinoratten die zes maanden of langer werden behandeld. Weefseldistributie studies bij honden en apen toonden een concentratie van Clonidine in het choroïd.
gezien de retinale degeneratie die bij ratten werd waargenomen, werden tijdens klinische studies bij 908 patiënten vóór en periodiek na de start van de behandeling met Clonidine oogonderzoeken uitgevoerd. Bij 353 van deze 908 patiënten werden de oogonderzoeken gedurende een periode van 24 maanden of langer uitgevoerd. Met uitzondering van enige droogheid van de ogen werden geen geneesmiddelgerelateerde abnormale oftalmologische bevindingen geregistreerd en, volgens gespecialiseerde tests zoals electroretinografie en macula dazzle, was de retinale functie onveranderd.
in combinatie met amitriptyline leidde toediening van Clonidinehydrochloride tot de ontwikkeling van corneale laesies bij ratten binnen 5 dagen.
carcinogenese, mutagenese,verminderde vruchtbaarheid
chronische toediening van Clonidine via de voeding was niet carcinogeen bij ratten (132 weken) of muizen (78 weken) die respectievelijk tot 46 of 70 maal de maximale aanbevolen dagelijkse dosis voor de mens als mg/kg kregen (9 of 6 maal de MRDHD op basis van mg/m2). Er was geen bewijs van Genotoxiciteit in de Ames-test voor mutageniciteit of in de micronucleustest bij muizen voor clastogeniciteit.
de vruchtbaarheid van mannelijke of vrouwelijke ratten werd niet beïnvloed door Clonidinedoses tot 150 mcg/kg (ongeveer 3 maal MRDHD). In een afzonderlijk experiment bleek de vruchtbaarheid van vrouwelijke ratten te worden beïnvloed bij dosisniveaus van 500 tot 2000 mcg/kg (10 tot 40 maal de orale MRDHD op basis van mg/kg; 2 tot 8 maal de MRDHD op basis van mg/m’.)
zwangerschap
teratogene effecten: zwangerschap categorie C. reproductiestudies uitgevoerd bij konijnen met doses tot ongeveer 3 maal de orale maximale aanbevolen dagelijkse dosis bij de mens (mrdhd) van Clonidinehydrochloride-tabletten leverden geen aanwijzingen op voor een teratogeen of embryotoxisch potentieel bij konijnen. Bij ratten werden echter doses tot 1/3 van de orale MRDHD (1/15 van de MRDHD op basis van mg/m2) Clonidine geassocieerd met verhoogde resorpties in een studie waarin moederdieren continu werden behandeld vanaf 2 maanden voorafgaand aan de paring. Verhoogde resorpties werden niet geassocieerd met een behandeling op hetzelfde moment of bij hogere doses (tot 3 maal de orale MRDHD) wanneer de moederdieren werden behandeld op dag 6 tot 15 van de dracht. Toenames van de resorptie werden waargenomen bij veel hogere doses (40 maal de orale MRDHD op basis van mg/kg).; 4 tot 8 maal de MRDHD op basis van mg / m2) bij muizen en ratten die werden behandeld op dag 1 tot 14 van de dracht (de laagste dosis die in het onderzoek werd gebruikt was 500 mcg/kg).
er zijn geen adequate, goed gecontroleerde onderzoeken uitgevoerd bij zwangere vrouwen. Clonidine passeert de placentabarrière (zie klinische farmacologie, farmacokinetiek). Omdat reproductiestudies bij dieren niet altijd voorspellend zijn voor de menselijke respons, moet dit medicijn tijdens de zwangerschap alleen worden gebruikt als het duidelijk nodig is.
moeders die borstvoeding geven
aangezien Clonidinehydrochloride wordt uitgescheiden in de moedermelk, is voorzichtigheid geboden wanneer Clonidinehydrochloride-tabletten worden toegediend aan een vrouw die borstvoeding geeft.
gebruik bij kinderen
veiligheid en werkzaamheid bij kinderen zijn niet vastgesteld in adequate en goed gecontroleerde studies (zie waarschuwingen, terugtrekking).
bijwerkingen
de meeste bijwerkingen zijn mild en verminderen gewoonlijk bij voortzetting van de behandeling. De meest voorkomende (die dosisafhankelijk lijken te zijn) is een droge mond, die optreedt bij ongeveer 40 van de 100 patiënten; slaperigheid, ongeveer 33 op de 100; duizeligheid, ongeveer 16 op de 100; constipatie en sedatie, elk ongeveer 10 op de 100.
de volgende minder frequente bijwerkingen zijn ook gemeld bij patiënten die Clonidinehydrochloride-tabletten kregen, maar in veel gevallen kregen patiënten gelijktijdig medicatie en een causaal verband is niet vastgesteld.
lichaam als geheel: vermoeidheid, koorts, hoofdpijn, bleekheid, zwakte en ontwenningssyndroom. Ook werden een zwak positieve Coombs-test en een verhoogde gevoeligheid voor alcohol gemeld.
cardiovasculair: Bradycardie, congestief hartfalen, elektrocardiografische afwijkingen (bijv. sinusknoopstilstand, junctionele bradycardie, hoge graad AV-blok en aritmieën), orthostatische symptomen, hartkloppingen, fenomeen van Raynaud, syncope en tachycardie.
gevallen van sinusbradycardie en atrioventriculair blok zijn gemeld, zowel met als zonder gelijktijdig gebruik van digitalis.
Centraal Zenuwstelsel: Agitatie, angst, delirium, waanvoorstellingen, hallucinaties (inclusief visuele en auditieve), slapeloosheid, mentale depressie, nervositeit, andere gedragsveranderingen, paresthesie, rusteloosheid, slaapstoornis en levendige dromen of nachtmerries.Dermatologisch: Alopecia, angioneurotisch oedeem, netelroos, pruritus, rash en urticaria.Maagdarmstelselaandoeningen: buikpijn, anorexie, constipatie, hepatitis, malaise, lichte voorbijgaande afwijkingen in leverfunctietesten, misselijkheid, parotitis, pseudo-obstructie (waaronder pseudo-obstructie van het colon), pijn aan de speekselklier en braken.Urogenitaal: verminderde seksuele activiteit, moeilijkheden bij mictie, erectiestoornissen, verlies van libido, nycturie en urineretentie.
Hematologisch: Trombocytopenie.
metabolisch: gynaecomastie, voorbijgaande verhoging van bloedglucose-of serumcreatinefosfokinase en gewichtstoename.
Skeletspierstelsel-en bindweefselaandoeningen: beenkrampen en spier-of gewrichtspijn.
Oro-otolaryngeaal: droogheid van het neusslijmvlies.
oftalmologisch: Accomodatiestoornis, wazig zien, branderig gevoel van de ogen, verminderde traanafscheiding en droge ogen.Overdosering
hypertensie kan zich vroeg ontwikkelen en kan worden gevolgd door hypotensie, bradycardie, ademhalingsdepressie, hypothermie, slaperigheid, verminderde of afwezige reflexen, zwakte, prikkelbaarheid en miose. De frequentie van CZS-depressie kan hoger zijn bij kinderen dan volwassenen. Grote overdoses kunnen resulteren in reversibele cardiale geleidingsstoornissen of dysritmie, apneu, coma en epileptische aanvallen. Klachten en symptomen van overdosering treden over het algemeen binnen 30 minuten tot twee uur na blootstelling op. Slechts 0,1 mg Clonidine heeft bij kinderen tekenen van toxiciteit veroorzaakt.
er is geen specifiek antidotum voor overdosering met Clonidine. Overdosering van Clonidine kan resulteren in de snelle ontwikkeling van CZS-depressie; daarom wordt inductie van braken met ipecac siroop niet aanbevolen. Maagspoeling kan geïndiceerd zijn na recente en/of grote inname. Toediening van actieve kool en/of een catharticum kan nuttig zijn. Ondersteunende zorg kan bestaan uit atropine sulfaat voor bradycardie, intraveneuze vloeistoffen en / of vasopressoren voor hypotensie en vaatverwijders voor hypertensie. Naloxon kan een nuttige aanvulling zijn voor de behandeling van door Clonidine geïnduceerde ademhalingsdepressie, hypotensie en/of coma; de bloeddruk moet worden gecontroleerd omdat de toediening van naloxon af en toe heeft geleid tot paradoxale hypertensie. Toediening van Tolazoline heeft inconsistente resultaten opgeleverd en wordt niet aanbevolen als eerstelijnsbehandeling. Dialyse zal waarschijnlijk de eliminatie van Clonidine niet significant verbeteren.
de grootste tot op heden gemelde overdosis betrof een 28-jarige man die 100 mg Clonidinehydrochloride-poeder innam. Deze patiënt ontwikkelde hypertensie gevolgd door hypotensie, bradycardie, apneu, hallucinaties, semicoom en premature ventriculaire contracties. De patiënt herstelde volledig na intensieve behandeling. De plasmaklonidinespiegels waren 60 ng/mL na 1 uur, 190 ng/mL na 1,5 uur, 370 ng/mL na 2 uur en 120 ng / mL na 5,5 en 6,5 uur. Bij muizen en ratten is de orale LD50 van Clonidine respectievelijk 206 en 465 mg/kg.
clonidine dosering en toediening
volwassenen
de dosis Clonidinehydrochloride-tabletten moet worden aangepast aan de individuele bloeddrukrespons van de patiënt. Hieronder volgt een algemene leidraad voor het beheer ervan.
aanvangsdosis
0,1 mg tablet tweemaal daags (’s ochtends en naar bed gaan). Oudere patiënten kunnen baat hebben bij een lagere aanvangsdosis.
onderhoudsdosis
indien nodig kunnen met wekelijkse intervallen verdere stappen van 0,1 mg per dag worden uitgevoerd totdat de gewenste respons is bereikt. Het nemen van het grootste deel van de orale dagelijkse dosis voor het slapengaan kan voorbijgaande aanpassing effecten van droge mond en slaperigheid minimaliseren. De meest gebruikte therapeutische doses varieerden van 0,2 mg tot 0,6 mg per dag gegeven in verdeelde doses.Studies hebben aangetoond dat 2,4 mg de maximale effectieve dagelijkse dosis is, maar zulke hoge doses zijn zelden gebruikt.
nierinsufficiëntie
patiënten met nierinsufficiëntie kunnen baat hebben bij een lagere aanvangsdosis. Patiënten moeten zorgvuldig worden gecontroleerd. Aangezien slechts een minimale hoeveelheid Clonidine wordt verwijderd tijdens routine hemodialyse, is het niet nodig om aanvullende Clonidine te geven na dialyse.
Hoe wordt Clonidine geleverd
Clonidinehydrochloride-tabletten, USP wordt als volgt geleverd:
0,1 mg: een roze tablet, in de vorm van “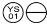 “.
“.
NDC 58657-647-01 (fles van 100)
NDC 58657-647-50 (fles van 500)
NDC 58657-647-10 (fles van 1000)
0,2 mg: een oranje tablet, in de vorm van ” 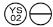 “.
“.
NDC 58657-648-01 (fles van 100)
NDC 58657-648-50 (fles van 500)
NDC 58657-648-10 (fles van 1000)
0,3 mg: een lichtoranje tablet, in de vorm van ” 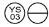 “.
“.
NDC 58657-649-01 (fles van 100)
NDC 58657-649-50 (fles van 500)
NDC 58657-649-10 (fles van 1000)
Bewaren bij 25°C; toegestane uitstapjes naar 15°C-30°C (59°F-86°F). Doseer in een strakke, lichtbestendige verpakking.
gefabriceerd door:
Yung Shin Pharmaceutical Ind. Gezamenlijk., Ltd.
Tachia, Taichung 43769
TAIWAN
verdeeld door:Method Pharmaceuticals, LLC
7333 Jack Newell Blvd. North, Suite 300
Fort Worth, Texas 76118
verslag ADVERSE DRUG ERVARING, bel Methode Pharmaceuticals 1-877-250-3427
Herziene: 06/20
PRINCIPAL DISPLAY van het BEDIENINGSPANEEL
NDC 58657-647-10
Clonidine
HYDROCHLORIDE
TABLETTEN, USP
0,1 mg
Rx Only
1000 Tabletten

OPDRACHTGEVER DISPLAY van het BEDIENINGSPANEEL
NDC 58657-648-10
Clonidine
HYDROCHLORIDE
TABLETTEN, USP
0.2 mg
Rx Only
1000 Tablets

PRINCIPAL DISPLAY PANEL
NDC 58657-649-10
Clonidine
HYDROCHLORIDE
TABLETS, USP
0.3 mg
Rx Only
1000 Tablets

| Clonidine HYDROCHLORIDE Clonidine hydrochloride tablet |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
| Clonidine HYDROCHLORIDE Clonidine hydrochloride tablet |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
| Clonidine HYDROCHLORIDE Clonidine hydrochloride tablet |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Labeler – Methode Pharmaceuticals, LLC (060216698)
Meer over clonidine
- bijwerkingen
- Tijdens de Zwangerschap of Borstvoeding
- Dosering Informatie
- Patiënt Tips
- Drug Afbeeldingen
- Drug Interactions
- Vergelijk Alternatieven
- Support Group
- Prijs & Coupons
- 619 Beoordelingen
- Drug klasse: antiadrenergic agenten, centraal handelt
- FDA Waarschuwingen (1)
Consument resources
- Patiënt Informatie
- … +5
Professional resources
- Prescribing Information
- CloNIDine (Professionele Patiënt Advies)
- Clonidine Extended Release Tabletten (FDA)
- Clonidine Injectie (FDA)
- Clonidine Patch (FDA)
- Clonidine Tabletten (FDA)
Overige merken Catapres, Kapvay, Catapres-TTS, Duraclon, Nexiclon XR
behandeling in Verband met gidsen
- Angst
- ADHD
- Alcohol Terugtrekking
- Atriale Fibrillatie
- … + 19 meer
medische Disclaimer